2. 内蒙古农牧业科学院, 呼和浩特 010010;
3. 内蒙古农业大学食品科学与工程学院, 呼和浩特 010018
2. Inner Mongolia Academy of Agriculture and Animal Husbandry, Hohhot 010010, China;
3. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China
在奶牛的乳腺中,乳腺上皮细胞(BMECs)增殖、分化和消退的过程,随着奶牛不同的生理期而循环往复,进而影响奶牛的泌乳[1, 2, 3, 4],因此了解BMECs这一周期性变化的规律、条件及机制,对于提高奶牛的产奶量有重要意义。但动物体内试验一般试验周期长、耗费大又难以控制机体复杂环境因子的相互影响,故一般采用体外培养来研究。目前BMECs体外培养常用的是二维培养,在二维培养的条件下BMECs所形成的形态结构与体内形成的网络管腔和腺泡结构相差较大。细胞的功能与其特定的形态结构存在相关性,这使得在利用二维培养研究奶牛泌乳调控时,细胞有些功能不能得到发挥。在三维培养体系中,BMECs经历连续增殖和迁移聚集,最终形成一个完整的类腺泡结构[5],该结构与体内形成的网络管腔和腺泡结构相似。但是国内外关于BMECs三维培养的研究较少,对于三维培养适宜时间的研究还未见报道。已有BMECs三维培养的研究中,由于研究者们采用的细胞来源、基质类型、接种方式不同,对三维培养模式下BMECs腺泡结构形成时间有不同结论[5, 6, 7, 8, 9, 10, 11, 12, 13, 14]。综上所述,体外培养条件下,类腺泡结构的形态与泌乳相关基因表达密切关联[15, 16, 17]。BMECs只有形成完整的腺泡结构时,才能反映机体内乳腺泌乳状态,研究乳腺腺泡结构的形成时间尤为关键。本试验通过检测BMECs αs1-酪蛋白、β-酪蛋白及κ-酪蛋白基因表达量的变化,旨在确定三维模式下,未经转染的BMECs的最佳培养时间。
在内蒙古地区选取3头健康的3~5岁泌乳黑白花奶牛的乳腺组织。
细胞培养所用的培养基成分为:DMEM/F12(美国Gibco公司)、胰岛素转铁蛋白硒钠(ITS,美国Sigma公司)、表皮生长因子(EGF,美国Sigma公司)、氢化可的松(He,美国Sigma公司)、催乳素(prolactin,美国Sigma公司)、胎牛血清(FBS,美国Hyclone公司)和基质(matrigel,美国Gibco公司)。
终止培养基为DMEM/F12的基础上添加10%的FBS;生长培养基为DMEM/F12的基础上添加FBS、ITS、EGF、He;贴壁培养基为DMEM/F12的基础上添加FBS、ITS、He、基质;分化培养基为DMEM/F12的基础上添加ITS、He、基质、催乳素。细胞培养基组成见表1。
| 表1 细胞培养基组成Table 1 Composition of the medium for cell culture mL |
组织消化所用的溶液:0.5%的Ⅱ型胶原酶(北京康倍斯科技有限公司)溶液。
细胞消化所用的溶液:0.25%胰蛋白酶(北京康倍斯科技有限公司)、0.02%的乙二胺四乙酸(EDTA,北京康倍斯科技有限公司)、磷酸盐缓冲液(PBS,美国HyClone公司)、双抗(青霉素-链霉素,双抗在溶液中的终浓度为100 U/mL,美国HyClone公司)。
酪蛋白基因表达的测试试剂如下:总RNA提取试剂盒RNAiso Plus(日本TaKaRa公司)、PrimeScript RT Master Mix perfect Real Time试剂盒(日本TaKaRa公司)、SYBR Premix Ex TaqrTM Ⅱ试剂盒(日本TaKaRa公司)、细胞回收液(美国BD公司)、氯仿、异丙醇、75%无酶乙醇(天津市登科化学试剂有限公司)等。
试验所用的主要仪器如下:高压灭菌锅(日本TOMY公司)、超声波清洗机(昆山超声波仪器有限公司)、倒置相差显微镜(香港麦克迪公司)、CO2培养箱(香港力康公司)、超净工作台(江苏苏净公司)、实时定量PCR仪(美国ABI公司)等。
本试验采集了3头健康的3~5岁泌乳期的黑白花奶牛的乳腺细胞。采用三维模式培养3、5、7、9 d后回收细胞,每头牛的乳腺细胞,每个时间点设2个重复,回收的细胞用于测定酪蛋白基因的表达量。
奶牛屠宰后迅速进行乳腺组织样品的采集,用75%的酒精将乳腺组织的中上部进行消毒,然后用无菌的手术剪、手术刀和镊子进行样品的采集。采集的乳腺组织约为50 g,采集的乳腺组织要求腺泡丰富、导管和脂肪较少。将其用无菌PBS(双抗的浓度为300 U/mL)冲洗至无明显的乳汁溢出,然后放入有无菌PBS(双抗的浓度为300 U/mL)的蓝盖瓶内,保持温度在-4 ℃左右迅速带回实验室,进行后续试验操作。
将采集的乳腺组织放入含有75%酒精的烧杯内清洗约30 s,然后依次用无菌PBS(双抗的浓度为100 U/mL)清洗3次,用无菌的眼科剪去除酒精浸泡过的外层组织,得到新鲜的组织样品。然后去除脂肪、结缔组织和残留的管腔结构。将符合上述要求的乳腺组织剪碎为直径1~2 mm的颗粒。将这些颗粒用无菌PBS(双抗的浓度为100 U/mL)清洗2~3次至洗液清亮,然后取适量清洗过的颗粒移入10 mL刻度离心管内,向离心管内加入0.5%的Ⅱ型胶原酶溶液,酶的加入量是组织样品体积的3倍,置于37 ℃、5% CO2饱和的培养箱中,消化1.0~1.5 h得到组织细胞混合液。
将消化1.0~1.5 h的组织细胞混合液用100目(孔径)的无菌尼龙滤网过滤,将细胞滤液转移至10 mL锥底刻度离心管中。于128×g离心8 min,弃去上清液。然后向离心管内加入生长培养基悬浮细胞,将细胞和生长培养基的混合液接种于75 cm2一次性细胞培养瓶中,于37 ℃、5% CO2饱和的培养箱中进行培养。
二维培养能够为三维培养提供足够数量较高纯度的BMECs,所以BMECs三维培养前先进行二维培养。
本试验中所用的BMECs的接种、分离及纯化的方法参见王秀美等[6]的方法。
将洗净灭菌的小玻璃片放入6 cm培养皿中,接种细胞,待细胞长到70%~80%时取出玻璃片,用PBS清洗3次。室温下用4%多聚甲醛固定30 min,再用含0.2% TritonX-100通透处理细胞10 min,PBS清洗3次,每次5 min。用含1%明胶的PBS封闭处理30 min。然后用鼠抗人角蛋白18(CK-18)单克隆抗体(1∶ 50稀释),于室温下振荡孵育1 h,PBS清洗3次,每次5 min。加入异硫氰酸荧光素(FITC)标记的山羊抗小鼠免疫球蛋白G(1∶ 50),室温下避光振荡孵育30 min,PBS清洗3次,每次5 min。再加入含碘化丙锭(PI)10 μg/mL的PBS,室温下染色10 min。用倒置相差荧光显微镜观察结果,同时用牛成纤维细胞作阴性对照。
如果待检细胞中具有CK-18,则FITC标记的二抗可以和一抗特异性结合,呈绿色,显示被检测抗原的位置,即CK-18的位置。同时,PI可以使细胞核呈现红色。
将基质放置于4 ℃内12 h,然后将基质铺入6孔细胞培养板内,每孔的加胶量为1 mL,上述铺胶的操作均在冰上进行。然后将6孔板置于培养箱内,约30 min胶凝固,胶凝固后将BMECs悬液接种于6孔细胞培养板内。
将1.2.4所述二维培养纯化的第1代BMECs用PBS悬浮,然后进行细胞计数,计数足够的细胞转移到新的10 mL离心管内,于128×g离心8 min,弃去上清液。加入贴壁培养基将细胞沉淀悬浮(细胞密度为1×106 mL-1)备用。
BMECs的三维培养参照Kozlowski等[5]的方法进行,本试验在该方法基础上,对细胞的生长浓度、铺胶量及血清浓度进行了调整,具体接种过程如下:将1.2.6.2所述密度为1×106 mL-1的上皮细胞悬液接种于包被了基质的6孔板中,每孔加入细胞悬液的量为2 mL。然后将6孔板置于37 ℃、5% CO2饱和的培养箱中进行培养,根据细胞生长状况进行换液,换液所用培养基为分化培养基,每天用倒置相差显微镜观察细胞生长状态并拍照。分别培养3、5、7、9 d时,进行酪蛋白基因表达量的测定。
三维培养的细胞分别于培养3、5、7、9 d进行总RNA的提取,首先进行三维培养细胞的回收,回收方法参见细胞回收液说明书。将回收得到的细胞经PBS清洗2次,然后离心,加入适量RNAiso Plus。将细胞和裂解液混合物转移至1.5 mL离心管内,总RNA的提取步骤参见RNAiso Plus的说明书。提取的总RNA用核酸测定仪测定吸光度值(OD)及浓度,然后将提取的总RNA进行琼脂糖凝胶(1.2%)电泳,以鉴定总RNA的完整性。将符合要求的总RNA于-70 ℃储存备用。
反转录:将三维培养的BMECs中提取的总RNA分别以相同的浓度进行反转录,反转录的具体步骤参见试剂盒说明书,反应体系中包括:5×PrimeScript RT Master Mix 5 μL,总RNA 2.5 μL,RNase-free水17.5 μL,总体积为25 μL。反应条件设置为:37 ℃ 15 min,然后85 ℃ 5 s。
实时定量PCR:引物序列见表2。PCR反应按照试剂盒说明进行。反应体系中包括:SYBR Premix Ex TaqrTMⅡ (2×)10 μL,PCR 上、下游引物(10 μmol/L)各0.8 μL,PCR Reverse Primer(10 μmol/L)0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA(<100 ng)2 μL,灭菌蒸馏水6.0 μL,反应体系的总体积20 μL。扩增条件:95 ℃,30 s;95 ℃,5 s,61 ℃,20 s,72 ℃,15 s,共45个循环。扩增结束后自动分析熔解曲线,确定PCR产物的特异性。将各基因的实时定量PCR产物进行琼脂糖凝胶电泳检测,进一步验证扩增片段的特异性和扩增片段长度。
| 表2 实时定量PCR引物Table 2 Primers for the RT-qPCR |
实时定量的数据统计方法参照Livak等[18]的方法进行,采用2-△△Ct法表示,数据经SPSS 18.0中的ANOVA过程进行单因素方差分析(one-way ANOVA)。
应用细胞荧光免疫染色法对分离纯化培养的BMECs的骨架蛋白CK-18进行了分析,经检测所培养的BMECs呈强阳性,阴性对照的奶牛成纤维细胞呈阴性。结果表明,培养的细胞是BMECs。
经三维培养的细胞用倒置相差显微镜(100×)进行观察,本试验中三维培养的BMECs在培养1 d时就可以观察到有类腺泡结构的形成(图1-A)。培养3 d时可以观察到有类腺泡和管腔结构的形成(图1-B)。培养4 d时可以观察到清晰的类腺泡结构和管腔枝杈形态(图1-C)。培养9 d时可以观察到类腺泡结构和管腔枝杈形态依然存在,但基质不平整,有的腺泡结构有自胶面上脱落的趋势(图1-D)。
由表3可见,利用三维模式培养5 d的BMECs的αs1-酪蛋白和κ-酪蛋白基因表达量极显著高于培养3、7、9 d(P<0.01)。利用三维模式培养5 d的BMECs的β-酪蛋白的基因表达量极显著高于培养3、7 d(P<0.01),而与培养9 d的BMECs的β-酪蛋白的基因表达量差异不显著(P>0.05)。
在细胞表面的受体蛋白、细胞自分泌因子及激酶等会影响细胞在三维基质中的迁移速度及形态的形成[19, 20]。在细胞和细胞之间存在着紧密连接蛋白,包括钙结合蛋白、整合素及免疫球蛋白家族等。所有这些都直接或间接地与肌动蛋白或是微丝细胞骨架相互作用,进而提供机械动力使细胞发生移动,使钙结合蛋白和细胞之间的连接能够迅速地发生变化,因此使细胞之间发生重排,允许细胞之间的位置变化,钙结合蛋白连接对细胞枝杈形态和管腔结构的形成是重要的[21, 22, 23, 24, 25, 26]。因此在这些因素的作用下细胞在基质中经历不断的增殖和迁移聚集,形成一个生长停滞的类腺泡结构,在此基础上该结构内部细胞不断的凋亡,最终形成一个由一层极化的上皮细胞组成的、有中空内腔的类腺泡结构[5]。本试验中三维培养的BMECs也遵循这样的规律,在培养1 d时可以观察到有类腺泡结构的形成,到培养3 d时就可以观察到有类腺泡和管腔结构的形成,培养4 d时可以观察到清晰的类腺泡结构和管腔、枝杈形态。本试验中三维培养所形成的结构与相关文献报道的三维细胞培养结果相似[5, 27]。该形态的形成使细胞的极化结构得以实现,使细胞表面的受体的活性部位得以暴露,使调控通路得到实现,细胞表面的受体从而与周围的环境更加有效作用,为激素的调控提供了条件。有些激素是转录信号通路的调控因子,影响细胞内基因的转录[28, 29]。由此可见,形态的形成和维持与细胞的功能性是密切相关的,本试验中BMECs培养4 d时形成了完整的类腺泡结构和管腔、枝杈结构,这可能与BMECs 3种酪蛋白基因的表达量的极显著提高有关。本试验中BMECs培养7 d的酪蛋白的基因表达量极显著低于培养5 d。有研究表明,细胞完整的类腺泡和管腔枝杈结构形成后,随着培养天数的增加,BMECs类腺泡结构内的细胞开始出现凋亡,细胞的数量在减少[27]。同时有研究表明,αs1-酪蛋白的合成和分泌除了受到基质条件和激素的影响外,还受最小细胞密度的影响,当低于这个最小细胞的密度时细胞将不会分泌。而αs1-酪蛋白在转录水平上是否会受到细胞密度的影响,未见有文献报道。在本试验中从发育完全的腺泡结构的发展过程可见,培养9 d的细胞密度将低于培养5 d,这主要是因为体外培养的BMECs腺泡结构的形成退化过程和体内相近,完整腺泡形成后,维持一定的时间细胞就开始凋亡,腺泡结构不再完整。同时在体内BMECs的凋亡时期是在乳腺回缩期,这个时期乳铁蛋白的合成会增加,而乳铁蛋白的增加会降低酪蛋白的合成[30, 31]。这些可能是本试验条件下培养5 d的BMECs αs1-酪蛋白和κ-酪蛋白2种酪蛋白基因的表达量显著高于培养7 d的原因。BMECs形成的类腺泡和管腔枝杈结构在本试验条件下维持到培养9 d,到培养9 d时可以观察到类腺泡结构和管腔枝杈形态依然存在,但基质不平整,有的腺泡结构有自胶面上脱落的趋势。BMECs是贴壁生长的细胞,细胞自胶面上脱落,可能是因为部分细胞死亡。而完整的腺泡结构是由一层极化的上皮细胞组成的有中空内腔的类腺泡结构,但是到培养9 d,这层极化的上皮细胞有部分死亡,这一结构不能维持。有研究认为当BMECs在基质中至培养10 d时,已经不具备完整的腺泡结构[32],同时也有研究报道体外培养的BMECs在激素的调控下也遵循体内腺泡的增殖、分化和凋亡的规律[5]。因为BMECs有这样的生理特性,BMECs在体外培养条件下,类腺泡结构和管腔枝杈形态不能够一直维持下去。而类腺泡和管腔枝杈结构是BMECs某些功能表现的必要条件,这可能是本试验条件下培养5 d的BMECs αs1-酪蛋白、β-酪蛋白和κ-酪蛋白基因的表达量高于培养9 d的原因。
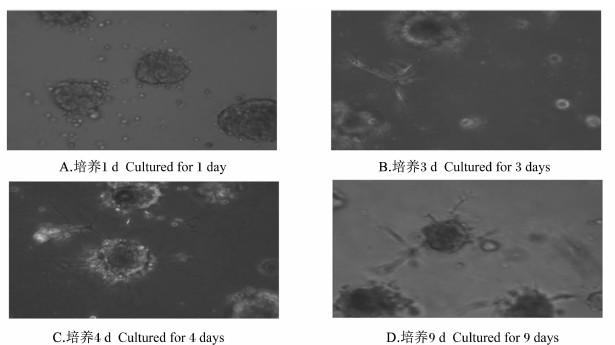 | 图1 三维模式下不同培养天数BMECs的细胞形态Fig.1 Cell morphous of BMECs in three-dimensional culture for different days (100×) |
| 表3 三维模式下不同的培养天数BMECs酪蛋白基因表达量Table 3 Expression levels of casein genes in BMECs in three-dimensional culture for different days |
三维模式下培养时间影响BMECs中αs1-酪蛋白、β-酪蛋白、κ-酪蛋白的基因表达量。根据本试验,三维模式下BMECs的适合培养时间为5 d。
| [1] | CAPUCO A V,ELLIS S.Bovine mammary progenitor cells:current concepts and future directions[J].Journal of Mammary Gland Biology and Neoplasia,2005(1):5-15.[本文引用:1] |
| [2] | BISSELL M J,RIZKI A,MIAN I S.Tissue architecture:the ultimate regulator of breast epithelial function[J].Cell Biology,2003,15:753-762.[本文引用:1] |
| [3] | REN X U,SPENCER V A D,GROESSER L,et al.Laminin regulates PI3K basal localization and activation to sustain STAT5 activation[J].Cell Cycle,2010,9(21):4315-4322.[本文引用:1] |
| [4] | ADAMSAND J C,WATT F M.Regulation of development and differentiation by the extracellular matrix[J].Development,1993,117:1183-1198.[本文引用:1] |
| [5] | KOZLOWSKI M,GAJEWSKA M,MAJEWSKA A,et al.Differences in growth and transcriptomic profile of bovine mammary epithelial monolayer and three-dimensional cell cultures[J].Journal of Physiology and Pharmacology,2009(Suppl.1):5-14.[本文引用:6] |
| [6] | 王秀美,考桂兰,高爱武,等.奶牛乳腺上皮细胞三维培养的形态观察[J].内蒙古农业大学学报,2009,30(4):9-13.[本文引用:2] |
| [7] | LI J X,ZHANG Y,MA L,et al.Isolation and culture of bovine mammary epithelial stem cells[J].Journal of Veterinary Medical Science,2009,71(1):15-19.[本文引用:1] |
| [8] | 王秀美,侯先志,考桂兰,等.奶牛乳腺上皮细胞的二维和三维培养及培养后酪蛋白基因的表达[J].动物营养学报,2012,24(6):1157-1164.[本文引用:1] |
| [9] | STREULI C H,BISSELL M J.Expression of extracellular matrix components is regulated by substratum[J].Journal of Cell Biology,1990,110:1405-1415.[本文引用:1] |
| [10] | LI M L,AGGELER J,FARSON D A,et al.Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells[J].Journal of Cell Biology,1987(84):136-140.[本文引用:1] |
| [11] | ELABARRE S D,CLAUDON C,LAURENT F.Influence of several extracelIular matrix components in primary cultures of bovine mammary epithelial cells[J].Tissue and Cell,1997,29(1):99-106.[本文引用:1] |
| [12] | KABOTYANSKI E B,RIJNKELAS M,ZADROWSKI C F,et al.Lactogenic hormonal induction of long-distance interactions between β-casein gene regulatory elements[J].The Journal of Biological Chemistry,2009(6):1-20.[本文引用:1] |
| [13] | ITAHANA Y,PIENS M,SUMIDA T,et al.Regulation of clusterin expression in mammary epithelial cells[J].Experimental Cell Research,2007,313(5):943-951.[本文引用:1] |
| [14] | ZAVIZION B,VAN DUFFELEN M,SCHAEFFER W,et al.Establishment and characterization of a bovine mammary epithelial cell line with unique properties[J].In Vitro Cellular and Developmental Biology:Animal,1996,32(3):138-148.[本文引用:1] |
| [15] | MUSCHLER J,LOCHTER A,ROSKELLEY C D,et al.Division of labor among the a6b4 integrin,β1 integrins,and an E3 laminin receptor to signal morphogenesis and β-casein expression in mammary epithelial cells[J].Molecular Biology of the Cell,1999,10:2817-2828.[本文引用:1] |
| [16] | LI N,ZHANG Y,NAYLOR M J,et al.β1 integrins regulate mammary gland proliferation and maintain the integrity of mammary alveoli[J].Uropean Molecular Biology Organization Journal,2005,24:1942-1953.[本文引用:1] |
| [17] | TAKAHASHI T,YAMADA O,SOARES M J,et al.Bovine prolactin-related protein-Ⅰis anchored to the extracellular matrix through interactions with type Ⅳ collagen[J].Journal of Endocrinology,2008,196:225-234[本文引用:1] |
| [18] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J].Methods,2001,25:402-408[本文引用:1] |
| [19] | FATA J E,WERB Z,BISSELL M J.Regulation of mammary gland branching morphogenesis by the extracellular matrix and its remodeling enzymes[J]. href="http://www.zl50.com/2011050751480234.html" target="_blank">Breast Cancer Research,2004,6:1-11.[本文引用:1] |
| [20] | SANTOS M F,MCCORMACK S A,GUO Z J,et al.Rho proteins play a critical role in cell migration during the early phase of mucosal restitution[J].Journal of Clinical Investigation,1997,100:216-225.[本文引用:1] |
| [21] | KAMETANI Y,TAKEICHI M.Basal to apical cadherin flow at cell junctions[J].Nature Cell Biology,2007,9:92-98.[本文引用:1] |
| [22] | YAMADA S,NELSON W J.Localized zones of Rho and Rac activities drive initiation and expansion of epithelial cell-cell adhesion[J].Journal of Cell Biology,2007,178:517-527.[本文引用:1] |
| [23] | KEMPEN L C L T,VAN DEN ORD J J,VAN MUJJEN G N P,et al.Activated leukocyte cell adhesion molecule/CD166,a marker of tumor progression in primary malignant melanoma of the skin[J].American Journal of Pathology,2000,156:769-774.[本文引用:1] |
| [24] | GAVERT N,BEN-SHMUEL A,RAVEH S,et al.L1-CAM in cancerous tissues[J].Expert Opinion on Biological Therapy,2008,8:1749-1757.[本文引用:1] |
| [25] | EWALD A J,BRENOT A,DUONG M,et al.Collective epithelial migration and cell drive mammary branching morphogenesis[J].Developmental cell,2008,14:570-581.[本文引用:1] |
| [26] | BARI M G D,GINSBURG E,PLANT J,et al.Msx2 induces epithelial-mesenchymal transition in mouse mammary epithelial cells through upregulation of Cripto-1[J].Journal of Cell Biology,2009,219:659-666.[本文引用:1] |
| [27] | DEBNATH J,MUTHUSWAMY S K,BRUGGE J S,et al.Morphogenesis and on cogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures[J].Methods,2003,30:256-268.[本文引用:2] |
| [28] | MENZIES K K,LEFEVRE C,MACMILLAN K L,et al.Insulin regulates milk protein synthesis at multiple levels in the bovine mammary gland[J].Functional & Integrative Genomic,2009,9:197-217.[本文引用:1] |
| [29] | SHEEHY P V A.DELLA-VEDOVA J J,NICHOLAS K R,et al.Hormone dependent milk protein gene expression in bovine mammary explants from biopsies at different stages of pregnancy[J].Journal of Dairy Research,2004,71:135-140.[本文引用:1] |
| [30] | TALHOUK R S,NEISWANGER R L,SCHANBACHERT F L.In vitro culture of cryopreserved bovine mammary cell on collagen gels:synthesis and secretion of casein and lactoferrin[J].Tissue and Cell,1990,22(5):583-599.[本文引用:1] |
| [31] | RILEY L G,WILLIAMSON P,WYNN P C,et al.Lactoferrin decreases primary bovine mammary epithelial cell viability and casein expression[J].Journal of Dairy Research,2008,75:135-141.[本文引用:1] |
| [32] | BLATCHFORD D R,WILDE C J,MATSUDA T,et al.Milk secretion in cultured mammary epithelial cells[J].Animal Cell Technology:Basic and Applied Aspects,1999,10:141-145.[本文引用:1] |




