菜籽饼在我国产量大,价格较低,且蛋白质含量在30%以上,是一种潜力很大的蛋白质饲料资源。但是,菜籽饼含有硫葡萄糖甙、单宁等抗营养因子[1],且蛋白质分子质量大[2],纤维物质含量高,降低了其作为饲料的安全性、适口性,以及动物对其营养物质利用率。因此,降低菜籽饼抗营养因子含量,改善其营养价值成为饲料开发行业的研究热点。化学脱毒、添加酶制剂、微生物发酵等方法是改善菜籽饼营养价值的主要手段,化学处理和添加酶制剂效果单一,成本高,而微生物发酵具有条件温和,干物质含量损失小,工艺条件简单等优势。一方面微生物发酵能够消除硫苷、纤维素和植酸等抗营养因子[3, 4, 5];另一方面微生物分泌多种酶,能改善蛋白质品质,提高养分利用效率[6, 7]。近年来,利用单菌固态发酵菜籽饼进行了 大量研究,筛选出了一些具有特定功能的菌种,例如:枯草芽孢杆菌(Bac.)、里氏木霉等,但是发酵效果单一,菜籽饼品质改善效果不明显,不能用于生产上大规模使用[8]。研究表明混菌发酵可以同时产生多种酶,弥补单菌发酵的缺陷[3, 9, 10]。为了在改善菜籽饼蛋白质品质的同时,降低抗营养因子的含量,混菌发酵具有进一步研究的必要性。
本研究以菜籽饼为原料,优化枯草芽孢杆菌、黑曲霉(Asp.)和白地霉(Geo.)混菌固态发酵(SSF)条件,在最佳发酵条件下,摸索物质变化规律,并结合中试发酵验证,考察SSF对菜籽饼营养价值和抗营养因子含量的影响,为新型生物蛋白质饲料的开发及菜籽饼的合理利用提供理论指导。
菌种:枯草芽孢杆菌、黑曲霉、白地霉均购于中国工业微生物菌种保藏中心;菜籽饼购于四川省雅安市农牧市场,为来自同种加工工艺(高温压榨,温度为130 ℃)的不同批次产品;麦麸购于四川省雅安市农牧市场。
发酵底物:菜籽饼90%,麦麸10%,尿素1.4%,加入一定量的水分搅拌均匀,自然pH。
菌种培养液:马铃薯培养液,马铃薯200 g(去皮,切成小块煮沸30 min,纱布过滤)、蔗糖20 g、蒸馏水定容至1 000 mL,自然pH,112 ℃灭菌20 min。牛肉-蛋白胨培养液,牛肉膏10 g,蛋白胨10 g,氯化钠5 g,蒸馏水定容至1 000 mL,自然pH,112 ℃灭菌20 min。
小试发酵步骤:1)将36 g菜籽饼和4 g麦麸装入250 mL三角瓶中,按一定料水比量取水,将0.56 g尿素溶于水中,加入三角瓶搅拌均匀,封口膜封口,115 ℃灭菌18 min。2)出锅后冷却,将菌种培养液以一定的接种量接入灭菌的发酵底物中,搅拌均匀,在28~30 ℃培养箱中封口发酵,每天定时翻料。发酵过程中定时取样,90 ℃恒温烘箱中灭酶活30 min,再在65 ℃烘干至恒重,待测。
接种量的计算:菌种接于菌种培养液,28 ℃条件下,恒温摇床上培养24 h的菌液混匀,稀释至吸光度值(OD)为1.5个单位,总接种量一定,为发酵底物总重的百分比。
以有效氮、小肽和硫苷降解率作为主要评判指标,确定发酵最佳条件。1)采用2×4双因素试验,考察枯草芽孢杆菌添加时间(3种菌同时添加、发酵3 d添加枯草芽孢杆菌)、菌种比例(黑曲霉∶ 白地霉∶ 枯草芽孢杆菌分别为1∶ 1∶ 1、1∶ 1∶ 2、2∶ 1∶ 2、1∶ 1∶ 3)对发酵效果的影响。2)采用3×3双因素试验,考察料水比(1.0∶ 1.0、1.0∶ 1.5和1.0∶ 2.0)和接种量(12%、16%、20%)对发酵的影响。3)按得出的以上因素最佳条件,在发酵的不同时间(0、1、2、3、4、5 d)取样,烘干,制成风干样品,测定有效氮、小肽、游离氨基酸、硫苷、粗纤维(CF)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、酸性洗涤木质素(ADL)的含量,以确定最佳发酵时间。
参照前期优化条件,采用白地霉、黑曲霉和枯草芽孢杆菌SSF,发酵混合物在消毒灭菌室静止发酵4 d,每天翻料1次。发酵结束后,发酵产品90 ℃恒温烘箱中灭酶活30 min,再风干样品得到发酵菜籽饼。
发酵混合物组成为:菜籽饼108.00 kg、麦麸12.00 kg、水100.80 L、尿素1.68 kg,喷洒枯草芽孢杆菌11.52 L、黑曲霉和白地霉分别为3.84 L,混匀。考察中试发酵前后营养物质及抗营养因子含量变化、发酵前后菜籽饼形态结构及蛋白质分子大小变化。
菜籽饼形态结构检测采用电镜扫描(SEM)法[11]。
菜籽饼蛋白质的提取:采用植物总蛋白质微量提取试剂盒提取菜籽饼总蛋白质,置于4 ℃冰箱放置,待用。
三甲基甘氨酸-十二烷基四乙酸二钠-聚丙烯酰胺凝胶电泳(Tricine-SDS-PAGE):参照Schgger[12]的方法,使用由4%浓缩胶、10%隔离胶、16%分离胶从上到下组成的3层Tricine-SDS-PAGE胶。每条泳道加样量为20 μL蛋白质提取液,20 mA恒流电泳4~5 h,考马斯亮蓝染色。
粗蛋白质(CP)采用凯氏定氮法测定;有效氮含量为凯氏定氮法测得的CP含量减去非蛋白氮含量;游离氨基酸和尿素采用全自动氨基酸分析仪(日本日立L-8800)测定;水解氨基酸采用全自动氨基酸分析仪(日本日立L-8900)测定;小肽测定参照GB/T 22492—2008;干物质(DM)采用烘箱干燥法测定;粗脂肪(EE)采用索氏抽提法测定;ADF、NDF、ADL、CF采用滤袋法测定;硫苷、异硫氰酸酯(ITC)和 唑烷硫酮(OZT)的测定分别参照NY/T 1596—2008、NY/T 1799—2009、NY/T 1582—2007,硫苷所用的标准品是烯丙基硫苷。
硫苷降解率(%)=100×(发酵前硫苷含量-发酵后硫苷含量)/发酵前硫苷含量。
试验数据通过SPSS 18.0统计软件中的一般线性模型分析,结合Duncan氏法进行多重比较,发酵过程物质含量变化采用相关性检验后进行线性回归分析。试验结果用平均值±标准误表示,P<0.05作为差异显著性标准。
通过对发酵条件的选择,以有效氮、小肽和硫苷降解率作为主要评判指标,优化出的最佳发酵条件为:3种菌同时添加,接种比例为黑曲霉:白地霉:枯草芽孢杆菌=1:1:3,接种量为16%,料水比=1:1,发酵4 d。
由表1可知,发酵时间与各常规养分(除CF外)含量呈线性相关;从发酵第0~4天,有效氮、小肽、游离氨基酸含量均显著提高(P<0.05),ADF和NDF含量显著降低(P<0.05),而在第4天和第5天变化不显著(P>0.05)。硫苷和ADL的含量到发酵第5天仍出现显著性下降(P<0.05)。发酵后,有效氮、小肽、游离氨基酸含量分别提高了13.44%、126.52%和2 426.92%,硫苷含量下降了51.96%,NDF下降了38.70%,ADF含量下降了27.88%。
| 表1 发酵时间对最佳发酵条件下菜籽饼常规养分的影响Table 1 Effects of fermentation time on common nutrients of rapeseed cake under optimal fermentation process % |
由图1可知,菜籽饼在发酵前网状结构清晰,表面光滑,排列紧密;发酵后网状结构消失,表面松散、粗糙,孔隙增加,小颗粒物增多。
由图2可知,菜籽饼蛋白质分子质量主要在60 ku以内,菜籽饼发酵后,大分子蛋白质(>20 ku)减少,分子质量主要集中在5.8 ku左右,中试发酵与小试发酵具有相似的结果,但中试发酵20 ku以上大分子质量条带几乎消失。
 | 图1 菜籽饼发酵后形态变化Fig.1 Morphologic changes of rapeseed cake after fermentation |
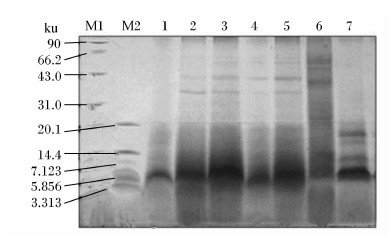 | 图2 菜籽饼发酵后蛋白质分子组成变化Fig.2 Changes of protein molecular composition of rapeseed cake after fermentation |
由表2可知,发酵后抗营养因子的含量降低,其中硫苷含量由10.04 μmol/g降低到0.65 μmol/g,降幅达到93.53%;OZT降低了36.00%,ITC完全被降解;CF、NDF、ADF、ADL分别下降了12.75%、7.20%、11.42%、10.46%。
由表3可知,有效氮、小肽、游离氨基酸含量分别提高了21.27%、385.19%、300.00%,EE的含量却降低了36.61%。水解氨基酸中赖氨酸(Lys)、苯丙氨酸(Phe)和酪氨酸(Tyr)的含量分别提高了22.73%、20.39%和20.51%,但是,蛋氨酸(Met)降到0.44%,降低了30.16%,其他氨基酸含量变化不大。
微生物发酵是改善菜籽饼营养价值的重要途径之一。研究表明,枯草芽孢杆菌是α-淀粉酶和中性蛋白酶的重要生产菌,能产胞外蛋白酶,用它发酵菜籽饼可以降低其蛋白质分子质量,增加小肽的含量[6, 13, 14];白地霉是一种类酵母真菌,在食品及饲料行业上进行了大量的研究,白地霉发酵可提高蛋白质含量,生产饲料酵母[15, 16, 17, 18];黑曲霉可以降低菜籽饼的硫苷及纤维类物质含量[19, 20]。但是,利用白地霉、黑曲霉和枯草芽孢杆菌混合固态发酵的研究还未见报道[21]。大量研究得出,SSF主要受温度、水分、菌种接种量和菌种接种比例的影响。本研究发现,菌种接种比例和料水比对发酵结果具有显著影响,随着枯草芽孢杆菌添加比例的增加,小肽和游离氨基酸含量显著增加,这主要是由于枯草芽孢杆菌产中性蛋白酶,产酶量会随着菌种量的增加而增加,接种比例为黑曲霉:白地霉:枯草芽孢杆菌=1:1:3时小肽含量最高。研究表明,SSF料水比一般在1.0:0.8~1.0:1.5[15, 22, 23],本试验结果显示,料水比=1:1时发酵效果最好。接种量的选择,各研究者报道不一样,变化范围在5%~25%,原因是菌体计量方式和发酵条件的差异。
| 表2 发酵后菜籽饼抗营养因子含量变化(干物质基础)Table 2 Changes of antinutritional factor contents of rapeseed cake after fermentation (DM basis) |
| 表3 发酵后菜籽饼常规养分和氨基酸含量的变化(干物质基础) Table 3 Changes of the contents of common nutrients and amino acids of rapeseed cake after fermentation (DM basis) % |
固态发酵改善发酵底物营养价值,降低抗营养因子含量,主要是由于微生物产生功能性酶的作用。本研究发现在一定时间内,随着发酵的进行,物质呈现一定线性变化规律,有效氮、小肽和游离氨基酸含量都呈线性增加,而硫苷和纤维类物质呈线性降低,这与Adebowale等[24]研究木豆粉发酵规律一致。但是在发酵第4~5天,小肽和游离氨基酸含量变化趋于稳定,分析可能原因是,芽孢杆菌固态发酵最佳发酵时间一般在36~72 h[25, 26],发酵到后期,菌落进入衰亡期,次级代谢产物分泌增加,培养基温度升高,蛋白酶的产量降低导致小肽和游离氨基酸含量增加速度变慢。较细菌而言,霉菌的最佳培养时间长,达到产酶高峰期的时间也较长,研究用黑曲霉发酵大豆皮和麦麸产纤维素酶时,在发酵96 h获得最高的产酶量[20],在72 h纤维素酶达到最佳产量[27],生长的不同步性表明枯草芽孢杆菌达到衰亡期,此时白地霉和黑曲霉还处在生长旺盛期,产酶量仍然较高,因此在发酵的第5天仍然有显著的变化。
从形态学观测,菜籽饼发酵后结构由光滑变得疏松多孔,网状结构消失,分析原因可能是由于菌株分泌的酶的水解作用,使纤维结构受到破坏,这也是发酵后纤维物质的含量下降的一个重要原因;由于酶的水解作用首先发生在物质的表面,逐步进入物质内部,从而产生了不同程度的疏松和孔隙[28];结构疏松多孔,将增加消化酶的接触面积,从而更有利于动物对营养物质的消化吸收。
菜籽饼的蛋白质结构受多种因素的影响,包括油菜籽品种、加工工艺条件等。研究表明,菜籽饼的蛋白质含量一般在30%以上,主要由球蛋白和白蛋白组成,还有一部份硫素蛋白、胰蛋白酶抑制因子等,氨基酸组成比较平衡[2],但受加工过程的影响一些含硫氨基酸受到破坏,本研究中菜籽饼水解氨基酸含量与李波等[29]及中国饲料成分及营养价值表(2010年)报道相近,但本试验中半胱氨酸(Cys)含量较低。动物对蛋白质及氨基酸的消化利用率是评判饲料蛋白质品质的主要标准,而饲料中蛋白质分子质量越小,氨基酸组成越平衡,小肽含量越高,越容易被动物消化吸收。从蛋白质电泳图可以观测到,菜籽饼是由多条不同分子质量的蛋白质条带组成,发酵后蛋白质分子明显集中在5.8 ku左右,表明发酵改变了蛋白质分子结构,与王刚[22]的结果一致。发酵后,氨基酸含量发生变化,主要与微生物复杂的分解合成代谢过程有关,具体机理需要进一步研究,最后总必需氨基酸和总非必需氨基酸含量变化不大,有效氮、小肽和游离氨基酸含量显著增加分别提高了21.27%、385.19%、300.00%,揭示了小试优化的发酵条件在中试发酵的可行性,也表明发酵后菜籽饼的蛋白质品质得到显著提高。微生物发酵降低菜籽饼抗营养因子的研究较多,鞠兴荣等[14]用枯草芽孢杆菌与宇佐美曲霉混菌发酵菜籽粕硫苷降解率最高达到79.49%,叶龙翔等[30]用黑曲霉、酵母菌和木霉(1:2:1)SSF硫苷降解率最高达到89.49%,王晓凡等[31]用多菌复合固态发酵菜籽粕硫苷降解率达到91.36%,本研究菜籽饼发酵后硫苷含量为0.65 μmol/g,降低了93.4%,OZT完全被降解。硫苷及其代谢产物是菜籽饼中主要的抗营养因子,能够降低动物采食量、蛋白质的消化率和氨基酸的可利用率,影响甲状腺功能等。不同动物品种对硫苷的耐受力不同,反刍动物、猪、兔子、家禽、鱼类对其耐受范围分别为1.55~4.22 μmol/g、0.78、7.0、5.4、3.6 μmol/g[32]。由此可见,本试验条件下发酵菜籽饼主要的抗营养因子已经基本去除,对动物的安全性和适口性显著提高,有利于动物对营养物质的消化吸收。
① 混菌固态发酵菜籽饼最佳的发酵条件为,3种菌同时添加,接种比例为黑曲霉:白地霉:枯草芽孢杆菌=1:1:3,接种量为16%,料水比=1:1,发酵4 d。
② 通过白地霉、黑曲霉和枯草芽孢杆菌固态发酵菜籽饼,能够显著提高有效氮、小肽和游离氨基酸含量,显著降低硫苷及其代谢产物等抗营养因子的含量,有利于改善菜籽饼的饲用价值。
| [1] | KHATTAB R,GOLDBERG E,LIN L,et al.Quantitative analysis and free-radical-scavenging activity of chlorophyll,phytic acid,and condensed tannins in canola[J].Food Chemistry,2010,122(4):1266-1272.[本文引用:1] |
| [2] | AIDER M,BARBANA C.Canola proteins:composition,extraction,functional properties,bioactivity,applications as a food ingredient and allergenicity-a practical and critical review[J].Trends in Food Science & Technology,2011,22(1):21-39.[本文引用:2] |
| [3] | COUTO S R,SANROMN M A.Application of solid-state fermentation to food industry-a review[J].Journal of Food Engineering,2006,76(3):291-302.[本文引用:2] |
| [4] | ARO S.Improvement in the nutritive quality of cassava and its by-products through microbial fermentation[J].African Journal of Biotechnology,2010,7(25):4789-4797.[本文引用:1] |
| [5] | RAMACHANDRAN S,ROOPESH K,NAMPOOTHIRI K M,et al.Mixed substrate fermentation for the production of phytase by Rhizopus spp. using oilcakes as substrates[J].Process Biochemistry,2005,40(5):1749-1754.[本文引用:1] |
| [6] | MUKHERJEE A K,ADHIKARI H,RAI S K.Production of alkaline protease by a thermophilic Bacillus subtilis under solid-state fermentation (SSF) condition using Imperata cylindrica grass and potato peel as low-cost medium:characterization and application of enzyme in detergent formulation[J].Biochemical Engineering Journal,2008,39(2):353-361.[本文引用:2] |
| [7] | GRAMINHA E,GONCALVES A,PIROTA R,et al.Enzyme production by solid-state fermentation:application to animal nutrition[J].Animal Feed Science and Technology,2008,144(1):1-22.[本文引用:1] |
| [8] | SINGHANIA R R,PATEL A K,SOCCOL C R,et al.Recent advances in solid-state fermentation[J].Biochemical Engineering Journal,2009,44(1):13-18.[本文引用:1] |
| [9] | MADEIRA J V,MACEDO J A,MACEDO G A.A new process for simultaneous production of tannase and phytase by Paecilomyces variotii in solid-state fermentation of orange pomace[J].Bioprocess and Biosystems Engineering,2012,35(3):477-482.[本文引用:1] |
| [10] | MADEIRA J V,MACEDO J A,MACEDO G A.Detoxification of castor bean residues and the simultaneous production of tannase and phytase by solid-state fermentation using Paecilomyces variotii[J].Bioresource Technology,2011,102(15):7343-7348.[本文引用:1] |
| [11] | ARAÙJO M A,CUNHA A M,MOTA M.Changes in morphology of starch-based prothestic thermoplastic material during enzymatic degradation[J].Journal of Biomaterials Science,2004,15(10):1263-1280.[本文引用:1] |
| [12] | SCHÄGGER H.Tricine-SDS-PAGE[J].Nature Protocols,2006,1(1):16-22.[本文引用:1] |
| [13] | JOO H S,CHANG C S.Production of an oxidant and SDS-stable alkaline protease from an alkaophilic Bacillus clausii Ⅰ-52 by submerged fermentation:feasibility as a laundry detergent additive[J].Enzyme and Microbial Technology,2006,38(1):176-183.[本文引用:1] |
| [14] | 鞠兴荣,王雪峰,王立峰,等.混菌固态发酵菜籽粕制备菜籽肽的菌种筛选[J].食品与发酵工业,2011,37(9):104-108.[本文引用:2] |
| [15] | 顾斌,马海乐,刘斌.菜籽粕混菌固态发酵制备多肽饲料的研究[J].中国粮食油学报,2011,26(1):83-87.[本文引用:2] |
| [16] | 周剑丽,胡建锋,陈秀勇,等.响应面法优化白地霉发酵麻疯树饼粕产蛋白质饲料工艺条件[J].中国饲料,2009(5):40-43,47.[本文引用:1] |
| [17] | 张应莲,黄永光,邱树毅.酱香大曲中白地霉产蛋白酶固态发酵条件及其优化[J].中国酿造,2012,31(003):35-38.[本文引用:1] |
| [18] | LEI H,WANG H,NING T,et al.Protein enrichment of potato starch residue by solid state fermentation with mixed strains[J].Journal of Animal and Veterinary Advances,2012,11(15):2700-2705.[本文引用:1] |
| [19] | GAMARRA N N,VILLENA G K,GUTI RREZ-CORREA M.Cellulase production by Aspergillus niger in biofilm,solid-state,and submerged fermentations[J].Applied Microbiology and Biotechnology,2010,87(2):545-551.[本文引用:1] |
| [20] | BRIJWANI K,OBEROI H S,VADLANI P V.Production of a cellulolytic enzyme system in mixed-culture solid-state fermentation of soybean hulls supplemented with wheat bran[J].Process Biochemistry,2010,45(1):120-128.[本文引用:2] |
| [21] | KRISHNA C.Solid-state fermentation systems-an overview[J].Critical Reviews in Biotechnology,2005,25(1/2):1-30.[本文引用:1] |
| [22] | 王刚.微生物发酵改善菜籽粕品质的初步研究.硕士学位论文.无锡:江南大学,2011,15-35.[本文引用:2] |
| [23] | 辜旭辉,张永光,赵国明,等.混菌固态发酵法提高菜籽粕饲用价值的研究[J].安徽农业科学,2010(14):7398-7400.[本文引用:1] |
| [24] | ADEBOWALE O,MALIKI K.Effect of fermentation period on the chemical composition and functional properties of Pigeon pea (Cajanus cajan) seed flour[J].International Food Research Journal,2011,18:1329-1333.[本文引用:1] |
| [25] | 张智,朱宏亮,钮宏禹,等.响应面法优化枯草芽孢杆菌产蛋白酶的发酵条件[J].食品科学,2008,29(12):400-404.[本文引用:1] |
| [26] | 姚刚,程建军,孙鹏,等.枯草芽孢杆菌发酵产碱性蛋白酶的研究[J].食品科学,2009,30(23):347-351.[本文引用:1] |
| [27] | 冯培勇,赵彦宏,张丽.响应面法优化黑曲霉产纤维素酶发酵条件[J].食品科学,2009,30(23):335-339.[本文引用:1] |
| [28] | GILANI G S,COCKELL K A,SEPEHR E.Effects of antinutritional factors on protein digestibility and amino acid availability in foods[J].Journal of AOAC International,2005,88(3):967-987.[本文引用:1] |
| [29] | 李波,陈代文,毛湘冰,等.不同加工工艺对菜籽饼粕化学组成及猪养分消化率的影响[J].中国畜牧杂志,2012,48(5):50-54.[本文引用:1] |
| [30] | 叶龙祥,牛兴亮.菜籽粕混菌发酵脱毒研究[J].粮食与食品工业,2010,17(4):41-44.[本文引用:1] |
| [31] | 王晓凡,王海滨,熊光权,等.多菌种复合固态发酵对菜籽粕硫甙去除效果的研究[J].食品科技,2012(3):205-209.[本文引用:1] |
| [32] | TRIPATHI M K,MISHRA A S.Glucosinolates in animal nutrition:a review[J].Animal Feed Science and Technology,2007,132(1/2):1-27.[本文引用:1] |




