从单细胞真核生物到人类,雷帕霉素靶蛋白(TOR)在结构和功能上都是相当保守的,它是一个非典型的丝氨酸/苏氨酸激酶,最早是在酿酒酵母中作为雷帕霉素的靶物被发现的[1]。随后在很多物种包括原生动物(布氏锥虫、粟酒裂殖酵母)、光合生物(拟南芥、莱茵衣藻)、后生动物(秀丽隐杆线虫、果蝇)和哺乳动物中均发现了TOR的存在。TOR整合多种刺激物调控生长、代谢和衰老[2, 3, 4, 5, 6]。在哺乳动物中,哺乳动物雷帕霉素靶蛋白(mTOR)能够被营养物质、生长因子以及细胞能量激活,受到胁迫后mTOR被抑制。mTOR的分子调控机制是极其复杂和多样的,近年来在mTOR的调节因子不断被发现同时,小G蛋白受到越来越多的关注。
小G蛋白是和异三聚体G蛋白α亚基偶联的单体鸟苷酸结合蛋白,分子质量约为21~30 ku。根据序列结构特征,小G蛋白被分为5个亚家族:Ras、Rho、Rab、Sar1/Arf和Ran[7, 8, 9],每个亚家族在细胞中起着不同的作用。Rheb、Rag、RalA、Rac1和Rab5都属于小G蛋白亚家族成员,在不同的刺激物作用下协同调控mTOR信号通路。本文综述了多种小G蛋白调控mTOR信号通路的最新进展。
对多种小G蛋白晶体结构进行核磁共振分析表明,小G蛋白都含有1个20 ku的三磷酸鸟苷(GTP)结合结构域[8, 10]。该结构域包括5个α螺旋(A1~A5)、6个β折叠(B1~B6)和5个环(loop,G1~G5)。其中5个环是GTP结合结构域最保守的结构元件。小G蛋白家族成员都含有4个鸟核苷酸结合区,1个效应器分子结合区和1个插入序列 ,这几个保守的结构域决定了小G蛋白的功能,而其在细胞内结合的位置取决于C端可变区域[11]。
小G蛋白对上、下游的调控机制如图1所示,质膜上的鸟苷酸交换因子(GEF)通过二磷酸鸟苷(GDP)/GTP的交换反应,催化结合GDP的非活化状态的小G蛋白转化为GTP结合形式的活化状态。此时处于活化态的小G蛋白就可以通过其上游的效应器结合位点与下游的1个或多个特异的效应器分子相互作用,进而执行不同的细胞生理功能。小G蛋白自身具有微弱的GTPase活性,可以把GTP水解为GDP+磷酸(Pi);GTPase激活蛋白(GAP)可以激活小G蛋白的水解活性,有效地将GTP水解掉,从而恢复小G蛋白的非活化状态。这样小G蛋白又可以开始新一周期的循环过程。大多数小G蛋白都有2种存在方式,一种是与质膜结合,另一种是在胞质中游离。只有与质膜结合的小G蛋白才能被GEF激活,胞质形式的小G蛋白可以与一种鸟苷酸解离抑制因子(GDI)结合,在它的负调节作用下,小G蛋白才能与膜解离,从而负调控小G蛋白的GTPase活性。小G蛋白上述复杂的调节方式在所有有机体中保守存在。尽管小G蛋白的分子质量很小,但是它通过与各种调控因子及效应器的相互作用在生物体各种生命活动中发挥极其重要的作用。
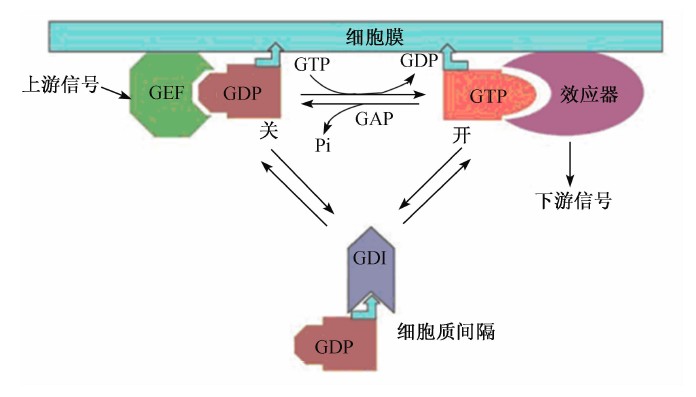 | 图1 小G蛋白的调控机制
Fig.1 Regulation mechanism of small G proteins[11] |
mTOR信号通路由于处于生长调节的中心环节而倍受关注。哺乳动物雷帕霉素靶蛋白复合体1(mTORC)由2个功能和结构都不同的多蛋白复合物mTORC1和mTORC2构成[6]。mTORC1调控蛋白质和核糖体的生物合成、营养物质的吸收和细胞自噬等过程。mTORC2调控肌动蛋白细胞骨架的排列、细胞的存活、脂质的合成等过程。一般认为,mTORC1对雷帕霉素敏感,而mTORC2对雷帕霉素不敏感。但是在哺乳动物细胞系中,长时间用雷帕霉素处理能够间接抑制mTORC2[12]。此外,越来越多的证据表明,并非所有的mTORC1都对雷帕霉素敏感[13, 14 15]。
哺乳动物含有1个mTOR,mTORC1的核心组分是mTOR、Raptor和mLST8。其他蛋白质如调控因子PRAS40和Deptor,直接与mTORC1结合从而调控它的酶活[16, 17, 18, 19]。在这些调控因子中最重要的是小G蛋白Rheb和Rag[2, 20]。哺乳动物mTORC2由mTOR、Rictor、mSIN1、mLST8和PRR5构成。与mTORC1类似,Deptor也与mTORC2结合调控它的酶活[16]。
现在普遍认为生长因子通过磷脂酰肌醇3激酶(PI3K)-蛋白激酶B(AKT)通路激活mTORC1。mTORC1被激活后,AKT磷酸化并且抑制异源二聚体结节硬化症蛋白1(TSC1)-结节硬化症蛋白2(TSC2)的形成,TSC2作为GAP使Rheb失活,从而抑制mTORC1活性[2]。TSC1-TSC2异源二聚体是一个“接收中心”,接收来自外界的各种刺激然后将信号传至mTORC1:通过AKT和细胞外调节蛋白激酶(ERK)通路传导生长因子信号;通过缺氧诱导因子1(HIF1)和发育及DNA损伤反应调节因子1(REDD1)传导组织缺氧信号;通过AMPK通路传导能量状态信号[5]。
当营养物质特别是氨基酸存在的条件下,Rag GTPases是激活mTORC1所必需的[20]。在哺乳动物中,氨基酸诱导细胞内钙离子浓度增加,通过第3类PI3K或者Ⅲ型磷脂酰肌醇3激酶(Vps34)激活mTORC1[21]。Ste20类激酶丝裂原活化蛋白激酶激酶激酶激酶3(MAP4K3)也参与mTORC1的活化[22, 23]。上述营养信号通路之间功能是否相关目前尚不清楚。我们对mTORC2的调控机制知之甚少。哺乳动物中的胰岛素通过PI3K介导mTORC2信号通路,活化的mTORC2直接与核糖体结合[24]。
在哺乳动物中,了解得最清楚的mTORC1的底物是核糖体蛋白S6激酶(S6K)和4E结合蛋白1(4E-BP1)。mTORC1激活S6K,S6K正调控蛋白质合成;mTORC1抑制4E-BP1,4E-BP1负调控蛋白质合成。磷酸化后的4E-BP1释放真核细胞翻译起始因子4E(eIF4E)。eIF4E与真核细胞翻译起始因子4F(eIF4F)复合物中的真核细胞翻译起始因子4G(eIF4G)亚单位结合,翻译起始。哺乳动物中的4E-BP1主要参与调控细胞增殖与代谢[14]。mTORC2对雷帕霉素不敏感,可能由于这个原因,它的下游相对mTORC1我们了解的较少。mTORC2调控肌动蛋白骨架的排列,以及哺乳动物中AGC激酶家族成员AKT、血清和糖皮质激素诱导的蛋白激酶1(SGK1)和蛋白激酶C(PKC)的磷酸化和活化[25]。
小G蛋白Rheb于1994年首次被发现[26],最初报道它是和Raf1激酶的相互作用[27]。2003年,哺乳动物细胞体外试验和果蝇体内试验证实Rheb是TSC1-TSC2的靶物,激活mTORC1[2]。哺乳动物有2个Rheb基因,分别为Rheb1和Rheb2[28]。Rheb1 mRNA普遍存在于机体的不同组织内,而Rheb2主要分布在大脑中[26]。Rheb激活mTORC1的作用机制尚未完全了解。Rheb直接与mTOR结合[29],但是这种相互作用非常微弱,并没有在内源蛋白质中被证实。通常结合了GTP的小G蛋白才能与下游效应器分子结合,但是Rheb的活化状态并不影响Rheb和mTOR的相互作用。与活化状态的Rheb结合,mTOR激酶活性被激活[17],与失活状态的Rheb结合,mTOR即失去活性[29]。Rheb的同系物Rhes也能够直接结合并激活mTOR,Rhes(-/-)小鼠表现出减弱的mTOR活性[30]。
TSC1-TSC2复合物受生长因子刺激,在调控Rheb中发挥关键作用。TSC1-TSC2复合物定位于质膜,发挥GAP功能,抑制Rheb活性,从而抑制mTORC1活性。生长因子诱导AKT、ERK和S6K等激酶磷酸化TSC2,从而抑制TSC1-TSC2复合物的形成[21]。磷酸化的TSC2迁移至细胞质中,因而Rheb和mTORC1都被活化[31]。TSC1-TSC2-Rheb途径也参与应激介导的mTORC1活化。氧化还原应激能激活Rheb和mTORC1活性[32]。
Rheb除了和mTOR直接结合外,还可以通过催化磷脂酸(PA)的生成来调控mTORC1。活化的Rheb结合并激活磷脂酶D(PLD)[33],PLD生成PA,PA直接结合并上调mTORC1。这个发现揭示了TSC1-TSC2-Rheb和PA途径在调控mTORC1信号通路中的交互对话。Yoon等[34]最新的研究阐明了PLD在调控mTORC1中的功能。氨基酸激活PLD,PLD迁移至溶酶体区域,这种迁移是激活mTORC1所必需的。
FK506结合蛋白38(FKBP38)是FK56结合蛋白家族成员之一,是mTOR的抑制因子。Rheb与FKBP38的相互作用阻止了FKBP38与mTOR的结合,从而逆转FKBP38对mTOR的抑制作用[35, 36]。Rheb还可以通过FKBP38活化蛋白激酶(PRAK)调控mTORC1[37]。该报道利用哺乳动物细胞培养技术,证实能量胁迫激活FKBP38β-PRAK级联。PRAK直接结合Rheb并磷酸化其130位的丝氨酸,使之失活,从而抑制mTORC1活性。FKBP38α的下游激酶丝裂原活化蛋白激酶激活蛋白激酶2(MK2)使TSC2中的1 210位丝氨酸磷酸化,抑制TSC2,从而活化Rheb和mTORC1[38]。FKBP38β通过磷酸化Raptor,参与亚砷酸盐诱导的mTORC1活化[39]。
Rheb是氨基酸对mTORC1信号通路的调控所必需的,现在普遍承认的模型是氨基酸介导mTORC1复合体迁移至溶酶体表面,与GTP结合形式的Rheb相互作用,mTORC1随之被活化[20]。但是,氨基酸上游调节Rheb的作用机制目前尚未明晰。
与其他Ras GTPase亚家族成员相比,Rag具有以下独特结构:它们形成异源二聚体,缺少膜定位序列[40]。1998年,哺乳动物的RagA和RagB首先被鉴定出来,随后RagC和RagD也被发现,它们分别与RagA和RagB形成异源二聚体[41]。最近有文献报道Rag参与调控mTOR信号通路,它是氨基酸诱导下TORC1的活化所必需的[20]。目前公认的氨基酸诱导下Rag蛋白调控mTORC1的模型是:Rag异源二聚体被调节子MP1-p14-p18锚定在溶酶体表面[42],信号接头p62与Rags结合,促进Rag复合物的形成,最终激活mTORC1[43]。在氨基酸缺乏的情况下,Rag异源二聚体中的RagA或RagB与GDP结合,导致mTORC1复合物不能转移至溶酶体表面,只能以非活化形式分散在细胞质中[20, 44]。
细胞中氨基酸的存在诱导RagA、RagB从GDP结合形式转化为GTP结合形式,这种转化机制目前尚不十分清楚。最近有文献报道了几种调控氨基酸诱导的mTORC1活性的关键因子。乙肝病毒X蛋白结合蛋白(HBXIP)和C7orf59这2种调节因子对于RagA和RagB具有核苷酸交换的活性,并且以氨基酸依赖型和空泡型三磷酸腺苷酶(V-ATPase)依赖型的方式与Rag异二聚体相互作用,行使Rag的GEF功能[45]。另一个调节因子亮氨酸-tRNA合成酶(LRS)通过鉴别细胞内亮氨酸的浓度和分子的变化来诱导mTORC1的活性。LRS直接结合在Rag GTPase上,作为Rag激活mTORC1途径的GAP蛋白[46]。
除了小G蛋白Rheb和Rag,PA也能够结合并激活mTORC1。PLD是mTORC1的正向调节因子,它介导卵磷脂水解生成PA。通过抑制PA的合成,抑制PLD活性,mTORC1的活性也随之减弱[47]。RalA参与PA激活mTORC1这一过程[48, 49]。RalA通过促进PLD与ARF6的结合,从而激活PLD[50]。抑制RalA活性,但是超表达Rheb组成型活化突变体仍能阻止氨基酸和葡萄糖诱导的mTORC1活化,说明RalA参与Rheb调控的mTORC1活化过程[48]。在人类癌细胞中,营养物质的加入诱导PLD和mTORC1的活化,这个过程需要RalA和ARF6的参与[49],因此,RalA-ARF6-PLD复合物应答营养物质,调控mTORC1活性。
在哺乳动物中,小G蛋白Rho亚家族最主要的成员是RhoA、Rac1和Cdc42。雷帕霉素抑制RhoA、Cdc42和Rac1蛋白的合成和活化。mTORC1介导的S6K1和4E-BP1信号途径参与这几个GTPases的蛋白质合成。表达组成型活化的RhoA对雷帕霉素抑制的细胞迁移产生抗性,因此雷帕霉素对细胞迁移的抑制可能是由于mTORC1信号通路对RhoA蛋白的下调表达引起的[51]。雷帕霉素处理降低RhoA、Cdc42和Rac1的mRNA水平,雷帕霉素通过mTOR介导的小G蛋白RhoA、Cdc42和Rac1信号途径抑制老鼠卵母细胞成熟过程中纺锤体的迁移和不对称分裂[52]。通过抑制mTORC1和mTORC2,小G蛋白RhoA和Rac1的活性也降低。研究发现升高的mTORC1和mTORC2活性通过RhoA和Rac1信号通路调控结肠直肠癌(CRC)的扩散[53]。神经酰胺1-磷酸盐(C1P)磷酸化RhoA,抑制RhoA下游效应器分子Rho相关蛋白激酶(ROCK)均能阻断mTOR信号通路和细胞增殖,表明mTORC1和RhoA-ROCK途径共同参与C1P诱导的巨噬细胞增殖[54]。
Rac1的活化促进肌动蛋白聚合和扇状伪足的形成[55]。P-Rex1是Rac1的GEF,P-Rex1直接与mTORC2结合,随后被mTORC2激活[56]。mTORC2调控Rac1活性,mTORC2通过Rac1将信号传到肌动蛋白细胞骨架[57]。除了作为mTORC2的靶物,最近有文献报道Rac1作用于mTOR的上游。哺乳动物中Rac1的抑制阻断了生长因子诱导的mTORC1和mTORC2的活化[58]。酪氨酸依赖的信号级联激活mTOR,mTOR直接与Rac1作用调控其活性。mTOR-Rac1轴在调控血小板功能中发挥关键作用[59]。
与P-Rex1相似,Rac1也直接与mTOR结合。这种互作被认为参与mTORC1和mTORC2的定位,因为Rac1的缺失影响mTOR的亚细胞定位。有趣的是,Rac1调控mTORC1和mTORC2不依赖Rac1与GTP的结合[58]。因此,Rac1与mTOR关系复杂,它能够直接与mTORC1和mTORC2结合,同时作用于二者的上游和下游。
在哺乳动物细胞中,组成型活化的Rab5和Arf1明显抑制mTORC1活性。Rab5和Arf1对mTORC1的作用是氨基酸依赖性的,葡萄糖诱导的mTORC1活化并不被Rab5或Arf1阻断。Rab5、Rab7、Rab10或Rab31的组成型活化突变体可以有效抑制人类细胞中S6K的磷酸化。Rab5在调控mTORC1活性中可能发挥了尤为重要的作用,因为Rab5的组成型活化突变体抑制Rag参与的S6K磷酸化,并不干扰Rheb对mTORC1的活化[60]。最近研究表明Rab5调控mTORC1的活性和定位,同时Rab5调控磷脂酰肌醇-3-磷酸(PI3P)的合成对mTORC1功能的维持至关重要[61]。
除了mTORC1,Rab家族成员还可以调控mTORC2。目前没有试验上的证据将哺乳动物中的Rab6与mTOR途径联系起来,但是有趣的是,人类Rab6在裂殖酵母中表达可以激活mTORC2,说明Rab6作为mTOR正向调控子的功能可能是保守的[62]。
本文综述了小G蛋白调控mTOR信号通路的最新研究进展。然而,现在缺少的是一系列mTOR调控子的整合,特别是不同小G蛋白亚家族成员之间是如何协同作用,共同调控mTOR信号通路,目前仍不十分明确。进一步了解小G蛋白的GEF-GAP系统是如何被调控的以及mTOR如何辨别从不同的GTP酶接收的各种信号将是未来研究的重点。
mTOR和小G蛋白是癌症治疗的靶物[63, 64]。小G蛋白与肿瘤的关系为当今研究热点,针对GTP酶使用法呢酰基转移酶抑制剂或香叶草基-香叶草基转移酶抑制剂,会影响信号转导通路、细胞周期、细胞增殖和细胞的生存。这2种类型的抑制剂,目前正用于癌症治疗[63]。此外对mTOR信号通路的深入研究将为肿瘤和相关代谢性疾病的治疗提供新的思路和方法。mTOR分子抑制剂是新型抗肿瘤靶向药物,在肿瘤的药物治疗中将起重要作用。
由于肿瘤的发生是多因素多步骤的机制,针对单一基因的治疗不足以抑制肿瘤生长,部分肿瘤对单一雷帕霉素衍生物治疗呈低反应性,因此研究mTOR抑制剂与其他抗癌药物联合应用的可行性迫在眉睫,这样不仅可以提高肿瘤的临床治疗效果,而且可减少耐药性的产生。研究表明Rheb和mTORC1可以作为缺血性心肌损伤[65]和前列腺癌[66]的治疗靶物。Rhe与mTORC1也将成为治疗帕金森疾病的潜在靶物[67]。因此更好地理解小G蛋白与mTOR之间的关系对癌症联合疗法的设计至关重要。
| [1] | HEITMAN J,MOVVA N R,HALL M N.Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast[J]. Science,1991,253:905-909. ( 1) 1)
|
| [2] | AVRUCH J,LONG X,ORTIZ-VEGA S,et al.Amino acid regulation of TOR complex 1[J]. Amrican Journal of Physiology:Endocrinology of Metabolism,2009,296(4):E592-E602. ( 4) 4)
|
| [3] | KIM J,GUAN K L.Amino acid signaling in TOR activation[J]. Annual Review of Biochemistry,2011,80:1001-1032. ( 1) 1)
|
| [4] | SOULARD A,COHEN A,HALL M N.TOR signaling in invertebrates[J]. Current Opinion in Cell Biology,2009,21(6):825-836. ( 1) 1)
|
| [5] | WULLSCHLEGER S,LOEWITH R,HALL M N.TOR signaling in growth and metabolism[J]. Cell,2006,124(3):471-484. ( 2) 2)
|
| [6] | ZONCU R,EFEYAN A,SABATINI D M.mTOR:from growth signal integration to cancer,diabetes and ageing[J]. Nature Reviews:Molecular Cell Biology,2011,12(1):21-35. ( 2) 2)
|
| [7] | BISCHOFF F,MOLENDIJK A,RAJENDRAKUMAR C S,et al.GTP-binding proteins in plants[J]. Cellular and Molecular Life Sciences,1999,55(2):233-256. ( 1) 1)
|
| [8] | PADUCH M,JELEN F,OTLEWSKI J.Structure of small G proteins and their regulators[J]. Acta Biochimica Polonica,2001,48(4):829-850. ( 2) 2)
|
| [9] | TAKAI Y,SASAKI T,MATOZAKI T.Small GTP-binding proteins[J]. Physiological Reviews,2001,81(1):153-208. ( 1) 1)
|
| [10] | BOURNE H R,SANDERS D A,MCCORMICK F.The GTPase superfamily:conserved structure and molecular mechanism[J]. Nature,1991,349:117-127. ( 1) 1)
|
| [11] | YANG Z.Small GTPase:versatile signaling switches in plants[J]. The Plant Cell,2002,14:S375-S388. ( 2) 2)
|
| [12] | SARBASSOV D D,ALI S M,SENGUPTA S,et al.Prolonged rapamycin treatment inhibits mTORC2 assembly and Akt/PKB[J]. Molecular Cell,2006,22(2):159-168. ( 1) 1)
|
| [13] | CHOO A Y,BLENIS J.Not all substrates are treated equally:implications for mTOR,rapamycin-resistance and cancer therapy[J]. Cell Cycle,2009,8(4):567-572. ( 1) 1)
|
| [14] | DOWLING R J,TOPISIROVIC I,ALAIN T,et al.mTORC1-mediated cell proliferation,but not cell growth,controlled by the 4E-BPs[J]. Science,2010,328:1172-1176. ( 2) 2)
|
| [15] | PETERSON T R,SENGUPTA S S,HARRIS T E,et al.mTOR complex 1 regulates lipin 1 localization to control the SREBP pathway[J]. Cell,2011,146(3):408-420. ( 1) 1)
|
| [16] | PETERSON T R,LAPLANTE M,THOREEN C C,et al.DEPTOR is an mTOR inhibitor frequently overexpressed in multiple myeloma cells and required for their survival[J]. Cell,2009,137(5):873-886. ( 2) 2)
|
| [17] | SANCAK Y,THOREEN C C,PETERSON T R,et al.PRAS40 is an insulin-regulated inhibitor of the mTORC1 protein kinase[J]. Molecular Cell,2007,25(6):903-915. ( 2) 2)
|
| [18] | THEDIECK K,POLAK P,KIM M L,et al.PRAS40 and PRR5-like protein are new mTOR interactors that regulate apoptosis[J]. PLoS One,2007,2(11):e1217. ( 1) 1)
|
| [19] | VANDER HAAR E,LEE S I,BANDHAKAVI S,et al.Insulin signalling to mTOR mediated by the Akt/PKB substrate PRAS40[J]. Nature Cell Biology,2007,9(3):316-323. ( 1) 1)
|
| [20] | SANCAK Y,PETERSON T R,SHAUL Y D,et al.The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1[J]. Science,2008,320:1496-1501. ( 5) 5)
|
| [21] | GULATI P,GASPERS L D,DANN S G,et al.Amino acids activate mTOR complex 1 via Ca2+/CaM signaling to hVps34[J]. Cell Metabolism,2008,7(5):456-465. ( 2) 2)
|
| [22] | FINDLAY G M,YAN L,PROCTER J,et al.A MAP4 kinase related to Ste20 is a nutrient-sensitive regulator of mTOR signalling[J]. The Biochemical Journal,2007,403(1):13-20. ( 1) 1)
|
| [23] | YAN L,MIEULET V,BURGESS D,et al.PP2A T61 epsilon is an inhibitor of MAP4K3 in nutrient signaling to mTOR[J]. Molecular Cell,2010,37(5):633-642. ( 1) 1)
|
| [24] | ZINZALLA V,STRACKA D,OPPLIGER W,et al.Activation of mTORC2 by association with the ribosome[J]. Cell,2011,144(5):757-768. ( 1) 1)
|
| [25] | CYBULSKI N,HALL M N.TOR complex 2:a signaling pathway of its own[J]. Trends in Biochemical Sciences,2009,34(12):620-627. ( 1) 1)
|
| [26] | YAMAGATA K,SANDERS L K,KAUFMANN W E,et al.Rheb,a growth factor-and synaptic activity-regulated gene,encodes a novel Ras-related protein[J]. The Journal of Biological Chemistry,1994,269(23):16333-16339. ( 2) 2)
|
| [27] | YEE W M,WORLEY P F.Rheb interacts with Raf 1 kinase and may function to integrate growth factor-and protein kinase A dependent signals[J]. Molecular and Cellular Biology,1997,17(2):921-933. ( 1) 1)
|
| [28] | PATEL P H,THAPAR N,GUO L,et al.Drosophila Rheb GTPase is required for cell cycle progression and cell growth[J]. Journal of Cell Science,2003,116:3601-3610. ( 1) 1)
|
| [29] | LONG X,LIN Y,ORTIZ-VEGA S,et al.Rheb binds and regulates the mTOR kinase[J]. Current Biology,2005,15(8):702-713. ( 2) 2)
|
| [30] | SUBRAMANIAM S,NAPOLITANO F,MEALER R G,et al.Rhes,a striatal-enriched small G protein,mediates Mtor signaling and L-DOPA-induced dyskinesia[J]. Nature Neuroscience,2011,15(2):191-193. ( 1) 1)
|
| [31] | CAI S L,TEE A R,SHORT J D,et al.Activity of TSC2 is inhibited by AKT-mediated phosphorylation and membrane partitioning[J]. The Journal of Cell Biology,2006,173(2):279-289. ( 1) 1)
|
| [32] | YOSHIDA S,HONG S,SUZUKI T,et al.Redox regulates mammalian target of rapamycin complex 1 (mTORC1) activity by modulating the TSC1/TSC2-Rheb GTPase pathway[J]. The Journal of Biological Chemistry,2011,286(37):32651-32660. ( 1) 1)
|
| [33] | SUN Y,FANG Y,YOON M S,et al.Phospholipase D1 is an effector of Rheb in the mTOR pathway[J]. Proceedings of the National Academy of Sciences of the USA,2008,105(24):8286-8291. ( 1) 1)
|
| [34] | YOON M S,DU G,BACKER J M,et al.Class Ⅲ PI 3 kinase activates phospholipase D in an amino acid-sensing mTORC1 pathway[J]. The Journal of Cell Biology,2011,195(3):435-447. ( 1) 1)
|
| [35] | BAI X,MA D,LIU A,et al.Rheb activates mTOR by antagonizing its endogenous inhibitor,FKBP38[J]. Science,2007,318:977-980. ( 1) 1)
|
| [36] | DUNLOP E A,DODD K M,SEYMOUR L A,et al.Mammalian target of rapamycin complex 1-mediated phosphorylation of eukaryotic initiation factor 4E-binding protein 1 requires multiple protein-protein interactions for substrate recognition[J]. Cellular Signalling,2009,21(7):1073-1084. ( 1) 1)
|
| [37] | ZHENG M,WANG Y H,WU X N,et al.Inactivation of Rheb by PRAK-mediated phosphorylation is essential for energy depletion induced suppression of mTORC1[J]. Nature Cell Biology,2011,13(3):263-272. ( 1) 1)
|
| [38] | LI Y,INOKI K,VACRATSIS P,et al.The p38 and MK2 kinase cascade phosphorylates tuberin,the tuberous sclerosis 2 gene product,and enhances its interaction with 14 3 3[J]. The Journal of Biological Chemistry,2003,278(16):13663-13671. ( 1) 1)
|
| [39] | WU X N,WANG X K,WU S Q,et al.Phosphorylation of Raptor by p38β participates in arsenite-induced mammalian target of rapamycin complex 1 (mTORC1) activation[J]. The Journal of Biological Chemistry,2011,286(36):31501-31511. ( 1) 1)
|
| [40] | SEKIGUCHI T,HIROSE E,NAKASHIMA N,et al.Novel G proteins,Rag C and Rag D,interact with GTP-binding proteins,Rag A and Rag B[J]. The Journal of Biological Chemistry,2001,276(10):7246-7257. ( 1) 1)
|
| [41] | HIROSE E,NAKASHIMA N,SEKIGUCHI T,et al.RagA is a functional homologue of S.cerevisiae Gtr1p involved in the Ran/Gsp1-GTPase pathway[J]. Journal of Cell Science,1998,111(Pt.1):11-21. ( 1) 1)
|
| [42] | SANCAK Y,BAR-PELED L,ZONCU R,et al.Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids[J]. Cell,2010,141(2):290-303. ( 1) 1)
|
| [43] | DURAN A,AMANCHY R,LINARES J F,et al.p62 is a key regulator of nutrient sensing in the mTORC1 pathway[J]. Molecular Cell,2011,44(1):134-146. ( 1) 1)
|
| [44] | KIM E,GORAKSHA-HICKS P,LI L,et al.Regulation of TORC1 by Rag GTPases in nutrient response[J]. Nature Cell Biology,2008,10(8):935-945. ( 1) 1)
|
| [45] | BAR-PELED L,SCHWEITZER L D,ZONCU R,et al.Ragulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1[J]. Cell,2012,150(6):1196-208. ( 1) 1)
|
| [46] | HAN J M,JEONG S J,PARK M C,et al.Leucyl-tRNA synthetase is an intracellular leucine sensor for the mTORC1-signaling pathway[J]. Cell,2012,149(2):410-424. ( 1) 1)
|
| [47] | FANG Y,VILELLA-BACH M,BACHMANN R,et al.Phosphatidic acid-mediated mitogenic activation of mTOR signaling[J]. Science,2001,294:1942-1945. ( 1) 1)
|
| [48] | MAEHAMA T,TANAKA M,NISHINA H,et al.RalA functions as an indispensable signal mediator for the nutrient-sensing system[J]. The Journal of Biological Chemistry,2008,283(50):35053-35059. ( 2) 2)
|
| [49] | XU L,SALLOUM D,MEDLIN P S,et al.Phospholipase D mediates nutrient input to mammalian target of rapamycin complex 1(mTORC1)[J]. The Journal of Biological Chemistry,2011,286(29):25477-25486. ( 2) 2)
|
| [50] | XU L,FRANKEL P,JACKSON D,et al.Elevated phospholipase D activity in H Ras but not K Ras transformed cells by the synergistic action of RalA and ARF6[J]. Molecular and Cellular Biology,2003,23(2):645-654. ( 1) 1)
|
| [51] | LIU L,LUO Y,CHEN L,et al.Rapamycin inhibits cytoskeleton reorganization and cell motility by suppressing RhoA expression and activity[J]. The Journal of Biological Chemistry,2010,285(49):38362-38373. ( 1) 1)
|
| [52] | LEE S E,SUN S C,CHOI H Y,et al.mTOR is required for asymmetric division through small GTPases in mouse oocytes[J]. Molecular Reproduction and development,2012,79(5):356-366. ( 1) 1)
|
| [53] | GULHATI P,BOWEN K A,LIU J,et al.mTORC1 and mTORC2 regulate EMT,motility,and metastasis of colorectal cancer via RhoA and Rac1 signaling pathways[J]. Cancer Research,2011,71(9):3246-3256. ( 1) 1)
|
| [54] | GANGOITI P,ARANA L,OURO A,et al.Activation of mTOR and RhoA is a major mechanism by which Ceramide 1-phosphate stimulates macrophage proliferation[J]. Cellular Signalling,2011,23(1):27-34. ( 1) 1)
|
| [55] | HALL A.Rho GTPases and the actin cytoskeleton[J]. Science,1998,279:509-514. ( 1) 1)
|
| [56] | HERNANDEZ-NEGRETE I,CARRETERO-ORTEGA J,ROSENFELDT H,et al.P Rex1 links mammalian target of rapamycin signaling to Rac activation and cell migration[J]. The Journal of Biological Chemistry,2007,282(32):23708-23715. ( 1) 1)
|
| [57] | JACINTO E,LOEWITH R,SCHMIDT A,et al.Mammalian TOR complex 2 controls the actin cytoskeleton and is rapamycin insensitive[J]. Nature Cell Biology,2004,6(11):1122-1128. ( 1) 1)
|
| [58] | SACI A,CANTLEY L C,CARPENTER C L.Rac1 regulates the activity of mTORC1 and mTORC2 and controls cellular size[J]. Molecular Cell,2011,42(1):50-61. ( 2) 2)
|
| [59] | ASLAN J E,MCCARTY O J.Regulation of the mTOR-Rac1 axis in platelet function[J]. Small GTPases,2012,3(1):67-70. ( 1) 1)
|
| [60] | LI L,KIM E,YUAN H,et al.Regulation of mTORC1 by the Rab and Arf GTPases[J]. The Journal of Biological Chemistry,2010,285(26):19705-19709. ( 1) 1)
|
| [61] | BRIDGES D,FISHER K,ZOLOV S N,et al.Rab5 proteins regulate activation and localization of target of rapamycin complex 1[J]. The Journal of Biological Chemistry,2012,287(25):20913-20921. ( 1) 1)
|
| [62] | TATEBE H,MORIGASAKI S,MURAYAMA S,et al.Rab-family GTPase regulates TOR complex 2 signaling in fission yeast[J]. Current Biology,2010,20(22):1975-1982. ( 1) 1)
|
| [63] | BERNDT N,HAMILTON A D,SEBTI S M.Targeting protein prenylation for cancer therapy[J]. Nature Reviews Cancer,2011,11(11):775-791. ( 2) 2)
|
| [64] | DAZERT E,HALL M N.mTOR signaling in disease[J]. Current Opinion in Cell Biology,2011,23(6):744-755. ( 1) 1)
|
| [65] | SCIARRETTA S,ZHAI P,SHAO D,et al.Rheb is a critical regulator of autophagy during myocardial ischemia:pathophysiological implications in obesity and metabolic syndrome[J]. Circulation,2012,125(9):1134-1146. ( 1) 1)
|
| [66] | KOBAYASHI T,SHIMIZU Y,TERADA N,et al.Regulation of androgen receptor transactivity and mTOR-S6 kinase pathway by Rheb in prostate cancer cell proliferation[J]. The Prostate,2010,70(8):866-874. ( 1) 1)
|
| [67] | PICCONI B,CALABRESI P.Rhes-mTORC1 interaction:a new possible therapeutic target in Parkinson’s disease and L-dopa-induced dyskinesia[J]. Movement Disorders,2012,27(7):815. ( 1) 1)
|




