2. 内蒙古农牧业科学院动物营养研究所,呼和浩特 010031
2. Animal Nutrition Institute, Inner Mongolia Academy of Agriculture and Animal Husbandry Sciences, Huhhot 010031, China
乳蛋白是构成牛奶品质的重要基础,氨基酸作为重要的前体物质对乳蛋白的合成具有调控作用[1, 2, 3]。近年来,理想氨基酸平衡模式已在猪禽饲粮配方中得到广泛的应用[4, 5],但是由于反刍动物自身的消化特点,针对于反刍动物理想氨基酸模式的研究还有待深入。有研究证实,饲粮中氨基酸组成能够影响泌乳反刍动物乳腺合成乳蛋白的能力[6],因此可以推测,或许存在着一种能够使奶牛乳腺上皮细胞乳蛋白合成能力达到最优的氨基酸模式。在国际上,研究者大多通过添加过瘤胃保护氨基酸,或者真胃灌注不同组成模式的氨基酸,研究其对乳蛋白合成的影响[7, 8, 9, 10];在国内,研究者以奶山羊为试验模型,采用阴外动脉灌注技术研究氨基酸平衡对乳蛋白含量的影响[11]。但是目前以奶牛乳腺上皮细胞为试验对象,在转录水平和蛋白质合成水平上针对不同氨基酸模式对乳蛋白合成影响的研究还未见报道。本试验在建立奶牛乳腺上皮细胞培养法的基础上,分别用实时荧光定量PCR(RT-qPCR)和酶联免疫吸附法(ELISA)检测乳蛋白合成基因αs1-酪蛋白(CSN1S1)和κ-酪蛋白(CSN3)mRNA表达量及αs-酪蛋白合成量,验证氨基酸模式的不同是否会影响乳腺上皮细胞酪蛋白的合成,并初步提出能够促进酪蛋白合成的较为理想的氨基酸模式。
试验采用完全随机试验设计设置4个组,分别为低蛋白质饲粮条件下血液氨基酸模式组(LPBP)[12]、全乳蛋白氨基酸模式组(MP)[13]、80%酪蛋白+20%乳清蛋白氨基酸模式组(CLP)[14]、酪蛋白氨基酸模式组(CP)[14],每个组3个重复,并重复试验3次。4种氨基酸模式组的氨基酸配比见表1。试验开始前,分别配制4种氨基酸模式的培养基,配制方法参考DMEM/F12培养基配方,各培养基中总氨基酸浓度均为1 070 mg/L,配制完成后调整培养基pH在7.0~7.4之间。
| 表1 不同氨基酸模式组的氨基酸配比 Table 1 Percentage of amino acids in groups of different amino acid patterns % |
乳腺上皮细胞培养方法参照Miranda等[15]略有修改。选取泌乳中期的健康中国荷斯坦奶牛,采集乳腺深层组织(注意避开结缔组织和脂肪组织)适量,放入含有双抗(Gibco,美国)的DMEM/F12培养基中,置于保温盒中迅速带回实验室。在超净台中用含有3倍双抗的杜氏磷酸盐缓冲液(DPBS,Hyclone,美国)冲洗乳腺组织块3遍,再放入75%的乙醇溶液中浸泡30 s,再用含有1倍双抗的DPBS冲洗至清澈。在培养皿中使用眼科剪刀和镊子精细选取腺泡组织,放入5 mL细胞冻存管中,再次使用眼科剪刀将其剪碎,放入等体积0.05% Ⅱ型胶原酶(Gibco,美国)溶液,放置于37 ℃、5% CO2培养箱消化90 min,期间每隔20 min震荡1次。取出已消化完成的溶液,使用80目网筛过滤,将滤液移入15 mL离心管中,以1 500 r/min离心3 min,弃去上清液,加入培养基后重新悬浮,接种于25 cm2细胞培养瓶中,放入37 ℃、5% CO2培养箱内培养。待细胞铺满瓶底后,进行传代与纯化。选取纯化后的第3代形态稳定的乳腺上皮细胞用胰蛋白酶消化后以3×105个/mL的密度接种于6孔板上,待细胞铺满以后再做处理。在正式试验前,将细胞置于无血清的培养基中空白处理24 h,以消除血清中未知因子对试验处理的影响,之后再换成不同氨基酸模式的培养基处理48 h。
处理后的乳腺上皮细胞用TIANGEN总RNA提取试剂盒(DP430)提取细胞总RNA后立即用TaKaRa反转录试剂盒(DRR036A)反转录成cDNA,然后使用实时定量PCR仪(Bio-Rad,美国),选用磷酸甘油脱氢酶(GAPDH)为内参基因,应用TaKaRa SYBR Premix Ex TaqTMⅡ(DRR081)试剂盒进行CSN1S1、CSN3基因mRNA表达量的定量分析。RT-qPCR引物信息及反应条件见表2。
| 表2 RT-qPCR引物信息及反应条件
Table 2 Primer information and reaction condition for RT-qPCR
|
处理后的乳腺上皮细胞应用天净沙细胞裂解液(80807B-50)进行处理。首先去除细胞培养基,用预冷的DPBS洗2遍,将6孔板放置在冰上,每孔加入100 μL细胞裂解液,冰上放置15 min后,将细胞培养板倾斜使上清液汇集在一起,并将其全部转移到1个新的1.5 mL塑料离心管中,以15 000×g于4 ℃离心10 min,将上清液转移到1个新的1.5 mL离心管中,放置冰上待用。采用R & D公司的牛αs-酪蛋白ELISA检测试剂盒测定各个组的αs-酪蛋白合成量。此试剂盒检测原理是采用双抗一步夹心ELISA,往预先包被αs-酪蛋白抗体的包被孔中一次加入标本、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经过温育并彻底洗涤。用底物3,3,5,5-四甲基联苯胺(TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的αs-酪蛋白合成量呈正相关。用酶标仪在450 nm波长下测定吸光值(OD),计算样品浓度。线性回归方程为:
y=0.002x+0.063 2(R2=0.996)。试验原始数据使用Excel 2007进行计算和整理,基因表达数据采用2-△△Ct法进行计算,所得整理后试验数据采用SAS 9.0软件的ANOVA过程进行单因子方差分析,多重比较采用Duncan氏法,P<0.05为差异显著,P<0.01为差异极显著。
由图1可知,不同氨基酸模式对CSN1S1基因mRNA表达量有显著影响(P<0.05),MP组CSN1S1基因mRNA表达量显著高于其他各组(P<0.05),其他各组间差异不显著(P>0.05)。CSN3基因mRNA表达量也有相同的结果,MP组CSN3基因mRNA表达量极显著高于LPBP组(P<0.01),CLP和CP组显著高于LPBP组(P<0.05)。
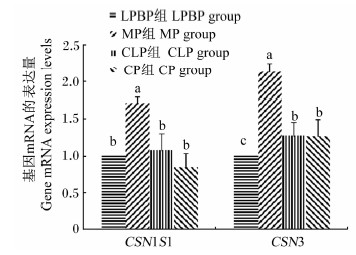 | 图1 不同氨基酸模式对奶牛乳腺上皮细胞CSN1S1和CSN3基因mRNA表达量的影响 Fig.1 Effects of different amino acid patterns on mRNA expression levels of CSN1S1 and CSN3 genes in mammary epithelial cells of dairy cows |
由图2可知,不同氨基酸模式对αs-酪蛋白合成量有显著影响(P<0.05),MP组极显著高于LPBP组(P<0.01),CLP和CP组也显著高于LPBP组(P<0.05)。
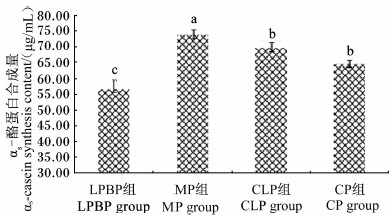 | 图2 不同氨基酸模式对奶牛乳腺上皮细胞 αs-酪蛋白合成量的影响 Fig.2 Effects of different amino acid patterns on αs-casein synthesis content in mammary epithelial cells of dairy cows |
牛乳腺上皮细胞培养在国际上已经有50多年的历史[16],而我国这方面的研究才刚刚起步。到目前为止,在我国尚无永生性牛乳腺上皮细胞系建立的报道。目前,在国际上已经存在的牛乳腺上皮细胞系并不是很多。Schmid等[17]首先建立了牛乳腺上皮细胞系BMGE;随后,Gibson等[18]又建立了PS-BME-L6和PS-BME-L7 2个细胞系。Huynh等[19]用SV40LT-抗原基因转染牛乳腺上皮细胞,使其获得永生性,从而建立了MAC-T细胞系。但是近年来,研究人员发现MAC-T在体外培养条件下呈现了许多异常的特性,因此在功能性乳腺研究方面,MAC-T存在自身的局限性[20]。因而,研究人员通常采用组织块法、酶消化法、乳汁上皮细胞分离法等方法对乳腺上皮细胞进行原代培养,但是由于乳腺上皮细胞是一种特异性的分化细胞,体外培养环境又难以和体内环境相一致,所以造成了乳腺上皮细胞的去分化,而这种去分化作用尤其表现在细胞内泌乳相关基因的表达上。有研究报道,细胞在体外培养的时间越长这种去分化作用就越明显[21],这就使在体外培养条件下检测乳腺上皮细胞泌乳相关基因表达与酪蛋白合成变得十分困难。本试验采用酶消化法对奶牛乳腺上皮细胞进行原代培养,并采用差酶消化法对其进行纯化,在研究中发现所采集乳腺的鲜活性和细胞传代时的接种密度对于泌乳相关基因的表达具有决定性的影响。
目前,国内外研究中使用奶牛乳腺上皮细胞为模型在体外研究氨基酸对乳蛋白合成调节主要集中在限制性氨基酸、功能性氨基酸、支链氨基酸及小肽等方面,而对理想氨基酸模式的研究较少。来金良[22]利用RT-qCR检测赖氨酸(Lys)、蛋氨酸(Met)、苏氨酸(Thr)、苯丙氨酸(Phe)对体外培养乳腺组织中CSN1S1基因表达影响时发现:Lys、Met、Thr、Phe添加水平不同,CSN1S1基因的表达量也不同;当培养基中Lys、Met、Thr、Phe水平分别为197、57、121、126 mg/L时,其表达量最高。徐柏林[23]以奶牛乳腺上皮细胞为模型研究发现,适宜浓度的精氨酸(Arg)能够促进奶牛乳腺上皮细胞中CSN1S1、αs2-酪蛋白(CSN1S2)、β-酪蛋白(CSN2)、CSN3基因的表达,且当体外细胞培养液中Arg浓度为556 mg/L时,这4种酪蛋白基因的表达显著上调。李喜艳[24]研究发现,当Lys和Met以1.2和0.4 mmol/L浓度,即3∶ 1比例 添加时奶牛乳腺上皮细胞中总酪蛋白的合成量最大,并显著地促进了乳蛋白合成相关基因的表达以及与乳蛋白合成相关路径的基因的表达。以上的研究结果说明,氨基酸作为乳蛋白合成的前体物对促进乳蛋白的合成应有适当的比例与浓度,氨基酸的平衡性对于提高乳蛋白含量和合成效率具有现实意义[25]。在本试验中,LPBP组代表的是低蛋白质(9.3%干物质)饲粮条件下泌乳奶牛静脉血中各氨基酸组成比例,除Thr外其他必需氨基酸的比例LPBP组明显低于其他各组,有可能是必需氨基酸比例过低导致了LPBP组αs-酪蛋白合成量与CSN1S1、CSN3基因mRNA表达量显著低于其他各组。在体内试验中,Bach等[26]饲喂不同粗蛋白质水平(15%和18%)及不同小肠食糜氨基酸构成(与酪蛋白氨基酸构成接近和有较大差异,分别用H和L表示)的4种饲粮,结果表明饲喂H型饲粮的乳腺组织对总氨基酸的吸收速度较快,15% H型饲粮的乳蛋白合成的氮利用率较高,达到33%,这充分说明应存在一个能使乳腺组织充分利用合成乳蛋白的氨基酸供给模式。有研究者建议把乳蛋白或者是微生物蛋白质氨基酸组成模式作为奶牛的理想氨基酸模式,也有研究者使用酪蛋白氨基酸组成模式作为理想氨基酸模式的参照。本试验的研究结果显示,在培养基中氨基酸浓度相同的情况下,相对于其他氨基酸模式,全乳蛋白氨基酸模式在泌乳相关基因转录及蛋白质合成2个层次上均有显著的促进作用,此研究结果可为反刍动物理想氨基酸模式理论的完善提供一些参考。
氨基酸模式的不同能够影响奶牛乳腺上皮细胞酪蛋白的合成,相对于其他氨基酸模式,全乳蛋白氨基酸模式更能促进奶牛乳腺上皮细胞酪蛋白的合成。
| [1] | WU G Y,MEININGER C J.Arginine nutrition and cardiovascular function[J].The Journal of Nutrition,2000,130:2626-2669. ( 1) 1)
|
| [2] | WU G Y.Amino acids:metabolism,functions,and nutrition[J].Amino Acids,2009,37:1-17. ( 1) 1)
|
| [3] | JOBGEN W S,FRIED S K,FU W J,et al.Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates[J]. The Journal of Nutritional Biochemistry,2006,17(9):571-588. ( 1) 1)
|
| [4] | WANG T C,FULLER M F.The optiumum dietary amino acid pattern for growing pigs.1.Experiments by amino acid deletion[J].British Journal of Nutrition,1989,62:77-89. ( 1) 1)
|
| [5] | MACK S,BERCOVICI D,GROOTE D E,et al.Ideal amino acid profile and dietary lysine specification for broiler chickens of 20 to 40 days of age[J].British Journal of Nutrition,1999,40:257-265. ( 1) 1)
|
| [6] | CHO J T,OVERTON R,SCHWAB C G,et al.Determining the amount of rumen-protected methionine supplement that corresponds to the optimal levels of methionine in metabolizable protein for maximizing milk protein production and profit on dairy farms[J]. Journal of Dairy Science,2007,90:4908-4916. ( 1) 1)
|
| [7] | BERTHIAUME R P,DUBREUIL M,STEVENSON B W,et al.Intestinal disappearance and mesenteric and portal appearance of amino acids in dairy cows fed ruminally protected methionine[J]. Journal of Dairy Science,2001,84:194-203. ( 1) 1)
|
| [8] | VARVIKKO T,VANHATALO A,JALAVA T,et al.Lactation and metabolic responses to graded abomasal doses of methionine and lysine in cows fed grass silage diets[J]. Journal of Dairy Science,1999,82:2659-2673. ( 1) 1)
|
| [9] | CHOUNG J,CHAMBERLAIN D G.The effects of abomasal infusions of casein or soya-bean-protein isolate on the milk production of dairy cows in mid-lactation[J]. British Journal of Nutrition,1993,69:103-115. ( 1) 1)
|
| [10] | RAGGIO G,LEMOSQUET S,LOBLEY G E,et al.Effect of casein and propionate supply on mammary protein metabolism in lactating dairy cows[J]. Journal of Dairy Science,2006,89:4340-4351. ( 1) 1)
|
| [11] | 王强.奶山羊阴外动脉内乳成分前体物理想平衡模式的研究.博士学位论文.呼和浩特:内蒙古农业大学,2010:39-45. ( 1) 1)
|
| [12] | WEEKES T L,LUIMES P H,CANT J P.Responses to amino acid imbalances and deficiencies in lactating dairy cows[J]. Journal of Dairy Science,2006,89:2177-2787. ( 1) 1)
|
| [13] | CSAPO J,SALAMON S E,LOKI K.Composition of mare’s colostrums and milk.Ⅱ.Protein content,amino acid composition and contents of macro- and micro-elements[J].Alimentaria,2009,2:133-148. ( 1) 1)
|
| [14] | WILLIAMSON M B.The amino acid composition of human milk proteins[J].The Journal of Biological Chemistry,1944,6:48-52. ( 1) 1)
|
| [15] | MIRANDA S G,WANG Y J,PURDIE N G,et al.Selenomethionine stimulates expression of glutathione peroxidase 1 and 3 and growth of bovine mammary epithelial cells in primary culture[J]. Journal of Dairy Science,2009,92:2670-2683. ( 1) 1)
|
| [16] | EBNER K E,HOOVER C R,HAGEMAN E C,et al.Cultivation and properties of bovine mammary cell cultures[J]. Experimental Cell Research,1961,23:373-381. ( 1) 1)
|
| [17] | SCHMID E,SCHILLER D L,GRUND C,et al.Tissue type-specific expression of intermediate filament proteins in a cultured epithelial cell line from bovine mammary gland[J]. The Journal of Cell Biology,1983,96(1):37-50. ( 1) 1)
|
| [18] | GIBSON C A,VEGA J R,BAUMRUCKER C R.Establishment and characterization of bovine mammary epithelial cell lines[J].In Vitro Cellular and Developmental Biology,1991,27A(7):585-594. ( 1) 1)
|
| [19] | HUYNH H T,ROBITAILTE G,TURNER J.Establishment of bovine mammary epithelial cells (MAC-T):an in vitro model for bovine lactation[J]. Experimental Cell Research,1991,197(2):191-199. ( 1) 1)
|
| [20] | SRENSEN B M,KAZALA E C,MURDOCH G K,et al.Effect of CLA and other C18 unsaturated fatty acids on DGAT in bovine milk fat biosynthetic systems[J]. Lipids,2008,43:903-912. ( 1) 1)
|
| [21] | ANDERS M,HANSEN R,DING R X.Disruption of 3D tissue integrity facilitates adenovirus infection by deregulating the coxsackievirus and adenovirus receptor[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(4):1943-1948. ( 1) 1)
|
| [22] | 来金良.必需氨基酸浓度对奶牛乳腺酪蛋白基因表达的影响 .硕士学位论文.杭州:浙江大学,2006. ( 1) 1)
|
| [23] | 徐柏林.精氨酸对乳腺上皮细胞中酪蛋白合成的影响及其调控机制 .硕士学位论文.扬州:扬州大学,2012. ( 1) 1)
|
| [24] | 李喜艳.奶牛乳腺上皮细胞中赖氨酸蛋氨酸配比模式对酪蛋白合成的影响及机理研究 .硕士学位论文.北京:中国农业科学院,2011. ( 1) 1)
|
| [25] | CHO J,OVETON T R,SCHWAB C G,et al.Determining the amount of rumen-protected methionine supplement that corresponds to the optimal levels of methionine in metabolizable protein for maximizing milk protein production and profit on dairy farms[J]. Journal of Dairy Science,2007,90:4908-4916. ( 1) 1)
|
| [26] | BACH A,HUNTINGTON G B,CALSAMIGLIS S.Nitrogen metabolism of early lactation cows fed diets with two different levels of protein and different amino acid profiles[J]. Journal of Dairy Science,2000,83:2585-2595. ( 1) 1)
|




