2. 四川农业大学动物营养研究所,雅安 625014
2. Animal Nutrition Institute, Sichuan Agricultural University, Ya’an 625014, China
脂肪是鱼类生长过程中所需能量和必需脂肪酸的重要来源,是各种组织器官修补和新组织生长的必需原料。同时,脂肪也是脂溶性维生素吸收和在体内运输的溶解介质,并可作为某些激素和维生素的合成原料[1]。饲料脂肪所提供的n-3多不饱和脂肪酸能提高亲鱼的繁殖力、受精率以及仔鱼生长和存活率[2]。Silva等[3]研究表明,适宜的饲料脂肪水平可改善饲料适口性,提高水产动物的增重率和饲料转化效率,降低养殖过程中对水环境的污染。梁友光[4]研究指出,适当增加饲料脂肪水平能够促进长吻 (Leiocassis longirostris)的生长并提高饲料效率。郑珂珂等[5]研究认为,高脂肪水平可诱导瓦氏黄颡鱼(Pelteobagrus vachelli)肝脏脂蛋白脂肪酶(LPL)基因的表达。王爱民等[6]研究表明,饲料中适宜脂肪水平可促进异育银鲫(Carassius auratus gibelio)肠道蛋白酶的分泌。甘晖等[7]研究表明,饲料脂肪水平与血液高密度脂蛋白含量呈正相关。饲料脂肪不足或缺乏可导致鱼类代谢紊乱,饲料蛋白质被消耗用于鱼体能量需要,同时还可能出现脂溶性维生素和脂肪酸的缺乏症,影响水产动物的正常生长、发育和繁殖[1]。研究发现,饲料中脂肪水平超过14%时,鳕鱼(Melanogrammus aeglefinus)的肝体指数和肝脂含量显著升高[8];饲料脂肪水平过高可导致鱼体脂肪沉积过多,抗病力下降,抑制鱼类生长,且饲料脂肪水平过高还易导致饲料氧化变质,不利于其贮藏与加工[9]。因此,饲料中的脂肪应保持适宜水平。
白甲鱼(Onychostoma simus)属鲤形目,鲤科,白甲鱼属,是长江上游及珠江流域的一种主要经济鱼。白甲鱼肌肉中含有丰富的蛋白质和氨基酸,二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等脂肪酸含量较高[10, 11],有关白甲鱼的胚胎和胚后发育[12],不同组织及同工酶的特异性[13, 14],人工驯养[15]、人工繁殖[16]、苗种培育及养殖[17, 18]等方面已有一些研究。但有关白甲鱼对脂肪等营养素的需求的研究还未见报道。本试验拟以白甲鱼幼鱼为研究对象,通过研究不同的饲料脂肪水平对其生长性能、体组成、血清生化指标的影响,以进一步丰富和完善其营养生理和消化生理,旨在为确定白甲鱼幼鱼的配合饲料营养标准和实用饲料配方提供科学依据。
以鱼粉、豆粕、花生粕、菜籽粕等为蛋白质源,大豆油为脂肪源,玉米淀粉和α-淀粉为糖源,采用单因子浓度梯度法配制豆油添加水平为0(对照)、2%、4%、6%、8%和10%的6种等氮(蛋白质含量为40%)等能(总能为16 MJ/kg)的试验饲料,其中脂肪水平的增减用α-淀粉调平。各原料均粉碎过60目筛,称重后混匀,量少的组分采用逐级扩大法混合,用实验室小型绞肉机制成直径为2 mm的试验饲料,在室温下晾干后保存在-20 ℃冰箱中备用。经测定,6种试验饲料中脂肪水平分别为2.83%、4.52%、6.68%、9.14%、11.35%和14.07%。试验饲料组成及营养水平见表1。
试验用白甲鱼幼鱼购自合川大口鲶原种场,购回后先用3%~5%的食盐水消毒后放入暂养池,用商品饲料暂养7 d。试验开始时,选择健康、无伤病的平均体重为(0.81±0.06) g的白甲鱼幼鱼900尾,随机分成6组,每组3个重复,每个重复50尾,以重复为单位放养于试验水泥池(150 cm×100 cm×50 cm)中。6组试验鱼分别投喂不同脂肪水平的试验饲料。每天按试验鱼体重的3%~5%投喂饲料(根据白甲鱼的摄食情况及水温等环境状况及时调整投喂率),每天08:00、13:00、16:00各投喂1次,投喂前虹吸清污,饱食后30 min迅速虹吸残饵并风干测定其质量。养殖期间每天换水1次,每次换水量为养殖水体的1/3。试验用水为曝气后的自来水,每日监测水温、水质、试验鱼的摄食行为和死亡数量等。试验期间水温维持在25~28 ℃,溶氧高于6.0 mg/L,pH为7.0~7.5,养殖时间60 d。
试验开始和结束前1天停食,对每个重复中的试验鱼称重。每组中随机取6尾鱼,其中3尾用于鱼体营养成分分析,另外3尾用50 mg/L的MS-222(化学名为间氨基苯甲酸乙酯甲磺酸盐)溶液麻醉,测定体质量后,用1 mL注射器于尾静脉取血,并用离心机(4 ℃,3 500 r/min)离心15 min,制备血清,用于测定血清生化指标;取血后于冰盘上解剖,然后取出内脏,再分离出肝胰脏和全肠,用4 ℃预冷的生理盐水冲洗,然后用滤纸吸干,准确称量肝胰脏和内脏团的质量;之后取出肌肉(第1根背鳍至最后1根背鳍之间,侧线以上白肌),并将所有样品置于-80 ℃冰箱中备用。
| 表1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) % |
根据测定的数据计算试验鱼的增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、蛋白质效率(protein efficiency ratio,PER)、饲料系数(feed conversion ratio,FCR)、肝体比(hepatosomatic index,HSI)、脏体比(viscerosomatic index,VSI),根据统计的试验鱼死亡情况计算成活率(survival rate,SR),计算公式如下:
增重率(%)=100×(Wt-W0)/W0; 特定生长率(%/d)=100×(lnWt-lnW0)/t; 蛋白质效率(%)=100×(Wt-W0)/F×P; 饲料系数=F/(Wt-W0); 肝体比(%)=100×Wh/W; 脏体比(%)=100×Wv/W; 成活率(%)=100×Nt/N0。式中:W0为试验鱼初始体质量(g);Wt为试验鱼终末体质量(g);F为饲料摄入总质量(g);P为饲料中粗蛋白质含量(%);t为试验天数(d);W为鱼体质量(g);Wh为鱼体肝胰脏质量(g);Wv为鱼体内脏质量(g);N0为试验开始时鱼的尾数(尾);Nt为试验结束时鱼的尾数(尾)。
试验鱼全鱼及肌肉粗蛋白质含量采用凯氏定氮法(GB 5009.5—2010)测定,粗脂肪含量采用索氏抽提法(GB 5009.6—2010)测定,水分含量采用恒温(105 ℃)干燥法(GB 5009.3—2010)测定,粗灰分含量采用马福炉高温(550 ℃)灼烧法(GB 5009.4—2010)测定[19]。
试验数据以平均值±标准差表示,采用SPSS 17.0统计软件中的one-way ANOVA进行方差分析,若组间差异显著,再用Duncan氏法进行多重比较,差异显著水平为P<0.05。通过非线性回归分析,用二次曲线模型对白甲鱼幼鱼的增重率、特定生长率、蛋白质效率、饲料系数与饲料脂肪水平的关系进行拟合。
由表2可知,白甲鱼幼鱼的增重率、特定生长率及蛋白质效率均随饲料脂肪水平的升高呈先升后降的变化趋势,且饲料脂肪水平为4.52%、6.68%、9.14%、11.35%和14.07%的组均显著高于对照组(P<0.05)。白甲鱼幼鱼的增重率、特定生长率均在饲料脂肪水平为11.35%时达到最大,分别为362.98%和3.06%/d,除与饲料脂肪水平为6.68%及9.14%的组差异不显著(P>0.05)外,与其余各组差异显著(P<0.05);蛋白质效率则在饲料脂肪水平为9.14%时达到最大,为3.70%,除与饲料脂肪水平为11.35%的组差异不显著(P>0.05)外,与其余各组差异显著(P<0.05)。白甲鱼幼鱼的饲料系数则随饲料脂肪水平的升高呈先降后升的变化趋势,且在饲料脂肪水平为9.14%时达到最低,为1.34,除与饲料脂肪水平为11.35%的组差异不显著(P>0.05)外,与其余各组差异显著(P<0.05)。白甲鱼幼鱼的肝体比则随饲料脂肪水平的升高而上升,除饲料脂肪水平为4.52%的组与对照组差异不显著(P>0.05)外,其余各组均显著高于对照组(P<0.05)。各组白甲鱼幼鱼的脏体比无显著差异(P>0.05)。试验期间各组白甲鱼幼鱼的成活率均为100%。
| 表2 饲料脂肪水平对白甲鱼幼鱼生长性能的影响
Table 2 Effects of dietary lipid level on growth performance of juvenile Onychostoma sima
|
分别以白甲鱼幼鱼的增重率、特定生长率、蛋白质效率、饲料系数为评价指标,通过二次曲线模型分析上述指标与饲料脂肪水平的关系。白甲鱼幼鱼的增重率(Y1)和饲料脂肪水平(X)的二次回归方程为Y1=-2.467 1X2+49.954X+116.67(R2=0.952 6,P<0.05),当饲料脂肪水平为10.12%时,增重率最大,为369.54%(图1);特定生长率(Y2)和饲料脂肪水平(X)的二次回归方程为Y2=-0.012 2X2+0.248 3X+1.842 9(R2=0.955 3,P<0.05),当饲料脂肪水平为10.18%时,特定生长率最大,为3.11%/d(图2);蛋白质效率(Y3)和饲料脂肪水平(X)的二次回归方程为Y3=-0.028 4X2+0.535 1X+1.133(R2=0.849 8,P<0.05),当饲料脂肪水平为9.42%时,蛋白质效率最大,为3.65%(图3);饲料系数(Y4)和饲料脂肪水平(X) 的二次回归方程为Y4=0.016 1X2-0.307 9X+2.796(R2=0.847 3,P<0.05),当饲料脂肪水平为9.56%时,饲料系数最小,为1.32(图4)。
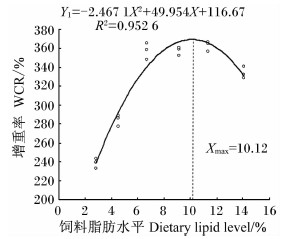 | 图1 饲料脂肪水平与白甲鱼幼鱼增重率的关系 Fig.1 Relationship between dietary lipid level and weight growth rate of juvenile Onychostoma sima |
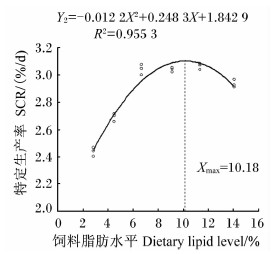 | 图2 饲料脂肪水平与白甲鱼幼鱼特定生长率的关系 Fig.2 Relationship between dietary lipid level and specific growth rate of juvenile Onychostoma sima |
由表3可知,白甲鱼幼鱼全鱼粗蛋白质含量随饲料脂肪水平的增加而呈先升后降的变化趋势,饲料脂肪水平在4.52%~11.35%时全鱼粗蛋白质含量差异不显著(P>0.05),饲料脂肪水平为6.68%、9.14%、11.35%的组全鱼粗蛋白质含量显著高于对照组(P<0.05);全鱼粗脂肪含量随饲料脂肪水平的增加逐渐升高,饲料脂肪水平为6.68%、9.14%、11.35%、14.07%的组全鱼粗脂肪含量显著高于对照组(P<0.05);随着饲料脂肪水平的升高,全鱼水分和粗灰分含量无显著变化(P>0.05)。
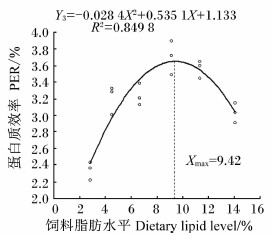 | 图3 饲料脂肪水平与白甲鱼幼鱼蛋白质效率的关系 Fig.3 Relationship between dietary lipid level and protein efficiency ratio of juvenile Onychostoma sima |
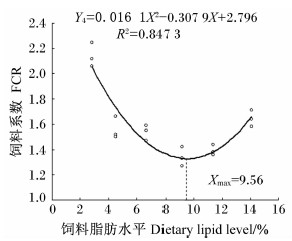 | 图4 饲料脂肪水平与白甲鱼幼鱼饲料系数的关系 Fig.4 Relationship between dietary lipid level and feed conversion ratio of juvenile Onychostoma sima |
由表3可知,白甲鱼幼鱼肌肉粗蛋白质含量也随着饲料脂肪水平的增加呈先升后降的变化趋势,除饲料脂肪水平为9.14%和14.07%的组肌肉粗蛋白质含量差异显著(P<0.05)外,其余各组间无显著差异(P>0.05);肌肉粗脂肪含量随饲料脂肪水平的增加而逐渐升高,饲料脂肪水平为4.52%、6.68%、9.14%、11.35%和14.07%的组均显著高于对照组(P<0.05),但饲料脂肪水平在6.68%~11.35%时肌肉粗脂肪含量差异不显著(P>0.05);随饲料脂肪水平的升高,肌肉的水分和粗灰分含量无显著变化(P>0.05)。
| 表3 饲料脂肪水平对白甲鱼幼鱼体组成的影响 Table 3 Effects of dietary lipid level on body composition of juvenile Onychostoma sima % |
由表4可知,随饲料脂肪水平的升高,白甲鱼幼鱼的血清胆固醇含量与甘油三酯含量均呈现先升高后降低的变化趋势。当饲料脂肪水平为9.14%时血清胆固醇含量达到最高,且与其他各组差异显著(P<0.05);当饲料脂肪水平为11.35%时血清甘油三酯含量达到最高,且与其他各组差异显著(P<0.05)。血清高密度脂蛋白胆固醇和胆汁酸含量随饲料脂肪水平的升高呈上升的变化趋势,并均在饲料脂肪水平为14.07%时达到最高,且与其他各组差异显著(P<0.05),饲料脂肪水平在6.68%~11.35%时各组间差异不显著(P>0.05)。血清低密度脂蛋白胆固醇含量随饲料脂肪水平的升高呈逐渐降低的变化趋势,当饲料脂肪水平≥9.14%时,各组间差异均不显著(P>0.05)。血清谷丙转氨酶、谷草转氨酶和碱性磷酸酶活性随饲料脂肪水平的升高呈逐渐升高的变化趋势,血清谷丙转氨酶、谷草转氨酶活性除在饲料脂肪水平为6.68%和9.14%的组间以及11.35%和14.07%的组间差异不显著(P>0.05)外,其余各组间差异显著(P<0.05); 血清碱性磷酸酶活性除在饲料脂肪水平为11.35%和14.07%的组间差异不显著(P>0.05)外,其余各组间差异显著(P<0.05)。
大多数鱼类对脂肪具有较高的吸收利用能力,当饲料中脂肪含量不足时,其用于生长的蛋白质被作为能源物质以维持鱼类的生存[22]。提高饲料脂肪水平有利于提高蛋白质的利用率,促进鱼类的生长,因此脂肪具有节约蛋白质、增加摄食量和提高饲料效率的作用[23]。适当提高饲料脂肪水平可提高鱼类的生长速度,提高饲料的蛋白质效率及降低饲料系数,但饲料脂肪水平过高时,鱼体对脂肪的消化吸收率则会降低,脂肪酸的重新合成受到抑制,使鱼类的生长速率降低[24]。刘波等[25]发现,摄食高脂肪水平饲料将增加翘嘴红鲌(Erythrocutler ilishaeformi)肝胰脏粗蛋白质与粗脂肪含量,造成其高血糖效应,并诱导葡萄糖-6-磷酸酶活性的升高及其基因的表达,从而影响对碳水化合物的利用。研究报道,饲料脂肪水平为7.71%时,鳡(Elopichthys bambusa)的特定生长率最高[26];饲料脂肪水平为8.86%时,尼罗罗非鱼(Oreochromis nilotica)幼鱼的增重率最高[27];饲料脂肪水平为6.62%~7.02%时,胭脂鱼(Myxocyprinus asiaticus)幼鱼的生长速度最快[28];饲料脂肪水平为7.88%~9.18%时,翘嘴红鲌的增重率、特定生长率最高[29];饲料脂肪水平为8.21%时,齐口裂腹鱼(Schizothorax prenanti)幼鱼的特定生长率最高[30]。本试验中,当饲料脂肪水平为11.35%时,白甲鱼幼鱼的增重率和特定生长率均为最高。通过二次多项式回归分析可知,当饲料脂肪水平在9.42%~10.18%时,可促进白甲鱼幼鱼的生长,提高其饲料利用效率。本试验得出的白甲鱼幼鱼饲料适宜脂肪水平比上述研究结果要高,比大西洋白姑鱼(Argyrosomus regius)[31]、奥尼罗非鱼(Oreochromis niloticus×O.Aureus)[32]、有名锤形石首鱼(Atractoscion nobilis)[33]等的结果要低,而与长吻
[34]、瓦氏黄颡鱼[35]、鲈(Lateolabrax japonicus)[36]等的研究结果基本一致。这可能与试验鱼的种类、生长发育阶段、消化系统发育程度、饲料营养成分及养殖条件等多种因素有关。
| 表4 饲料脂肪水平对白甲鱼幼鱼血清生化指标的影响
Table 4 Effects of dietary lipid level on serum biochemical indices of juvenile Onychostoma sima
|
在一定范围内提高饲料脂肪水平可节约作为能源而消耗的部分蛋白质,并能很好地提高蛋白质的效率,增加摄食量,提高饲料效率等[37]。当饲料脂肪水平过低时,过多的蛋白质将被消耗用于鱼类的能量需要,同时过低的脂肪水平不能满足鱼类对脂肪酸的需要,导致其生长性能降低;当饲料中脂肪供给过多时,则可能抑制其消化道中消化酶的活性,使脂肪在其肠道内累积而影响肠道对营养物质的吸收,抑制鱼类的生长[38]。同时,蓄积的脂肪还将使鱼产品质量下降[39]。向枭等[29]发现,当翘嘴红鲌的饲料脂肪水平从2.07%上升到9.26%时,其饲料蛋白质效率从1.23%上升到2.02%,饲料系数则从2.67下降到1.25;且饲料脂肪水平为7.14%~9.26%时,其消化酶活性显著提高。Takeuchi等[40]证明,真鲷(Pagrosomus major)饲料中脂肪水平从15%升高到20%时,饲料蛋白质水平从48%下降到35%不会对其生长有任何影响。Buchet等[41]认为,饲料脂肪水平影响美国红鱼(Sciaenops ocellatus)肠道脂肪酶、胰蛋白酶和淀粉酶的活性。王吉桥等[42]研究认为,鱼类胃肠蛋白酶和脂肪酶活性随饲料中脂肪水平的升高而逐渐下降。涂玮等[27]研究表明,当饲料脂肪水平低于11.13%时,尼罗罗非鱼幼鱼肠道脂肪酶活性呈上升趋势,而饲料脂肪水平超过11.13%时,其肠道脂肪酶活性则呈下降趋势。王爱民等[43]研究得出,吉富罗非鱼(Oreochromis niloticus)对粗脂肪消化率与饲料中脂肪水平呈正相关关系。本试验中,饲料脂肪水平为9.14%时,白甲鱼幼鱼的蛋白质效率最高,饲料系数最低,且饲料脂肪水平从2.83%增加到9.14%时,蛋白质效率从2.33%上升到3.70%,饲料系数则从2.14下降到1.34,当饲料脂肪水平增加到11.35%时反而出现其蛋白质效率显著降低,饲料系数显著升高的变化。这与白甲鱼幼鱼的肝体比和脏体比的变化趋势相一致。肝脏是鱼类中间代谢的主要器官,也是鱼类重要的营养储存场所。Nanton等[8]认为,黑线鳕鱼的肝体比随着饲料脂肪水平的增加而逐渐升高。汪开毓等[44]研究表明,连续投喂高脂饲料后草鱼(Ctenopharyngodon idellus)的肝胰脏及乙酰辅酶A羧化酶1(ACC1)mRNA相对表达量显著升高,加速了脂肪在肝脏中的合成速度。上述研究结果说明,适量的饲料脂肪水平能有效提高鱼类消化酶的活性,提高饲料的消化利用率;而饲料脂肪水平过高时,过量的脂肪在肝脏中沉积,使肝组织受损,影响了其正常代谢功能,从而导致饲料系数升高,蛋白质节约效应消失。这与王爱民等[6]对异育银鲫、王爱英等[45]对厚唇弱棘 (Hiphaestus fuliginos)、袁立强等[35]对瓦氏黄颡鱼的研究结果相一致。
脂肪是水产动物体内重要的贮能物质,但饲料脂肪水平的增加会使鱼体脂肪含量增加,过量脂肪会沉积在鱼体腹腔、肝脏和肌肉组织[36]。王朝明等[28]报道,随着饲料脂肪水平的升高,胭脂鱼全鱼、肌肉和肝胰脏的脂肪含量呈先上升后稳定的变化趋势,而全鱼和肌肉水分和粗蛋白质含量变化不显著。郑珂珂等[5]报道,瓦氏黄颡鱼鱼体脂肪、干物质含量随饲料脂肪水平的升高而显著升高,而鱼体蛋白质、水分含量则随着饲料脂肪水平的升高而降低。段彪等[30]认为,随着饲料脂肪水平的升高,齐口裂腹鱼鱼体脂肪含量呈先降后升的变化趋势,而蛋白质含量则呈先升后降的变化趋势。Chatzifotis等[31]研究发现,大西洋白姑鱼全鱼和肌肉脂肪含量均随饲料脂肪水平的升高而增大。López等[46]研究发现,有名锤形石首鱼的全鱼、肌肉、肝脏脂肪含量随饲料脂肪水平升高而升高,肌肉和肝脏脂肪酸的组成反映了饲料的脂肪酸组成情况,组织中n-3和n-6多不饱和脂肪酸的含量也与饲料的脂肪水平呈正比。本试验中,白甲鱼幼鱼全鱼和肌肉中粗脂肪含量均随饲料脂肪水平的升高呈逐渐升高,粗蛋白质含量则均随着饲料脂肪水平的升高呈先升后降的变化趋势,而水分和粗灰分含量的变化则不显著,与赵巧娥等[26]对鳡的研究结果基本一致。上述结果说明饲料脂肪水平的提高可促进脂肪在白甲鱼幼鱼机体中的沉积。不同试验结果的差异可能是由于鱼的种类、生长阶段和试验饲料组成等不同而引起。
血脂水平的变化与鱼类机体的新陈代谢和生理状况密切相关,胆固醇和甘油三酯是血脂的重要组成部分,且都主要在肝脏中合成,因此血清胆固醇和甘油三酯含量的变化在一定程度上反映了肝脏对脂肪的代谢状况[47]。Ding等[48]认为胆固醇和甘油三酯含量升高表明动物内生脂肪转运活跃,是脂肪运输系统对高脂饲料的应答反应。研究表明,鳡血清胆固醇含量随饲料脂肪水平的升高而降低,甘油三酯含量在饲料脂肪水平为6%和15%时较之前均有显著降低[26]。本试验中,白甲鱼幼鱼血清胆固醇和甘油三酯含量均随饲料脂肪水平的升高而呈先升后降的变化趋势,这与尼罗罗非鱼[29]、吉富罗非鱼[42]等的研究结果相一致。Du等[9]研究发现,幼龄草鱼摄入脂肪水平高的饲料6周后血浆中胆固醇和甘油三酯含量升高,并出现了类似哺乳动物高脂血症的症状。王兴强等[49]认为,饲料中的脂肪能被鱼类吸收并转化为游离脂肪酸,最后被肝脏所摄取。因此,饲料脂肪水平小于9.14%时白甲鱼幼鱼血清胆固醇含量逐渐升高,饲料脂肪水平小于11.35%时白甲鱼幼鱼血清甘油三酯含量逐渐升高的原因可能是由于饲料脂肪水平的不断提高,白甲鱼幼鱼从饲料中吸收的脂肪转化成的游离脂肪酸不断增多,使肝脏合成并转运出去的胆固醇和甘油三酯的量也不断增多,从而使血清胆固醇和甘油三酯含量升高。但当鱼类肝脏脂肪积累到一定程度时,血液胆固醇和甘油三酯含量反而会减少[50]。过高脂肪水平的饲料可诱导瓦氏黄颡鱼肝脏脂蛋白脂酶mRNA表达量显著升高[5];高脂饲料诱导真鲷产生大量脂蛋白脂酶,使肝脏可能出现营养诱导性脂肪蓄积[51]。本试验中,当饲料脂肪水平大于9.14%时,白甲鱼幼鱼肝脏积累的脂肪增多,使肝细胞受到损伤,合成胆固醇和甘油三酯的能力减弱。
高密度脂蛋白(HDL)和低密度脂蛋白(LDL)是反映脂类在动物体内的分解与转运及肝脏脂肪代谢的重要指标[24]。高密度脂蛋白将动物机体内的胆固醇以高密度脂蛋白胆固醇的形式运回肝脏,并经肝脏转化代谢,具有减轻血液中过多的胆固醇作用,而低密度脂蛋白则是将肝脏合成的内源性胆固醇以低密度脂蛋白胆固醇的形式转运到机体组织[52]。Babin等[53]认为,鱼体内的脂蛋白水平会对养殖过程中的投喂频率、饲料脂肪水平、鱼类自身状况等产生应答。本试验中,随饲料脂肪水平的升高,白甲鱼幼鱼血清高密度脂蛋白胆固醇含量逐渐升高,而低密度脂蛋白胆固醇含量则逐渐降低。这与奥尼罗非鱼[7]、尼罗罗非鱼[27]、厚唇弱棘 [45]等的研究结果基本一致。上述结果说明当饲料中脂肪水平不断升高后,由于血清中胆固醇的积累,促使血液中高密度脂蛋白含量增加,来转运和清除血液中的胆固醇,导致血液中高密度脂蛋白胆固醇含量升高;当鱼类肝细胞受到损伤后,卵磷脂胆固醇脂酰基转移酶(LCAT)活性降低,低密度脂蛋白含量减少,使肝细胞中的胆固醇不能及时运出,就会造成脂肪在肝脏中的积聚,进一步使肝脏中脂肪含量升高,血清低密度脂蛋白胆固醇含量降低。
正常情况下,动物血清中转氨酶的活性保持在较低水平[24],肝组织受损或病变时会导致肝细胞坏死或细胞膜通透性增加,致使肝细胞中的谷丙转氨酶和谷草转氨酶渗入血液,使血液中的转氨酶活性增加[54];碱性磷酸酶则在动物体内直接参与磷酸基团的转移和代谢,与蛋白质、脂质等代谢有关,同时受机体营养状况、环境变化及疾病和生长阶段的影响[55],当动物发生脂肪肝等病变时,血清碱性磷酸酶活性会显著升高[7];胆汁酸是在肝脏内以胆固醇为原料合成的一种有机酸,可反映肝脏分泌状态、合成摄取情况及肝细胞损伤程度。肝脏对血液中的胆汁酸有很大的亲和力,正常情况下血清中胆汁酸含量极低,当肝细胞出现实质性损害时,肝细胞对胆汁的摄取功能降低,导致血清中胆汁酸含量升高[56]。本试验结果表明,白甲鱼幼鱼血清谷丙转氨酶、谷草转氨酶、碱性磷酸酶活性及胆汁酸含量均随饲料脂肪水平的升高而逐渐升高。在吉富罗非鱼[57]、红白锦鲤(Cyprinus carpio)[58]、厚唇弱棘 [45]等上也有相似的结论,这说明饲料脂肪水平的逐渐升高使白甲鱼幼鱼肝脏细胞组织发生了一定生理病变。
① 适宜的饲料脂肪水平可促进白甲鱼幼鱼的生长,提高其饲料转化率和免疫能力,饲料脂肪水平过高则可引起肝损伤或组织病变。
② 在本试验条件下,综合考虑生长性能、体组成及血清生化指标,白甲鱼幼鱼饲料中适宜的脂肪水平为9.42%~10.18%。
| [1] | 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1998:36-46. ( 2) 2)
|
| [2] | CAVALLI R O,LAVENS P,SORGELOOS P.Performance of Macrobrachium rosenbergii broodstock fed diets with different fatty acid composition[J]. Aquaculture,1999,179(1/2/3/4):387-402. ( 1) 1)
|
| [3] | SILVA S S,GUNASEKERA R M,SHIM K F.Interactions of varying dietary protein and lipid levels in young red tilapia:evidence of protein sparing[J]. Aquaculture,1991,95(3/4):305-318. ( 1) 1)
|
| [4] | 梁友光.饲料脂肪水平对长吻鱼危生长的影响[J]. 水利渔业,1999,19(1):45-46. ( 1) 1)
|
| [5] | 郑珂珂,朱晓鸣,韩冬,等.饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J]. 水生生物学报,2010,34(4):815-821. ( 3) 3)
|
| [6] | 王爱民,吕富,杨文平,等.饲料脂肪水平对异育银鲫生长性能、体脂沉积、肌肉成分及消化酶活性的影响[J]. 动物营养学报,2010,22(3):625-63 ( 2) 2)
|
| [7] | 甘晖,李坚明,冯广朋,等.饲料脂肪水平对奥尼罗非鱼幼鱼生长和血浆生化指标的影响[J]. 上海海洋大学学报,2009,18(1):35-41. ( 3) 3)
|
| [8] | NANTON D A,LALL S P,MCNIVEN M A.Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock,Melanog rammus aeglefinus L[J]. Aquaculture Research,2001,32(Suppl.1):225-234. ( 2) 2)
|
| [9] | DU Z Y,LIU Y J,TIAN L X,et al.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition,2005,11(2):139-146. ( 2) 2)
|
| [10] | 周兴华,郑曙明,向枭,等.白甲鱼肌肉营养成分与品质的评价[J]. 西南大学学报:自然科学版,2007,29(8):123-128. ( 1) 1)
|
| [11] | 代应贵,王晓辉.稀有白甲鱼含肉率及肌肉营养成分分析[J]. 水产科学,2007,26(1):7-11. ( 1) 1)
|
| [12] | 李勇,张耀光,谢碧文,等.白甲鱼胚胎和胚后发育的初步观察[J]. 西南师范大学学报:自然科学版,2006,31(5):142-147. ( 1) 1)
|
| [13] | 钟有超.白甲鱼、大鳍鳠和斑鳜肾的比较组织学研究[J]. 水产学报,1996,20(1):76-80 ( 1) 1)
|
| [14] | 王红叶,张娟,蔡焰值,等.白甲鱼不同组织同工酶的组织特异性研究[J]. 湖北农业科学,2011,50(23):4912-4915. ( 1) 1)
|
| [15] | 胡世然,张竹青,周承辉,等.白甲鱼生物学特性及人工驯养技术[J]. 贵州农业科学,2009,37(10):152-154. ( 1) 1)
|
| [16] | 陈先均,周剑,李孟均.白甲鱼生物学特征与繁殖技术初探[J]. 江苏农业科学,2008(6):222-223. ( 1) 1)
|
| [17] | 何斌,陈先均,龙治海,等.白甲鱼苗种培育试验[J]. 科学养鱼,2010(12):6-7. ( 1) 1)
|
| [18] | 万松彤.四川白甲鱼的网箱养殖试验[J]. 渔业致富指南,2010(13):58-59. ( 1) 1)
|
| [19] | 贺建华.饲料分析与检测[M].北京:中国农业出版社,2003:19-46. ( 1) 1)
|
| [20] | 王琰,钱士匀.生物化学和临床生物化学检验实[M].北京:清华大学出版社,2005:70-102. ( 1) 1)
|
| [21] | 张艳君,李明润.血清低密度与高密度脂蛋白胆固醇含量测定方法比较[J].中华医学研究杂志,2003,3(7):604-606. ( 1) 1)
|
| [22] | CHO C Y.Feeding systems for rainbow trout and other salmonids with reference to current estimates of energy and protein requirement[J]. Aquaculture,1992,100(1/2/3):107-123. ( 1) 1)
|
| [23] | 付世建,谢小军,张文兵,等.南方鲇的营养学研究:Ⅲ.饲料脂肪对蛋白质的节约效应[J]. 水生生物学报,2001,25(1):70-75. ( 1) 1)
|
| [24] | HALVER J E,HARDY R W.Fish nutrition[M].London:Academic Press,1989:154-209. ( 3) 3)
|
| [25] | 刘波,唐永凯,俞菊华,等.饲料脂肪对翘嘴红鲌生长、葡萄糖激酶和葡萄糖-6-磷酸酶活性与基因表达的影响[J]. 中国水产科学,2008,15(6):1024-1033. ( 1) 1)
|
| [26] | 赵巧娥,朱邦科,沈凡,等.饲料脂肪水平对鳡幼鱼生长、体成分及血清生化指标的影响[J]. 华中农业大学学报,2012,3l(3):357-363. ( 3) 3)
|
| [27] | 涂玮,田娟,文华,等.尼罗罗非鱼幼鱼饲料的适宜脂肪需要量[J]. 中国水产科学,2012,19(3):436-44. ( 3) 3)
|
| [28] | 王朝明,罗莉,张桂众,等.饲料脂肪水平对胭脂鱼幼鱼生长、体组成和抗氧化能力的影响[J]. 淡水渔业,2010,40(5):47-53. ( 2) 2)
|
| [29] | 向枭,周兴华,陈建,等.日粮脂肪水平对翘嘴红鲌幼鱼生长性能和体组成的影响[J]. 动物营养学报,2009,21(3):411-416. ( 3) 3)
|
| [30] | 段彪,向枭,周兴华,等.齐口裂腹鱼饲料中适宜脂肪需要量的研究[J]. 动物营养学报,2007,19(3):232-236. ( 2) 2)
|
| [31] | CHATZIFOTIS S,PANAGIOTIDOU M,PAPAIOANNOU N,et al.Effect of dietary lipid levels on growth,feed utilization,body composition and serum metabolites of meagre (Argyrosomus regius) juveniles[J]. Aquaculture,2010,307(1/2):65-70. ( 2) 2)
|
| [32] | CHOU B S,SHIAU S Y.Optimal dietary lipid level for growth of juvenile hybrid tilapia Oreochromis niloticus ×Oreochromis aureus[J]. Aquaculture,1996,143(2):185-195. ( 1) 1)
|
| [33] | LPEZ L M,TORRES A L,DURAZO E,et al.Effects of lipid on growth and feed utilization of white seabass (Atractoscion nobilis) fingerlings[J]. Aquaculture,2006,253(1/2/3/4):557-563. ( 1) 1)
|
| [34] | 张泽芸,张季涛,陈先均.饲料中的脂肪含量对长吻(鱼危)鱼种生长的影响[J]. 西南农业学报,1991,4(4):110-114. ( 1) 1)
|
| [35] | 袁立强,马旭洲,王武,等.饲料脂肪水平对瓦氏黄颡鱼生长和鱼体色的影响[J]. 上海水产大学学报,2008,17(5):577-584. ( 2) 2)
|
| [36] | LUO G,XU J H,TENG Y J,et al.Effects of dietary lipid levels on the growth,digestive enzyme,feed utilization and fatty acid composition of Japanese sea bass (Lateolabrax japonicus L.) reared in freshwater[J]. Aquaculture Research,2010,41:210-219. ( 2) 2)
|
| [37] | 宋理平,韩勃,王爱英,等.脂肪水平对淡水黑鲷生长及体成分的影响[J]. 长江大学学报:自然科学版,2010,7(1):27-31. ( 1) 1)
|
| [38] | MORAISA S,CONCEIÇOA L E C,RNNESTAD I,et al.Dietary neutral lipid level and source in marine fish larvae:effects on digestive physiology and food intake[J]. Aquaculture,2007,268(1/2/3/4):106-122. ( 1) 1)
|
| [39] | KAUSHIK S J,MEDALE F,FAUCONNEAU B,et al.Effect of digestible carbohydrates on protein/energy utilization and on glucose metabolism in rainbow trout (Salmo gairdneri R.)[J]. Aquaculture,1989,79(1/2/3/4):63-74. ( 1) 1)
|
| [40] | TAKEUCHI T,SHIINA Y,WATANABE T.Suitable protein and lipid levels in diet for fingerling of red sea bream Pagrus major[J]. Nippon Suisan Gakkaishi,1991,57(2):293-299. ( 1) 1)
|
| [41] | BUCHET V,ZAMBONINO I J L,CAHU C L.Effect of lipid level in a compound diet on the development of red drum (Sciaenops ocellatus) larvae[J]. Aquaculture,2000,184(3/4):339-347. ( 1) 1)
|
| [42] | 王吉桥,耿加振,姜玉声,等.饲料中脂肪含量对七彩神仙鱼幼鱼生长和消化的影响[J]. 水产学杂志,2009,22(1):24-30. ( 2) 2)
|
| [43] | 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J]. 水生生物学报,2011,35(1):80-87. ( 1) 1)
|
| [44] | 汪开毓,苗常鸿,黄锦炉,等.投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1 mRNA表达的变化[J]. 动物营养学报,2012,24(12):2375-2383. ( 1) 1)
|
| [45] | 王爱英,韩勃,宋理平,等.不同脂肪水平对厚唇弱棘 血液生化指标的影响[J]. 浙江海洋学院学报:自然科学版,2010,29(3):222-226. ( 3) 3)
|
| [46] | LPEZ L M,DURAZO E,VIANA M T,et al.Effect of dietary lipid levels on performance,body composition and fatty acid profile of juvenile white seabass,Atractoscion nobilis[J]. Aquaculture,2009,289(1/2):101-105. ( 1) 1)
|
| [47] | 程汉良,夏德全,吴婷婷.鱼类脂类代谢调控与脂肪肝[J]. 动物营养学报,2006,18(4):294-298. ( 1) 1)
|
| [48] | DING L Y,ZHANG L M,WANG J Y,et al.Effect of dietary lipid level on the growth performance,feed utilization,body composition and blood chemistry of juvenile starry flounder (Platichthys stellatus)[J]. Aquaculture Research,2010,41:1470-1478. ( 1) 1)
|
| [49] | 王兴强,段青源,麦康森,等.养殖鱼类脂肪肝研究概况[J]. 海洋科学,2002,26(7):36-39. ( 1) 1)
|
| [50] | LIN D,MAO Y Q,CAI F S.Nutritional lipid liver disease of grass carp Ctenopharyngodon idullus[J]. Chinese Journal of Oceanology and Limnology,1990,8(4):363-373. ( 1) 1)
|
| [51] | 梁旭方,自俊杰,劳海华,等.真鲷脂蛋白脂肪酶基因表达与内脏脂肪蓄积营养调控定量研究[J]. 海洋与湖沼,2003,34(6):625-63. ( 1) 1)
|
| [52] | 周顺伍.动物生物化学[M].3版.北京:中国农业出版社,2009:144-147. ( 1) 1)
|
| [53] | BABIN P J,VERNIER J M.Plasma lipoproteins in fish[J].Journal of Lipid Research,1989,30:467-489. ( 1) 1)
|
| [54] | RICHARD J S,CARL B S,JAMES T G.Corticoid stress responses to handling and temperature in salmonids[J]. Transactions of the American Fisheries Society,1977,106(3):213-218. ( 1) 1)
|
| [55] | 徐奇友,许红,李婵,等.用豆油代替鱼油对虹鳟生长、非特异性免疫和组织酶活性的影响[J]. 大连水产学院学报,2009,24(2):104-108. ( 1) 1)
|
| [56] | 周志东,林霞.血清总胆汁酸和前清蛋白测定在不同肝病中的临床意义[J]. 检验医学与临床,2010,7(23):2634-2635. ( 1) 1)
|
| [57] | 石桂城,董晓慧,陈刚,等.饲料脂肪水平对吉富罗非鱼生长性能及其在低温应激下血清生化指标和肝脏脂肪酸组成的影响[J]. 动物营养学报,2012,24(11):2154-2164. ( 1) 1)
|
| [58] | 崔培,姜志强,韩雨哲,等.饲料脂肪水平对红白锦鲤体色、生长及部分生理生化指标的影响[J]. 天津农学院学报,2011,18(2):23-31. ( 1) 1)
|




