高黎贡山猪是我国云南省特有的山地放牧型小型猪种[1],主要分布在高黎贡山平均海拔2 300 m(987~3 980 m)以上地区,具有耐粗饲、抗逆性强、贮脂能力强等特性。成年猪体重约45 kg,产仔数为(6.22±1.01)头,初生重(0.72±0.80) kg;2月龄体重(6.16±0.96) kg;6月龄体重22~25 kg;12月龄体重约35 kg,肉质鲜嫩,肌肉粗脂肪含量达7%以上[2],肌肉亚油酸、亚麻油酸和花生油酸含量分别为19.75%、16.24%和20.99%[3],是我国珍稀的优良地方猪种。研究高黎贡山猪在适应高原低氧环境过程中抗氧化基因的表达差异,可为揭示高原动物抗氧化适应性生命活动的生物学机制提供重要生物信息,为高黎贡山猪这一珍稀猪种的保种和利用提供科学依据。高黎贡山猪种的研究报道非常少,目前仅处于资源调查、血液多态性分析等方面。谷氧还蛋白(glutaredoxin,GRX)和硫氧还蛋白(thioredoxin,TRX)分别由GRX1和TRX1基因编码,是独立于谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)抗氧化酶外的抗氧化系统。GRX和TRX分别是氧化酶和非酶系统的成员,具有抗衰老、强抗氧化效应[4]。维生素E是机体抗氧化防御系统中非酶反应体系的重要组成成分,在清除自由基、提高抗氧化酶活性等方面发挥重要作用。迄今为止,国内外均未见维生素E对猪的GRX1、TRX1基因表达与抗氧化效应及作用机理的研究报道。基于高黎贡山猪独特的生物学特性和遗传特性及其生存条件,可以推测在云南高原立体生态环境下,高黎贡山猪组织中TRX1、GRX1基因表达存在差异,而氧化应激可能诱导氧化应激细胞中TRX1、GRX1基因产生过表达,特定功能性营养素对其表达具有调节作用。因此,本试验采用实时荧光定量PCR(RT-qPCR)方法检测高黎贡山猪的垂体、下丘脑、甲状腺、胸腺、胰腺、生殖腺、十二指肠、空肠、回肠、肝脏、皮肤11种组织中GRX1、TRX1基因表达量;以过氧化氢(H2O2)诱导构建氧化应激细胞模型,在氧化应激状态下,探讨外源维生素E对GRX1、TRX1基因表达的调节作用及高黎贡山猪高原低氧适应性的基因基础,为这一独特优势资源的优化利用的深入研究提供研究思路和新的试验证据。
在高黎贡山原产地,随机选取健康、2月龄、放牧饲养管理相同、体重 相近的放牧型高黎贡山小型猪12头(公母各占1/2),按试验要求屠宰,迅速取出垂体、下丘脑、甲状腺、胸腺、胰腺、生殖腺、十二指肠、空肠、回肠、肝脏、皮肤11种组织,液氮速冻,-80 ℃保存待用。
采用猪胎儿皮肤成纤维细胞(PFSF)为细胞培养材料,整个试验均在细胞的3~5代间进行。
RNAsimple Total RNA Kit(北京天根生化科技有限公司);PrimeScript RT Master Mix (Perfect Real Time)反转录试剂盒(日本TaKaRa公司);SsoFastTM Eva Green Supermix(美国Bio-Rad公司);维生素E(美国Sigma公司);DMEM/F12细胞培养基、胎牛血清(美国Gibco公司)。
细胞培养箱(美国Thermo公司);Bio-Rad CFX96TM Real-Time PCR仪(美国Bio-Rad公司)。
利用Primer 5.0软件进行引物设计,并用NCBI数据库中的Primer-Blast工具确认引物的特异性,由上海英骏生物技术有限公司合成,选用在猪体内稳定表达的β-肌动蛋白(β-actin)、甘油醛-3-磷酸脱氢酶(GAPDH)、TATA框结合蛋白(TBP)3个基因作为内参基因[5, 6],引物信息见表1。
PFSF来源于妊娠第40~50天的猪胎儿背部组织,在含10%的胎牛血清的DMEM/F12培养液中,37 ℃,5% CO2饱和湿度条件下培养。用胰酶消化、传代,取增殖旺盛、状态良好的细胞用于试验研究。
非应激细胞(正常态细胞):用含10%的胎牛血清的DMEM/F12培养液培养;氧化应激细胞:用含有10 μmol/L的H2O2的DMEM/F12培养液应激5 min后,同时移去非应激细胞和氧化应激细胞培养板中的培养液,用磷酸盐缓冲液(PBS)冲洗1次,换用含有维生素E的DMEM/F12培养液(含有5%的胎牛血清)继续培养。具体浓度分别是0(对照)、5、10、20、40、80 μg/mL,每个浓度设3个重复。24 h后移去培养液,用PBS冲洗3次,提取总RNA。
按照RNAsimple Total RNA Kit试剂盒说明书提取高黎贡山猪各组织和细胞中的总RNA,分别吸取1 μL总RNA溶液,测定OD260 nm、OD280 nm值;将所提取的总RNA用1.5%琼脂糖凝胶电泳检测RNA质量。参照PrimeScript RT Master Mix (Perfect Real Time)说明书,合成cDNA第1条链,-20 ℃保存。
以cDNA为模板进行PCR,扩增产物经琼脂糖凝胶DNA回收试剂盒回收目的片段。使用EASY Dilution(日本TaKaRa公司)先100倍稀释回收产物,然后10倍梯度连续稀释得到RT-qPCR的标准品。
| 表1 RT-qPCR引物信息
Table 1 Information of primers used for RT-qPCR
|
采用RT-qPCR的染料法,反应在Bio-Rad CFX96TM Real-Time PCR仪上进行。按照预先筛选好的RT-qPCR反应条件和体系将上述标准品进行扩增。每次反应都设置标准品、未知样品(重复3次)和1个阴性对照。结果通过Bio-Rad CFX96TM软件分析制作标准曲线,根据标准曲线和熔解曲线的循环阈值(Ct)计算定量结果。
RT-qPCR反应体系为20 μL:SsoFastTM Eva Green SuperMix 10 μL,上、下游引物(10 μmol/L)各1 μL,cDNA模板2 μL,灭菌去离子水6 μL。 反应条件为:95 ℃预变性30 s;95 ℃变性5 s,55.5 ℃退火20 s,72 ℃延伸15 s,40个循环。
所有组织以及细胞中的GRX1、TRX1基因的表达量均是以β-actin、GAPDH、TBP为内参基因,最终以相对表达量来表示,计算方法参考Pfaffl[7]报道的方法进行计算,结果使用SAS 8.20软件进行统计分析,进行最小二乘均值分析,结果以最小二乘均值±标准差表示,均值间的多重比较用Duncan氏法。
依据含H2O2的DMEM/F12培养液对细胞氧化应激预试验的结果和参考Gallogly等[8]报道,本试验最终选用含有20 μmol/L H2O2的DMEM/F12培养液,应激时间为5 min。细胞的各种形态如图1所示。
所提取的总RNA用1.5%琼脂糖凝胶电泳鉴定其完整性(图2),28S、18S条带清晰,无DNA污染条带,OD260 nm/OD280 nm在1.8~2.0之间,表明提取的总RNA纯度较高。
本试验标准曲线的相关系数(R2)和扩增效率(E)均等于或接近1.000,说明本试验得到的Ct可以准确确定起始cDNA拷贝数,试验误差较小,可信度较高。
本试验目的基因的定量熔解曲线均有1个单一的峰,如图3所示,说明在扩增过程中没有非特异性扩增和引物二聚体的产生,荧光强度均来自于特异性扩增。
由图4可知,高黎贡山母猪胸腺、生殖腺、回肠、肝脏中GRX1基因表达量显著高于公猪(P<0.05),胰腺GRX1基因表达量极显著高于公猪(P<0.01)。由图5可知,高黎贡山母猪垂体、胸腺、胰腺、生殖腺和肝脏中TRX1基因表达量显著高于公猪(P<0.05)。
 | 图1 PFSF的形态
Fig.1 Morphology of PFSF (40×) |
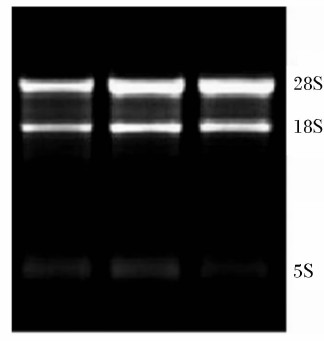 | 图2 总RNA提取电泳图
Fig.2 Agarose gel electrophoresis of total RNA |
由图6和图7可知,高黎贡山猪被检组织中GRX1、TRX1基因表达谱为:肝脏中GRX1、TRX1基因表达量最高,皮肤和空肠中GRX1、TRX1基因表达量较高,内分泌腺和其他组织中表达量较低。
由图8和图9可知,公猪及母猪下丘脑中GRX1基因表达量显著高于垂体、甲状腺和胸腺(P<0.05);公猪垂体中TRX1基因表达量显著低于下丘脑、甲状腺和胸腺(P<0.05),母猪垂体、下丘脑、甲状腺和胸腺间TRX1基因表达量差异不显著(P>0.05)。
由图10和图11可知,高黎贡山公猪和母猪空肠中GRX1基因表达量显著或极显著高于十二指肠和回肠(P<0.05或P<0.01),空肠中TRX1基因表达量极显著高于十二指肠和回肠(P<0.01)。
由图12和图13可知,肝脏、皮肤中GRX1、TRX1基因表达量极显著高于胰腺和生殖腺(P<0.01),肝脏中GRX1、TRX1基因表达量显著或极显著高于皮肤(P<0.05或P<0.01),胰腺与生殖腺间GRX1、TRX1基因表达量差异不显著(P>0.05)。
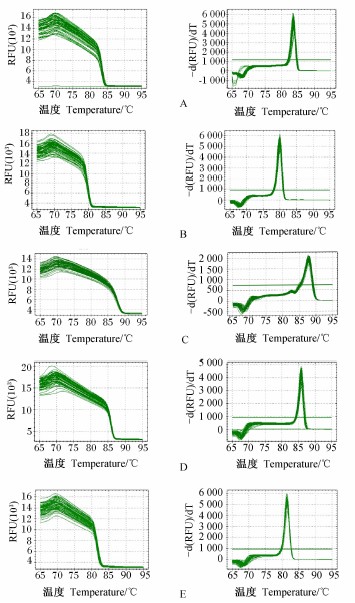 | 图3 RT-qPCR反应产物熔解曲线
Fig.3 Melting curves of RT-qPCR reaction product |
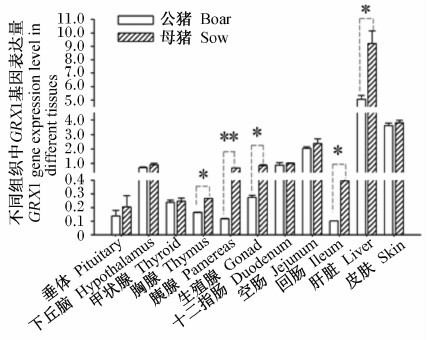 | 图4 GRX1基因在高黎贡山猪不同性别间的表达 Fig.4 GRX1 gene expression in different genders of Gaoligongshan pigs |
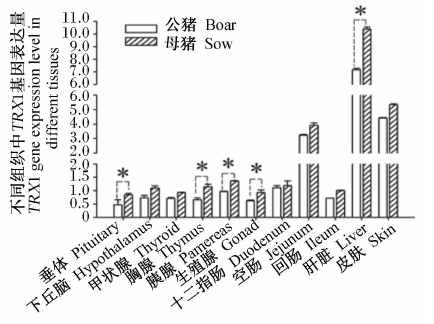 | 图5 TRX1基因在高黎贡山猪不同性别间的表达 Fig.5 TRX1 gene expression in different genders of Gaoligongshan pigs |
由图14和图15可知,相同维生素E浓度条件下,与非应激细胞相比,氧化应激细胞GRX1基因表达量无显著变化(P>0.05),TRX1基因表达量显著高于非应激细胞(P<0.05);未添加维生素E(对照)时,与非应激细胞相比,氧化应激细胞中GRX1基因表达量差异不显著(P>0.05),TRX1基因表达量比非应激细胞高出45.9%,差异显著(P<0.05)。
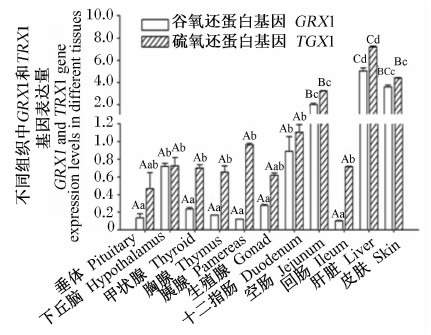 | 图6 GRX1、TRX1基因在高黎贡山公猪不同组织中的表达 Fig.6 GRX1 and TRX1 gene expressions in different tissues of Gaoligongshan boars |
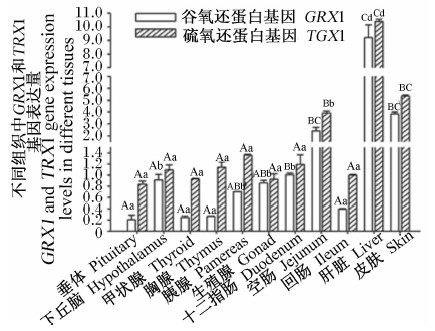 | 图7 GRX1、TRX1基因在高黎贡山母猪不同组织中的表达 Fig.7 GRX1 and TRX1 gene expressions in different tissues of Gaoligongshan sows |
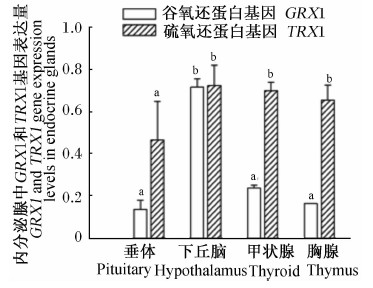 | 图8 GRX1、TRX1基因在高黎贡山公猪垂体、下丘脑、甲状腺和胸腺中的表达 Fig.8 GRX1 and TRX1 gene expressions in pituitary, hypothalamus, thyroid and thymus of Gaoligongshan boars |
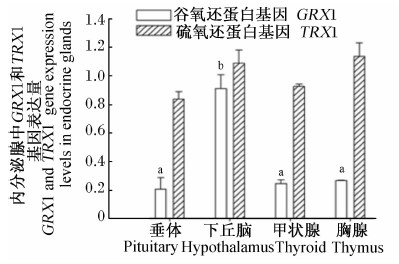 | 图9 GRX1、TRX1基因在高黎贡山母猪垂体、下丘脑、甲状腺和胸腺组织中的表达 Fig.9 GRX1 and TRX1 gene expressions in pituitary, hypothalamus, thyroid and thymus of Gaoligongshan sows |
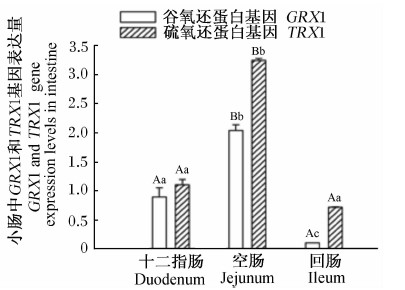 | 图10 GRX1、TRX1基因在高黎贡山公猪小肠中的表达 Fig.10 GRX1 and TRX1 gene expressions in small intestine of Gaoligongshan boars |
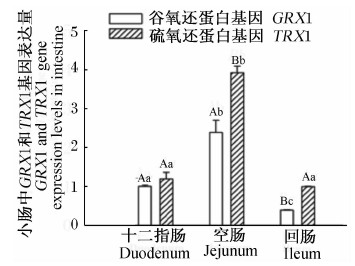 | 图11 GRX1、TRX1基因在高黎贡山母猪小肠中的表达 Fig.11 GRX1 and TRX1 gene expressions in small intestine of Gaoligongshan sows |
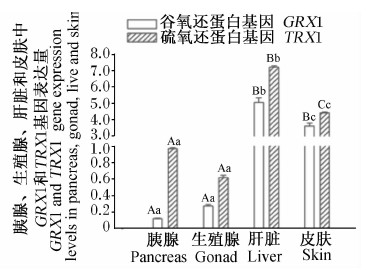 | 图12 GRX1、TRX1基因在高黎贡山公猪胰腺、生殖腺、肝脏和皮肤中的表达 Fig.12 GRX1 and TRX1 gene expressions in pancreas, gonad, liver and skin of Gaoligongshan boars |
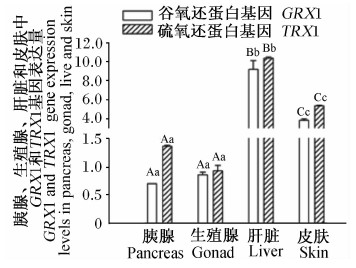 | 图13 GRX1、TRX1基因在高黎贡山母猪胰腺、生殖腺、肝脏和皮肤中的表达 Fig.13 GRX1 and TRX1 gene expressions in pancreas, gonad, liver and skin of Gaoligongshan sows |
由图14可知,随着维生素E浓度的增加,非应激细胞和氧化应激细胞中GRX1基因表达量提高。与对照比较,维生素E浓度达40和80 μg/mL时,显著提高GRX1基因表达量(P<0.05);其他浓度与对照之间差异不显著(P>0.05)。
由图15可知,随着维生素E浓度的增加,非应激细胞和氧化应激细胞中TRX1基因表达量提高,在维生素E浓度达到40 μg/mL时,TRX1基因表达量与对照之间差异极显著(P<0.01), 随后呈下降趋势;维生素E浓度达20、80 μg/mL时,TRX1基因表达量与对照之间差异显著(P<0.05)。
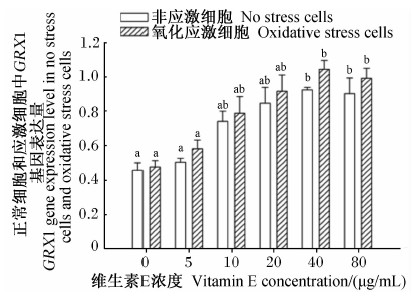 | 图14 维生素E对氧化应激细胞中GRX1基因表达的影响 Fig.14 Effects of vitamin E on GRX1 gene expression in oxidative stress cells |
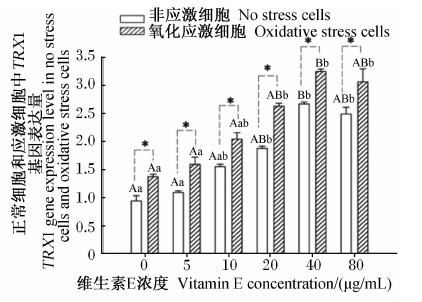 | 图15 维生素E对氧化应激细胞中TRX1基因表达的影响 Fig.15 Effects of vitamin E on TRX1 gene expression in oxidative stress cells |
高黎贡山猪肝脏、皮肤及空肠中GRX1、TRX1基因表达量相对较高,各内分泌腺组织中GRX1、TRX1基因表达量相对较低。肝脏是动物机体主要的代谢和分泌器官[9, 10],容易受到体内化学性应激源的袭击。空肠是小肠的一部分,处于弯曲的袢状,血管丰富、管壁厚、管腔大,黏膜面有高而密的环形皱襞,消化和吸收力强,比较容易受到体内营养性应激源的袭击[11, 12]。皮肤是动物机体和外界环境间的第1道防御线,直接与外界环境接触,皮肤组织的破坏会导致病原入侵,导致发炎甚至疾病。因此,皮肤比较容易受到生长环境物理性、微生物等应激源的袭击[13, 14]。本研究结果表明,GRX1、TRX1基因在肝脏、皮肤及空肠中的表达量相对较高,因此,发生氧化应激的组织中GRX1、TRX1基因表达量可能高于正常组织,即组织在受到氧化应激或因氧化应激而产生病变时产生过表达,以减缓氧化应激的损伤。Ivarsson等[15]报道,烟酰胺腺嘌呤二核苷酸磷酸/谷氧还蛋白/硫氧还蛋白(NADPH/GRX/TRX)系统介导的一种新型的氧化还原调节信号转导通路能促进胰岛素的分泌,有利于预防糖尿病的发生;Baker等[16]研究表明,在人结肠癌的癌前病变结肠息肉的正常黏膜中,TRX蛋白水平无显著增加,但在癌变后却增加了6倍,并且TRX蛋白在癌症病人血浆中水平增高;此外,TRX可以抑制胰腺癌[17]、乳腺癌[18]引起的细胞凋亡,等等。高黎贡山猪GRX1、TRX1基因表达量在肝脏、皮肤和肠道组织中较高,在胰腺、内分泌腺各组织中相对较低。高黎贡山猪生长在云南独特的高原生态环境下,经过长期的选育,具有较强的低氧适应性,其组织中GRX1、TRX1基因表达差异可能影响高黎贡山猪的抗氧化能力。
高黎贡山猪被检组织中均有GRX1、TRX1基因的表达,母猪组织中GRX1、TRX1基因表达量高于公猪。TRX1基因的高表达可能与高原低氧环境及放牧有关。刘莹莹[19]研究报道,松江鲈(Trachidermus fasciatus)硫氧还蛋白1(TfTrx1)基因受到脂多糖(LPS)刺激后,在皮肤、肝脏、脾、和脑中TfTrx1基因转录水平存在明显的上调。母猪组织中GRX1、TRX1基因表达量较高,可能与高黎贡山母猪的繁殖生理密切相关。母猪生存和繁衍后代经历了特殊的妊娠、哺乳和非妊娠繁殖生理过程,在云南高原低氧立体环境生态条件下,放牧型高黎贡山猪更易受到各种应激的刺激,从而导致母猪组织中TRX1基因表达量发生适应性变化。但对氧化应激引起高黎贡山母猪组织中GRX1、TRX1基因表达之间可能存在的互作与机理,有待进一步研究。
H2O2是一种重要的活性氧,也是体内氧化代谢的中间产物,性质相对稳定,极易透过细胞膜。H2O2可直接作用于细胞膜结构上的不饱和脂肪酸诱发脂质过氧化反应,也可进入细胞内,破坏细胞成分,影响细胞DNA、生物膜和抗氧化酶等的结构与功能,造成细胞损伤和细胞死亡[20]。皮肤是动物机体和环境间的第1道防御线,保护机体内组织和器官免受物理性、机械性、化学性和病原微生物性的侵袭。本试验GRX1、TRX1基因在皮肤中的表达量较高,因此,选择皮肤组织研究高黎贡山猪的氧化应激效应及其调控是可行的。
GRX1、TRX1分别属于抗氧化酶系统和抗氧化非酶系统的主要成员,具有缓解细胞氧化胁迫的作用。当细胞受到氧化应激时,GRX1、TRX1基因发生过表达。邹朝霞[21]报道,GRX1在氧化应激的HEK293T细胞中的表达量较高。Norihiko等[22]研究表明,在人类T淋巴细胞受到H2O2应激时,TRX1基因会大量表达;Gallogly等[8]发现,在氧化应激状态下,细胞中的GRX1基因表达量会增加,抑制GRX1基因表达时,氧化性的细胞增加。在本试验中发现,细胞氧化应激后GRX1、TRX1基因表达量增加,这是细胞应答氧化应激的重要方式之一,诱导GRX1、TRX1基因表达,则可能改变氧化应激细胞的抗氧化能力,说明诱导氧化应激细胞中GRX1、TRX1基因表达量增加有利于缓解细胞氧化应激损伤。
维生素E是体内主要的脂溶性的断链性抗氧化剂,与SOD、GSH-Px一起构成体内抗氧化系统,保护细胞膜及细胞内的核酸免受自由基的攻击[23]。李彦等[24]报道,饲粮添加维生素E及维生素A可提高肉鸡血清中SOD、GSH-Px的活性、降低丙二醛(MDA)含量。蒋守群等[25]报道,添加10、20 mg/kg维生素E可显著提高肉鸡血清、肝脏中GSH-Px活性,提高肌肉中总过氧化物歧化酶(T-SOD)活性,显著降低肝脏中MDA含量。Nava等[26]报道,维生素E可在脂蛋白和膜中通过阻断多不饱和脂肪酸(PUFA)脂质过氧化的链式反应,保护细胞膜免遭氧化损伤,并调节依赖于活性氧的细胞内信号传导通路。丛义梅[27]报道,维生素E对细胞的凋亡有抑制作用,并且随着浓度的增大而作用更明显,但大于50 μmol/mL时,作用下降。添加适宜浓度维生素E使氧化应激细胞中GRX1、TRX1基因表达量更高,说明维生素E影响GRX1、TRX1基因表达,其作用机理还有待研究。本试验结果表明,随着维生素E浓度的增大,GRX1、TRX1基因表达量增高,维生素E浓度为40 μg/mL时,表达量最高;浓度大于80 μg/mL时,其表达量呈下降趋势,添加维生素E对氧化应激细胞损伤具有保护作用,维生素E对GRX1、TRX1基因表达调控的适宜浓度为40 μg/mL。
① 在高黎贡山猪的各组织中均可以检测到GRX1、TRX1基因的表达,肝脏、皮肤组织中GRX1、TRX1基因表达量最高,其次是空肠;母猪组织中GRX1、TRX1基因表达量高于公猪。高黎贡山猪组织中GRX1、TRX1基因的表达存在性别和组织上的差异性。
② 氧化应激可诱导细胞中GRX1、TRX1基因发生过表达,维生素E对氧化应激细胞中GRX1、TRX1基因表达具有调节作用,其适宜浓度为40 μg/mL。诱导猪体内GRX1、TRX1基因过表达可能是缓解机体氧化应激的一种重要方式,添加适宜浓度的维生素E可以诱导猪氧化应激细胞中GRX1、TRX1基因表达,从而增强猪机体的抗氧化能力。
| [1] | 云南省畜牧局.云南省家畜家禽品种志[M].昆明:云南科技出版社,1987. ( 1) 1)
|
| [2] | 赵桂英,严达伟,连林生,等.高黎贡山猪遗传资源现状的调查[J]. 云南农业大学学报,2010,25(2):219-225. ( 1) 1)
|
| [3] | 连林生,屈再久,李琦华,等.高黎贡山猪[J]. 养猪,2004(2):24-25. ( 1) 1)
|
| [4] | HOLMGREN A.Antioxidant function of thioredoxin and glutaredoxin systems[J]. Antioxidants & Redox Signaling,2000,2(4):811-820. ( 1) 1)
|
| [5] | KERR C A,BUNTER K L,SEYMOUR R,et al.The heritability of the expression of two stress-regulated gene fragments in pigs[J].Journal of Animal Science,2005,83:1753-1765. ( 1) 1)
|
| [6] | TIM E,MARIO V P,PEELMAN L J,et al.Development of a new set of reference genes for normalization of real-time RT-PCR data of porcine backfat and longissimus dorsi muscle,and evaluation with PPARGC1A[J]. BMC Biotechnology,2006,6:41. ( 1) 1)
|
| [7] | PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research,2001,29(9):e45. ( 1) 1)
|
| [8] | GALLOGLY M M,SHELTON M D,QANUNGO S,et al.Glutaredoxin regulates apoptosis in cardiomyocytes via NFκB targets Bcl-2 and Bcl-xL:implications for cardiac aging[J]. Antioxidants & Redox Signaling,2010,12(12):1339-1353. ( 2) 2)
|
| [9] | SHERLOCK S,DOOLEY J.Diseases of the liver and biliary system[M].11th ed.Oxford:Blackwell Science Ltd.,2007. ( 1) 1)
|
| [10] | SATDARSHAN P S M.Molecular pathology of liver diseases[M].New York:Springer-Verlag New York Inc.,2010. ( 1) 1)
|
| [11] | MORETO M,PEREZ A B.Dietary plasma proteins,the intestinal immune system,and the barrier functions of the intestinal mucosa[J]. Journal of Animal Science,2009,87:E92-E100. ( 1) 1)
|
| [12] | O’NEIL M R,LARDY G P,REYNOLDS L P,et al.Impacts of linseed meal and estradiol-17β on mass,cellularity,angiogenic factors,and vascularity of the jejunum[J]. Journal of Animal Science,2008,86:3014-3022. ( 1) 1)
|
| [13] | ANDERSON R R,PARRISH J A.The optics of human skin[J]. Journal of Investigative Dermatology,1981,77:13-19. ( 1) 1)
|
| [14] | NESTLE F O,MEGLIO P D,JIAN Z Q.et al.Skin immune sentinels in health and disease[J].Nature Reviews Immunology,2009,9(10):679-691. ( 1) 1)
|
| [15] | IVARSSON R,QUINTENS R,DEJONGHE S,et al.Regulatory role of NADPH,thioredoxin, and glutaredoxin[J]. Diabetes,2005,54(7):2132-2142. ( 1) 1)
|
| [16] | BAKER A F,DRAGOVICHA T,TATEA W R,et al.The antitumor thioredoxin-1 inhibitor PX-12 (1-methylpropyl 2-imidazolyl disulfide) decreases thioredoxin-1 and VEGF levels in cancer patient plasma[J]. Journal of Laboratory and Clinical Medicine,2006,147(2):83-90. ( 1) 1)
|
| [17] | NAKAMURA H,BAI J,NISHINAKA Y,et al.Expression of thioredoxin and glutaredoxin,redox-regulating proteins,in pancreatic cancer[J].Cancer Detection and Prevention,2000,24(1):53-60. ( 1) 1)
|
| [18] | RAVID D,MUNIYAPPA H,DAS K C.Endogenous thioredoxin is required for redox cycling of anthracyclines and p53-dependent apoptosis in cancer cells[J]. The Journal of Biological Chemistry,2005,280(48):40084-40096. ( 1) 1)
|
| [19] | 刘莹莹.松江鲈(Trachidermus fasciatus)抗氧化相关基因的克隆、表达与功能分析 .博士学位论文.济南:山东大学,2012. ( 1) 1)
|
| [20] | RHEE S G.H2O2,a necessary evil for cell signaling[J]. Science,2006,312:1882-1883. ( 1) 1)
|
| [21] | 邹朝霞.GRX1过表达在H2O2诱导的p38MAPK途径中的作用 .硕士学位论文.哈尔滨:哈尔滨医科大学,2006. ( 1) 1)
|
| [22] | NORIHIKO K,YASUYUKI I,JUNJI Y, et al.Redox-sensing release of human thioredoxin from T lymphocytes with negative feedback loops[J].The Journal of Immunology,2004,172:442-448. ( 1) 1)
|
| [23] | SANYAL A J,CHALASANI N,KOWDLEY K V,et al.Pioglitazone,vitamin E,or placebo for nonalcoholic steatohepatitis[J]. The New England Journal of Medicine,2010,362(18):1675-1685. ( 1) 1)
|
| [24] | 李彦,杨在宾,杨维仁,等.日粮维生素A和维生素E水平对肉鸡抗氧化和免疫性能的影响[J]. 动物营养学报,2008,20(4):417-422. ( 1) 1)
|
| [25] | 蒋守群,周桂莲,蒋宗勇,等.饲粮维生素E水平对43-63日龄黄羽肉鸡肉品质和抗氧化功能的影响[J]. 动物营养学报,2012,24(4):646-653. ( 1) 1)
|
| [26] | NAVA M,QUIROZ Y,VAZIRI N,et al.Melatonin reduces renal interstitial inflammation and improves hypertension in spontaneously hypertensive rats[J]. American Journal of Physiology Renal Physiology,2003,284:F447-F454. ( 1) 1)
|
| [27] | 丛义梅.维生素E抗紫外线诱导的北京油鸡成纤维细胞凋亡作用的研究 .硕士学位论文.北京:中国农业科学院,2008. ( 1) 1)
|




