反刍动物胃肠道寄生虫感染一直是限制其生产性能提高的重要问题。感染羊的胃肠道寄生虫主要有线虫、吸虫和绦虫[1]。其中,吸血线虫的危害较大,如捻转血矛线虫(Haemonchus contortus,H. contortus),它不仅损伤羊皱胃黏膜,影响宿主物质代谢,降低饲料利用率,而且造成羊贫血、腹泻、瘫痪甚至死亡。目前国内外普遍采用化学驱虫药对胃肠道线虫(gastrointestinal nematode,GI)感染进行预防或治疗,虽然取得了显著的效果,但寄生虫很快产生抗药性,而且残留在畜产品中的驱虫药严重影响人类健康。昂贵的新药开发费用和食品安全问题促使人们寻求新的抗虫措施,其中,通过营养调控提高宿主寄生虫抗性的措施成为研究热点。然而,科学有效的营养调控措施必须建立在明确的寄生虫免疫机理及其与宿主营养之间的确切关系之上。因此,本文综述羊H. contortus的生活史、免疫机理及其指导下的控制羊H. contortus感染的主要营养调控措施。
通过研究寄生虫的生活史及其对环境的适应性,可以在其生长的关键环节实施有效的控制措施,降低其对宿主动物的危害。
H. contortus是感染羊(绵羊和山羊)的主要胃肠道线虫之一,绵羊比山羊易感[1],而且不同品种的绵羊对H. contortus的抗性也不同[2]。从地区来讲,温暖潮湿的热带和亚热带地区H. contortus感染尤为严重[3]。
1903年Rudolphi首次将H. contortus归为线虫动物门,线虫纲,圆形目,毛圆科,血矛属[4]。H. contortus不需要中间宿主,进入羊体内的幼虫经14 d左右发育成熟,成熟的雌虫和雄虫在皱胃里交配,雌虫开始产卵。雌虫的繁殖力极高,1只感染H. contortus的羊每天可以排出数百万枚虫卵[5]。处于桑葚胚阶段的虫卵随动物粪便排出体外,经24~48 h即可发育成1期(L1)幼虫。L1幼虫完成第1次脱鞘发育成2期(L2)幼虫,L2幼虫以细菌为生继续发育,经10 d左右发育成具有感染能力的3期(L3)幼虫。L3幼虫有2层体鞘,因而停止进食靠体内贮存的能量存活。L3幼虫随动物采食进入体内,在瘤胃内脱鞘发育为4期(L4)幼虫后到达皱胃定植,尤其喜欢定植在皱胃底部的隐窝里。L4幼虫钻入皱胃黏膜吸食宿主血液,经再一次脱鞘后发育为成虫后返回皱胃继续繁殖[3]。图1为归纳的H. contortus的生活史。
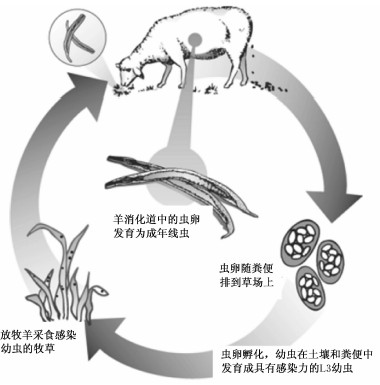 | 图1 H. contortus的生活史
Fig.1 Life cycle of H. contortus |
研究发现,H. contortus在其生活史的各个阶段都存在一定的适应性。首先,H. contortus幼虫在宿主体外存在特殊的适应性,具体表现在:在黎明或阴雨天里,幼虫会依靠露珠尽量爬到植物顶端叶片上,这样易被动物摄食而完成生活史。Dijk等[6]证实,降雨量和环境的湿度及温度直接影响草地上幼虫向植物顶端的移动。此外,H. contortus在宿主体内对寄生环境的适应能力很强。在寒冷的季节,动物体内的成虫会通过休眠停止发育,并在初春来临时继续发育。H. contortus在体内究竟是如何感知宿主体外温度的变化一直是个问题,有人提出是因为动物不断从草地上摄入不同发育阶段的幼虫,幼虫会向体内定植的成虫发出生物信号,外界环境不同,刚进入体内的幼虫传递给体内成虫的信号不同,这种信号会决定成虫是否进入休眠状态[7, 8]。虽然这一推测的机理有待证实,但是关于放牧牛、羊H. contortus感染的动态变化规律研究表明,H. contortus感染存在“春季大爆发”的现象,这也是导致羊群“春死亡”的因素之一[9]。
自20世纪80年代末以来,市场的需求和相关政策的推动极大地促进了养羊业的发展,中国已经成为绵羊和山羊饲养量、出栏量和羊肉产量最多的国家。胃肠道线虫感染是限制放牧牛、羊生产性能提高的重要因素之一,我国东北、华北和西北地区以及南美洲各国和澳大利亚等都很严重[10, 11]。在感染反刍动物的胃肠道线虫中,H. contortus对羊的危害极大。H. contortus感染降低羊日增重、产奶量、乳品质以及羊毛产量,严重感染时导致动物贫血、厌食甚至死亡[12, 13]。
H. contortus感染羊后,如果血液损失不大,一般观察不到临床症状。但是,在H. contortus感染的高峰期,体内大量成虫将导致宿主严重贫血,当宿主血液红细胞压积小于15%后会出现体弱、呼吸困难和精神萎靡等症状[14],临床上可以通过检查血红素、眼结膜颜色、下颌水肿状况以及粪便虫卵数等方法诊断[15]。
H. contortus感染之所以对羊危害极大,主要因为寄生虫和宿主免疫在漫长的共同进化过程中形成了独特的寄生关系,部分寄生虫通过某种生理代谢过程逃过宿主的保护性免疫反应,这样“免疫逃避”现象成为寄生虫完成生活史的重要过程。但是,尽管寄生虫和宿主的关系比较复杂,研究寄生虫免疫机理仍是研制寄生虫疫苗进行免疫预防的基础和关键。控制寄生虫感染首先要明确寄生虫引起宿主的免疫反应类型,其次要明确宿主有效排除寄生虫的保护性免疫反应类型。
对于羊胃肠道线虫感染,虽然虫体天然隐形抗原H11[16]、H-gal-GP[17]免疫可以使宿主获得一定免疫力,但是H. contortus会通过脱鞘逃避宿主的免疫反应,而且脱掉的外鞘也会引起宿主免疫反应。同时,胃肠道线虫释放钙网蛋白(calreticulin,CRT)帮助线虫具备持久免疫逃避能力,其机制可能与CRT结合宿主C反应蛋白和CRT阻碍吞噬细胞发挥吞噬作用有关[18, 19]。由此可见,分离特异性抗原本身较难,而且寄生虫存在免疫逃避机制是至今仍没有成功的H. contortus疫苗上市的主要原因之一。
H. contortus感染主要引起宿主肠道寄生部位的局部黏膜免疫,以Th2型免疫反应为主[20, 21],宿主组织嗜酸性粒细胞和肥大细胞增生以及特异性抗体免疫球蛋白(Ig)A和IgG1水平提高[22, 23]。但是关于Th2型免疫反应能否排除或杀死宿主体内线虫还没有定论。当H. contortus幼虫进入宿主体内后,肥大细胞增生以及白细胞介素(IL)-5和IL-13等Th2型细胞因子引起的快速排斥反应阻止幼虫在皱胃底部定植[24]。当羊反复感染H. contortus后会产生抗性[25],应用免疫抑制类药物能消除抗性[26],但H. contortus抗性机制还不明确。但是,也有研究发现尽管宿主产生很强的Th2型免疫反应,大量幼虫仍会逃过宿主Th2型免疫反应而定植发育[27, 28],原因可能是:1)Th2型免疫反应没有达到排出幼虫的强度;2)皱胃不是有效的免疫器官;3)H. contortus存在对抗宿主免疫反应的保护自身的“逃避”机制,“逃避”机制可能与选择性激活的巨噬细胞和T调节细胞有关[29]。总之,Th2型免疫反应是动物对抗病原感染的先天的保护性免疫,H. contortus幼虫很可能会在进入宿主体内后短时间内逆转这种保护性免疫,诱导宿主机体产生适应性免疫,这种推测在关于鼠类胃肠道线虫感染的研究[30]中已有报道,H. contortus是否也是通过建立类似的适应性免疫完成寄生需进一步研究证实。
目前国内外一直采用抗蠕虫药驱虫,虽然取得了较好的效果,但是线虫很快产生抗药性,而且动物产品中的药物残留直接损害人类健康[31, 32]。昂贵的新药开发费用和食品安全问题迫使人们寻求新的驱虫方法。动物的营养水平影响寄生虫和宿主的关系,营养好的羊抵抗寄生虫感染的能力就强。鉴于此,营养学家提出了通过营养调控措施提高动物胃肠道线虫抗性和恢复力的观点[33]。
胃肠道线虫对宿主物质代谢的影响主要是导致宿主采食量和饲料利用率降低,蛋白质、能量和矿物质缺乏,组织沉积和骨骼生长受损,最终导致生产性能下降,羔羊和泌乳期母羊尤其严重[34]。吸血线虫的危害较大,如H. contortus,它不仅损伤皱胃黏膜,影响宿主物质代谢,而且造成动物贫血、腹泻和瘫痪。一方面,羊感染胃肠道线虫降低宿主动物采食量,使饲粮总蛋白质摄入量减少;另一方面,胃肠道线虫增加机体对蛋白质和能量的需求,因为线虫感染会引起宿主免疫反应,饲料蛋白质和能量的分配被优先用于合成Ig和修复受损的肠道黏膜,结果用于动物体组织沉积的蛋白质减少,2方面因素共同引起动物蛋白质缺乏。
H. contortus L4幼虫和成虫通过皱胃黏膜吸食宿主血液发育,造成宿主血浆蛋白质和内源蛋白质损耗增加,导致贫血。增加饲粮蛋白质水平可以提高宿主动物对胃肠道线虫的抵抗力和感染后的恢复力,但这种作用在不同品种羔羊之间存在差异[35]。
进入动物体内的幼虫要能成功定植才能继续发育。Nnadi等[36]发现,山羊摄食高蛋白质饲粮对血液总蛋白水平和血液红细胞压积没有显著影响,但会延迟幼虫在体内的定植,降低粪便虫卵数。饲粮蛋白质水平影响幼虫定植发育与免疫有关,饲粮蛋白质水平影响宿主血液IgA水平,而IgA被认为与宿主保护性免疫有关[28]。如果能在幼虫定植这一环节实施有效的营养调控,无疑能从根本上减轻感染程度。
围产期的羊会出现短暂的免疫力低下现象,此时对胃肠道线虫的抗性也较低,同时维持泌乳需要提高饲粮蛋白质水平。Donaldson等[37]报道,提高饲粮蛋白质水平可以降低围产期的羊H. contortus的感染程度,降低粪便虫卵数,减少虫卵对初春草地的污染,能在一定程度上缓解因胃肠道线虫感染引起的羊“春死亡”现象。
胃肠道线虫感染还会引起宿主动物铜、钴、钼、锌和硒等矿物元素缺乏,导致动物生长缓慢甚至骨质疏松[38],因为大多胃肠道线虫要在肠黏膜中发育并通过肠黏膜摄取营养,该过程对黏膜的损伤会导致宿主动物对矿物元素的吸收率降低,同时内源性损失增加。
研究表明,线虫感染引起铜缺乏,药物驱虫后动物体内的铜水平升高,主要是由于线虫感染造成铜吸收率降低而内源损失增加,从而使得代谢过程中铜有效供应降低[39]。正常生理情况下山羊每日铜需要量为8~10 mg/kg,绵羊为7~11 mg/kg(干物质基础)[40],低于AFRC(1997)的推荐量(10~20 mg/kg)[41]。铜制剂只能提高羊对皱胃中线虫的抗性,对其他部位的线虫没有影响。增加皱胃可溶性铜的水平可以提高体内线虫的排除量,这可能和机体的抗氧化系统有关,但需进一步验证[42]。氧化铜颗粒用于提高感染羊的铜水平在美国被广泛应用。感染H. contortus的断奶羔羊口服低于2 g氧化铜颗粒后粪便虫卵数减少[43],但是提高饲粮铜水平的同时要根据宿主感染的线虫种类和宿主病例反应评估铜需要量,防止铜中毒。血浆锌水平与动物食欲有关,低于正常水平的锌会降低动物的食欲。感染胃肠道线虫的羊血浆锌水平低于未感染羊。关于锌营养和H. contortus感染的研究比较少,Symons[44]报道,感染Trichostrongylus colubriformis的绵羊,血浆锌水平从1.42 μg/mL下降到1.00 μg/mL。
除了调控饲粮常规营养水平外,寻找有效的具有抗虫性的营养活性物质成为研究的重点。筛选并鉴定有效的抗虫营养物质是一项耗时的工作。因为,虽然有些生物活性物质对某一种寄生虫有效,但不一定具有广谱抗虫性,而且多数寄生虫也只“害怕”某一类特定的药物。所以,这就需要大量的试验进行逐一验证。通常药物筛选试验分为体内饲养试验、体外虫卵孵化试验(egg hatch assay,EHA)、幼虫营养抑制试验(larvae feeding inhibition assay,LFIA)和发育抑制试验(larvae development assay,LDA)[45]。综合来讲,植物单宁和具有抗氧化性的物质对H. contortus有一定的杀伤作用。
大量试验发现某些放牧绵羊摄食黄芪、红豆草、百脉根和胡枝子等植物后胃肠道的抗虫性提高,而摄食黑麦草、苜蓿不能提高胃肠道的抗虫性[46]。起初有人认为是这些植物中的香精油和半胱氨酸蛋白酶起抗虫的作用[47],随着研究的深入,如用聚乙二醇消除植物单宁的作用后,原本发挥抗虫作用的植物失去作用,证明发挥重要抗虫作用的植物次级代谢产物是植物单宁,而且不同植物的单宁提取物的抗虫性不同,通常缩合单宁的比例越高抗虫性越高。而且,感染胃肠道线虫的羊对高单宁牧草的采食量提高,动物这种自我调控生理需要的机制也暗示了单宁的抗虫作用[48, 49]。钟荣珍等[50]对植物单宁调控反刍动物胃肠道线虫及作用机理进行了综述,指出单宁既可以直接与线虫体蛋白质结合,阻断线虫正常生理代谢,也可以通过调控宿主免疫反应而排除进入体内的线虫。
寄生虫感染会增加宿主动物体内自由基的产生。同时,寄生虫感染会引起宿主免疫反应,主要是巨噬细胞、嗜酸性粒细胞和嗜中性粒细胞增生,这些细胞同时会影响抗氧化酶表达来保护寄生虫免遭宿主体内自由基的攻击,这说明寄生虫能够利用宿主的免疫排斥反应来保护自己[51, 52]。一些研究探讨了抗氧化剂在抗虫方面的用法及其机理。Bricarello等[35]发现,无论是否感染胃肠道线虫,山羊血液中抗氧化物质,如巯基蛋白、微生素E和微生素A含量,以及总抗氧化能力都高于绵羊。因此,动物通过摄食抗氧化剂提高自身胃肠道线虫抗性的营养调控措施必须考虑抗氧化剂的吸收性和溶解性,如果抗氧化剂易被动物吸收入血液,则可能提高宿主血液和组织的抗氧化酶水平,这对宿主有利;如果抗氧化剂的吸收性很差,大部分和食糜一起通过肠道直接接触胃肠道线虫,则这种抗氧化剂反而会保护胃肠道线虫。抗氧化性维生素是较易吸收入血液的物质。Do Rêgo Leal等[53]报道,羔羊感染H. contortus后,饲喂维生素E和硒对其红细胞数量和血红素含量都没有显著影响,但是可以通过调控嗜中性粒细胞数量而提高宿主细胞免疫反应。De Wolf[54]研究也发现,与每天饲喂5.3 IU/kg BW维生素E相比,饲喂10.0 IU/kg BW维生素E可降低羔羊皱胃中49%的H. contortus定植率,但是对粪便虫卵数和红细胞压积没有显著影响,这可能是因为维生素E对雌虫的繁殖力没有影响。以上报道初步表明抗氧化剂可能是通过调控宿主细胞免疫反应而发挥抗虫作用的。
目前,基于寄生虫免疫机理的寄生虫疫苗研制技术尚不成熟。H. contortus是一种对羊群危害较大的胃肠道线虫,对目前市场上常用的驱虫药极易产生抗药性。药物控制虽然短时间内有效,但养殖市场用药的混乱和畜品安全问题不容忽视。降低羊H. contortus感染的营养措施虽然不能彻底根除寄生虫感染,但是过去的研究足以证实其优越性,具体措施不限于此文所综述,有待深入研究,如培育具有抗虫性牧草等。
| [1] | LIGHTBODY J H,STEVENSON L M,JACKSON F,et al.Comparative aspects of plasma antioxidant status in sheep and goats,and the influence of experimental abomasal nematode infection[J]. Journal of Comparative Pathology,2001,124(2/3):192-199. ( 2) 2)
|
| [2] | GONZÁLEZ J F,HERNÁNDEZ A,MOLINA J M,et al.Comparative experimental Haemonchus contortus infection of two sheep breeds native to the Canary islands[J]. Veterinary Parasitology,2008,153(3/4):374-378. ( 1) 1)
|
| [3] | OLSEN O W.Animal parasites—their life cycles and ecology[M]. Mineola,N.Y.:Dover Publication Inc.,1986. ( 2) 2)
|
| [4] | DAS K M,WHITLOCK J H.Subspeciation in Haemonchus contortus (Rudolphi,1803) Nemata,Trichostrongyloidea[J]. Cornell Veterinarian,1960,50:182-197. ( 1) 1)
|
| [5] | KAPLAN R M.Drug resistance in nematodes of veterinary importance:a status report.[J]. Trends in Parasitology,2004,20(10):477-481. ( 1) 1)
|
| [6] | DIJK J V,DAVID G P,BAIRD G,et al.Back to the future:developing hypotheses on the effects of climate change on ovine parasitic gastroenteritis from historical data[J]. Veterinary Parasitology,2008,158(1/2):73-84. ( 1) 1)
|
| [7] | JOHNSTONE C.Parasites and parasitic diseases of domestic animals.(2000-01-24) http://cal.vet.upenn.edu/projects/merial/Nematodes/nems_9.htm. ( 1) 1)
|
| [8] | LANGROVÁ I,MAKOVCOVÁ K,VADLEJCH J,et al.Arrested development of sheep strongyles:onset and resumption under field conditions of Central Europe[J]. Parasitology Research,2008,103(2):387-392. ( 1) 1)
|
| [9] | MICHEL J F.Arrested development of nematodes and some related phenomena[J]. Advances in Parasitology,1974,12:279-366. ( 1) 1)
|
| [10] | 沈杰,叶明忠,陈永军,等.绵羊寄生线虫在体内及牧场上各发育阶段的季节动态研究[J]. 中国兽医寄生虫病,1994,2(1):10-15. ( 1) 1)
|
| [11] | 王春仁,马桂芬,赵金萍,等.黑龙江西部羊寄生虫的调查及控制技术的建立[J]. 黑龙江八一农垦学报,2005,17(4):53-57. ( 1) 1)
|
| [12] | MILLER J E,BAHIRATHAN M,LEMARIE S L,et al.Epidemiology of gastrointetinal nematode parasitism in Suffolk and Gulf Coast Native sheep with special emphasis on relative susceptibility to Haemonchus contortus infection[J]. Veterinary Parasitology,1998,74(1):55-74. ( 1) 1)
|
| [13] | HOSTE H,CHARTIER C.Response to challenge infection with Haemonchus contortus and Trichostrongylus colubriformis in dairy goats.Consequences on milk production [J]. Veterinary Parasitology,1998,74(1):43-54. ( 1) 1)
|
| [14] | GEORGI J R,GEORGI M E.Parasitology for veterinarians[M]. Philadelphia,P.A.:W.B.Saunders Company,1990. ( 1) 1)
|
| [15] | BURKE J M,KAPLAN R M,MILLER J E,et al.Accuracy of the FAMACHA system for on-farm use by sheep and goat producers in the southeastern United States[J]. Veterinary Parasitology,2007,147(1/2):89-95. ( 1) 1)
|
| [16] | MUNN E A,SMITH T S,GRAHAM M,et al.Vaccination of merino lambs against haemonchosis with membrane-associated proteins from the adult parasite[J]. Parasitology,1993,106(1):63-66. ( 1) 1)
|
| [17] | SMITH W D,SMITH S K,MURRAY J M.Protection studies with integral membrane fractions of Haemonchus contortus[J]. Parasite Immunology,1994,16(5):231-241. ( 1) 1)
|
| [18] | SUCHITRA S,JOSHI P.Characterization of Haemonchus contortus calreticulin suggests its role in feeding and immune evasion by the parasite[J]. Biochimica et Biophysica Acta,2005,1722(3):293-303. ( 1) 1)
|
| [19] | SUCHITRA S,ANBU K A,RATHORE D K,et al.Haemonchus contortus calreticulin binds to C-reactive protein of its host,a novel survival strategy of the parasite[J]. Parasite Immunology,2008,30(6/7):371-473. ( 1) 1)
|
| [20] | ELSEA K J,FINKELMAN F D,MALISZEWKI C R,et al.Cytokine-mediated regulation of chronic intestinal helmith infection[J]. The Journal of Experimental Medicine,1994,179(1):347-351. ( 1) 1)
|
| [21] | GILL H S.Cell-mediated immunity in Merino lambs with genetic resistance to Haemonchus contortus[J]. International Journal of Parasitology,1994,24(5):749-756. ( 1) 1)
|
| [22] | GILL H S,WATSON D L,BRANDON M R.Monoclonal antibody to CD4+ T cells abrogates genetic resistance to Haemonchus contortus in sheep[J]. Immunology,1993,78(1):43-49. ( 1) 1)
|
| [23] | MCDONALD V.Parasites in the gastrointestinal tract[J]. Parasite Immunology,2003,25(5):231-234. ( 1) 1)
|
| [24] | GASBARRE L C.Effects of gastrointestinal nematode infection on the ruminant immune system[J]. Veterinary Parasitology,1997,72(3/4):327-343. ( 1) 1)
|
| [25] | MILLER H R,JACKSON F,NEWLANDS G,et al.Immune exclusion,a mechanism of protection against the ovine nematode Haemonchus contortus[J]. Research in Veterinary Science,1983,35(3):357-363. ( 1) 1)
|
| [26] | HUNTLEY J F,NEWLANDS G F,JACKSON F,et al.The influence of challenge dose,duration of immunity,or steroid treatment on mucosal mast cells and on the distribution of sheep mast cell proteinase in Haemonchus-infected sheep[J]. Parasite Immunology,1992,14(4):429-440. ( 1) 1)
|
| [27] | GILL H S,ALTMANN K,CROSS M L,et al.Induction of T helper 1- and T helper 2-type immune responses during Haemonchus contortus infection in sheep[J]. Immonology,2000,99(3):458-463. ( 1) 1)
|
| [28] | STRAIN S A J,STEAR M J.The influence of protein supplementation on the immune response to Haemonchus contortus[J]. Parasite Immunology,2001,23(10):527-531. ( 2) 2)
|
| [29] | ELSE K J.Have gastrointestinal nematodes outwitted the immune system?[J]. Parasite Immunology,2005,27(10/11):407-415. ( 1) 1)
|
| [30] | BELLABY T,ROBINSON K,WAKELIN D.Induction of differential T-helper-cell responses in mice infected with variants of the parasitic nematode Trichuris muris[J]. Infection and Immunity,1996,64(3):791-795. ( 1) 1)
|
| [31] | JACKSON F,COOP R L.The development of anthelmintic resistance in sheep nematodes[J]. Parasitology,2000,120(Suppl.):95-107. ( 1) 1)
|
| [32] | WALLER P J,THAMSBORG S M.Nematode control in green ruminant production systems[J]. Trends in Parasitology,2004,20(10):493-497. ( 1) 1)
|
| [33] | VALDERRÁBANO J,GOMEZ-RINCÓN C,URIARTE J.Effect of nutritional status and fat reserves on the periparturient immune response to Haemonchus contortus infection in sheep[J]. Veterinary Parasitology,2006,141(1/2):122-131. ( 1) 1)
|
| [34] | POPPI D P,SYKES A R.The effect of endoparasitism on host nutrition—the implication for nutrient manipulation[J]. Proceedings of the New Zealand Society of Animal Production,1990,50:237-243. ( 1) 1)
|
| [35] | BRICARELLO P A,AMARANTE A F T,ROCHA R A,et al.Influence of dietary protein supply on resistance to experimental infections with Haemonchus contortus in Ile de France and Santa Ines lambs[J]. Veterinary Parasitology,2005,134(1/2):99-109. ( 2) 2)
|
| [36] | NNADI P A,KAMALU T N,ONAH D N.The effect of dietary protein on the productivity of West African Dwarf (WAD) goats infected with Haemonchus contortus[J]. Veterinary Parasitology,2009,161(3/4):232-238. ( 1) 1)
|
| [37] | DONALDSON J,VAN HOUTERT M F J,SYKES A R.The effect of dietary fish meal supplementation on parasite burdens of periparturient sheep[J]. Animal Science,2001,72(1):149-158. ( 1) 1)
|
| [38] | WALLER P J,BERNES G,RUDBY-MARTIN L,et al.Evaluation of copper supplementation of control Haemonchus contortus infections of sheep in Sweden[J]. Acta Veterinaria Scandinavica,2004,45:149-160. ( 1) 1)
|
| [39] | SIDDIQUI H U R,CAMERON R D.Effect of Haemonchus contortus infection and nutrition on glucose and trace element[J]. International Journal of Agriculture and Biology,2005,7(2):281-284. ( 1) 1)
|
| [40] | NRC.Mineral nutrient requirements of sheep[S]. 7th ed. Washington,D.C.:National Academy Press,1985. ( 1) 1)
|
| [41] | AFRC.Technical committee on responses to nutrients.Report 10.The nutrition of goats[J]. Nutrition Abstracts and Reviews Z:Series B,1997,67:806-815. ( 1) 1)
|
| [42] | CHARTIER C,ETTER E,HESTE H,et al.Efficacy of copper oxide needles for the control of nematode parasites in dairy goats[J]. Veterinary Research Communications,2000,24(6):389-399. ( 1) 1)
|
| [43] | BURKE J M,MILLER J E.Evaluation of multiple low doses of copper oxide wire particles compared with levamisole for control of Haemonchus contortus in lambs[J]. Veterinary Parasitology,2006,139(1/2/3):145-149. ( 1) 1)
|
| [44] | SYMONS L E.Plasma zinc and inappetence in sheep infected with Trichostrongylus columbriformis[J]. Journal of Comparative Pathology,1983,93(4):547-550. ( 1) 1)
|
| [45] | HOSKIN S O,WILSON P R,BARRY T N,et al.Effect of forage legumes containing condensed tannins on lungworm (Dictyocaulus sp.) and gastrointestinal parasitism in young red deer (Cervus elaphus)[J]. Research in Veterinary Science,2000,68(3):223-230. ( 1) 1)
|
| [46] | SHAIK S A,TERRILL T H,MILLER J E,et al.Effects of feeding sericea lespedeza hay to goats infected with Haemonchus contortus[J]. South African Journal of Animal Science,2004,34:234-237. ( 1) 1)
|
| [47] | STEPEK G,BEHNKE J M,BUTTLE D J,et al.Natural plant cysteine proteinases as anthelmintics?[J]. Trends in Parasitology,2004,20(7):322-327. ( 1) 1)
|
| [48] | HOSTE H,JACKSON F,ATHANASIADOU S,et al.The effects of tannin-rich plants on parasitic nematodes in ruminants[J]. Trends in Parasitology,2006,22(6):253-261. ( 1) 1)
|
| [49] | KABASA J D,OPUDA-ASIBO J,TER MEULEN U.The effect of oral administration of polyethylene glycol on faecal helminth egg counts in pregnant goats grazed on browse containing condensed tannins[J]. Tropical Animal Heath and Production,2000,32(2):73-86. ( 1) 1)
|
| [50] | 钟荣珍,孙海霞,刘华伟,等.植物单宁调控反刍动物胃肠道线虫抗性及作用机理研究进展[J]. 华北农学报,2011,26:252-257. ( 1) 1)
|
| [51] | CALLAHAN H L,CROUCH R K,JAMES E R.Helminth anti-oxidant enzymes:a protective mechanism against host oxidants?[J]. Parasitology Today,1988,4(8):218-225. ( 1) 1)
|
| [52] | BROPHY P M,PRITCHARD D I.Immunity to helminths:ready to tip the biochemical balance?[J]. Parasitology Today,1992,8(12):419-422. ( 1) 1)
|
| [53] | DO RÊGO LEAL M L,NICOLODI P R S J,SOARES J F,et al.Hematological parameters of lambs infected experimentally with Haemonchus contortus and supplemented with selenium and vitamin E[J]. Comparative Clinical Pathology,2011,20:369-374. ( 1) 1)
|
| [54] | DE WOLF B M.The effect of vitamin E supplementation on an experimental Haemonchus contortus infection in Dorset lambs.Ph.D.Thesis.University of Rhode Island,2012:1-15. ( 1) 1)
|




