上皮细胞能通过一系列的细胞间连接方式与相邻细胞紧密结合形成屏障,这些连接方式统称为上皮细胞连接复合体,包括紧密连接(tight junctions)、黏附连接(adherens junctions)和桥粒连接(desmosome)。紧密连接是其中最重要一种的连接方式,它以环状形式位于基底外侧膜顶端,在维持上皮细胞结构与生物学功能中有重要作用[1]。Walsh等[2]用Ca2+开关试验研究发现,抑制Ras同源蛋白(Rho)A-Rho激酶(ROCK)信号转导途径能彻底阻断紧密连接的形成,表明RhoA-ROCK信号转导途径是介导紧密连接合成与聚合的重要转导途径,而一些细胞因子导致RhoA-ROCK信号过度激活能造成紧密连接的解聚[3]。因此,RhoA-ROCK信号转导途径对上皮细胞的间隙通透性有重要调节作用,本文拟就该领域的研究进展作一综述,为深入认识肠道健康及其营养调控措施提供参考。
上皮细胞连接复合体包含跨膜蛋白以及与其相连接的多种细胞骨架结构,在调节相邻细胞间黏附程度、形成和维持上皮细胞屏障功能中起着至关重要的作用[4]。在分子水平上,紧密连接主要由蛋白质复合体组成,这种复合体与其他细胞间连接复合体有着相似的构成成分,而在结构和生物学功能上却存在一定差异。紧密连接主要由跨膜蛋白和外周蛋白构成,跨膜蛋白按照跨膜的次数分为:1次跨膜蛋白 、3次跨膜蛋白 和4次跨膜蛋白 [5]。除跨膜蛋白以外,外周蛋白闭合小环蛋白(zonula occludens,ZOs)在紧密连接构成及其功能发挥中起着重要的作用[6]。因此,在组成紧密连接的蛋白中occludin、claudins和ZOs是最为重要的3种蛋白质。
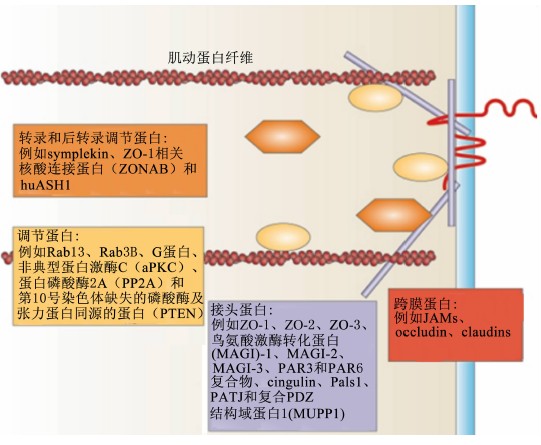 | 图1 紧密连接的构成 Fig.1 The construction of tight junctions[6] |
occludin是一种4次跨膜蛋白,分子质量约为65 ku(62~82 ku),能与肌动蛋白细胞骨架和其他细胞内蛋白质结合[7]。研究表明,occludin与ZO-1结合是紧密连接形成所必需的。通过研究occludin细胞质区域羧基末端嵌合体表明,在构成紧密连接中occludin能与ZO-1、ZO-2和ZO-3复合体结合。occludin的第2次跨膜结构域在稳定occludin结构中有至关重要的作用。此外,occludin还能受多种激酶和磷酸酶的调节[8]。
claudins分子质量为20~27 ku,在哺乳动物中有24种亚基。claudins与occludin类似,具有4个跨膜结构域,但两者在组成结构上存在较大的差异[9, 10]。电镜检测结果表明,claudins是紧密连接的重要组成成分[11]。claudins能通过形成亲水性的细胞间隙通路而选择性的调控紧密连接通透性。Hou等[12]研究发现,变异的claudin-16、claudin-19是家族性低镁血症高尿钙和肾钙质沉着(FHHNC)中致病基因产物,且与二价离子通道形成有关。因此,部分claudins的生物学功能仍然需进一步研究。
ZOs属于外周膜蛋白,含有鸟苷酸激酶样结构域(GUK)、盘状同源区域(PDZ)、Src同源结构域(SH3)、酸性结构域等组成的保守序列,其中ZO-1、ZO-2和ZO-3在紧密连接中起重要连接作用。ZOs能直接与肌动蛋白细胞骨架结合,从而稳定细胞间连接复合体并为环状肌动球蛋白在细胞间的收缩提供动力支撑。ZO-1属于多结构域蛋白质,是膜结合鸟苷酸激酶同源物(MAGUKs),能与跨膜蛋白occludin、紧密连接特异性MAGUK、ZO-2和肌动蛋白结合,在紧密连接形成中起重要的直接脚手架连接作用。Adachi等[13]在ZO-3基因敲除大鼠试验中表明,缺乏ZO-3基因不影响试验大鼠紧密连接的基因表达和定位、生存与繁殖活力,说明ZO-3是维持试验大鼠个体活力,表皮细胞分化和紧密连接稳定过程中的非必需成分。
紧密连接是上皮细胞顶端连接复合体的重要组成部分,除了能选择性调节离子和其他溶质的细胞间隙途径、限制顶端/基底外侧膜内脂质的扩散以外,还能通过调节多种不同的信号成分进而影响上皮细胞的增生、分化和极化[11]。紧密连接具有3种相互关联的生物学作用:维持门控功能、屏障功能和相邻细胞间联系[1]。
紧密连接作为细胞间隙途径中重要的调控因子,能通过对物质种类和分子大小筛选来发挥其门控功能。上皮细胞能通过其门控功能控制流体和溶质透过细胞,这种门控功能主要是通过以下2条途径实现:1)跨细胞途径-受位于上皮细胞膜顶部和基地外侧且呈不均匀分布的能量依赖蛋白质转运体和通道控制;2)细胞间隙途径-细胞间隙顶端的紧密连接蛋白调控离子和小分子电中性溶质被动扩散通过细胞间隙。Leung等[14]研究MDCK-1细胞和费雪大鼠甲状腺细胞时发现,真菌代谢物处理能破坏紧密连接降低2种细胞的跨上皮电阻(TER),增加通透性,证明了紧密连接的重要性。进一步研究发现,紧密连接并没有发生结构性改变,说明紧密连接发挥门控功能是在分子水平进行调节,且具有高度特异性。
RhoA-ROCK信号转导途径的重要起始物质为Rho,它属于Ras超家族的一种三磷酸鸟苷(GTP)绑定小蛋白质,是首先被确定的肌动蛋白细胞骨架重要调节因子,在调节基因表达、丝裂原活化蛋白激酶(MAPKs)级联反应和炎症因子信号转导中有重要的作用[18]。
GTP酶偶联的Rho家族包括RhoA、Rac和Cdc 42,能接受不同的信号刺激从而调控多种肌动蛋白结构,RhoA是其中最重要的一种。RhoA前体形式为GDP绑定形式(RhoA-GDP),激活形式为GTP绑定形式(RhoA-GTP),能在活性的GTP绑定构象和非活性的GDP绑定构象之间转换。当RhoA被激活后,构象发生改变从而影响下游效应蛋白质。鸟苷酸交换因子(GEFs)能激活RhoA,而GTP酶活化蛋白(GAPs)能钝化RhoA,RhoA正是在这2种物质的调控下实现2种形式之间的循环。C3转移酶是一种取自于肉毒梭菌的一种酶类,因其能催化RhoA发生ADP核糖基化的而被用来作为RhoA的特异性抑制剂。
在哺乳动物中,GTP酶偶联的Rho共有大约20种形式[19],而人类基因编码的GEFs和GAPs超过70种,因此能保证生物体能在空间上和时间上精确调控RhoA-ROCK信号转导途径生理作用的发挥[20, 21]。
ROCKs是RhoA的下游效应物,属于丝氨酸/苏氨酸激酶家族。ROCKs能直接调节肌球蛋白轻链(MLC)2或肌球蛋白磷酸酶靶亚基(MYPT)磷酸化,肌球蛋白磷酸酶活性从而调节肌动球蛋白收缩。此外,ROCKs还能调节紧密连接相关蛋白的磷酸化从而影响紧密连接的合成与解聚。
RhoA-ROCK信号转导途径在上皮细胞紧密连接形成中有重要的作用。在研究Rho信号转导途径在紧密连接中的作用时建立了2种研究模型,持续活化突变体因具有较低基础水平的GTP水解活性而使RhoA持续处于活化状态;显性失活突变体因具有较高的GDP亲和力而使RhoA持续处于非活化状态[22]。
在Caco-2、T-84和MDCK细胞上的研究发现,使用C3转移酶特异性抑制RhoA活性除能破坏紧密连接的结构和功能外,还能抑制紧密连接的聚合构成,用ROCK特异性抑制剂Y27632抑制ROCK活性能破坏顶端肌动蛋白环状结构而对紧密连接的定位没有影响。然而,在Ca2+开关试验研究紧密连接聚合构成时发现,抑制ROCK能阻止紧密连接蛋白在细胞间连接的再分配,说明ROCK在紧密连接蛋白的聚合构成中有至关重要的作用[2]。Gopalakrishnan等[23]在MDCK细胞ATP耗竭试验模型研究中发现,激活RhoA能较好地维持紧密连接的结构,而抑制RhoA却能导致紧密连接成分大量减少。该试验表明,RhoA-ROCK信号转导途径的激活对于维持紧密连接结构有重要作用。
RhoA-ROCK信号转导途径除了在紧密连接的聚合构成中有重要作用以外还参与了紧密连接的解聚调节过程。Utech等[3]使用细胞因子干扰素γ(IFN-γ)处理T84上皮细胞后发现,ROCK基因表达量显著上升,说明RhoA-ROCK信号转导途径由于IFN-γ处理而激活;紧密连接关键蛋白occludin基因表达量显著下降,当使用ROCK特异性抑制剂Y-27632抑制RhoA-ROCK信号转导途径后occludin基因表达量显著上升。进一步研究发现,IFN-γ导致细胞膜顶端和紧密连接蛋白occludin、JAM-A和claudins处肌动蛋白液泡(VAC)的产生。除了IFN-γ外,2-甲氧雌二醇(2-ME)、肺癌细胞迁移因子等一些因素均能通过激活RhoA信号转导通路打开细胞间紧密连接,因此明确这些因素调控上皮细胞紧密连接和屏障功能的分子机制具有较高的理论和应用价值[24, 25, 26]。研究发现,IFN-γ和2-ME均能激活RhoA进而上调下游效应物ROCK,通过肌球蛋白轻链激酶(MLCK)途径使MLC2磷酸化,最终导致紧密连接的解聚和细胞间隙通透性的增强。ROCK小干扰RNA(siRNAs)试验发现,ROCK参与了由2-ME导致的紧密连接破坏[26]。
Fujita等[27]在MDCK细胞上的研究表明,RhoA-ROCK信号转导途径能直接影响上皮细胞的通透性。紧密连接相关蛋白 与肌动蛋白丝的相互作用除了能稳定连接以外还能传递力量,以改变2种蛋白质之间的作用从而改变细胞间隙的通透性。RhoA-ROCK信号转导途径在调节细胞间隙通透性的过程中有着重要的作用,Rho的下游效应物能通过影响肌动球蛋白细胞骨架进而影响细胞间隙通透性[24]。
GEF-H1激活RhoA后,在紧密连接有关的鸟嘌呤核苷酸交换因子作用下特异性激活ROCK。ROCK磷酸化、肌球蛋白轻链磷酸酶(MLCP)被抑制以及MLC2的激活导致肌动球蛋白收缩从而增加细胞间隙通透性[27]。
研究发现,在SK-CO15结肠上皮细胞中下调肌动蛋白质重链2亚型A能显著改变细胞形态和细胞间隙通透性[28]。调节肌球蛋白活性在调节细胞间隙通透性的过程中有着至关重要的作用。而ROCK作为一种丝氨酸/苏氨酸激酶是调节紧密连接通透性的一种重要RhoA效应物,它除了能通过调节MLC2的磷酸化状态进而激活肌球蛋白,还能通过磷酸化抑制MYPT进而增加肌球蛋白活性。
MLCK也能调节肌球蛋白的磷酸化过程,从而影响紧密连接和细胞间隙通透性。Ma等[29]在研究肿瘤坏死因子α(TNF-α)对Caco-2细胞间隙通透性时发现阻断RhoA-ROCK-MLC转导途径后,能缓解由TNF-α诱导的细胞间隙通透性增加,说明RhoA-ROCK-MLC转导途径能介导物质对细胞间隙通透性的调节。MLCK药理性抑制剂能同时抑制由Na+-营养物质共转运、细菌感染、促炎症细胞因子等生理病理学刺激造成的MLC2磷酸化以及紧密连接屏障功能的降低。在成熟单层细胞中MLCK基因的过量表达试验证明了MLCK在调节通透性中的作用,而在缺乏任何上游刺激的情况下,MLC2磷酸化能单独作为调节紧密连接的有效刺激源[30]。而在内皮细胞上的研究表明,由TNF-α导致的通透性逐渐增加与紧密连接重组有关而非通过Rho、ROCK、MLCK等发挥调节作用[31]。
除了RhoA-ROCK-MLC2途径以外,其他RhoA效应物也能调控紧密连接通透性。mDia能通过促进肌动蛋白成核和丝聚合从而调节黏着连接的形成和肌动蛋白的活性,是一种与ROCK具有相反作用的RhoA效应物。Gavard等[32]在研究血管内皮生长因子(VEGF)对上皮细胞通透性时发现,VEGF能导致上皮细胞通透性增加,而血管生成素1(Ang1)能通过RhoA-mDia调控途径抑制由VEGF诱导的上皮细胞通透性的增加。
紧密连接对于维持上皮细胞屏障功能,尤其是肠道的通透性和肠道健康有着至关重要的作用。它能通过维持门控作用、屏障作用和细胞间联系而保障机体健康。RhoA-ROCK信号转导途径在紧密连接的形成过程中有重要的作用,RhoA-ROCK信号转导途径能调节紧密连接的基因表达、蛋白聚合或解聚,从而影响紧密连接功能的发挥,但RhoA-ROCK信号转导途径调节紧密连接蛋白基因表达的具体分子机制尚不完全清楚。而RhoA的稳态与精密调节是紧密连接生理功能正常发挥的重要保证。RhoA信号主要是通过调节肌动球蛋白收缩,肌动蛋白聚合以及直接调节连接膜蛋白等多条不同的细胞信号转导途径而调控细胞间隙通透性,保障细胞的稳态和健康。
由于不同信号物质对RhoA-ROCK信号转导途径的下游信号激酶以及紧密连接的影响存在差异,因此明确RhoA-ROCK的信号特异性并合理应用该信号刺激来发挥紧密连接的功能,保障机体健康具有重要的研究价值。
| [1] | CEREIJIDO M,CONTRERAS R G,SHOSHANI L,et al.Tight junction and polarity interaction in the transporting epithelial phenotype[J]. Biochimica et Biophysica Acta:Biomembranes,2008,1778(3):770-793. ( 2) 2)
|
| [2] | WALSH S V,HOPKINS A M,CHEN J,et al.Rho kinase regulates tight junction function and is necessary for tight junction assembly in polarized intestinal epithelia[J]. Gastroenterology,2001,121(3):566-579. ( 2) 2)
|
| [3] | UTECH M,IYANOV A I,SAMARIN S N,et al.Mechanism of IFN-γ-induced endocytosis of tight junction proteins:myosin Ⅱ-dependent vacuolarization of the apical plasma membrane[J]. Molecular Biology of the Cell,2005,16(10):5040-5052. ( 2) 2)
|
| [4] | TERRY S,NIE M,MATTER K,et al.Rho signaling and tight junction functions[J]. American Physiological Society,2010,25(1):16-26. ( 1) 1)
|
| [5] | RUSS P K,PINO C J,WILLIAMS C S,et al.Bves modulates tight junction associated signaling[J]. PLoS One,2011,6(1):e14563. ( 1) 1)
|
| [6] | MATTER K,BALDA M S.Signalling to and from tight junctions[J]. Nature Reviews Molecular Cell Biology,2003,4(3):225-237. ( 2) 2)
|
| [7] | PARIS L,TONUTTI L,VANNINI C,et al.Structural organization of the tight junctions[J]. Biochimica et Biophysica Acta:Biomembranes,2008,1778(3):646-659. ( 1) 1)
|
| [8] | DÖRFEL M J,HUBER O.Modulation of tight junction structure and function by kinases and phosphatases targeting occludin[J]. Journal of Biomedicine and Biotechnology,2012,2012:807356. ( 1) 1)
|
| [9] | ANGELOW S,AHLSTROM R,YU A S L.Biology of claudins[J]. American Journal of Physiology:Renal Physiology,2008,295(4):F867-F876. ( 1) 1)
|
| [10] | HARTSOCK A,NELSON W J.Adherens and tight junctions:structure,function and connections to the actin cytoskeleton[J]. Biochimica et Biophysica Acta:Biomembranes,2008,1778(3):660-669. ( 1) 1)
|
| [11] | AIJAZ S,BALDA M S,MATTER K.Tight junctions:molecular architecture and function[J]. International Review of Cytology,2006,248:261-298. ( 2) 2)
|
| [12] | HOU J H,RENIGUNTA A,KONRAD M,et al.Claudin-16 and claudin-19 interact and form a cation-selective tight junction complex[J]. The Journal of Clinical Investigation,2008,118(2):619-628. ( 1) 1)
|
| [13] | ADACHI M,INOKO A,HATA M,et al.Normal establishment of epithelial tight junctions in mice and cultured cells lacking expression of ZO-3,a tight-junction MAGUK protein[J]. Molecular and Cellular Biology,2006,26(23):9003-9015. ( 1) 1)
|
| [14] | LEUNG L W,CONTRERAS R G,FLORES-MALDONADO C,et al.Inhibitors of glycosphingolipid biosynthesis reduce transepithelial electrical resistance in MDCK I and FRT cells[J]. American Journal of Physiology:Cell Physiology,2003,284(4):C1021-C1030. ( 1) 1)
|
| [15] | NAKAO T,KURITA N,KOMATSU M,et al.Irinotecan injures tight junction and causes bacterial translocation in rat[J]. Journal of Surgical Research,2012,173:341-347. ( 1) 1)
|
| [16] | SCHNEEBERGER E E,LYNCH R D.The tight junction:a multifunctional complex[J]. American Journal of Physiology:Cell Physiology,2004,286(6):C1213-C1228. ( 1) 1)
|
| [17] | LAFFAFIAN I,HALLETT M B.Lipid-protein cargo transfer:a mode of direct cell-to-cell communication for lipids and their associated proteins[J]. Journal of Cellular Physiology,2007,210(2):336-342. ( 1) 1)
|
| [18] | COLEMAN M L,MARSHALL C J,OLSON M F.RAS and RHO GTPases in G1-phase cell-cycle regulation[J]. Nature Reviews Molecular Cell Biology,2004,5(5):355-366. ( 1) 1)
|
| [19] | ETIENNE-MANNEVILLE S,HALL A.Rho GTPases in cell biology[J]. Nature,2002,420:629-635. ( 1) 1)
|
| [20] | BERNARDS A,SETTLEMAN J.GAPs in growth factor signaling[J]. Growth Factors,2005,23(2):143-149. ( 1) 1)
|
| [21] | GARCÍA-MATA R,BURRIDGE K.Catching a GEF by its tail[J]. Trends in Cell Biology,2007,17(1):36-43. ( 1) 1)
|
| [22] | BRUEWER M,HOPKINS A M,HOBERT M E,et al.RhoA,Rac1,and Cdc42 exert distinct effects on epithelial barrier via selective structural and biochemical modulation of junctional proteins and F-actin[J]. American Journal of Physiology:Cell Physiology,2004,287(2):C327-C335. ( 1) 1)
|
| [23] | GOPALAKRISHNAN S,RAMAN N,ATKINSON S J,et al.Rho GTPase signaling regulates tight junction assembly and protects tight junctions during ATP depletion[J]. American Journal of Physiology:Cell Physiology,1998,275:C798-C809. ( 1) 1)
|
| [24] | BIRUKOVA A A,ADYSHEV D,GORSHKOV B,et al.GEF-H1 is involved in agonist-induced human pulmonary endothelial barrier dysfunction[J]. American Journal of Physiology:Lung Cellular and Molecular Physiology,2006,290:L540-L548. ( 2) 2)
|
| [25] | LI B,ZHAO W D,TAN Z M,et al.Involvement of Rho/ROCK signalling in small cell lung cancer migration through human brain microvascular endothelial cells[J]. FEBS Letters,2006,580(17):4252-4260. ( 1) 1)
|
| [26] | BOGATCHEVA N V,ADYSHEV D,MAMBETSARIEV B,et al.Involvement of microtubules,p38,and Rho kinases pathway in 2-methoxyestradiol-induced lung vascular barrier dysfunction[J]. American Journal of Physiology:Lung Cellular and Molecular Physiology,2007,292:L487-L499. ( 2) 2)
|
| [27] | FUJITA H,KATOH H,HASEGAWA H,et al.Molecular decipherment of Rho effector pathways regulating tight-junction permeability[J]. Biochemical Journal,2000,346:617-622. ( 2) 2)
|
| [28] | IVANOV A I,BACHAR M,BABBIN B A,et al.A unique role for nonmuscle myosin heavy chain ⅡA in regulation of epithelial apical junctions[J]. PLoS One,2007,2(8):e658. ( 1) 1)
|
| [29] | MA T Y,BOIVIN M A,YE D M,et al.Mechanism of TNF-α modulation of Caco-2 intestinal epithelial tight junction barrier:role of myosin light-chain kinase protein expression[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology,2005,288:G422-G430. ( 1) 1)
|
| [30] | SHEN L,BLACK E D,WITKOWSKI E D,et al.Myosin light chain phosphorylation regulates barrier function by remodeling tight junction structure[J]. Journal of Cell Science,2006,119:2095-2106. ( 1) 1)
|
| [31] | MCKENZIE J A G,RIDLEY A J.Roles of RhoROCK and MLCK in TNF-α-induced changes in endothelial morphology and permeability[J]. Journal of Cellular Physiology,2007,213:221-228. ( 1) 1)
|
| [32] | GAVARD J,PATEL V,GUTKIND J S.Angiopoietin-1 prevents VEGF-induced endothelial permeability by sequestering Src through mDia[J]. Developmental Cell,2008,14(1):25-36. ( 1) 1)
|
| [33] | BERNARD O.Lim kinases,regulators of actin dynamics[J]. The International Journal of Biochemistry & Cell Biology,2007,39(6):1071-1076. ( 1) 1)
|
| [34] | NAGUMO Y,HAN J,BELLILA A,et al.Cofilin mediates tight-junction opening by redistributing actin and tight-junction proteins[J]. Biochemical and Biophysical Research Communications,2008,377(3):921-925. ( 1) 1)
|
| [35] | MIYAZAKI T,HONDA K,OHATA H.m-Calpain antagonizes RhoA overactivation and endothelial barrier dysfunction under disturbed shear conditions[J]. Cardiovascular Research,2010,85(3):530-541. ( 1) 1)
|
| [36] | GOPALAKRISHNAN S,RAMAN N,ATKINSON S J,et al.Rho GTPase signaling regulates tight junction assembly and protects tight junctions during ATP depletion[J]. American Journal of Physiology:Cell Physiology,1998,275:C798-C809. ( 1) 1)
|
| [37] | HIRASE T,KAWASHIMA S,WONG E Y M,et al.Regulation of tight junction permeability and occludin phosphorylation by Rhoa-p160ROCK-dependent and-independent mechanisms[J]. The Journal of Biological Chemistry,2001,276(13):10423-10431. ( 1) 1)
|




