2. 浙江大学动物科学学院, 生物饲料安全与污染防控国家工程实验室, 杭州 310058
2. National Engineering Laboratory of Biofeed Safety & Pollution Control, College of Animal Science, Zhejiang University, Hangzhou 310058, China
肠道是一个具有多样性的微环境,这其中生长有超过500多种细菌。单层上皮细胞将共生的微生物和病原菌与下层的免疫细胞分割构成肠道屏障,所以肠道上皮屏障是阻止感染和炎症的防御机制的主要成分。益生菌是一类对宿主有益的微生物,能够减轻或者阻止疾病的发生,例如腹泻、肠易激综合征、炎症性肠病等[1]。益生菌与肠道上皮屏障的相互作用机制的研究对开发利用益生菌具有重要意义。国内外研究显示,益生菌通过增强肠道屏障、调节免疫、竞争性黏附黏膜等发挥益生性功能作用,但是其调节肠道屏障的功能作用及机制仍然不完全明晰。本文拟从肠道上皮屏障及微生态系统组成、益生菌增强肠道上皮屏障功能作用、微生物与肠道上皮之间的相互作用及机制3个主要方面展开综述,旨在分析益生菌对肠道上皮屏障功能的调节作用及其作用机制。
IECs被认为是胃肠道中的免疫“哨兵”,在维持宿主先天和适应性肠道黏膜免疫系统中起着重要的作用。IECs是宿主防御病原菌入侵或者致炎性物质刺激的第1道防线,通过产生大量细胞因子和趋化因子使分散在其周围的免疫细胞发挥免疫作用。IECs与肠道微生物菌群直接接触,病原菌产生的炎症反应要比肠道中共生细菌产生的炎症反应剧烈的多[2]。但是有报道称,IECs对于一些不致病的共生细菌也会产生过度的炎症反应[3],对一些共生细菌如鼠李糖乳杆菌(Lactobacillus rhamnosus)、大肠杆菌(Escherichia coli)、乳双歧杆菌(Bifidobacterium lactis)等会产生炎症细胞因子 或者趋化因子 等[4]。
肠道上皮细胞通过适应机制来限制细菌的生长,减少与细菌的直接接触以及防止细菌进入黏膜下层组织来防止自身产生过度的炎症反应。破坏这层细胞屏障会导致机体对微生物菌群的免疫耐受能力下降,产生异常的免疫反应,甚至会引发炎症性肠病、溃疡性结肠炎等[1]。单层上皮细胞将共生的微生物、病原菌和杯状细胞分泌的黏液与下层的免疫细胞分割构成肠道屏障(图1),所以肠道上皮屏障是阻止感染和炎症的主要防御机制。
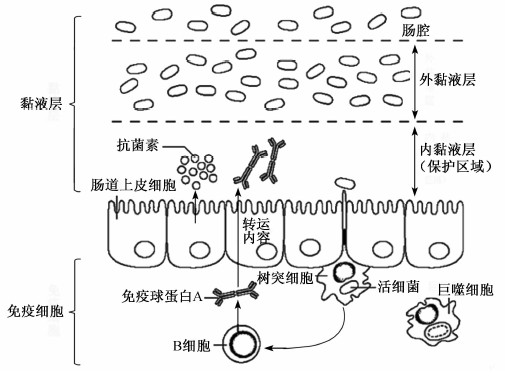 | 图1 肠道屏障示意图
Fig.1 Schematic diagram of intestinal tract barrier[5] |
动物肠道是一个具有生物多样性的微环境,其中生长着几百种细菌、古生菌以及真菌,不同微生物菌群之间的交互作用形成肠道微生物稳态。肠道微生物菌群在肠道新陈代谢、肠道上皮细胞功能、免疫系统以及炎症反应信号通路等方面发挥着重要的作用。一般正常动物体内肠道微生物菌群组成相对恒定,而当机体处于外环境变化或者接受抗生素治疗时,动物体内肠道微生物菌群组成会发生改变。一些疾病的发生常伴随肠道微生物菌群失调,如肠易激综合征、炎症性肠病、结肠癌、酒精肝以及肥胖和其他代谢失调[6, 7]。患有溃疡性结肠炎等疾病的个体与健康个体相比,肠道微生物菌群的多样性减少,但是其机制仍然不完全清楚[8]。
益生菌为肠道微生物重要组成部分,在肠道中发挥着重要的调节作用。基于细菌培养技术和分子生物学检测技术证明益生菌能够改变动物肠道微生物菌群的组成。尼氏大肠杆菌(Escherichia coli Nissle 1917,EcN)是一种常用的益生菌,普遍用于治疗肠道感染疾病,majs等[8]用EcN饲喂母猪2周后检测肠道微生物菌群组成变化,结果显示与没有饲喂EcN母猪肠道微生物菌群组成相比较,服用EcN的母猪肠道大肠杆菌菌群多样性减少。
根据定义,益生菌的概念源于希腊语“对生命有益的细菌”,益生菌通常是定植于动物肠道、生殖系统内,能产生确切健康功效的活性有益微生物(细菌或者酵母)的总称。常见的益生菌包括乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacteria)、链球菌属(Streptococcus)以及少部分大肠杆菌等。一些乳酸乳球菌(Lactococcus lactis)和肠球菌(Enterococcus)也常被使用。益生菌主要从健康的个体中分离得到,除了对宿主有益,和共生肠道微生物菌群没有本质的区别。益生菌发挥功能的机制包括对免疫功能进行调节、对共生细菌和病原菌发挥直接干预作用而阻止机体感染、对肠道稳态的修复以及致病性毒素的降解[9]。乳酸杆菌处理过的猪肠道上皮细胞通过Toll样受体4(TLR4)介导产生的白细胞介素-6(IL-6)、IL-8表达量与未用乳酸杆菌处理的细胞的IL-6、IL-8表达量比较相对降低,显示乳酸杆菌发挥免疫保护作用[10]。对于病毒感染过的无菌猪产生的炎症反应,乳酸杆菌能够通过调节致炎性细胞因子和抗炎性细胞因子的相对水平达到维持体内免疫平衡状态[11]。
在肠道组织结构中,杯状细胞分布于整个肠道(图2)。杯状细胞能够分泌黏蛋白,高度糖基化的黏蛋白分布于细胞膜或者分泌进肠腔中形成一层黏液层。在18种糖基化黏蛋白中,黏蛋白2(MUC2)是一类主要存在于肠道黏膜的糖基化黏蛋白。MUC2的N端和C端没有被糖基化,中间的半胱氨酸残基处高度糖基化,多糖基团具有抑制蛋白质降解的作用,同时可以提高亲水性,通过二硫键的连接构成了黏液层的骨架。黏液层能够保护肠道上皮细胞免受病原微生物的侵袭,同时是肠道蠕动的润滑剂。黏蛋白能够与肠道上皮细胞表面的糖基结合构成黏液层的下层,直接与黏膜接触,而上层则相对疏松。黏液层的厚度从50 μm到800 μm不等,在30 μm厚度的区域是离上皮细胞最近的无菌区域(图1)。综上所述,黏液层是肠道屏障的第1道防线,病原微生物必须先突破黏液层才能到达上皮细胞。经过不断的进化,微生物形成了多种方法降解黏液层达到入侵上皮细胞的目的,比如幽门螺杆菌能够切断二硫键,绿脓杆菌(P. aeruginosa)和阿米巴虫具有蛋白酶能够分解黏蛋白,一些微生物还具有糖苷酶功能,能够分解糖苷键等。当肠道某区域发生炎症反应,那么该区域的黏液层会变薄,使病原微生物入侵上皮细胞变得更加容易。
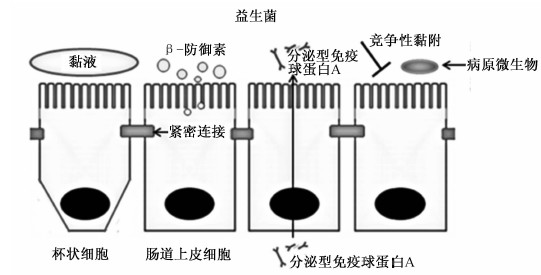 | 图2 益生菌与肠道上皮屏障作用机制示意图
Fig.2 Schematic diagram of mechanism between probiotics and intestinal epithelial barrier[12] |
益生菌能够通过增加黏蛋白的分泌量来增强肠道屏障功能,阻止病原微生物的侵袭。一些研究显示,某些乳酸杆菌能够黏附在Caco-2细胞或者HT29细胞表面增加黏蛋白MUC2分泌量,阻止大肠杆菌的入侵和黏附[13],但也有研究显示,嗜酸乳杆菌(Lactobacillus acidophilus)不需要黏附在HT29细胞表面就可以有效增加MUC2的分泌量[14]。由于体内试验研究较少,体内的研究结果并不一致,用益生菌制剂VSL#3饲喂小鼠14 d发现没有改变黏蛋白分泌量和黏液层厚度[15],而另一研究用相同剂量的VSL#3饲喂小鼠7 d MUC2表达量就增加了60倍[16]。因此,益生菌是否在体内试验中有效增加黏蛋白分泌和增加黏液层厚度还需要进一步的研究证明。
在肠道抗菌多肽中有2大类家族,抗菌肽和防御素(图2)。肠道上皮细胞在受到病原微生物入侵时能够连续分泌α-螺旋抗菌多肽。防御素进一步可以分类成主要由小肠潘氏细胞合成分泌的α-防御素和由肠道上皮细胞分泌的β-防御素。β-防御素具有抗菌功能,能够阻止病原微生物如细菌、真菌和一些病毒入侵上皮细胞。益生菌不仅可以提高肠道上皮合成和分泌抗菌肽和防御素,还可以通过产生短链脂肪酸(SCFA)或者细菌素直接阻止病原体生长。益生菌合成分泌的抗菌因子可以看作是肠道上皮屏障的重要组成部分,尤其是一些能够抑制或者杀死病原体的抗菌因子。有体外试验研究表明,乳酸杆菌能够通过分泌乙酸和乳酸降低pH,从而抑制大肠杆菌等病原体的生长繁殖[17]。SCFA能够破坏革兰氏阴性菌病原体如肠出血性大肠杆菌、绿脓杆菌和沙门杆菌(S. typhimurium)等的外层细胞膜从而杀死病原体,SCFA的穿透能力能够辅助其他抗菌因子更加容易地进入病原体细胞内发挥抗菌作用。细菌素是一类可以由益生菌或者共生微生物合成分泌的多肽,能够杀死细菌或者抑制细菌生长。细菌素不仅能够穿透革兰氏阴性菌的细胞膜内层,还可以干扰细菌的细胞壁合成,唾液乳杆菌(L. salivarius)能够合成分泌细菌素ABP-118抑制芽孢杆菌属(Bacillus)、利斯特菌属(Listeria)、肠球菌属(Enterococcus)和葡萄球菌属(Staphylococcus)等的生长繁殖,而大部分乳酸杆菌的生长不受其抑制,说明细菌素ABP-118对于肠道微生物定植具有选择性以及限制病原微生物的生长繁殖[18]。
在肠道黏液中存在有大约80%的浆细胞,同时肠道黏液中的免疫球蛋白A(IgA)比其他部位多(图2),派尔集合淋巴结是主要的IgA生成部位。免疫球蛋白M(IgM)的B细胞聚集到派尔集合淋巴结中受到T细胞和树突细胞激活增殖,IL-6、白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)使IgM的B细胞转换成能够生成IgA的B细胞,最终B细胞分化成IgA浆细胞。IgA二聚体通过肠道上皮细胞上的免疫球蛋白受体被分泌到肠腔中,即sIgA。IgG和IgA都存在于肠道黏液中,IgA被认为是黏液免疫反应中最主要的一类抗体,IgG则被认为是在外来抗原的黏液免疫反应中起到了重要的作用[19]。
在肠道屏障的黏液层中,sIgA通过与病原微生物的表面抗原结合来保护肠道上皮细胞不受微生物侵袭。sIgA包裹病原微生物后形成一层亲水性的膜,能被肠道上皮细胞上的多糖黏蛋白所排斥。IgA与抗原结合形成的复合体还能结合到一些免疫细胞(如中性粒细胞、树突状细胞、单核细胞以及巨噬细胞等)的人IgA Fc受体FcαRI(CD89)上,受体被激活后能够使免疫细胞发挥抗菌作用,包括细胞毒性作用、吞噬作用和生成抗菌性过氧化物等,根据细胞种类的不同以及IgA配体的不同还能激活抗炎性信号通路或者致炎性信号通路[20]。免疫排斥功能不仅能保护肠道上皮细胞免受病原微生物的侵袭,同时还能维持肠道微生物菌群的稳态[21]。
研究表明,当肠道上皮受到病原微生物侵袭时,益生菌能提高机体产生病原体特异性和非特异性的sIgA,但是并没有提高益生菌特异性的sIgA的分泌量,当用酪乳杆菌(L. casei)饲喂小鼠之后,IgA和IL-6的分泌量增加,但并不产生对益生菌酪乳杆菌特异性的抗体,表明肠道免疫系统对于益生菌没有特异性[22]。不是所有的益生菌在sIgA表达方面都具有一样的效果,益生菌鼠李糖乳杆菌和乳双歧杆菌混合物并没有引起小鼠肠道sIgA分泌量的增高,而当小鼠用益生元或者合生元饲喂后却引起sIgA的分泌量提高[23],表明刺激物的多样性能够增强肠道免疫系统的免疫排斥反应。
益生菌可以通过与病原微生物竞争性黏附肠道上皮细胞的结合位点来对抗入侵的病原微生物(图2),鼠李糖乳杆菌和嗜酸乳杆菌可以竞争性附着于HEp-2细胞系和T84细胞系的黏附位点,减少细胞表面的黏附位点从而阻止如肠致病性大肠埃希菌等病原微生物的入侵[24]。研究显示,乳酸杆菌的保护作用能够通过热激失活,但是一些乳酸杆菌的表面蛋白依旧能够与肠道上皮细胞结合。汪海峰等[25]对于S层蛋白、黏膜结合蛋白和胞外间质黏附的调节性表面蛋白等乳酸杆菌表面蛋白结构特征及其在肠道黏附中的作用与机制做了全面的综述。研究表明,经纯化的瑞士乳杆菌(L. helveticus)的表面蛋白能够阻止肠毒性大肠埃希杆菌对肠道上皮细胞的黏附,维持肠道屏障的完整性[26]。
一些乳酸杆菌还能够直接与沙门氏菌等病原微生物竞争位于Caco-2细胞表面和黏液层的位点,替换已经结合在黏附位点上的病原微生物[27],相关研究显示,益生菌EcN能够分泌一种非细菌素的成分作用于病原微生物或者宿主细胞来减弱一些病原微生物的黏附[8],布拉氏酵母菌(S. boulardii)分泌的一种热不稳定的物质能够降低病原菌在上皮细胞上的黏附能力[28],以上表明益生菌能够通过多种方式阻止病原微生物黏附于肠道上皮,从而增强肠道屏障功能。
肠道上皮细胞的胞间连接,是肠道屏障发挥功能的基础。许多成分构成了胞间连接复合体:紧密连接、黏附连接、间隙连接以及细胞桥粒等(图3)。肠道上皮细胞的紧密连接相关复合体蛋白包含有胞内和细胞表面蛋白。胞内蛋白有ZO-1、ZO-2、ZO-3、Cingulin、7H6、Symplekin以及ZA-1。膜蛋白包括在紧密连接中发现的多种跨膜蛋白,如Occludin、Claudin等,用来连接周围的肠道上皮细胞组成紧密连接。
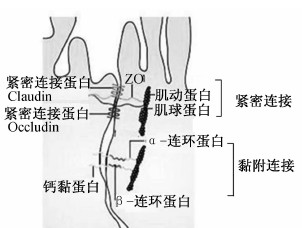 | 图3 细胞间紧密连接示意图
Fig.3 Schematic diagram of intercellular junction[29] |
病原微生物通过各种毒力因子攻击紧密连接蛋白入侵肠道屏障。大肠杆菌通过将Occludin蛋白从紧密连接处转移至胞质内从而摧毁紧密连接。梭状芽胞杆菌(C. difficile)的毒力因子A和B通过溶解蛋白Occludin、ZO-1、ZO-2进入肠道屏障。一种从霍乱弧菌提取的Zonulin蛋白通过与细胞膜受体结合后分解胞内的紧密连接。Zonulin蛋白的失调在许多疾病中都出现,导致细胞间连接不完整引起病原微生物的侵袭感染[30]。
益生菌通过提高紧密连接蛋白的表达量实现增强肠道上皮的屏障功能。Dai等[31]在蛋白水平的研究显示,益生菌VSL#3能够通过激活p38和胞外信号调剂激酶(ERK)信号分子通路保护肠道上皮屏障,提高紧密连接蛋白的表达量增强肠道上皮屏障功能。Resta-Lenert等[32]研究表明,嗜热乳酸链球菌(Streptococcus thermophilus)和嗜酸乳杆菌能够激活p38、ERK、c-Jun氨基末端激酶(JNK)、磷酸肌醇3激酶(PI3K)信号分子通路,提高ZO-1和Occludin蛋白磷酸化表达量,增强HT-29细胞和Caco-2细胞的屏障功能,这与Dai等[31]研究结果相一致。基因水平的研究显示,植物乳杆菌(Lactobacillus plantarum)MB452能够改变肠上皮细胞紧密连接相关基因的表达量,如编码Occludin和细胞骨架的基因[33]。同样有报道称EcN能提高肠道上皮细胞的紧密连接蛋白表达,Ukena等[34]用EcN饲喂小鼠后ZO-1的mRNA表达量和蛋白表达量都相应上升,同时修复肠道黏膜层增强上皮屏障功能。
益生菌在肠道中还有其他的免疫调控效应,包括增强树突细胞和T细胞免疫功能,阻止致炎性细胞因子的合成以及增强自然杀伤细胞的作用[35]。益生菌刺激肠道免疫系统的功能和机制需要做进一步深入研究。
微生物菌群通过与黏膜免疫系统交互作用,调节肠道上皮与黏膜系统的生长、存活以及炎症控制。本课题组章文明等[36]对肠道上皮细胞免疫调节相关受体做了全面的综述。肠道黏膜具有跨膜或者胞质内的受体,即模式识别受体(PRRs),它们通过特异性识别并结合特异性微生物大分子配体(图4)。这些配体即是微生物相关分子模式(MAMPs),包括脂多糖、鞭毛、肽聚糖以及甲酰化多肽(表1)。跨膜PRRs包括外膜和内体浆质隔室的代表Toll样受体(TLRs),以及胞内受体的代表核苷酸结合寡聚化结构域NOD样受体(NLRs),它们能够保护胞质内隔室。微生物配体与黏膜受体的相互作用使机体产生免疫耐受,从而使核心微生物菌群可以稳定地生长。益生菌或者共生菌群能够竞争肠道上皮细胞受体位点,抑制病原微生物黏附,阻止病原微生物在肠道中形成规模,所以建立一个由多种原生共生微生物种群构成的稳定微生物菌群对宿主是有利的。在中性粒细胞的表面,跨膜受体属于甲酰化多肽受体(FPRs),是一类高亲和力的PRRs[37]。当有对应的MAMP激活FPRs时,FPRs能够激活中性粒细胞信号转导通路,产生还原型尼克酰胺腺嘌呤二核苷酸脱氢酶(NADPH)氧化物依赖的活性氧以提高嗜菌细胞的运动性。一些中性粒细胞的FPRs在IECs上被发现,表明IECs上的FPRs可能与在吞噬细胞中的作用相类似,维持肠道微生物稳态平衡。
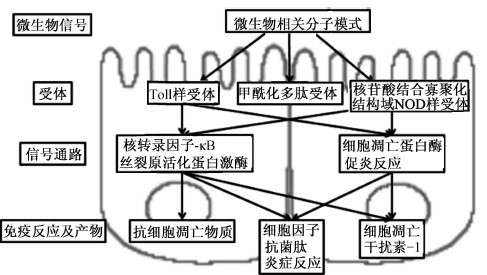 | 图4 微生物与肠道上皮相互作用示意图
Fig.4 Schematic diagram of interaction between microbe and intestinal epithelium[38] |
|
| 表1 模式识别受体与微生物相关分子模式
Table 1 PRRs and MAMPs[38]
|
在肠道黏膜中,PRRs的激活启动调节通路,如核转录因子-κB(NF-κB)通路、丝裂原活化蛋白激酶(MAPK)通路以及细胞凋亡蛋白酶依赖的信号级联反应来产生各类细胞因子和趋化因子或者引起细胞凋亡(图4)。NF-κB被认为是在炎症反应中起重要作用的一类因子,能够调控一些细胞因子的表达,如TNF-α、IL-6、γ-干扰素(IFN-γ)等[39],MAPK在炎症反应中也发挥着非常重要的调节作用,不同配体与相应的PRRs结合后通过p38、ERK、JNK的磷酸化来激活MAPK级联反应产生免疫应答效应,激活的MAPK受各类与炎症反应相关的信号转导通路调节,比如细胞因子以及其基因,通过NF-κB从胞质进入核内与DNA结合来调节MAPK级联反应,所以抑制NF-κB通路和MAPK通路对于治疗炎症反应是一项有效的措施[39]。
肠道黏膜对于微生物的转录应答是不同的,一些PRR配体为益生菌或者共生细菌受体,而肠道黏膜对于这些细菌的应答并不引起肠道黏膜的炎症反应,这些益生菌或者共生细菌通过减轻病原细菌诱导产生的致炎性免疫因子应答反应来发挥保护肠道上皮屏障的作用。由病原菌或者其他应激信号引起的炎症或者细胞凋亡,是由NF-κB信号通路和细胞凋亡蛋白酶依赖的信号级联反应来控制,大部分益生菌通过阻止上皮细胞蛋白酶功能和阻止NF-κB的负调节因子抑制蛋白-κB(IκB)降解,或者通过过氧化物酶体增殖物激活受体γ(PPARγ)依赖的信号通路将NF-κB亚基p65从细胞核中输导出来从而限制NF-κB通路[39]。益生菌还能够诱导转化生长因子-β(TGF-β)信号通路和MMP3K信号通路,介导抗炎和抗细胞凋亡作用[11]。细菌脂蛋白和肠道上皮细胞Toll样受体2(TLR2)相互作用能够激活骨髓分化主要响应基因88(Myd88),随后集合快速集合死亡域(FADD)激活半胱氨酸天冬氨酸蛋白酶8信号通路发生细胞凋亡[40, 41]。鞭毛在细胞凋亡应答中起了重要作用,Toll样受体5(TLR5)和鞭毛相互作用启动促炎反应信号通路和促细胞凋亡信号通路,具有鞭毛结构的病原微生物与肠道上皮细胞接触,通过激活TLR5来启动促炎反应的产生,巨噬细胞利用胞内白细胞介素-1β(IL-1β)转换酶蛋白酶激活因子(IPAF)或者凋亡抑制蛋白-5(NAIP-5)来识别胞质内鞭毛,应答IL-1或者引起细胞凋亡[42]。
当黏膜与微生物相互作用激活PRR,PRR通过转录或者转录后过程将信号传递进胞内,通过信号转导级联反应产生相应的分子产物(如细胞因子、趋化因子)或者引导细胞凋亡反应等(图4)。免疫过程中产生的细胞因子分为致炎性细胞因子如IL-6、IL-8、TNF-α、IFN-γ等和抗炎性细胞因子如IL-10、白细胞介素-15(IL-15)等。致炎性细胞因子在肠道中的功能主要是引起肠道上皮细胞产生免疫反应,激活肠道屏障中的免疫屏障的各类免疫细胞如树突细胞、巨噬细胞等的免疫应答。抗炎性细胞因子在肠道中的功能主要是阻止致炎性细胞因子引起肠道屏障的破坏和炎症的发生。细胞能对细菌的刺激产生炎症反应,猪肠道上皮细胞在受到鼠伤寒细菌感染之后能产生IL-8和TNF-α[43],用内毒素刺激肠道上皮细胞能够使细胞产生IL-1β、IL-6、IL-8以及CCL2(CC亚家族配体2)、CCL20等致炎性细胞因子和趋化因子[39]。IL-10的抗炎作用是通过抑制NF-κB中的IκB的降解来影响致炎性细胞因子的合成,如TNF-α、IL-1β以及IL-6[44],PI3K通路能够减少致炎因子如TNF-α、IL-6、IL-8等的表达,增加抗炎因子IL-10的表达[45],可以推测IL-10在益生菌对肠道屏障的免疫保护作用中起到重要的作用。
肠道上皮屏障是阻止病原微生物入侵的第1道防线,益生菌通过促进黏液层的形成、分泌抗菌因子、促进肠道sIgA的分泌、竞争黏附位点、增进紧密连接形成等多种方式来发挥益生作用。研究益生菌与肠道上皮屏障相互作用及其机制,对提高人与动物的肠道健康水平具有重要意义。大量研究表明,益生菌通过与肠道黏膜免疫系统的交互作用来增强肠道上皮屏障功能,但益生菌通过何种具体、全面的机制发挥调节作用仍然不清楚,有关益生菌调节肠道上皮屏障的作用机制仍有待进一步的深入研究。作者目前正在从事有关乳酸杆菌对肠道上皮细胞的免疫保护作用的研究工作,以期阐明乳酸杆菌对肠道上皮细胞发挥免疫保护作用的机制。
| [1] | CHICHLOWSKI M,HALE L P.Bacterial-mucosal interactions in inflammatory bowel disease:an alliance gone bad[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2008,295(6):G1139-G1149. ( 2) 2)
|
| [2] | VIZOSO PINTO M G,RODRIGUEZ GÓMEZ M,SEIFERT S,et al.Lactobacilli stimulate the innate immune response and modulate the TLR expression of HT29 intestinal epithelial cells in vitro[J]. International Journal of Food Microbiology,2009,133(1/2):86-93. ( 1) 1)
|
| [3] | LOTZ M,GÜTLE D,WALTHER S,et al.Postnatal acquisition of endotoxin tolerance in intestinal epithelial cells[J]. The Journal of Experimental Medicine,2006,203(4):973-984. ( 1) 1)
|
| [4] | ZEUTHEN L H,FINK L N,METZDORFF S B,et al.Lactobacillus acidophilus induces a slow but more sustained chemokine and cytokine response in naǐve foetal enterocytes compared to commensal Escherichia coli[J]. BMC Immunology,2010,11:2. ( 1) 1)
|
| [5] | GERSEMANN M,WEHKAMP J,STANGE E F.Innate immune dysfunction in inflammatory bowel disease[J]. Journal of Internal Medicine,2012,271(5):421-428. ( 1) 1)
|
| [6] | JOOSSENS M,HUYS G,CNOCKAERT M,et al.Dysbiosis of the faecal microbiota in patients with Crohn's disease and their unaffected relatives[J]. Gut,2011,60(5):631-637. ( 1) 1)
|
| [7] | YAN A W,FOUTS D E,BRANDL J,et al.Enteric dysbiosis associated with a mouse model of alcoholic liver disease[J]. Hepatology,2011,53(1):96-105. ( 1) 1)
|
| [8] | SMAJS D,BUREŠ J,SMARDA J,et al.Experimental administration of the probiotic Escherichia coli strain Nissle 1917 results in decreased diversity of E. coli strains in pigs[J]. Current Microbiology,2012,64(3):205-210. ( 3) 3)
|
| [9] | OELSCHLAEGER T A.Mechanisms of probiotic actions:a review[J]. International Journal of Medical Microbiology,2010,300(1):57-62. ( 1) 1)
|
| [10] | SHIMAZU T,VILLENA J,TOHNO M,et al.Immunobiotic Lactobacillus jensenii elicits anti-inflammatory activity in porcine intestinal epithelial cells by modulating negative regulators of the Toll-like receptor signaling pathway[J]. Infection and Immunity,2012,80(1):276-288. ( 1) 1)
|
| [11] | AZEVEDO M S P,ZHANG W,WEN K,et al.Lactobacillus acidophilus and Lactobacillus reuteri modulate cytokine responses in gnotobiotic pigs infected with human rotavirus[J]. Beneficial Microbes,2012,3(1):33-42. ( 2) 2)
|
| [12] | OHLAND C L,MACNAUGHTON W K.Probiotic bacteria and intestinal epithelial barrier function[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2010,298(6):G807-G819. ( 1) 1)
|
| [13] | MACK D R,AHRNE S,HYDE L,et al.Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro[J]. Gut,2003,52(6):827-833. ( 1) 1)
|
| [14] | KIM Y,KIM S H,WHANG K Y,et al.Inhibition of Escherichia coli O157:H7 attachment by interactions between lactic acid bacteria and intestinal epithelial cells[J]. Journal of Microbiology and Biotechnology,2008,18(7):1278-1285. ( 1) 1)
|
| [15] | GAUDIER E,MICHEL C,SEGAIN J P,et al.The VSL#3 probiotic mixture modifies microflora but does not heal chronic dextran-sodium sulfate-induced colitis or reinforce the mucus barrier in mice[J]. The Journal of Nutrition,2005,135(12):2753-2761. ( 1) 1)
|
| [16] | CABALLERO-FRANCO C,KELLER K,DE SIMONE C,et al.The VSL#3 probiotic formula induces mucin gene expression and secretion in colonic epithelial cells[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2007,292(1):G315-G322. ( 1) 1)
|
| [17] | OGAWA M,SHIMIZU K,NOMOTO K,et al.Inhibition of in vitro growth of Shiga toxin-producing Escherichia coli O157:H7 by probiotic Lactobacillus strains due to production of lactic acid[J]. International Journal of Food Microbiology,2001,68(1/2):135-140. ( 1) 1)
|
| [18] | FLYNN S,VAN SINDEREN D,THORNTON G M,et al.Characterization of the genetic locus responsible for the production of ABP-118,a novel bacteriocin produced by the probiotic bacterium Lactobacillus salivarius subsp. salivarius UCC118[J]. Microbiology,2002,148(4):973-984. ( 1) 1)
|
| [19] | TANA,WATARAI S,ISOGAI E,et al.Induction of intestinal IgA and IgG antibodies preventing adhesion of verotoxin-producing Escherichia coli to Caco-2 cells by oral immunization with liposomes[J]. Letters in Applied Microbiology,2003,36(3):135-139. ( 1) 1)
|
| [20] | MIHAI S,NIMMERJAHN F.The role of Fc receptors and complement in autoimmunity[J]. Autoimmunity Reviews,2013,12:657-660. ( 1) 1)
|
| [21] | TSUJI M,SUZUKI K,KINOSHITA K,et al.Dynamic interactions between bacteria and immune cells leading to intestinal IgA synthesis[J]. Seminars in Immunology,2008,20(1):59-66. ( 1) 1)
|
| [22] | GALDEANO C M,PERDIGÓN G.The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity[J]. Clinical and Vaccine Immunology,2006,13(2):219-226. ( 1) 1)
|
| [23] | ROLLER M,RECHKEMMER G,WATZL B.Prebiotic inulin enriched with oligofructose in combination with the probiotics Lactobacillus rhamnosus and Bifidobacterium lactis modulates intestinal immune functions in rats[J]. The Journal of Nutrition,2004,134(1):153-156. ( 1) 1)
|
| [24] | SHERMAN P M,JOHNSON-HENRY K C,YEUNG H P,et al.Probiotics reduce enterohemorrhagic Escherichia coli O157:H7- and enteropathogenic E. coli O127:H6-induced changes in polarized T84 epithelial cell monolayers by reducing bacterial adhesion and cytoskeletal rearrangements[J]. Infection and Immunity,2005,73(8):5183-5188. ( 1) 1)
|
| [25] | 汪海峰,章文明,汪以真,等.乳酸杆菌与肠道黏附相关表面因子及其机制的研究进展[J]. 动物营养学报,2011,23(2):179-186. ( 1) 1)
|
| [26] | LIU Z H,SHEN T Y,ZHANG P,et al.Lactobacillus plantarum surface layer adhesive protein protects intestinal epithelial cells against tight junction injury induced by enteropathogenic Escherichia coli[J]. Molecular Biology Reports,2011,38(5):3471-3480. ( 1) 1)
|
| [27] | LEE Y K,PUONG K Y,OUWEHAND A C,et al.Displacement of bacterial pathogens from mucus and Caco-2 cell surface by lactobacilli[J]. Journal of Medical Microbiology,2003,52(Pt 10):925-930. ( 1) 1)
|
| [28] | WU X,VALLANCE B A,BOYER L,et al.Saccharomyces boulardii ameliorates Citrobacter rodentium-induced colitis through actions on bacterial virulence factors[J]. American Journal of Physiology Gastrointestinal and Liver Physiology,2008,294(1):G295-G306. ( 1) 1)
|
| [29] | TURNER J R.Intestinal mucosal barrier function in health and disease[J]. Nature Reviews Immunology,2009,9(11):799-809. ( 1) 1)
|
| [30] | FASANO A.Zonulin and its regulation of intestinal barrier function:the biological door to inflammation,autoimmunity,and cancer[J]. Physiological Reviews,2011,91(1):151-175. ( 1) 1)
|
| [31] | DAI C,ZHAO D H,JIANG M.VSL#3 probiotics regulate the intestinal epithelial barrier in vivo and in vitro via the p38 and ERK signaling pathways[J]. International Journal of Molecular Medicine,2012,29(2):202-208. ( 2) 2)
|
| [32] | RESTA-LENERT S,BARRETT K E.Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC)[J]. Gut,2003,52(7):988-997. ( 1) 1)
|
| [33] | ANDERSON R C,COOKSON A L,MCNABB W C,et al.Lactobacillus plantarum MB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation[J]. BMC Microbiology,2010,10:316. ( 1) 1)
|
| [34] | UKENA S N,SINGH A,DRINGENBERG U,et al.Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity[J]. PLoS One,2007,2(12):e1308. ( 1) 1)
|
| [35] | MARTEAU P.Probiotics in functional intestinal disorders and IBS:proof of action and dissecting the multiple mechanisms[J]. Gut,2010,59(3):285-286. ( 1) 1)
|
| [36] | 章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J]. 动物营养学报,2012,24(3):389-396. ( 1) 1)
|
| [37] | MOLLICA A,STEFANUCCI A,COSTANTE R,et al.Role of formyl peptide receptors (FPR) in abnormal inflammation responses involved in neurodegenerative diseases[J]. Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry,2012,11(1):20-36. ( 1) 1)
|
| [38] | SHARMA R,YOUNG C,NEU J.Molecular modulation of intestinal epithelial barrier:contribution of microbiota[J]. Journal of Biomedicine & Biotechnology,2010,2010:305879. ( 1) 1)
|
| [39] | JIANG Y J,LV X N,MAN C X,et al.Lactobacillus acidophilus induces cytokine and chemokine production via NF-κB and p38 mitogen-activated protein kinase signaling pathways in intestinal epithelial cells[J]. Clinical and Vaccine Immunology,2012,19(4):603-608. ( 4) 4)
|
| [40] | HRMANNSPERGER G,HALLER D.Molecular crosstalk of probiotic bacteria with the intestinal immune system:clinical relevance in the context of inflammatory bowel disease[J]. International Journal of Medical Microbiology,2010,300(1):63-73. ( 1) 1)
|
| [41] | SHIN E M,ZHOU H Y,GUO L Y,et al.Anti-inflammatory effects of glycyrol isolated from Glycyrrhiza uralensis in LPS-stimulated RAW264.7 macrophages[J]. International Immunopharmacology,2008,8(11):1524-1532. ( 1) 1)
|
| [42] | LI N,QUIDGLEY M C,KOBEISSY F H,et al.Microbial cell components induced tolerance to flagellin-stimulated inflammation through Toll-like receptor pathways in intestinal epithelial cells[J]. Cytokine,2012,60(3):806-811. ( 1) 1)
|
| [43] | COLLADO-ROMERO M,ARCE C,RAMREZ-BOO M,et al.Quantitative analysis of the immune response upon Salmonella typhimurium infection along the porcine intestinal gut[J]. Veterinary Research,2010,41(2):23. ( 1) 1)
|
| [44] | CHON H,CHOI B,LEE E,et al.Immunomodulatory effects of specific bacterial components of Lactobacillus plantarum KFCC11389P on the murine macrophage cell line RAW 264.7[J]. Journal of Applied Microbiology,2009,107(5):1588-1597. ( 1) 1)
|
| [45] | ANTONIV T T,IVASHKIV L B.Interleukin-10-induced gene expression and suppressive function are selectively modulated by the PI3K-Akt-GSK3 pathway[J]. Immunology,2011,132(4):567-577. ( 1) 1)
|




