2. 甘肃农业大学动物科学技术学院, 兰州 730070
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China
瘤胃乳头是瘤胃黏膜上皮的小突起,该突起可增加瘤胃壁吸收营养物质的表面积。大量研究表明,饲粮是影响瘤胃乳头形态学变化最主要的因素,包括饲粮的物理结构[1]、饲粮组成[2]、营养水平[3]等。我国农作物秸秆资源丰富,年产玉米秸秆2亿t以上。我国北方许多养殖户仍以玉米秸秆并添加高水平精料来满足奶牛的营养需要。本课题组前期试验结果表明,与饲喂玉米秸秆并添加高水平精料饲粮相比,给泌乳奶牛饲喂优质的苜蓿、羊草和玉米青贮并添加低水平精料饲粮显著提高了泌乳奶牛的干物质采食量、乳脂产量和总固形物产量[4]。玉米秸秆品质粗糙,长期饲喂低品质粗饲料并添加高水平精料饲粮可能会对奶牛的瘤胃形态结构产生影响。因此,本试验以苜蓿、羊草和全株玉米青贮并添加低水平精料饲粮为对照,探讨玉米秸秆并添加高水平精料饲粮对奶牛瘤胃乳头形态学的影响,以便为奶牛的合理饲养提供形态学方面的参考。
选择10头体重为(542±22) kg的头胎泌乳中期 荷斯坦奶牛,每头奶牛安装有永久性瘤胃瘘管。采用完全随机试验设计,按照体重、泌乳日龄和产奶量随机分为2组,每组5头牛。奶牛每日饲喂2次(07:00和19:00),挤奶2次(04:00和15:30),单栏栓系式饲养,自由饮水。试验预试期2周,正试期为7周。
饲粮的配制参照NY/T 34—2004奶牛营养需要[5]。2种饲粮组成,一种以玉米秸秆为唯一粗饲料来源并添加高水平精料,该组称为单一秸秆组(CS组);另一种以羊草、苜蓿干草、全株玉米青贮为粗饲料来源并添加低水平精料,该组称为混合粗料组(MF组)。饲粮组成及营养水平见表1。
| 表1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of diets (DM basis) % |
试验期最后1天通过瘤胃瘘管采集每头奶牛的瘤胃壁乳头,采集步骤参照Steele等[2]的方法。首先通过瘘管掏出部分瘤胃食糜,暴露腹囊部乳头,清水冲洗掉食糜后用手术剪剪取少量瘤胃乳头,紧接着用预冷的磷酸盐缓冲液(PBS,pH=7.4,1×)反复冲洗后,立即放入4%甲醛溶液或2.5%戊二醛溶液中固定。
取样后用冰冷的PBS冲洗干净后,立即投入4%甲醛溶液中固定至少48 h。常规石蜡包埋、切片、苏木精-伊红染色后,在显微镜(Olympus,IX71,日本)下观察并拍照。采用Image-Pro Express 6.0图像分析系统软件测量瘤胃乳头宽度和细胞层厚度。瘤胃乳头宽度的测量采用4倍物镜观察,细胞层厚度的测量采用20倍物镜观察。
将瘤胃乳头切成小于1 mm3的组织块,投入2.5%戊二醛溶液中前固定24 h,后用PBS冲洗,然后置于1%锇酸中后固定2 h,双蒸水冲洗后系列酒精脱水,100%树脂包埋,超薄切片机(Leica,EM-UC6,德国)切片(60~100 nm),3%醋酸铀-柠檬酸铅复染,透射电镜(Hitachi,H-7500,日本)下观察并拍照。
采用SAS 9.0统计处理软件中的ANOVA程序对试验数据进行统计分析,差异显著用Duncan氏法进行多重比较。
图1是CS组和MF组奶牛瘤胃乳头的组织切片图。由表2可知,通过图像分析系统软件测得CS组奶牛的瘤胃乳头宽度极显著高于MF组(P<0.01)。MF组奶牛的瘤胃乳头表面上皮的颗粒层、棘层和基底层的厚度均高于CS组,角质层厚度低于CS组,但组间差异均不显著(P>0.05)。
奶牛瘤胃乳头的表面由复层鳞状上皮细胞组成,由内向外分为基底层、棘层、颗粒层和角质层(图2A和图2B)。角质层由完全角质化的细胞构成,胞质中出现不同程度的角质颗粒,高倍镜下观察到有部分角质层剥落,CS组的角质层剥落程度大于MF组。颗粒层由较扁的梭形细胞组成,细胞长轴与上皮表面相平行。棘层是上皮中最厚的一层,细胞排列疏松,呈不规则多角形,体积较大,细胞核为圆形或椭圆形,细胞核着色较浅。基底层细胞排列较紧密,呈矮柱状,细胞核为卵圆形。CS组颗粒层、棘层和基底层这3层的细胞核着色较MF组的浅,基底层细胞不断分裂和增殖,以补充角质层脱落的细胞。
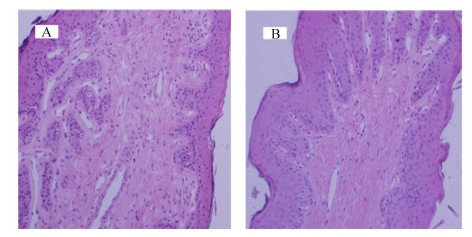 | 图1 2组奶牛瘤胃乳头组织切片图
Fig.1 Tissue section images of ruminal papillae of dairy cows in the two groups (20×) |
| 表2 不同类型饲粮对奶牛瘤胃乳头组织结构的影响 Table 2 Effects of different types of diets on morphological structure of ruminal papillae of dairy cows |
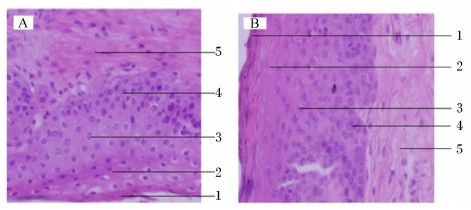 | 图2 高倍镜下2组奶牛瘤胃乳头显微结构图
Fig.2 Microstructure images of ruminal papillae of dairy cows in the two groups under the high power lens (40×) |
瘤胃乳头透射电镜结果表明:MF组,奶牛瘤胃乳头上皮细胞内的组织较多,而细胞间隙较小(图3A);角质层细胞分层较少;各层细胞排列紧密,清晰可辨,细胞之间通过细胞连接,尤其是细胞桥粒紧密连接在一起;角质层和颗粒层之间几乎无转型细胞;棘层和基底层细胞分别呈多角形和短柱状,细胞垂直于基底表面。
CS组,奶牛瘤胃乳头上皮各层细胞之间存在较大的空隙,角质层下的细胞层细胞呈现加速的迁移状态(图3B);乳头上皮的角质层出现少量的剥落;各层细胞之间的界限变得扩散,因为基底层细胞呈加速地往外迁移;角质层和颗粒层细胞之间的连接变得很松散,细胞之间存在很大的间隙;颗粒层细胞呈扁形,含有大量透明角质样的小颗粒(图4A);颗粒层细胞之间的细胞连接,尤其桥粒变得不清晰;棘层和基底层细胞内含有较大卵形核和大量的线粒体、内质网、核糖体等细胞器(图4B);基底层的细胞呈柱形,细胞间隙较大,有些甚至达到3 μm(图4C)。
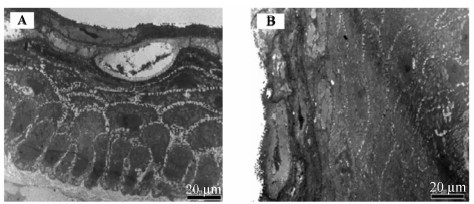 | 图3 不同类型饲粮饲喂下奶牛瘤胃乳头透射电镜图
Fig.3 Transmission electron images of ruminal papillae of dairy cows receiving different types of diets |
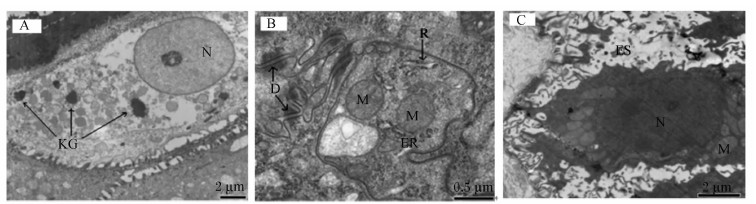 | 图4 单一秸秆组奶牛瘤胃乳头的超微结构图
Fig.4 Ultrastructure images of ruminal papillae of dairy cows in CS group |
瘤胃乳头长度是瘤胃发育研究中最为重要的参数,但是由于乳头的长度在瘤胃不同区域间具有高度变异性,若需要充分反映瘤胃发育状况,就要增加采样区域和数量。本研究乳头的采集是通过瘤胃瘘管活体取样,而并非屠宰后取样,从而限制了乳头长度测定的代表性,因此本试验未能得到2组奶牛瘤胃乳头长度的具体数值,但是,从肉眼观察可见MF组奶牛的瘤胃腹囊部乳头长度明显大于CS组。乳头宽度的变异性较小,一般可作为评价瘤胃发育的第2重要指标。有关饲粮组成对瘤胃乳头宽度影响的报道结果不一致。Shen等[6]给山羊灌注42 d的丁酸显著提高了瘤胃乳头的表面积,但并不影响乳头的长度和宽度;黄智南[7]研究表明,饲喂高营养水平饲粮的山羊瘤胃上皮表面积显著高于低营养组,但乳头宽度差异不显著;而张双奇等[8]给荷斯坦公犊饲喂3种不同精粗比例的饲粮,结果表明瘤胃乳头的宽度随精料比例的增加而减小。本试验结果表明,MF组的奶牛瘤胃乳头宽度极显著低于CS组,这与张双奇等[8]报道的结果相反,说明粗饲料品质可能比精料水平对瘤胃乳头宽度的影响更大。
正常情况下,在瘤胃内容物的连续磨损下,角质化细胞层只有3~4层,对营养物质吸收作用的影响不大,却具有明显的保护作用。研究显示,瘤胃上皮对营养物质的吸收转运在很大程度上依赖于角质层细胞的角质化程度[9]。而角质层细胞的角质化程度与饲粮的组成密切相关,饲喂高营养水平饲粮能够使角质层的厚度增加到15层,而饲喂粗饲料时的瘤胃角质层则仅由4层细胞组成[10]。本试验结果表明,CS组奶牛瘤胃乳头的角质层厚度大于MF组,其原因主要是CS组以玉米秸秆为唯一粗饲料来源,而玉米秸秆品质粗糙,纤维含量高,且体积大,需要瘤胃强烈收缩和舒张来完成机械消化,促使瘤胃乳头角质层增厚。颗粒层没有皮脂腺分泌,水分可自由通过;棘层是瘤胃上皮组织中短链脂肪酸代谢的部位;而基底层细胞具有持续分裂能力,参与瘤胃上皮的更新和修复。研究表明,高营养饲粮水平能增加瘤胃上皮基底层细胞数量,基底层细胞分化向上迁移,引起颗粒层和棘层细胞数量增加,从而促进瘤胃上皮乳头的发育[7]。而Steele等[2]研究表明,饲喂高精料(65%混合谷物)饲粮显著降低了奶牛瘤胃乳头的颗粒层、棘层和基底层的厚度。本试验结果显示,瘤胃乳头角质层、颗粒层、棘层和基底层的厚度在MF组和CS组之间无统计学差异,提示本试验条件的饲粮营养水平对瘤胃乳头表面细胞层厚度的影响不明显。
通过透射电镜可观察到奶牛瘤胃乳头的颗粒层细胞内含有大小不一的透明角质样颗粒,胞质中含有透明角质样颗粒是颗粒层细胞的主要特点,其主要成分为富有组氨酸的蛋白质。研究报道透明角质样颗粒在基底层细胞内开始合成[11],并向表层逐渐移动,最后转变成角质细胞。颗粒层细胞之间存在紧密的桥粒连接,可有效地防止有害物质以扩散方式通过瘤胃壁。本试验通过透射电镜观察到,CS组奶牛瘤胃乳头的颗粒层细胞之间的连接退化,细胞之间存在较大的空隙,从而细胞的渗透性增强,一些微生物和有毒物质从瘤胃壁到血液的渗透力增强,进而对动物的健康造成威胁[12, 13]。基底层的细胞间隙较大,有些甚至达到3 μm,说明基底层细胞呈加速地往外迁移,以补充角质层脱落的细胞。基底层细胞内含有大量的线粒体,主要用于细胞代谢和生酮作用供能[14],因此其数量明显比颗粒层和棘层细胞内的多。
与MF组相比,给泌乳奶牛饲喂CS组饲粮,影响了瘤胃乳头的发育,乳头角质层有少量的蜕皮现象,角质层下的细胞层细胞呈现加速的迁移状态;瘤胃乳头颗粒层的细胞连接退化,细胞之间存在较大的空隙,可能造成细胞膜渗透性增强。因此,生产上给泌乳奶牛饲喂低质玉米秸秆并添加高水平精料饲粮是不合理的。
| [1] | BEHARKA A A,NAGARAJA T G,MORRILL J L,et al.Effect of form of the diet on anatomical,and fermentative development of rumen of neonatal calves[J]. Journal of Dairy Science,1998,81(7):1946-1955. ( 1) 1)
|
| [2] | STEELE M A,CROOM J,KAHLER M,et al.Bovine rumen epithelium undergoes rapid structural adaptation during grain-induced subacute ruminal acidosis[J]. American of Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2011,300(6):1515-1523. ( 3) 3)
|
| [3] | WANG Y H,XU M,WANG F N,et al.Effect of dietary starch on rumen and small intestine morphology and digesta pH in goats[J]. Livestock Science,2009,122(1):48-52. ( 1) 1)
|
| [4] | 赵小伟.不同类型日粮对泌乳奶牛乳脂肪酸组成的影响[D]. 硕士学位论文.兰州:甘肃农业大学,2012. ( 1) 1)
|
| [5] | 中华人民共和国农业部.NY/T34—2004奶牛营养需要[S]. 北京:中国标准出版社,2004. ( 1) 1)
|
| [6] | SHEN Z,SEYFERT H M,LOHRKE B,et al.An energy-rich diet causes rumen papillae proliferation associated with more IGF type 1 receptors and increased plasma IGF-1 concentration in young goats[J]. The Journal of Nutrition,2004,134(1):11-17. ( 1) 1)
|
| [7] | 黄智南.日粮营养对前胃上皮生长和组织形态的影响[D]. 硕士学位论文.南京:南京农业大学,2010. ( 2) 2)
|
| [8] | 张双奇,昝林森,梁大勇,等.日粮精粗比对荷斯坦公犊瘤胃组织结构的影响[J]. 西北农林科技大学学报,2009,37(9):59-64. ( 2) 2)
|
| [9] | BALDWIN R L,JESSE B W.Developmental changes in glucose and butyrate metabolism by isolated sheep ruminal cells[J]. The Journal of Nutrition,1992,122(5):1149-1153. ( 1) 1)
|
| [10] | GAEBEL G,MARTENS H,SUENDERMANN M,et al.The effect of diet,intraruminal pH and osmolarity on sodium, chloride and magnesium absorption from the temporarity isolated and washed reticulorumen of sheep[J]. Experimental Physiology,1987,72(1):501-511. ( 1) 1)
|
| [11] | HENRIKSON R C.Ultrastructure of ovine ruminal epithelium and localization of sodium in the tissue[J]. Journal of Ultrastructure Research,1970,30(3/4):385-401. ( 1) 1)
|
| [12] | GOZHO G N,PLAIZIER J C,KRAUSE D O,et al.Subacute ruminal acidosis induces ruminal lipopolysaccharide endotoxin release and triggers an inflammatory response[J]. Journal of Dairy Science,2005,88(4):1399-1403. ( 1) 1)
|
| [13] | PLAIZIER J C,KRAUSE D O,GOZHO G N,et al.Subacute ruminal acidosis in dairy cows:the physiological causes,incidence and consequences[J]. The Veterinary Journal,2008,176(1):21-31. ( 1) 1)
|
| [14] | LEIGHTON B,NICHOLAS A R,POGSON C I.The pathway of ketogenesis in rumen epithelium of the sheep[J]. Biochemical Journal,1983,216(3):769-772. ( 1) 1)
|




