2. 泰山医学院, 泰安 271000
2. Department of Basic Medicine, Taishan Medical University, Tai'an 271000, China
三价铬(Cr3+)作为葡萄糖耐量因子(glucose tolerance factor,GFT)的活性组成成分[1, 2],通过增强胰岛素的作用来发挥其生物学功能[3, 4, 5]。一般认为,铬作为胰岛素的辅助因子,可以降低血糖浓度,增强机体葡萄糖耐受能力[6, 7]。研究表明,铬不仅可以改善大鼠胰岛素与靶细胞的结合能力[8],增加胰岛素受体(insulin receptor,IR)的数量[9],还可以提高仓鼠卵巢细胞IR酪氨酸蛋白激酶的活性[10]以及加快葡萄糖转运载体(glucose transporter,GLUT)4的转膜速率[11, 12]。目前,在人和动物营养上应用的铬的化合物有很多。根据铬所结合的配体的形式,将铬源分为无机铬源和有机铬源。无机铬源包括氯化铬(CrCl3)、硫酸铬 及硝酸铬 等;有机铬源包括吡啶羧酸铬、酵母铬、烟酸铬等。
鱼类利用碳水化合物的能力低下,被认为是“葡萄糖不耐受”[13, 14]。鉴于铬对糖代谢的营养功能,大量试验研究将铬添加到鱼类饲料中,探究铬是否可以提高鱼类对碳水化合物的利用率。研究发现,在鱼类饲料中添加铬可以提高鱼体的增重,改善鱼体组成,增强血清中溶菌酶的活性[15, 16, 17, 18, 19]。然而,关于铬对鱼类营养作用的报道也不尽一致。也有研究发现在鱼类饲料中添加铬并不能影响鱼体生长以及碳水化合物的代谢[20, 21, 22]。因此,探究铬对鱼类的营养作用机制显得至关重要。本试验拟研究不同浓度酵母铬对尼罗罗非鱼生长性能、血液生化指标和鱼体营养组成的影响,并从核酸水平上进一步研究酵母铬对鱼类糖代谢 相关的2个基因——IR和GLUT基因表达的影响。
挑选健康、规格相同、平均体重为(15.80±0.02) g的罗非鱼300尾,随机分配到12个水族箱内。试验分为4个组,每个组设3个重复(3个水族箱),每个重复25尾鱼。基础饲料组成及营养水平见表1。以酵母铬(纯度为99.7%)为铬源,在基础饲料中的添加水平分别为0(对照组)、0.2、0.4、0.8 mg/kg(以Cr3+浓度计算),配制4种饲料。
| 表1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) % |
饲养试验在山东农业大学动物科技学院水产养殖基地的循环水养殖系统中进行,试验期为50 d。每天人工投喂3次(08:00、12:00、17:00),采用饱食投喂的方式。投喂时,投料速度先快后慢,当大部分鱼不再游到水表层觅食时,视为表观饱食状态。水温控制在(27.0±1.0) ℃,pH保持在7.0左右;增氧机24 h供氧(除投饲期间),溶氧在5.0 mg/L以上。
试验结束时,停饲24 h,计数后称量每箱鱼的总重,并统计总采食量,计算终末均重、增重率、特定生长率以及饲料系数;从每箱中随机选取5尾鱼,立即用MS-222(化学名为间氨基苯甲酸乙酯甲磺酸盐)麻醉,保存到-20 ℃冰箱中,用于鱼体营养成分分析;从每箱中再随机选取5尾鱼,麻醉后,用医疗注射器从尾静脉采血至5 mL离心管,血样在4 ℃下静置2 h,然后使用离心机3 000 r/min离心15 min,取上层血清,保存于-20 ℃冰箱中,用于血液生化指标的测定;将采血后的罗非鱼迅速放置在冰盘上,取其肝脏及肌肉组织,投入液氮中,再转移到-80 ℃冰箱中保存,用于糖代谢相关基因表达分析。
所测生长性能指标计算公式如下:
特定生长率(%/d)=100× /t; 增重率(%)=100×(G2-G1)/G1; 饲料系数=(R1-R2)/(G2-G1-G0)。式中:R1、R2分别为投饵量和残饵量;G0、G1和G2分别为死亡鱼体重、初始均重和终末均重;t为试验天数。
饲料和全鱼样品的营养成分的测定方法如下:105 ℃烘干至恒重测定水分含量;凯氏定氮法测定粗蛋白质含量;索氏抽提法测定粗脂肪含量。
采用日立7020型生化分析仪测定血清中总蛋白、总胆固醇、甘油三酯、尿素氮、葡萄糖浓度以及谷丙转氨酶活性。
取保存的肝脏或肌肉组织各50 mg,剪碎后放入盛有1 mL Trizol(Invitrogen Reagent)的离心管中,按照Trizol试剂盒说明书提取总RNA。将提取的总RNA沉淀用焦碳酸二乙酯(DEPC)溶液溶解后,在紫外分光光度计下测定其在的260和280 nm下的吸光度(OD)值,OD260 nm/OD280 nm的值在1.8~2.0之间,说明提取的总RNA质量较好。将提取的总RNA放入-80 ℃冰箱中保存备用。
总RNA用DNase Ⅰ去除基因组DNA后,取1 μg总RNA使用PrimeScriptTM RT Reagent Kit (Perfect Real Time)试剂盒(TaKaRa)反转录为cDNA,cDNA保存于-20 ℃冰箱中备用。
本实验室前期关于尼罗罗非鱼IR和GLUT基因的研究中发现,GLUT基因在罗非鱼不同组织中表达的优势亚型不同,其中GLUT2基因在肝脏中高表达,而GLUT4基因在肌肉中高表达。为检测不同添加水平的酵母铬对尼罗罗非鱼IR和GLUT基因表达的影响,以尼罗罗非鱼β-肌动蛋白(β-actin)为看家基因,利用qRT-PCR分别检测肝脏中IR和GLUT2以及肌肉中IR和GLUT4基因的表达量。查询NCBI上GenBank数据库中已报道的尼罗罗非鱼GLUT2(GenBank登录号:XM003442884)和β-actin(GenBank登录号:AB037865)的cDNA序列,以及由本实验室克隆出来的尼罗罗非鱼IR(GenBank登录号:JN967750)和GLUT4(GenBank登录号:JN900493)的cDNA序列设计引物,引物由上海生物工程有限公司负责合成,引物序列如表2所示。
| 表2 qRT-PCR的引物序列 Table 2 Primer sequences for qRT-PCR |
qRT-PCR采用SYBR Green染色法,选用SYBR PrimeScriptTM RT-PCR Kit试剂盒(TaKaRa)在ABI 7500 Real-time System(Bio-Rad)系统下进行。PCR反应体系为:SYBR Premix Ex TaqTM(2×)10.0 μL,PCR 上游引物 (10 μmol/L) 0.4 μL,PCR 下游引物 (10 μmol/L) 0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,DNA模板(cDNA)2.0 μL,dH2O 6.8 μL。反应程序为:95 ℃预变性10 s,40个PCR循环(95 ℃ 5 s,60 ℃ 34 s),收集荧光信号。每个样品重复3次,目的基因的相对表达量以2-△△Ct法进行分析[23]。
试验数据采用SPSS 13.0软件的单因素方差分析(one-way ANOVA)和Duncan氏法多重比较进行统计分析,显著性水平为P<0.05,结果用平均值±标准差表示。
由表3可知,饲料中添加不同水平的酵母铬对尼罗罗非鱼的终末均重、增重率、特定生长率及饲料系数均无显著影响(P>0.05),但0.2和0.4 mg/kg组鱼体的增重率比对照组分别提高了5.4%和6.6%。
由表4可知,饲料中添加不同水平的酵母铬对尼罗罗非鱼的血清总蛋白、总胆固醇、甘油三酯、尿素氮、葡萄糖浓度以及谷丙转氨酶活性均无显著影响(P>0.05),但血糖(血清葡萄糖)浓度随酵母铬添加水平的升高(由0.2 mg/kg 升高到0.8 mg/kg)而下降。
| 表3 酵母铬对尼罗罗非鱼生长性能的影响 Table 3 Effects of chromium yeast on growth performance of Nile tilapia |
| 表4 酵母铬对尼罗罗非鱼血液生化指标的影响 Table 4 Effects of chromium yeast on blood biochemical indices of Nile tilapia |
由表5可知,尼罗罗非鱼鱼体的水分、粗蛋白质以及粗脂肪含量在各组间均无显著差异(P>0.05),但各酵母铬添加组罗非鱼鱼体的粗脂肪含量均比对照组低,而且粗脂肪的含量随着酵母铬添加水平的升高(由0.2 mg/kg 升高到0.8 mg/kg)呈上升趋势。
| 表5 酵母铬对尼罗罗非鱼鱼体营养组成的影响 Table 5 Effects of chromium yeast on body nutrient composition of Nile tilapia % |
由图1可以看出,酵母铬添加水平对尼罗罗非鱼肝脏和肌肉中IR基因的表达量影响不显著(P>0.05),对尼罗罗非鱼肌肉中GLUT4基因的表达量影响也不显著(P>0.05),但对肝脏中GLUT2基因的表达量有显著影响(P<0.05),其中0.8 mg/kg组肝脏中GLUT2基因的表达量显著高于对照组和0.2 mg/kg组(P<0.05)。
铬是动物机体代谢所必需的微量元素,参与机体血糖的调节以及营养物质的代谢。鉴于铬对糖代谢的作用和鱼类的“葡萄糖不耐受”体质,大量研究者将铬应用于鱼类饲料中,以提高鱼类对碳水化合物的利用。潘庆等[24]发现,在奥尼罗非鱼(Oreochromis niloticus×O. aureus)的饲料中分别添加2 mg/kg烟酸铬和吡啶羧酸铬,其特定生长率显著高于对照组,这一结果与刘太亮等[25]在草鱼饲料中添加不同水平(0.2、0.4、0.8、1.6和3.2 mg/kg)的吡啶铬所得到的结果一致。然而,也有试验证实有机铬并不能影响鱼类的生长表现。Pan等[20]给奥尼罗非鱼饲喂含2 mg/kg吡啶铬的饲料,其生长表现和饲料系数并没有显著性的提高;另外,在金头鲷(Sparus aurata L.)[18]、彩虹鳟(Oncorhynchus mykiss)[21]和斑点叉尾 (Ictalurus punctatus)[26]的饲料中添加有机铬,也并没有提高鱼体的生长。在本试验中,添加酵母铬虽没有显著提高罗非鱼的生长性能,但0.2和0.4 mg/kg组鱼体的增重率比对照组分别提高了5.4%和6.6%,这说明酵母铬具有潜在改善鱼体生长的能力。
从血液生化指标的结果可以看出,虽然酵母铬没有显著影响血清总蛋白、总胆固醇、甘油三酯等指标的浓度,但血糖浓度随饲料中酵母铬添加水平的升高呈现下降趋势。蒋伟明等[27]也发现,在奥尼罗非鱼饲料中添加0.75、1.50、2.25、3.00 mg/kg的烟酸铬,在摄食后的不同时间点试验组血糖浓度显著低于对照组;另外,鱼体营养组成分析结果显示各组间鱼体营养组成的差异虽没达到显著水平,但各酵母铬添加组尼罗罗非鱼鱼体的粗脂肪含量均比对照组低,这与Liu等[28]在草鱼中得出的添加不同水平(0.2、0.4、0.8、1.6和3.2 mg/kg)的吡啶铬可以显著影响鱼体粗脂肪含量的结果基本一致。上述结果表明酵母铬具有降低血糖浓度以及鱼体粗脂肪含量的趋势。
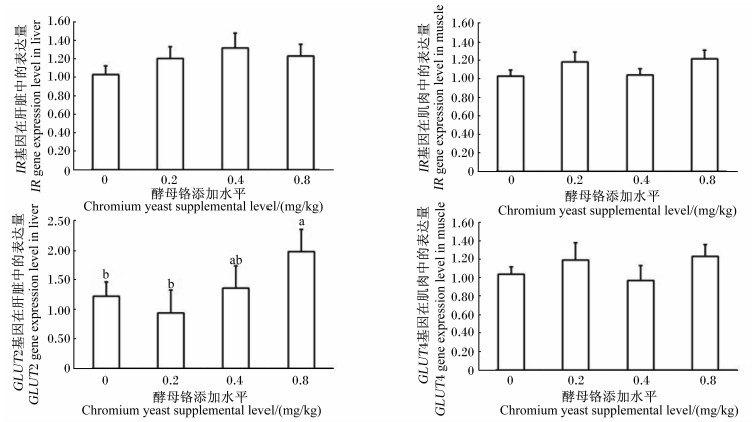 | 图1 酵母铬对尼罗罗非鱼肝脏、肌肉中IR和GLUT基因表达量的影响
Fig.1 Effects of chromium yeast on expression levels of IR and GLUT genes in liver and muscle of Nile tilapia |
当血液中的葡萄糖浓度升高时,胰岛分泌胰岛素作用于肝脏和肌肉组织,肝细胞和肌肉细胞膜表面的IR接受信号,并经过胞内一系列的信号传递过程,最后将信号作用于胞浆中的GLUT,接受信号的GLUT由胞浆转移到细胞膜上,将血液中的葡萄糖转入胞浆合成糖原,贮存于组织中,降低血液中葡萄糖的浓度[29, 30]。体外分子试验表明,铬可以影响糖代谢相关基因的表达。Qiao等[31]发现,铬通过作用于胰岛素信号通路,增加IR和GLUT基因的表达,促使胰岛素最大程度地发挥糖代谢的功能。为了进一步研究铬在鱼体内的作用机制,本试验利用qRT-PCR技术,定量分析了IR和GLUT基因在肝脏和肌肉中的表达,这也是初次在分子水平探究铬在鱼体内的作用机制。基因表达的结果显示,酵母铬没有显著影响肝脏和肌肉中IR以及肌肉中GLUT4基因的表达,但0.8 mg/kg组肝脏中GLUT2基因的表达量显著高于对照组和0.2 mg/kg组,说明高水平酵母铬促进了肝脏中GLUT2基因的表达,这一结果与Qiao等[31]在体外细胞试验中得到的结果一致。当血糖浓度过高时,肝细胞膜上的GLUT2起作用,快速摄取过多的葡萄糖进入肝细胞,通过肝糖原合成来降低血糖浓度[32]。本试验中血糖浓度随着酵母铬添加水平的升高而下降的趋势,也提示酵母铬具有潜在降低血糖的能力。
酵母铬具有上调尼罗罗非鱼肝脏中GLUT2基因表达的潜在能力。
| [1] | SCHWARZ K,MERTZ W.Aglucose tolerance factor and its differentiation from factor 3[J]. Archives of Biochemistry and Biophysics,1957,72(2):515-518. ( 1) 1)
|
| [2] | SCHWARZ K,MERTZ W.Chromium (Ⅲ) and the glucose tolerance factor[J]. Archives of Biochemistry and Biophysics,1959,85:292-295. ( 1) 1)
|
| [3] | EVANS G W,BOWMAN T D.Chromium picolinate increases membrane fluidity and rate of insulin internalization[J]. Journal of Inorganic Biochemistry,1992,46(4):243-250. ( 1) 1)
|
| [4] | MERTZ W,TOEPFER E W,ROGINSKI E E.Present knowledge of the role of chromium[J]. Federation Proceedings,1974,33(11):2275-2280. ( 1) 1)
|
| [5] | VINCENT J B.The biochemistry of chromium[J]. The Journal of Nutrition,2000,130(4):715-718. ( 1) 1)
|
| [6] | JEEJEEBHOY K N,CHU R C,MARLISS E B,et al.Chromium deficiency,glucose intolerance,and neuropathy reversed by chromium supplementation,in a patient receiving long-term total parenteral nutrition[J]. American Journal of Clinical Nutrition,1977,30(4):531-538. ( 1) 1)
|
| [7] | ANDERSON R A.Chromium and parenteral nutrition[J]. Nutrition,1995,11(Suppl.1):83-86. ( 1) 1)
|
| [8] | YOSHIMOTO S,SAKAMOTO K,WAKABAYASHI I,et al.Effect of chromium administration on glucose tolerance in stroke-prone spontaneously hypertensive rats with streptozotocin-induced diabetes[J]. Metabolism,1992,41(6):636-642. ( 1) 1)
|
| [9] | ANDERSON R A.Chromium,glucose intolerance and diabetes[J]. Journal of the American College of Nutrition,1998,17(6):548-555. ( 1) 1)
|
| [10] | WANG H,KRUZEWSKI A,BRAUTIGAN D L.Cellular chromium enhances activation of insulin receptor kinase[J]. Biochemistry,2005,44(22):8167-8175. ( 1) 1)
|
| [11] | CEFALU W T,WANG Z Q,ZHANG X H,et al.Oral chromium picolinate improves carbohydrate and lipid metabolism and enhances skeletal muscle Glut-4 translocation in obese,hyperinsulinemic (JCR-LA corpulent) rats[J]. The Journal of Nutrition,2002,132(6):1107-1114. ( 1) 1)
|
| [12] | DONG F,KANDADI M R,REN J,et al.Chromium (D-phenylalanine) 3 supplementation alters glucose disposal,insulin signaling,and glucose transporter-4 membrane translocation in insulin-resistant mice[J]. The Journal of Nutrition,2008,138(10):1846-1851. ( 1) 1)
|
| [13] | MOON T W.Glucose intolerance in teleost fish:fact or fiction[J]. Comparative Biochemistry and Physiology-Part B:Biochemistry and Molecular Biology,2001,129(2):243-249. ( 1) 1)
|
| [14] | WILSON R.Utilization of dietary carbohydrate by fish[J]. Aquaculture,1994,124:67-80. ( 1) 1)
|
| [15] | SHIAU S Y,CHEN M J.Carbohydrate utilization by tilapia (Oreochromis niloticus×O.aureus) as influenced by different chromium sources[J]. The Journal of Nutrition,1993,123(10):1747-1753. ( 1) 1)
|
| [16] | SHIAU S Y,LIANG H S.Carbohydrate utilization and digestibility by tilapia,Oreochromis niloticus×O.aureus,are affected by chromic oxide inclusion in the diet[J]. The Journal of Nutrition,1995,125(4):976-982. ( 1) 1)
|
| [17] | SHIAU S Y,HY S M.Dietary chromic oxide inclusion level required to maximize glucose utilization in hybrid tilapia,Oreochromis niloticus×O.aureus[J]. Aquaculture,1998,161:357-364. ( 1) 1)
|
| [18] | GATTA P P,PIVA A,PAOLINI M,et al.Effects of dietary organic chromium on gilthead seabream (Sparus aurata L.) performances and liver microsomal metabolism[J]. Aquaculture Research,2001,32(Suppl.1):60-69. ( 2) 2)
|
| [19] | GATTA P P,THOMPSON K D,SMULLEN R,et al.Dietary organic chromium supplementation and its effect on the immune response of rainbow trout (Oncorhynchus mykiss)[J]. Fish and Shellfish Immunology,2001,11(5):371-382. ( 1) 1)
|
| [20] | PAN Q,LIU S,TAN Y G,et al.The effect of chromium picolinate on growth and carbohydrate utilization in tilapia,Oreochromis niloticus×Oreochromis aureus[J]. Aquaculture,2003,225:421-429. ( 2) 2)
|
| [21] | SELCUK Z,TIRIL S U,ALAGIL F,et al.Effects of dietary L-carnitine and chromium picolinate supplementations on performance and some serum parameters in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture International,2010,18(2):213-221. ( 2) 2)
|
| [22] | MEHRIM A.Effect of dietary chromium picolinate supplementation on growth performance,carcass composition and organs indices of Nile tilapia (Oreochromis niloticus L.) fingerlings[J]. Journal of Fisheries and Aquatic Sciences,2012,7(3):224-232. ( 1) 1)
|
| [23] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods,2001,25(4):402-408. ( 1) 1)
|
| [24] | 潘庆,毕英佐,颜惜玲,等.有机铬对奥尼罗非鱼生长和糖利用的影响[J]. 水生生物学报,2002,26(4):393-399. ( 1) 1)
|
| [25] | 刘太亮,蒋明,文华,等.吡啶羧酸铬对草鱼生长和耐糖量的影响[J]. 华中农业大学学报,2009,28(2):198-201. ( 1) 1)
|
| [26] | NG W K,WILSON R P.Chromic oxide inclusion in the diet does not affect glucose utilization or chromium retention by channel catfish,Ictalurus punctatus[J]. The Journal of Nutrition,1997,127:2357-2362. ( 1) 1)
|
| [27] | 蒋伟明,韩耀全,李大列.不同含量烟酸铬日粮对奥尼罗非鱼的影响[J]. 西南农业学报,2004,17(2):235-239. ( 1) 1)
|
| [28] | LIU T L,WEN H,JIANG M,et al.Effect of dietary chromium picolinate on growth performance and blood parameters in grass carp fingerling,Ctenopharyngodon idellus[J]. Fish Physiology and Biochemistry,2010,36(3):565-572. ( 1) 1)
|
| [29] | LAYCHOCK S.Insulin receptor signaling[C]//Encyclopedia of hormones.Austin:Academic Press,2003:368-380. ( 1) 1)
|
| [30] | SIDDLE K.The insulin receptor and downstream signaling[M]//KUMAR S,O'RAHILLY S.Insulin resistance:insulin action and its disturbances in disease.New Jersey:John Wiley & Sons,2005:61-62. ( 1) 1)
|
| [31] | QIAO W,PENG Z,WANG Z,et al.Chromium improves glucose uptake and metabolism through upregulating the mRNA levels of IR,GLUT4,GS,and UCP3 in skeletal muscle cells[J]. Biological Trace Element Research,2009,131(2):133-142. ( 2) 2)
|
| [32] | HALL J R,SHORT C E,DRIEDZIC W R.Sequence of Atlantic cod (Gadus morhua) GLUT4,GLUT2 and GPDH:developmental stage expression,tissue expression and relationship to starvation-induced changes in blood glucose[J]. Journal of Experimental Biology,2006(209):4490-4502. ( 1) 1)
|




