引用本文

彭程远, 解俊, 金珊, 赵青松, 陈寅儿, 王国良. 鱼诺卡氏菌全肽聚糖对乌鳢非特异性免疫力的影响[J]. 动物营养学报, 2013, 25(9): 2150-2159.

PENG Chengyuan, XIE Jun, JIN Shan, ZHAO Qingsong, CHEN Yin, WANG Guoliang. Effects of Whole Peptidoglycan from
Nocardia seriolae on Non-Specific Immunity of
Channa argus[J]. Chinese Journal of Animal Nutrition, 2013, 25(9): 2150-2159.

鱼诺卡氏菌全肽聚糖对乌鳢非特异性免疫力的影响
彭程远

, 解俊, 金珊


, 赵青松, 陈寅儿, 王国良
收稿日期:2013-03-27
基金项目:浙江省自然科学基金(Y3100511);宁波市自然科学基金(2012A610138);宁波大学学科项目(xk111094)
作者简介:彭程远(1989—),男,广西平南人,硕士研究生,从事水产动物免疫学及病害防控研究。E-mail:806083590@qq.com
通讯作者:金珊,教授,硕士生导师,E-mail:jinshan@nbu.edu.cn
摘要:为了解 鱼诺卡氏菌全肽聚糖(WPG)对鱼类的免疫效应,应用1% 鱼诺卡氏菌WPG溶液对乌鳢进行腹腔注射,在注射后第0、1、2、3、4、5、6、7、8天对乌鳢血液、黏液、肝脏、头肾组织进行取样,测定血细胞吞噬指数(PI)、血清替代途径补体活力(ACH50)以及组织中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)、溶菌酶(LSZ)活力等非特异性免疫相关指标。同法等量注射0.7%灭菌生理盐水作为对照。此外,通过攻毒试验测定 鱼诺卡氏菌WPG对感染 鱼诺卡氏菌乌鳢的免疫保护效应。结果表明:与对照组相比,试验组红细胞和白细胞PI及血清ACH50在注射后第1天就显著或极显著升高(P<0.05或P<0.01),并分别在注射后第2天、第2天和第1天达到峰值,峰值分别为2.45%、3.64%和306.67 unit/mL。试验组血清中LSZ和AKP活力分别从注射后第3天和第4天开始显著或极显著高于对照组(P<0.05或P<0.01),而血清中ACP和SOD活力则在注射后第1~7天均显著或极显著高于对照组(P<0.05或P<0.01)。注射 鱼诺卡氏菌WPG后,黏液、肝脏、头肾中ACP活力均有升高现象,达峰值时间分别为第2天、第4天、第7天;黏液和头肾中AKP活力在各时间点均无显著变化(P>0.05),肝脏中AKP活力仅在第3天、第4天出现显著或极显著升高(P<0.05或P<0.01);肝脏和头肾中SOD活力在各时间点均无显著变化(P>0.05),而黏液中SOD活力在各时间点均显著或极显著升高(P<0.05或P<0.01);黏液和肝脏中LSZ活力在第1天就显著或极显著升高(P<0.05或P<0.01),在第2天均达峰值,而头肾LSZ活力呈现逐渐升高再降低的变化趋势,仅在第5天表现出显著升高(P<0.05)。 鱼诺卡氏菌攻毒试验结果显示, 鱼诺卡氏菌WPG腹腔注射免疫7、21、35 d后对乌鳢的保护率分别为35%、55%、60%。以上结果说明, 鱼诺卡氏菌WPG对乌鳢血细胞PI、血清ACH50及组织中ACP、AKP、SOD、LSZ活力具有明显的调节作用,但调节作用的强弱存在组织差异性; 鱼诺卡氏菌WPG腹腔注射免疫21 d以上对乌鳢诺卡氏菌病有明显的保护作用。
关键词:
鱼诺卡氏菌
全肽聚糖
乌鳢
非特异性免疫力
免疫保护
Effects of Whole Peptidoglycan from Nocardia seriolae on Non-Specific Immunity of Channa argus
PENG Chengyuan

, XIE Jun, JIN Shan


, ZHAO Qingsong, CHEN Yin, WANG Guoliang
School of Marine Sciences, Ningbo University, Ningbo 315211, China
Abstract: In order to research the immune effects of whole peptidoglycan (WPG) from Nocardia seriolae for fish, the non-specific immune indices such as haemocytes phagocytic index (PI), serum alternative complement pathway activity (ACH50), and superoxide dismutase (SOD), acid phosphatase (ACP), alkaline phosphatase (AKP) and lysozyme (LSZ) activities in different tissues of Channa argus were determined by injection with 0.3 mL/tail 0.1% solution of WPG from N. seriolae intraperitoneally. The C. argus injected 0.3 mL/tail 0.7% sterilized saline as a control. The samples, including serum, mucus, liver and head kidney, were taken from fish on day 0, 1, 2, 3, 4, 5, 6, 7 and 8 post-injection. Moreover, the immune protective efficacy of WPG from N. seriolae against N. seriolae in C. argus was measured by the challenge experiment. The results showed as follows: compared with the control group, the erythrocytes PI, leucocytes PI and serum ACH50 in trial group were significantly increased on day 1 (P<0.05 or P<0.01) and then got the peak on day 2, 2 and 1, which were 2.45%, 3.64% and 306.67 unit/mL, respectively. In serum, the AKP and LSZ activities in trial group were significantly increased from day 4 and 3 (P<0.05 or P<0.01), respectively, and the ACP and SOD activities were all significantly increased from day 1 to day 7 compared with the control group (P<0.05 or P<0.01). After injection WPG from N. seriolae, the activity of ACP in mucus, liver and head kidney was all increased and then got the peak on day 2, 4 and 7, respectively; no significant difference was found in the activity of AKP in mucus and head kidney on any time points (P>0.05), and the activity of AKP in liver was significantly increased on day 3 and 4 (P<0.05 or P<0.01); no significant difference was found in the activity of SOD in liver and head kidney on any time points (P>0.05), while the activity of SOD in mucus was significantly increased on any time points (P<0.05 or P<0.01); the activity of LSZ in mucus and liver was significantly increased on day 1 (P<0.05 or P<0.01) and then got the peak on day 2, while the activity of LSZ in head kidney was firstly increased and then decreased and only got a significant increase on day 5 (P<0.05). N. seriolae challenge experiment result showed that protective rate for C. argus after the WPG intraperitoneal injection on day 7, 21 and 35 were 35%, 55% and 60%, respectively. The above results indicate that WPG from N. seriolae has a significantly regulating effect on haemocytes PI, serum ACH50, and tissue ACP, AKP, SOD and LSZ activities of C. argus, but the strength of regulating effect is different in different tissues. There is a significant protective effect for Nocardia infected C. argus with the WPG from N. seriolae intraperitoneal injection more than 21 days.
Key words:
Nocardia seriolae
whole peptidoglycan
Channa argus
non-specific immunity
immune protection
诺卡氏菌(Nocardia)是一种革兰氏阳性丝状杆菌,属于放线菌类微生物,它是水产动物诺卡氏菌病的主要致病菌,可引起五条 (Seriola quinqueradiata)、海鲈(Lateolabrax japonicus) 、大黄鱼(Pseudosciaena crocea) 、乌鳢(Channa argus)等多种养殖鱼类的严重死亡[1]。鱼类诺卡氏菌病由于发生延续流行时间长,从感染至死亡的时间一般需15 d以上,且早期体表无明显症状,因此至今还没有很好的技术手段来预防和治疗该病[2]。
肽聚糖(peptidoglycan,PG)是细菌细胞壁的重要组成部分,是一种强免疫增强剂,主要通过诱导各种免疫调控物质的释放或表达来刺激机体免疫系统发挥免疫功能[3]。全肽聚糖(whole peptidoglycan,WPG)是指未经物理破碎并保持细菌细胞壁骨架“袋形”结构完整性的肽聚糖[4]。研究表明,WPG是一种生物反应调节剂,它在动物体内体外都能激活免疫细胞、活化补体并调节机体的体液免疫和细胞免疫应答,表现出较强的免疫赋活作用,且其免疫活性与其细胞壁物理形态的完整程度呈正相关[5, 6, 7]。
鱼类非特异性免疫机制主要包括细胞防御和体液防御,其细胞防御主要是通过各种血细胞的吞噬作用来实现的,而体液防御因子分布于血清、黏液及组织细胞中,主要有溶菌酶等多种酶、补体、干扰素、凝集素等,它们能非特异性地抑制多种微生物的生长[8, 9]。为了明确WPG对鱼类非特异性免疫力的调节作用,本试验根据鱼类的免疫特点[9]和其他学者的研究资料[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标,研究了 鱼诺卡氏菌(Nocardia seriolae)WPG对乌鳢黏液、血清及肝脏、肾脏组织中主要非特异性免疫指标的影响,以期为鱼类诺卡氏菌病免疫防治寻找新的契机,为诺卡氏菌亚单位疫苗的研制及免疫增强剂的开发提供理论依据。
1 材料与方法
1.1 试验材料
鱼诺卡氏菌、酿酒酵母菌(Saccharomyces cerevisiae)由宁波大学海洋学院水产动物病害防控实验室提供, 鱼诺卡氏菌WPG冻干粉由本实验室自制。
1.2 试验动物与饲养管理
试验用乌鳢购自宁波市水产市场,体重300~400 g,共250尾,养于室内大水族箱中,并用遮阳布适当遮盖。根据水质情况每天及时吸出粪便并用事先曝气处理的自来水换水1~2次,每次换水1/3,试验期间连续充氧,每天投喂鱼体重5%的小杂鱼,早晚各1次。
1.3 样品的制备
将100尾乌鳢分为试验组和对照组,每组5个重复,每个重复10尾。试验组每尾腹腔注射0.3 mL质量分数为1%的 鱼诺卡氏菌WPG溶液,对照组同法等量注射0.7%灭菌生理盐水。于腹腔注射后第0、1、2、3、4、5、6、7、8天随机从各重复中取5尾鱼进行样品的采集。首先采集鱼体表黏液,参照陈昌福等[17]的方法进行;然后用注射器尾静脉采血,所采血液分为2份,一份不抗凝,取出后直接放入离心管中4 ℃静置2 h后,4 ℃离心(3 000 r/min)10 min,取上层血清冷藏待测,另一份用无菌肝素钠抗凝,用于血细胞吞噬指数(phagocytic index,PI)的测定;最后无菌操作解剖鱼取肝脏和头肾组织,冷藏待测。
1.4 样品的处理
1.4.1 黏液的处理[18]
将收集有黏液的Eppendorf管于4 ℃下3 000 r/min离心,用移液枪枪头吸掉管底的重力水,称重记录数据,扣除空Eppendorf管管重(取20个管的均值)后得黏液净重,按所得黏液净重加入9倍重量的灭菌生理盐水,冰浴匀浆后于4 ℃离心(10 000 r/min)15 min,取上清液分装,冷藏待测。
1.4.2 组织的处理
分别取肝脏和头肾,经灭菌生理盐水润洗,吸水纸吸去表面水分后称重,取各组织块0.2 g,加入9倍重量的灭菌生理盐水,后续操作同1.4.1。
1.5 血细胞吞噬指数的测定
取0.3 mL抗凝血,等量加入酵母菌悬液(6.0×108 cell/mL),边加边摇,28 ℃放置45 min,每隔10 min左右摇1次,取出后1 500 r/min离心5 min。弃去上清液后取表层细胞制成血涂片,自然干燥后甲醇固定5 min,吉姆萨(Giemsa)染色15~20 min,风干后油镜下随机观察50个参与吞噬的细胞,记录吞噬细胞内酵母菌总数,计算吞噬指数。
血细胞吞噬指数=吞噬细胞内的酵母菌总数/ 参与吞噬的吞噬细胞数。
1.6 血清替代途径补体活力(alternative complement pathway activity,ACH50)的测定
ACH50的测定参照Yano[18]的方法进行。先将保存在阿氏液(Alsever’s solution)中的兔红血细胞用缓冲液EGTA-Mg2+-GVB缓冲液冲洗3遍后,用该缓冲液将其浓度调至2.0×108 cell/mL,再将待测血清也用上述缓冲液稀释20倍备用。取7支离心管,其中1~6号离心管分别加入0、0.050、0.090、0.125、0.150、0.250 mL EGTA-Mg2+-GVB缓冲液,并加入事先稀释好的血清,使每支离心管中总体积为0.250 mL;7号离心管为100%溶血对照管,仅加入3.400 mL蒸馏水。同时向每一离心管中加入0.100 mL浓度为2.0×108 cell/mL的兔红血细胞,20 ℃温育90 min,期间不断摇动,反应结束后立即将所有离心管放入冰浴中终止反应,然后向1~6号离心管中加入3.15 mL的生理盐水。所有离心管在1 600×g下离心5 min,取上清液在414 nm下测定吸光度(OD)值,以未加血清的6号离心管作为空白对照。样品的溶血度由相应的OD值除以100%溶血对照管的OD值求出Y,以Y/(1-Y)为横坐标,以对应的血清体积X(mL)为纵坐标作图,将产生50%溶血时的血清体积记为K。
血清ACH50(unit/mL)=1/
K×血清稀释倍数。
1.7 酶活力及蛋白质含量的测定
血清、黏液、肝脏及头肾组织中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和溶菌酶(LSZ)活力及蛋白质含量的测定均采用南京建成生物工程研究所提供的试剂盒进行。
1.8 鱼诺卡氏菌WPG对乌鳢的攻毒保护试验
将150尾乌鳢分为免疫组和对照组,每组75尾。免疫组每尾腹腔注射0.3 mL质量分数为1%的 鱼诺卡氏菌WPG溶液,对照组同法等量注射0.7%灭菌生理盐水。在免疫后的第7、21、35天,分别从免疫组和对照组各取20尾鱼用浓度约为3.0×108 CFU/mL的 鱼诺卡氏菌菌悬液腹腔注射0.2 mL/尾进行攻毒试验,逐日观察记录乌鳢45 d内的死亡情况并计算免疫保护率。
免疫保护率(%)=(1-免疫组死亡率/ 对照组死亡率)×100。
1.9 数据统计分析
试验结果以平均值±标准差表示,采用SPSS 16.0软件进行统计分析。以t检验进行差异显著性检验:P>0.05,不存在显著差异;P<0.05,存在显著差异;P<0.01,存在极显著差异。
/div>
2 结果与分析
2.1 鱼诺卡氏菌WPG对乌鳢血细胞吞噬指数的影响
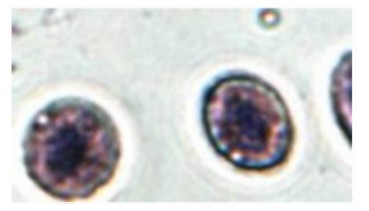
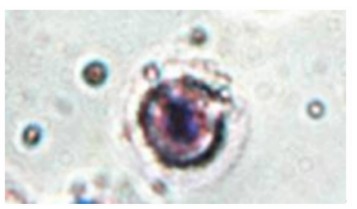
乌鳢红细胞和白细胞都具有吞噬异物的功能,它们对酵母菌的吞噬作用分别见图1和图2。注射 鱼诺卡氏菌WPG后乌鳢血细胞吞噬指数的变化见表1。与对照组相比,试验组乌鳢红细胞和白细胞吞噬指数均在注射后第1天就显著或极显著升高(P<0.05或P<0.01),在第2天达峰值,随后红细胞和白细胞吞噬指数均逐渐下降,在注射后第3天、第4天红细胞吞噬指数仍显著或极显著高于对照组(P<0.05或P<0.01)。
2.2 鱼诺卡氏菌WPG对乌鳢血清ACH50的影响
注射 鱼诺卡氏菌WPG后乌鳢血清ACH50呈先升高后降低的变化趋势(表2)。与对照组相比,试验组乌鳢在注射后第1天其血清ACH50迅速升高并达峰值306.67 unit/mL(P<0.01),之后逐渐下降,但相比对照组,试验组第2天、第3天、第4天仍存在显著差异(P<0.05)。
2.3 鱼诺卡氏菌WPG对乌鳢不同组织中ACP活力的影响
注射 鱼诺卡氏菌WPG后乌鳢血清、黏液、肝脏、头肾4种组织中ACP活力变化见表3。与对照组相比,试验组各组织中ACP活力变化明显,在注射后第1天均出现了极显著升高现象(P<0.01),血清、黏液、肝脏、头肾中ACP活力峰值分别出现在第4天、第2天、第4天、第7天(P<0.01)。
表1
Table 1
表1(Table 1)
 表1 注射 鱼诺卡氏菌WPG后乌鳢血细胞吞噬指数的变化
Table 1 The variation of haemocytes phagocytic index of Channa argus after injection with WPG from Nocardia seriolae (n=5) %
| 时间点 Time points |
红细胞吞噬指数 Phagocytic index of erythrocytes |
|
白细胞吞噬指数 Phagocytic index of leukocytes |
| 试验组 Experimental group |
对照组 Control group |
试验组 Experimental group |
对照组 Control group |
|
第0天 Day 0 | 1.62±0.14 | 1.58±0.15 | | 2.21±0.15 | 2.26±0.13 | |
第1天 Day 1 | 2.09±0.08* * | 1.54±0.06 | | 2.68±0.12* | 2.37±0.34 | |
第2天 Day 2 | 2.45±0.18* * | 1.63±0.10 | | 3.64±0.07* * | 2.35±0.15 | |
第3天 Day 3 | 1.93±0.12* * | 1.65±0.08 | | 2.33±0.29 | 2.25±0.32 | |
第4天 Day 4 | 1.80±0.15* | 1.61±0.02 | | 2.39±0.24 | 2.21±0.20 | |
第5天 Day 5 | 1.71±0.03 | 1.75±0.08 | | 2.24±0.18 | 2.29±0.36 | |
第6天 Day 6 | 1.71±0.05 | 1.57±0.12 | | 2.50±0.21 | 2.43±0.14 | |
第7天 Day 7 | 1.61±0.08 | 1.65±0.15 | | 2.48±0.33 | 2.45±0.06 | |
第8天 Day 8 | 1.68±0.11 | 1.67±0.07 | | 2.67±0.24 | 2.52±0.14 |
|
数据肩标*表示试验组与对照组存在显著差异(P<0.05),* *表示试验组与对照组存在极显著差异(P<0.01)。下表同。
Values with * superscript mean significant difference between experimental group and control group (P<0.05), and with * * superscript mean extremely significant difference between experimental group and control group (P<0.01). The same as below.
|
| 表1 注射 鱼诺卡氏菌WPG后乌鳢血细胞吞噬指数的变化
Table 1 The variation of haemocytes phagocytic index of Channa argus after injection with WPG from Nocardia seriolae (n=5) %
|
表2
Table 2
表2(Table 2)
 表2 注射 鱼诺卡氏菌WPG后乌鳢血清ACH50的变化
Table 2 The variation of serum ACH50 of Channa argus after injection with WPG from Nocardia seriolae (n=5) unit/mL
|
时间点 Time points | 试验组 Experimental group | 对照组 Control group
| |
第0天 Day 0 | 227.16±23.90 | 227.67±12.34 | |
第1天 Day 1 | 306.67±12.58* * | 226.67±14.57 | |
第2天 Day 2 | 281.00±21.52* | 225.00±14.11 | |
第3天 Day 3 | 260.00±8.66* | 221.67±15.53 | |
第4天 Day 4 | 250.33±2.52* | 226.00±9.17 | |
第5天 Day 5 | 241.33±11.72 | 230.00±17.58 | |
第6天 Day 6 | 228.00±16.82 | 227.67±15.53 | |
第7天 Day 7 | 230.33±6.11 | 224.33±20.84 | |
第8天 Day 8 | 221.33±16.65 | 221.67±18.15
|
| 表2 注射 鱼诺卡氏菌WPG后乌鳢血清ACH50的变化
Table 2 The variation of serum ACH50 of Channa argus after injection with WPG from Nocardia seriolae (n=5) unit/mL
|
2.4 鱼诺卡氏菌WPG对乌鳢不同组织中AKP 活力的影响
注射 鱼诺卡氏菌WPG后乌鳢不同组织中AKP活力的变化见表4。与对照组相比,黏液和头肾中AKP活力在所有时间点均无显著变化(P>0.05);血清和肝脏中AKP活力呈现先升高后降低的趋势,峰值分别出现在第6天、第4天(P<0.01)。
2.5 鱼诺卡氏菌WPG对乌鳢不同组织中SOD活力的影响
注射 鱼诺卡氏菌WPG后乌鳢不同组织中SOD活力变化见表5。与对照组相比,肝脏和头肾中SOD活力在各时间点均未出现显著性差异(P>0.05);而血清和黏液中SOD活力变化明显,峰值分别出现在第4天和第2天(P<0.01)。
表3
Table 3
表3(Table 3)
 表3 注射 鱼诺卡氏菌WPG后乌鳢不同组织中ACP活力的变化
Table 3 The variation of ACP activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/dL
| 时间点 Time points |
组别 Groups |
组织 Tissues |
| 血清 Serum |
黏液 Mucus |
肝脏 Liver |
头肾 Head kidney |
|
第0天 | 试验组 Experimental group | 21.79±2.90 | 55.20±5.20 | 398.02±15.53 | 427.42±20.55 | |
Day 0 | 对照组 Control group | 22.10±2.57 | 53.41±5.33 | 399.35±3.20 | 428.50±27.68 | |
第1天 | 试验组 Experimental group | 28.95±1.90* * | 74.87±12.80* * | 517.15±19.05* * | 510.44±8.71* * | |
Day 1 | 对照组 Control group | 20.91±2.69 | 52.24±3.49 | 405.52±10.24 | 431.27±15.51 | |
第2天 | 试验组 Experimental group | 24.69±0.89* | 87.52±4.24* * | 415.56±24.28 | 464.62±28.03* | |
Day 2 | 对照组 Control group | 22.29±2.83 | 51.72±5.36 | 401.67±6.68 | 434.96±20.01 | |
第3天 | 试验组 Experimental group | 26.66±2.23* | 60.14±8.65 | 406.21±10.57 | 514.13±26.94* | |
Day 3 | 对照组 Control group | 22.63±2.40 | 55.58±8.37 | 401.42±14.10 | 446.20±9.38 | |
第4天 | 试验组 Experimental group | 40.92±1.33* * | 57.60±4.48 | 598.76±28.41* * | 474.74±18.50* | |
Day 4 | 对照组 Control group | 21.41±2.30 | 50.12±2.21 | 399.91±16.70 | 422.45±25.24 | |
第5天 | 试验组 Experimental group | 30.63±1.74* * | 58.27±6.02 | 402.31±12.66 | 452.47±11.36 | |
Day 5 | 对照组 Control group | 20.89±1.02 | 50.47±3.29 | 390.23±30.95 | 437.47±10.67 | |
第6天 | 试验组 Experimental group | 32.08±2.31* * | 52.19±5.56 | 443.30±31.52* | 504.53±15.32* * | |
Day 6 | 对照组 Control group | 21.75±1.96 | 49.55±7.40 | 400.89±15.37 | 433.22±19.84 | |
第7天 | 试验组 Experimental group | 31.14±2.39* | 57.03±1.78 | 424.07±15.84 | 541.66±22.56* * | |
Day 7 | 对照组 Control group | 22.09±2.44 | 51.08±5.93 | 401.54±20.52 | 425.73±16.71 | |
第8天 | 试验组 Experimental group | 31.81±2.92* | 58.27±5.12 | 404.76±22.90 | 487.25±33.15* | |
Day 8 | 对照组 Control group | 22.31±3.36 | 51.68±9.01 | 391.00±16.64 | 437.97±3.50
| | 表3 注射 鱼诺卡氏菌WPG后乌鳢不同组织中ACP活力的变化
Table 3 The variation of ACP activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/dL
|
表4
Table 4
表4(Table 4)
 表4 注射 鱼诺卡氏菌WPG后乌鳢不同组织中AKP活力的变化
Table 4 The variation of AKP activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) 金氏单位/dL
| 时间点 Time points |
组别 Groups |
组织 Tissues |
| 血清 Serum |
黏液 Mucus |
肝脏 Liver |
头肾 Head kidney |
|
第0天 | 试验组 Experimental group | 7.10±1.35 | 51.67±2.54 | 205.44±8.67 | 468.36±28.56 | |
Day 0 | 对照组 Control group | 7.00±2.52 | 52.43±1.21 | 203.17±8.25 | 469.64±27.02 | |
第1天 | 试验组 Experimental group | 7.99±1.96 | 50.78±6.92 | 209.63±16.86 | 490.15±26.49 | |
Day 1 | 对照组 Control group | 6.67±1.12 | 48.47±6.68 | 206.05±10.22 | 462.79±20.06 | |
第2天 | 试验组 Experimental group | 8.53±2.12 | 47.84±2.75 | 210.08±29.05 | 468.23±24.95 | |
Day 2 | 对照组 Control group | 7.28±2.81 | 46.31±4.63 | 204.73±19.67 | 462.08±28.81 | |
第3天 | 试验组 Experimental group | 8.10±1.30 | 47.47±8.17 | 241.81±25.80* | 474.54±25.43 | |
Day 3 | 对照组 Control group | 7.72±0.97 | 50.27±11.03 | 202.42±11.42 | 464.97±26.95 | |
第4天 | 试验组 Experimental group | 9.33±0.98* | 56.23±2.80 | 264.13±24.73* * | 471.25±26.01 | |
Day 4 | 对照组 Control group | 7.95±1.82 | 53.68±1.61 | 200.52±21.77 | 474.90±23.72 | |
第5天 | 试验组 Experimental group | 8.12±1.24* | 50.24±3.71 | 203.03±11.85 | 478.49±26.84 | |
Day 5 | 对照组 Control group | 7.56±0.75 | 48.83±3.05 | 200.97±13.69 | 475.43±27.33 | |
第6天 | 试验组 Experimental group | 16.16±1.98* * | 49.22±12.62 | 219.39±21.31 | 469.52±24.65 | |
Day 6 | 对照组 Control group | 8.45±1.19 | 51.27±9.22 | 198.50±23.74 | 469.16±18.27 | |
第7天 | 试验组 Experimental group | 9.60±0.41* | 50.31±3.72 | 205.38±15.26 | 475.21±22.11 | |
Day 7 | 对照组 Control group | 8.15±1.12 | 46.23±11.32 | 191.18±28.60 | 475.08±22.22 | |
第8天 | 试验组 Experimental group | 9.51±0.32 | 48.95±7.88 | 192.43±20.60 | 480.79±7.53 | |
Day 8 | 对照组 Control group | 8.90±1.72 | 50.32±6.66 | 191.27±16.55 | 468.65±26.52
| | 表4 注射 鱼诺卡氏菌WPG后乌鳢不同组织中AKP活力的变化
Table 4 The variation of AKP activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) 金氏单位/dL
|
表5
Table 5
表5(Table 5)
 表5 注射 鱼诺卡氏菌WPG后乌鳢不同组织中SOD活力的变化
Table 5 The variation of SOD activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/mL
| 时间点 Time points |
组别 Groups |
组织 Tissues |
| 血清 Serum |
黏液 Mucus |
肝脏 Liver |
头肾 Head kidney |
|
第0天 | 试验组 Experimental group | 108.82±17.65 | 20.18±3.48 | 13.26±1.52 | 6.42±1.45 | |
Day 0 | 对照组 Control group | 107.96±17.66 | 20.76±1.20 | 13.56±1.64 | 6.38±0.80 | |
第1天 | 试验组 Experimental group | 136.53±14.45* | 23.33±2.79* | 14.81±1.90 | 7.39±1.29 | |
Day 1 | 对照组 Control group | 103.00±10.62 | 20.17±2.03 | 14.13±1.42 | 7.15±1.00 | |
第2天 | 试验组 Experimental group | 152.35±6.37* * | 28.91±1.28* * | 13.93±1.23 | 7.54±1.50 | |
Day 2 | 对照组 Control group | 110.29±2.68 | 20.61±2.55 | 12.75±1.82 | 7.22±1.51 | |
第3天 | 试验组 Experimental group | 144.92±16.35* * | 26.17±0.86* * | 13.06±2.39 | 7.46±1.17 | |
Day 3 | 对照组 Control group | 105.00±13.53 | 19.44±1.01 | 13.05±0.15 | 7.01±1.82 | |
第4天 | 试验组 Experimental group | 184.00±24.20* * | 26.87±0.54* * | 14.40±1.87 | 6.77±0.86 | |
Day 4 | 对照组 Control group | 105.42±24.05 | 18.76±2.56 | 12.24±1.26 | 6.52±1.26 | |
第5天 | 试验组 Experimental group | 139.44±5.96* * | 27.95±3.01* * | 13.56±1.38 | 6.89±0.77 | |
Day 5 | 对照组 Control group | 108.91±14.68 | 20.60±3.22 | 12.31±2.35 | 7.07±1.80 | |
第6天 | 试验组 Experimental group | 135.51±7.25* | 22.99±1.01* | 14.12±1.16 | 6.74±1.91 | |
Day 6 | 对照组 Control group | 117.65±21.77 | 18.24±2.02 | 14.45±0.39 | 6.20±0.69 | |
第7天 | 试验组 Experimental group | 140.17±16.23* * | 23.25±3.23* | 13.37±3.53 | 6.91±1.38 | |
Day 7 | 对照组 Control group | 100.53±14.19 | 20.42±2.66 | 13.15±2.58 | 6.91±0.42 | |
第8天 | 试验组 Experimental group | 120.95±3.27 | 26.37±0.69* * | 14.09±2.90 | 6.66±1.56 | |
Day 8 | 对照组 Control group | 106.13±15.11 | 20.26±3.25 | 13.79±2.98 | 6.61±1.07
| | 表5 注射 鱼诺卡氏菌WPG后乌鳢不同组织中SOD活力的变化
Table 5 The variation of SOD activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/mL
|
2.6 鱼诺卡氏菌WPG对乌鳢不同组织中LSZ活力的影响
注射 鱼诺卡氏菌WPG后乌鳢不同组织中LSZ活力的变化见表6。与对照组相比,黏液和肝脏中LSZ活力在注射后第1天就出现了显著或极显著升高(P<0.05或P<0.01),第2天均达峰值(P<0.01);血清中LSZ活力在注射后第3天才开始显著升高(P<0.05),峰值出现在第4天(P<0.01);而头肾中LSZ活力则呈现逐渐升高再降低的变化趋势,峰值出现在第5天(P>0.05)。
2.7 鱼诺卡氏菌WPG对乌鳢的免疫保护效应
经 鱼诺卡氏菌WPG免疫后,乌鳢无明显不良反应,成活率为98.3%。用 鱼诺卡氏菌攻毒后,对照组第1周就有少量鱼死亡,死亡主要集中在第2周,攻毒后20 d内死亡率为100%。免疫组在第2周开始发生死亡现象,主要集中在第3周以后。攻毒后45 d内免疫组和对照组死亡率和保护率见表7,由表中数据可知 鱼诺卡氏菌WPG腹腔注射免疫21 d以上对乌鳢诺卡氏菌病有明显的保护作用,保护率在50%以上。
3 讨 论
鱼类属于低等脊椎动物,其非特异性体液免疫因子和吞噬细胞在机体的免疫防御过程中起着主导的作用[8]。有研究表明,鱼类除了白细胞外,其红细胞也具有吞噬功能[19, 20, 21],这在本试验中也得到了证实(图1)。王旭东等[21]认为这主要是因为红细胞和白细胞都来源于造血干细胞,即使后来由于细胞的分化使白细胞获得了各种免疫防御机能,而红细胞则成为携带氧和调节体液酸碱和离子平衡者,但红细胞仍保持了对异物的黏附和吞噬的免疫功能,这可能与它们细胞膜中含有糖基磷脂酰肌醇有关,且红细胞的黏附和吞噬功能在低等动物中更加明显。本试验结果显示, 鱼诺卡氏菌WPG可以较快地刺激乌鳢红细胞和白细胞的吞噬能力,且对红细胞吞噬能力的促进更大,这与温安祥等[22]的研究结果类似。
鱼类补体直接参与机体防御,其生物学活性影响机体抵抗微生物的能力、免疫反应细胞间的通讯联系、免疫复合物的形成和持续时间等,而ACH50是衡量鱼类非特异性免疫力的一项重要指标[23]。本试验结果显示,注射 鱼诺卡氏菌WPG后第1天乌鳢的血清ACH50就极显著升高,在注射后的4 d内均显著高于对照组,这与张璐等[10]、张春晓等[11]、周进等[24]的研究结果基本一致,说明 鱼诺卡氏菌WPG具有激活鱼类补体系统的作用。
表6
Table 6
表6(Table 6)
 表6 注射 鱼诺卡氏菌WPG后乌鳢不同组织中LSZ活力的变化
Table 6 The variation of LSZ activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/mL
| 时间点 Time points |
组别 Groups |
组织 Tissues |
| 血清 Serum |
黏液 Mucus |
肝脏 Liver |
头肾 Head kidney |
|
第0天 | 试验组 Experimental group | 968.67±69.96 | 21.76±2.97 | 53.25±4.41 | 199.44±11.84 | |
Day 0 | 对照组 Control group | 984.13±123.17 | 21.94±2.56 | 52.38±4.53 | 200.50±20.34 | |
第1天 | 试验组 Experimental group | 975.30±112.10 | 40.54±2.18* * | 68.83±10.26* | 201.21±22.51 | |
Day 1 | 对照组 Control group | 912.53±41.05 | 22.35±4.12 | 54.84±5.48 | 199.24±7.30 | |
第2天 | 试验组 Experimental group | 1 059.46±162.88 | 51.56±3.71* * | 87.66±9.60* * | 210.19±7.25 | |
Day 2 | 对照组 Control group | 975.86±80.67 | 21.54±3.43 | 54.57±6.67 | 199.16±33.83 | |
第3天 | 试验组 Experimental group | 1 144.79±49.84* | 28.73±5.06* | 57.26±7.11* | 216.56±5.11 | |
Day 3 | 对照组 Control group | 951.04±92.72 | 19.91±6.03 | 52.30±9.11 | 197.45±7.20 | |
第4天 | 试验组 Experimental group | 1 702.64±101.85* * | 20.98±1.57 | 79.61±6.81* * | 220.54±11.88 | |
Day 4 | 对照组 Control group | 965.86±106.55 | 21.31±3.65 | 50.83±8.39 | 203.04±18.16 | |
第5天 | 试验组 Experimental group | 1 606.08±57.79* * | 20.06±2.04 | 62.23±2.20 | 225.93±17.03* | |
Day 5 | 对照组 Control group | 952.39±69.08 | 22.67±4.14 | 51.29±9.86 | 201.17±15.53 | |
第6天 | 试验组 Experimental group | 1 293.10±133.45* * | 22.55±4.31 | 64.76±7.79 | 218.78±18.32 | |
Day 6 | 对照组 Control group | 971.09±80.31 | 20.73±2.78 | 49.26±5.45 | 202.81±23.87 | |
第7天 | 试验组 Experimental group | 1 554.32±55.47* * | 21.49±4.80 | 64.38±6.11 | 211.48±16.88 | |
Day 7 | 对照组 Control group | 963.30±117.70 | 21.14±3.06 | 53.31±6.13 | 202.56±17.97 | |
第8天 | 试验组 Experimental group | 1 207.40±35.32* * | 24.08±4.21 | 66.95±5.11 | 199.20±7.41 | |
Day 8 | 对照组 Control group | 956.04±121.68 | 22.23±1.89 | 54.46±12.37 | 198.40±6.77
| | 表6 注射 鱼诺卡氏菌WPG后乌鳢不同组织中LSZ活力的变化
Table 6 The variation of LSZ activity in different tissues of Channa argu after injection with WPG from Nocardia seriolae (n=5) U/mL
|
表7
Table 7
表7(Table 7)
 表7 鱼诺卡氏菌WPG对乌鳢的免疫保护效应
Table 7 Immune protective efficacy of WPG from Nocardia seriolae on Channa argu
|
免疫时间 Immune time/d | 组别 Groups | 试验鱼尾数 Experimental fish No./尾 | 死亡鱼尾数 Dead fish No./尾 | 死亡率Mortality/% | 保护率 Protective rate/%
| |
7 | 免疫组 Immune group | 20 | 13 | 65 | 35 | |
0 | 对照组 Control group | 20 | 20 | 100 | | |
21 | 免疫组 Immune group | 20 | 9 | 45 | 55 | |
0 | 对照组 Control group | 20 | 20 | 100 | | |
35 | 免疫组 Immune group | 20 | 8 | 40 | 60 | |
0 | 对照组 Control group | 20 | 20 | 100 |
|
| 表7 鱼诺卡氏菌WPG对乌鳢的免疫保护效应
Table 7 Immune protective efficacy of WPG from Nocardia seriolae on Channa argu
|
ACP主要存在于肝脏、肾脏、血液、骨骼等组织中,是溶酶体的标志酶;AKP主要存在于骨骼、肝脏和血液中,可催化有机磷酸酯水解,通过改变细菌表面结构增强其异己性,从而被免疫细胞识别达到免疫防御的作用[12, 25],它们都是动物体内参与免疫防御的重要水解酶,可作为衡量动物体非特异性免疫力的指标[9]。本试验结果表明,对照组乌鳢ACP活力肝脏>肾脏>黏液,AKP活力肾脏>肝脏>黏液,这与周进等[13]的研究结果相似;而 鱼诺卡氏菌WPG能显著提高乌鳢血清、头肾、肝脏、黏液中ACP活力及血清、肝脏中AKP活力,但对头肾和黏液中AKP活力没有显著影响,作者认为这可能与ACP和AKP的功能及它们与不同组织的亲和性等有关。关于表3中部分组织ACP活力出现多峰的现象,作者推测一方面 鱼诺卡氏菌WPG作为已知的病原模式分子进入鱼体后可以激活肽聚糖结合蛋白等模式识别受体,从而引起多种免疫应答反应,包括ACP的产生和激活[26];另一方面ACP是溶酶体中的主要水解酶,而溶酶体具有防御和消化的双重功能, 鱼诺卡氏菌WPG作为机体的异物,在它完成免疫调节作用后必须被消化清除,因而造成了ACP活力的又一次增强;此外,由于鱼类是变温动物,外界环境因素及试验操作都有可能影响其组织中酶的活力,但这些均还需要进一步的试验证实。
SOD主要是清除动物体液或组织中的超氧基,在防御细胞组织超氧阴离子(O-2)毒性、生物分子损伤方面起着十分重要的作用[14]。周进等[16]研究表明,牙鲆组织中SOD活力黏液>肝脏>肾脏,投喂肽聚糖后对肝脏、肾脏、血清中SOD活力没有显著影响,而不同的投喂方式对黏液中SOD活力有显著影响;宋晓玲等[15]的研究发现,肽聚糖能适当提高日本对虾血清中SOD活力,但影响不显著。本研究结果显示,乌鳢在注射 鱼诺卡氏菌WPG后肝脏和头肾中SOD活力无显著变化,而血清和黏液中SOD活力均有所升高,作者认为这与SOD的功能有关,因为黏液是机体免疫保护的第1道屏障,而血液可以进入机体的各个组织和器官,因此血清和黏液中SOD活力的升高说明 鱼诺卡氏菌WPG可以促进机体对有毒物质清除的加强,提高机体免疫力[16]。
LSZ由单核细胞、巨噬细胞和嗜中性粒细胞等产生,主要存在于动物的分泌液和血清中,在机体抵抗病原微生物的防御中起着重要作用[27]。本研究结果表明,乌鳢LSZ活力血清>头肾>肝脏>黏液,而注射 鱼诺卡氏菌WPG后乌鳢各组织中LSZ活力都发生了明显的变化,尤其是黏液、血清和肝脏,其LSZ活力在一定时间内升高极显著,但变化趋势不尽相同,这与张璐等[10]、张春晓等[11]和宋晓玲等[15]的研究结果基本相同。Di Luzio[28]认为免疫多糖可以促进单核细胞或巨噬细胞的增生,激活它们分泌LSZ。由于本试验是采用腹腔注射免疫的方法,因此作者推测当注射 鱼诺卡氏菌WPG后乌鳢血液和肝脏组织中的巨噬细胞等首先被激活并进行增生和分泌LSZ,黏液中LSZ主要是鱼体应激分泌产生,而 鱼诺卡氏菌WPG对头肾的作用相对稍晚,短时间内主要是促进免疫细胞的增生和分化,因此头肾中LSZ活力上调没有黏液、血清和肝脏等组织明显。
鱼诺卡氏菌攻毒试验显示, 鱼诺卡氏菌WPG注射免疫在短时间内对 鱼诺卡氏菌就有一定的保护作用,但在免疫21 d以上才能对乌鳢诺卡氏菌病有明显的保护效应。由于鱼类养殖的特殊性,关于 鱼诺卡氏菌WPG的使用方式和应用剂量还有待于进一步的探索。
4 结 论
① 鱼诺卡氏菌WPG对乌鳢血细胞吞噬指数、血清ACH50以及血清中ACP、AKP、SOD、LSZ活力均具有明显的调节作用,但对不同指标调节作用的快慢、强弱及持续时间存在组织差异性。
② 鱼诺卡氏菌WPG对乌鳢黏液、肝脏和头肾3种组织中ACP、LSZ及肝脏中AKP和黏液中SOD活力具有明显的调节作用,但对黏液和头肾中AKP及肝脏和头肾中SOD活力没有明显的调节作用。
③ 鱼诺卡氏菌WPG腹腔注射免疫21 d以上对乌鳢诺卡氏菌病有明显的保护作用。
参考文献
|
[1] | 袁思平,王国良,金珊.养殖鱼类致病诺卡氏菌研究进展[J]. 微生物学通报,2006,33(2):137-141. ( 1) 1)
|
|
[2] | 徐益军.养殖乌鳢诺卡氏菌病的病原与致病机理[D]. 硕士学位论文.宁波:宁波大学,2008:12-29. ( 1) 1)
|
|
[3] | 王静华,赵洪涛,汪以真.细菌细胞壁肽聚糖的研究进展[J]. 中国兽药杂志,2004,38(1):38-40. ( 1) 1)
|
|
[4] | SEKINE K,TOIDA T,SAITO M,et al.A new morphologically characterized cell wall preparation (whole peptidoglycan) from Bifidobacterium infantis with a higher efficacy on the regression of an established tumor in mice[J]. Cancer Research,1985,45:1300-1307. ( 1) 1)
|
|
[5] | 丁喜顺.长双歧杆菌细胞壁完整肽聚糖分离及其免疫、抑瘤活性的研究[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2009:7-38. ( 1) 1)
|
|
[6] | SEKINE K,OHTA J,PNISHI M,et al.Analysis of antitumor properties of effector cells stimulated with a cell wall preparation (WPG) of Bifidobacterium infantis[J]. Biological & Pharmaceutical Bulletin,1995,18:148-153. ( 1) 1)
|
|
[7] | PICARD C,FIORAMONTI J,FRANCOIS A,et al. Review article:bifidobacteria as probiotic agents-physiological effects and clinical benefits[J]. Alimentary Pharmacology Therapeutics,2005,22(3):495-512. ( 1) 1)
|
|
[8] | TANG M, MA G Z,XU J.Advances in research of fish immunology[J]. Journal of Immunology,2002,18(3):112-116. ( 2) 2)
|
|
[9] | 肖克宇,邓时铭,向建国,等.水产动物免疫与应用[M]. 北京:科学出版社,2007:16-30. ( 3) 3)
|
|
[10] | 张璐,艾庆辉,麦康森,等.肽聚糖对鲈鱼生长和非特异性免疫力的影响[J]. 中国海洋大学学报,2008,38(4):551-556. ( 3) 3)
|
|
[11] | 张春晓,麦康森,艾庆辉,等.饲料中添加肽聚糖对大黄鱼生长和非特异性免疫力的影响[J]. 水产学报,2008,32(3):411-416. ( 3) 3)
|
|
[12] | 刘树青,江晓路,牟海津,等.免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J]. 海洋与湖沼,1999,30(3):278-283. ( 2) 2)
|
|
[13] | 周进,宋晓玲,陈国福,等.A3α-肽聚糖不同投喂方式下牙鲆及组织中相关酶的变化[J]. 饲料工业,2006,27(2):5-9. ( 2) 2)
|
|
[14] | 李敬玺,刘继兰,王选年,等.超氧化物歧化酶研究和应用进展[J]. 动物医学进展,2007,28(7):70-75. ( 2) 2)
|
|
[15] | 宋晓玲,杨旭彤,偲瀚文,等.双歧杆菌细胞壁肽聚糖的分离及其对二种海产动物免疫活性的影响[J]. 水产学报,2005,29(3):350-355. ( 3) 3)
|
|
[16] | 周进,宋晓玲,黄倢,等.A3α-肽聚糖对牙鲆不同组织中超氧化物歧化酶及磷酸酶活性的影响[J]. 中国水产科学,2004,11(4):296-301. ( 3) 3)
|
|
[17] | 陈昌福,罗宇良,蔡冰,等.实验水温对草鱼溶菌酶活性的影响[J]. 中国水产科学,1996,3(3):24-30. ( 1) 1)
|
|
[18] | YANO T.Assays of hemolytic complement activity[J]. Techniques in Fish Immunology,1992,43:131-141. ( 2) 2)
|
|
[19] | 蔡完其,轩兴荣.红鲤4群体间红细胞免疫功能及差异[J]. 中国水产科学,2003,10(2):133-136. ( 1) 1)
|
|
[20] | 周贤君,代应贵,王开功,等.低等脊椎动物血细胞研究概况[J]. 水利渔业,2008,28(2):9-12. ( 1) 1)
|
|
[21] | 王旭东,饶家荣.红细胞广泛吞噬作用的发现和研究[J]. 水产学报,1996,20(1):72-75. ( 2) 2)
|
|
[22] | 温安祥,张辽.β-(1,3)-葡聚糖对齐口裂腹鱼非特异性免疫功能的影响[J]. 四川农业大学学报,2010,28(3):361-365. ( 1) 1)
|
|
[23] | 王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J]. 水生生物学报,2008,32(5):760-769. ( 1) 1)
|
|
[24] | 周进,宋晓玲,黄倢,等.牙鲆口服A3α-肽聚糖最佳投喂方案的选择[J]. 海洋水产研究,2005,26(4):19-25. ( 1) 1)
|
|
[25] | 朱忠勇.实用医学检验学[M]. 北京:人民军医出版社,1997. ( 1) 1)
|
|
[26] | 赵蕾,张克英,丁雪梅.肽聚糖在非特异性免疫中的信号作用[J]. 饲料工业,2008,29(2):45-47. ( 1) 1)
|
|
[27] | ENGSTAD R E,ROBRTESEN B,FRIVOLD E.Yeast glucan induces increase in activity of lysozyme and complement-mediated haemolytic activity in Atlantic salmon blood[J]. Fish & Shellfish Immunology,1992(2):287-297. ( 1) 1)
|
|
[28] | DI LUZIO N R.Lysozyme,glucan-antivated macrophages and neoplasia[J]. Journal of the Reticuloendothelial Society,1979,26:67-81. ( 1) 1)
|
1
本文献在全文中的定位:
... 可引起五条 (
Seriola quinqueradiata)、海鲈(
Lateolabrax japonicus) 、大黄鱼(
Pseudosciaena crocea) 、乌鳢(
Channa argus)等多种养殖鱼类的严重死亡
[1] ...
1
本文献在全文中的定位:
... 因此至今还没有很好的技术手段来预防和治疗该病
[2] ...
1
本文献在全文中的定位:
... 主要通过诱导各种免疫调控物质的释放或表达来刺激机体免疫系统发挥免疫功能
[3] ...
1
本文献在全文中的定位:
... 全肽聚糖(whole peptidoglycan,WPG)是指未经物理破碎并保持细菌细胞壁骨架“袋形”结构完整性的肽聚糖
[4] ...
1
本文献在全文中的定位:
... 且其免疫活性与其细胞壁物理形态的完整程度呈正相关
[5, 6, 7] ...
1
本文献在全文中的定位:
... 且其免疫活性与其细胞壁物理形态的完整程度呈正相关
[5, 6, 7] ...
1
本文献在全文中的定位:
... 且其免疫活性与其细胞壁物理形态的完整程度呈正相关
[5, 6, 7] ...
2
本文献在全文中的定位:
... 它们能非特异性地抑制多种微生物的生长
[8, 9] ...
... 其非特异性体液免疫因子和吞噬细胞在机体的免疫防御过程中起着主导的作用
[8] ...
3
本文献在全文中的定位:
... 它们能非特异性地抑制多种微生物的生长
[8, 9] ...
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 可作为衡量动物体非特异性免疫力的指标
[9] ...
3
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 这与张璐等
[10]、张春晓等
[11]、周进等
[24]的研究结果基本一致 ...
... 这与张璐等
[10]、张春晓等
[11]和宋晓玲等
[15]的研究结果基本相同 ...
3
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 这与张璐等
[10]、张春晓等
[11]、周进等
[24]的研究结果基本一致 ...
... 这与张璐等
[10]、张春晓等
[11]和宋晓玲等
[15]的研究结果基本相同 ...
2
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 从而被免疫细胞识别达到免疫防御的作用
[12, 25] ...
2
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 这与周进等
[13]的研究结果相似;而 鱼诺卡氏菌WPG能显著提高乌鳢血清、头肾、肝脏、黏液中ACP活力及血清、肝脏中AKP活力 ...
2
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 在防御细胞组织超氧阴离子(O
-2)毒性、生物分子损伤方面起着十分重要的作用
[14] ...
3
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
... 而不同的投喂方式对黏液中SOD活力有显著影响;宋晓玲等
[15]的研究发现 ...
... 这与张璐等
[10]、张春晓等
[11]和宋晓玲等
[15]的研究结果基本相同 ...
3
本文献在全文中的定位:
... 本试验根据鱼类的免疫特点
[9]和其他学者的研究资料
[10, 11, 12, 13, 14, 15, 16]筛选出了与鱼类非特异性免疫相关的检测指标 ...
1
本文献在全文中的定位:
... 参照陈昌福等
[17]的方法进行;然后用注射器尾静脉采血 ...
2
本文献在全文中的定位:
... ACH50的测定参照Yano
[18]的方法进行 ...
1
本文献在全文中的定位:
... 其红细胞也具有吞噬功能
[19, 20, 21] ...
1
本文献在全文中的定位:
... 其红细胞也具有吞噬功能
[19, 20, 21] ...
2
本文献在全文中的定位:
... 其红细胞也具有吞噬功能
[19, 20, 21] ...
... 王旭东等
[21]认为这主要是因为红细胞和白细胞都来源于造血干细胞 ...
1
本文献在全文中的定位:
... 这与温安祥等
[22]的研究结果类似 ...
1
本文献在全文中的定位:
... 而ACH50是衡量鱼类非特异性免疫力的一项重要指标
[23] ...
1
本文献在全文中的定位:
... 这与张璐等
[10]、张春晓等
[11]、周进等
[24]的研究结果基本一致 ...
1
本文献在全文中的定位:
... 从而被免疫细胞识别达到免疫防御的作用
[12, 25] ...
1
本文献在全文中的定位:
... 包括ACP的产生和激活
[26];另一方面ACP是溶酶体中的主要水解酶 ...
1
本文献在全文中的定位:
... 在机体抵抗病原微生物的防御中起着重要作用
[27] ...
1
本文献在全文中的定位:
... Di Luzio
[28]认为免疫多糖可以促进单核细胞或巨噬细胞的增生 ...
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 2)
2)
 3)
3)
 3)
3)
 3)
3)
 2)
2)
 2)
2)
 2)
2)
 3)
3)
 3)
3)
 1)
1)
 2)
2)
 1)
1)
 1)
1)
 2)
2)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)
 1)
1)




