采食量是动物生产性能充分发挥的基石,直接影响遗传潜力的发挥和生产效益。因此,认识动物采食量调控的规律和机制对调节动物采食量,尤其是通过营养调控手段提高动物的采食量具有重要的意义。动物采食量调控的生理机制涉及多个中枢神经通路及体液调节因子的共同参与(图1)。感官调节是通过视觉、嗅觉、触觉及味觉对所摄入的饲粮进行第1次评价,适口性较好的饲粮引起动物相对较高的采食量[1]。采食的饲粮在消化道被消化,营养物质则可刺激胃肠内分泌细胞合成及分泌参与采食量调控的调节肽,这些调节肽在采食量短期调节中发挥重要的作用[2]。而在采食量的调控过程中,中枢神经系统(cental nervous system,CNS)是采食量调节的关键,复杂的食物信号在中枢内得到整合及加工,继而引起与采食量相关的中枢兴奋,从而影响动物的食欲,调节采食量[1]。近些年来,对中枢神经系统调节采食量的分子机制的认识越来越深入,研究发现下丘脑是中枢神经系统调节采食量的重要部位,哺乳动物下丘脑雷帕霉素靶蛋白(mammalian target of rapamycinm,mTOR)通路在调控采食量中扮演重要的角色[3, 4]。大脑前梨状皮质层(anterior piriform cortex,APC)细胞可感受饲粮氨基酸缺乏或不足,激活一般性氨基酸应答过程(general amino acid control,GAAC),引起动物采食量的减少[5, 6]。此外,一些转录因子,如叉头转录因子1(forkhead transcription factor 1,FoxO1)和信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)等可直接影响神经肽基因的转录来调节采食量。本文旨在简要回顾采食量调节的生理机制的基础上,主要对外周信号在中枢神经系统发挥采食量调节的分子机制等研究进展进行综述。
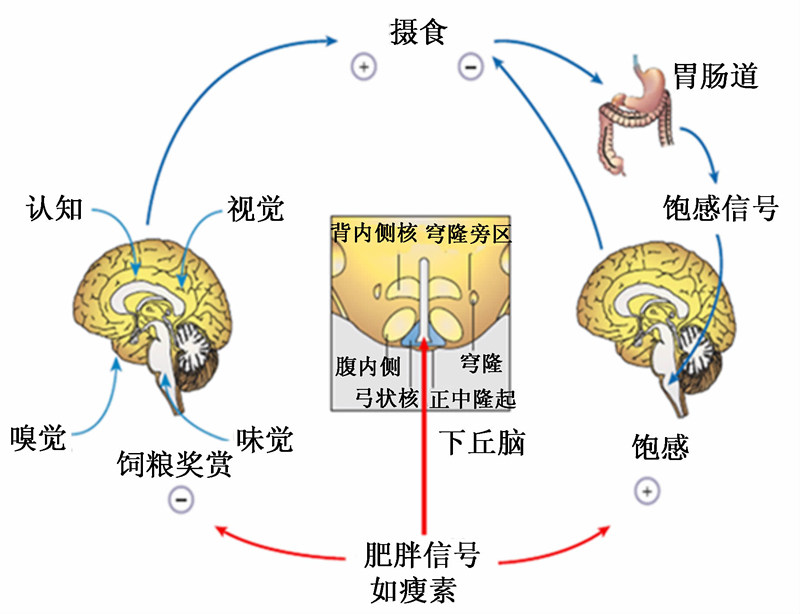 | 图1 动物采食量负反馈调节模式 Fig.1 Model for negative-feedback regulation of feed intake in animals[1] |
动物采食量调节的方式包括短期调节和长期调节。短期调节主要是由胃肠系统及中枢神经系统协同参与完成的,感觉系统在采食量短期调节中也发挥一定的作用。长期调节主要取决于体内能量储备,动物为了保持体内有一定的脂肪储备,通过增加或减少瘦素及胰岛素的合成及分泌,对采食量进行长期的调节。
感官调节是动物在采食过程中通过嗅觉、味觉、视觉及触觉等对所要摄入食物进行第1次判断,以鉴定所摄取食物是否存在潜在的危害性及适口性好坏等[1]。其中味觉在采食量的感官调节中发挥重要的作用,舌头上的味觉细胞可感受食物的味道产生味觉信号,并将这些味觉信号经迷走神经转导至大脑的孤束核内[7, 8]。孤束核又将复杂的味觉信号传递给负责感受和辨别不同味道的大脑区域,这些区域包括后脑臂旁核、中脑腹侧被盖区(ventral tegmental area,VTA)及前脑伏隔核(nucleus accumbens,NAc)等[8],从而引起动物对不同味道饲粮摄取的差异。而动物喜好适口性较好饲粮的可能机制是:适口性好的饲粮刺激腹侧被盖区细胞合成及分泌更多的多巴胺,激活前脑伏隔核细胞内的μ-阿片受体信号过程,从而促进动物摄食[8, 9]。这提示,在生产实践中饲粮的适口性对提高动物的采食量起着重要的作用。
胃肠道系统对采食量的调节主要包括物理调节和化学调节。胃肠道紧张或排空引起的压力变化负反馈调节采食量,动物摄食后,胃肠道内存在的机械受体可感受这种压力变化,并将信息通过传入神经纤维传递给饱中枢,从而终止摄食。而进入胃肠道内的营养物质能与相应化学受体结合,激活胃肠道中内分泌细胞合成及分泌一些参与食欲调节的多肽[2],通常被称为胃肠调节肽(gastrointestinal peptides)。研究发现胃肠道内感受化学刺激的受体主要是G蛋白偶联受体(GPCRs),它是一类负责将胞外刺激信号转导至胞内的蛋白质家族[10],主要包括T1R2/3甜味受体、T2R苦味受体家族以及G蛋白α-gustducin受体[2]。胃肠内营养物质及其降解产物,比如脂肪酸、糖类、氨基酸及多肽与胃肠内分泌细胞上相应GPCRs结合促使胞内钙离子浓度发生变化,继而引起这些胃肠调节肽的合成及分泌[10]。而胃肠调节肽的作用途径有2个方面:一方面可作为长距离调节激素,通过血液循环运至中枢神经系统,穿过血脑屏障与相应受体结合来调节摄食行为;另一方面直接作用于内分泌细胞附近的传入神经末端上的迷走、脊柱及肠肌间神经元,引起传入神经纤维兴奋并将信号传至中枢神经系统,与前者相比,后者的作用时间相对较短[2]。此外,一些胃肠调节肽也可抑制食糜在胃肠道的排空,从而增强胃肠道机械受体对机械刺激应答的敏感性[11]。近些年发现的胃肠调节肽主要包括:胆囊收缩素(cholecystokinin,CCK)、胰高血糖素样肽1(glucagon-like peptide-1,GLP1)、葡萄糖依赖性促胰岛素激素(glucose-dependent insulinotropic polypeptide,GIP)、胰多肽(pancreatic polypeptide,PP)、胰淀素(amylin)、生长激素释放肽(ghrelin)及肽YY(peptide YY,PYY)等。其中CCK、GLP1、GIP、PP及胰淀素的作用是负调节动物的采食量;生长激素释放肽的作用是促进动物摄食;而PYY对采食量的调节则随处理方式的差异呈现不同的结果:外周处理可促进摄食,而脑室内注射则降低了采食量,可能的原因是不同方式处理激活的PYY受体类型存在差异[2]。
中枢神经系统是采食量调节的关键,其作用是整合及加工传入的复杂食物信号,经整合及加工后的信号可刺激摄食中枢兴奋,使动物产生饱感或饥饿感,从而调节动物的采食量[1]。目前对发挥采食量调节的中枢神经系统的准确定位及其作用机制尚未完全清楚,但研究表明下丘脑是采食量调节的重要部位,下丘脑调控采食量的一种潜在机制是通过mTOR感受胞外信号分子(比如激素、氨基酸等),引起胞内蛋白质合成发生改变,并最终影响动物摄食[3, 4]。
下丘脑弓状核(hypothalamic arcuate nucleus,ARC)是下丘脑发挥采食量调节的重要部位,存在参与采食量调控的2类主要神经元。一类神经元可合成及分泌神经肽Y(neuropeptide Y,NPY)及刺鼠相关蛋白(agouti-related protein,AgRP),两者皆被证明可作为食欲刺激因子来提高动物的采食量[12, 13]。另一类神经元可合成及分泌阿黑皮素原(pro-opiomelanocortin,POMC),POMC是一些活性神经肽的前体物。弓状核内POMC经加工生成α-黑素细胞刺激激素(α-melanocyte-stimulating hormone,αMSH),αMSH或黑素皮质素4受体(melanocortin-4 receptor,MC4R)的激动剂处理结果显著降低了动物的采食量及体重[14]。αMSH由突出末端释放并与大脑内黑素皮质激素受体(尤其是MC4R)结合,从而减少动物的采食量[15]。而NPY/AgRP神经元及POMC神经元的兴奋性受采食量长期调节因子瘦素及胰岛素的调节,瘦素及胰岛素抑制NPY/AgRP神经元兴奋,刺激POMC神经元兴奋,并将神经信号传至孤束核内,孤束核又将神经信号传至大脑皮层内采食量调控相关区域,从而降低动物的采食量[1],图2是外周信号刺激中枢引起的神经信号转导模式。
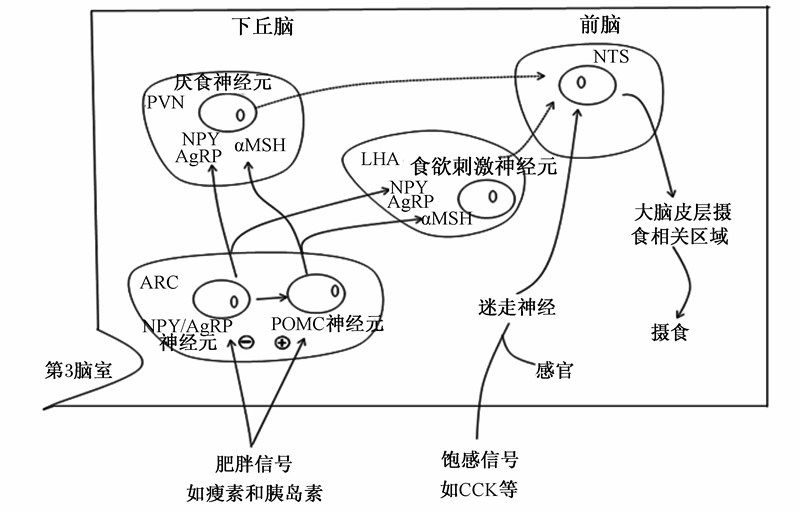 | PVN:室旁核 paraventricular nucleus;LHA:下丘脑外侧区 lateral hypothalamic area;NTS:孤束核 nucleus tractus solitarius。图2 外周信号刺激中枢引起的神经信号转导模式
Fig.2 Model of CNS pathways for integration of peripheral stimuli[1, 16] |
采食量的外周调节因子主要包括胃肠调节肽、肥胖信号分子(如胰岛素和瘦素)及营养物质,它们在采食量调节中起着重要的作用。其中胃肠调节肽(如CCK等)半衰期相对较短,主要在采食量的短期调节中扮演重要的角色[17, 18]。胰岛素和瘦素可反映体内脂肪的储存情况,循环中两者的浓度与脂肪组织含量呈正相关,故可作为肥胖信号。它们是长期调节采食量和能量的2个最为关键的外周信号分子。此外,营养物质也参与对采食量的调节。本文主要介绍肥胖信号分子(胰岛素和瘦素)及营养物质对采食量的调节及作用机理的研究进展。
胰岛素是由胰岛β细胞合成及分泌的,是机体内唯一可降低血糖的激素,同时也参与对糖原、脂肪、蛋白质等的合成代谢调节。研究表明胰岛素在中枢也具有一些特殊的功能,主要包括调节神经元突触可塑性、神经发育及摄食行为[19]。中枢内胰岛素大部分来自血液循环,主要以胰岛素受体的易化转运方式,经毛细内皮细胞通过血脑屏障进入中枢,且是一个浓度依赖的特异性饱和转运过程[20]。动物摄食后,循环胰岛素浓度迅速升高,但胰岛素通过特异性饱和转运过程进入中枢所需的时间较长,这与胰岛素调节采食量是一个长期的过程相符[21]。胰岛素受体在胰岛素生理功能得以发挥中起着关键作用,广泛表达于脑部,其中下丘脑、大脑皮层、小脑及海马的表达量较高,而尤以采食量调节关键部位弓状核的表达量最高[22]。
胰岛素调控采食量的主要方式是长期调节,脑部注射胰岛素降低了动物采食量及体重,且以浓度依赖的方式降低[23]。针对胰岛素受体前体蛋白设计反义寡核苷酸,靶向沉默下丘脑弓状核内的表达结果促进了摄食及提高了脂肪组织质量[24]。进入中枢的胰岛素可与下丘脑弓状核神经元上相应受体结合,激活胰岛素受体信号,抑制NPY/AgRP神经元表达NPY及AgRP[25],促进POMC神经元合成及分泌POMC[15],从而负调节动物的采食。而循环胰岛素的浓度与体脂的含量呈正比[26]。因此,当动物体脂过高时,循环胰岛素增加,对采食量长期调节的效果是降低动物的采食量。
瘦素是肥胖基因编码的一种蛋白激酶,主要由脂肪细胞合成及分泌;它的分泌具有昼夜节律,晚上最高,并呈现脉冲性分泌。循环中瘦素水平并不因摄食而发生较大的变化[27],而是与脂肪含量成正比[18]。瘦素在中枢内可发挥采食量调节作用,主要通过一种特异性饱和转运的方式穿过血脑屏障进入脑部,该过程需要分布于大脑脉络丛及血脑屏障微管丛中的瘦素受体作为结合/转运蛋白,而进入中枢的瘦素主要在下丘脑弓状核内发挥效应[28]。
瘦素生理功能的发挥需要其受体来介导,研究发现哺乳动物内主要存在3种瘦素受体亚型,其中Ob-Rb受体在下丘脑高表达,且在食欲调节中发挥主要的作用[29]。Ob-Rb受体突变的db/ob小鼠表现为肥胖,缺乏瘦素的ob/ob小鼠呈现高的采食量及肥胖症,瘦素处理又可出现可逆的现象[30]。瘦素在中枢内发挥采食量调节的机理是通过影响神经肽基因的表达,在弓状核内(包括NPY/AgRP及POMC神经元)高表达瘦素受体,瘦素与其受体的结合可抑制NPY/AgRP神经元兴奋,促进POMC神经元兴奋,结果降低了动物的采食量,以及提高了能量消耗[31]。
营养物质不仅可通过影响胃肠道内采食量调节肽的合成及分泌来参与采食量的调控[10],近年来也发现营养物质(如葡萄糖、氨基酸及游离脂肪酸等)可经血液循环运输至中枢、穿过血脑屏障通过直接影响中枢来调节摄食[32]。游离脂肪酸具有胰岛素样的效应,通过影响下丘脑弓状核神经元兴奋来负调节采食量,且可能与长链脂肪酸辅酶A在胞内的积累有关[33]。葡萄糖、脂肪酸及氨基酸等营养物质均可通过影响胞内单磷酸腺苷激活的蛋白激酶[adenosine monophosphate (AMP)-activated kinase,AMPK]的活性来调节摄食[4, 32]。AMPK是机体内能量的感受器,对AMP/ATP值高度敏感[34]。当能量供应不足时,AMP/ATP值升高,AMPK被激活;相反,充足的营养供应使AMP/ATP值下降,导致AMPK失活[35]。在下丘脑内活化的AMPK被证实可通过直接引起NPY/AGRP神经元兴奋[36]及降低胞内丙二酰辅酶A的水平[37]促进动物摄食。此外,AMPK也可抑制mTOR的活性,从而提高采食量[3]。氨基酸也可通过直接影响下丘脑mTOR的活性[3]及GAAC的应答过程[5, 6]来参与采食量的调节。
采食量主要受中枢神经系统的调节,肥胖信号分子(如胰岛素、瘦素等)、胃肠泌激素及营养等参与采食量的调节均是通过影响中枢来发挥作用的,中枢神经系统感受外周刺激的分子机制已成为提高采食量研究的热点。随着对中枢神经系统发挥采食量调节的分子机制的认识越来越深入,发现中枢内存在可整合外周信号引起采食量变化的信号转导过程,主要包括:1)感受营养、激素、能量状态等信号的mTOR通路[3, 38];2)感受胞外氨基酸缺乏或不足的APC内一般性调控阻遏蛋白激酶2(general control nonderepressible-2 kinase,GCN2)介导的GAAC。此外,一些转录因子(如FoxO1及STAT3等)可作为影响神经肽基因转录的关键节点来调节采食量。
mTOR是一种进化上保守的丝氨酸/苏氨酸蛋白激酶,在感受营养、激素、能量状态等信号、调节细胞生长、增殖及代谢中发挥关键性的作用,外周组织中活化的mTOR使下游靶蛋白核糖体S6激酶1(ribosomal s6 kinase 1,S6K1)及真核起始因子4E结合蛋白1 (eukaryotic translation initiation factor 4e binding protein 1,4E-BP1)磷酸化,促进翻译的起始,从而增加蛋白质的合成[39, 40]。与大多数细胞和组织一样,下丘脑弓状核神经元也表达mTOR及其下游靶蛋白S6K1,且这2种蛋白质的磷酸化形式仅与NPY/AgRP及POMC发生共定位[3],暗示下丘脑mTOR信号可能参与采食量的调节。大鼠侧脑室内注射亮氨酸激活了下丘脑mTOR信号,并降低了采食量及体重;相反,抑制剂雷帕霉素或抑制mTOR活性则提高了采食量[3, 38]。下丘脑mTOR在瘦素抑制采食量的过程中起着重要的作用,抑制mTOR活性阻断了瘦素对采食量的抑制作用[3]。而降低下丘脑mTOR信号可引起饮食诱导肥胖过程中的体重增加及瘦素抗性增强[41]。在一项果蝇的研究中也发现,下调可分泌胰岛素样多肽的神经元内S6K的活性可提高采食量,上调其活性则抑制动物摄食[42]。最近的一项研究发现mTOR-p70S6K激酶对AMPK丝氨酸491位点的磷酸化可介导瘦素对采食量的调控效应,抑制丝氨酸491位点的磷酸化可激活下丘脑AMPK的活性,提高采食量及体重[43]。以上表明下丘脑mTOR信号在中枢神经系统发挥采食量调节中起着重要的作用,激活下丘脑mTOR信号可引起动物采食量的降低。
瘦素、胰岛素与相应受体结合会引起一系列信号级联反应,其中磷酸肌醇3-激酶(phosphoinositide-3-kinase,PI3K)信号是两者均可激活的通路。磷酸化的PI3K激活下游靶蛋白蛋白激酶B(protein kinase B,PKB),进而激活mTOR,引起神经肽(如NPY/AgRP)表达的变化,抑制摄食[1];而氨基酸,尤其是亮氨酸则可直接激活mTOR信号通路来起到负调节采食量的作用[3]。此外,葡萄糖、脂肪酸及氨基酸等营养物质也可通过影响胞内的氧化磷酸化来调节能量状态,AMPK作为能量的感受器感应能量水平的变化,并将这一变化传递给mTOR,进而引起采食量的改变[32]。
动物正常的生命活动需要补充各种氨基酸,而当氨基酸缺乏或不足时,机体则会减少采食来尽可能降低氨基酸缺乏或不足带来的潜在危害[6],这暗示机体内存在感受氨基酸缺乏或不足的机制。研究发现APC是感受氨基酸缺乏或不足的主要部位,APC损伤的动物失去了对氨基酸不平衡饲粮摄入减少的能力[44]。进一步研究发现APC内GAAC应答过程在氨基酸缺乏或不足引起的采食量降低中起着重要的作用(图4),其中蛋白激酶GCN2是GAAC应答通路的核心蛋白,它能感受氨基酸的缺乏或不足,激活GAAC应答过程,进而降低采食量。而基因敲除GCN2小鼠在应对氨基酸缺乏时采食量并没有发生改变[5]。
通过遗传学手段研究真核生物GCN2蛋白的结构发现其含有组氨酸-tRNA合成酶(HisRS)相关结构域[45, 46]。而非负载tRNA较负载有相应氨基酸的tRNA相比对该结构域具有较高的亲和性,当氨基酸缺乏时,可导致细胞内非负载tRNA数量的增加,而非负载tRNA与GCN2上的HisRS结构域结合可激活GCN2,继而磷酸化真核起始因子2α(eIF2α)[47],APC细胞内eIF2α的磷酸化继而引起采食量的下调。而APC内磷酸化eIF2α引起采食量下降的机制仍不是很清楚,目前研究发现其参与采食量调节的可能机制包括:1)激活细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2),从而激活Na+偶联的中性氨基酸转运体(system a sodium dependent neutral amino acid transporters,SNATs)对氨基酸的转运活性[48];2)增强APC谷氨酸能神经元内谷氨酸的转氨基作用或谷氨酸-谷氨酰胺循环反应,进而增加胞内谷氨酸的浓度,从而激活谷氨酸来源的α-氨基-3-羟基-5-甲基异恶唑-4-丙酸受体 (α-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptors,AMPAR) 活性[49],AMPAR被证实在APC应对氨基酸缺乏时起着重要的作用[50];3)激活钙/钙调素依赖的蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ),进而增加胞内钙离子的浓度,激活钙离子信号[50];4)抑制蛋白质的合成,继而引起包括γ-氨基酸丁酸(gamma amino butyric acid,GABA)受体在内的膜蛋白发生快速降解,结果使得GABA对神经的抑制作用减弱[51],而APC内GABA能系统对神经系统的抑制作用在调节动物摄食中发挥一定的作用。
除以上2个关键的采食量调控信号转导过程外,近些年也鉴定了一些参与采食量调节的关键转录因子,主要包括FoxO1和STAT3,它们可以直接影响神经肽基因的转录来调节采食量[1]。下丘脑内Npy/Agrp和Pomc基因的启动子附近存在FoxO1(转录活性受PI3K的抑制)及STAT3的结合位点,但2个转录因子对神经肽基因的转录调节效应却是相反的:FoxO1转录激活Npy/Agrp基因的表达,抑制Pomc基因的表达,进而促进摄食;而STAT3的激活则下调Npy/Agrp基因的表达,上调Pomc基因的表达,进而抑制摄食[52](图3)。研究表明瘦素及胰岛素都可以激活PI3K信号[53, 54],活化的PI3K又可抑制FoxO1的转录活性。因此,FoxO1在作为瘦素及胰岛素信号的关键节点可引起Npy/Agrp基因表达降低,Pomc基因表达升高,进而在降低采食量中扮演重要的角色。此外,两面神激酶(janus kinase,JAK)-STAT3信号是瘦素发挥生物学作用的一个关键通路, 活化 的STAT3结果下调了Npy/Agrp基因的表达,上调了Pomc基因的表达,最终引起采食量的降低[52]。
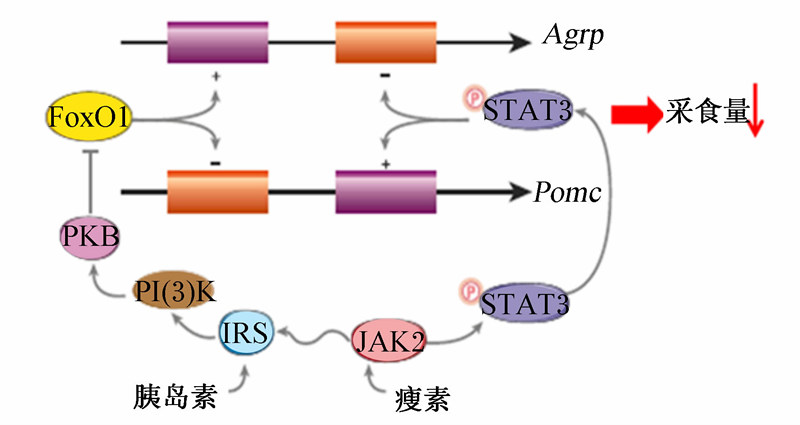 | PKB:蛋白激酶 protein kinase B;IRS:胰岛素受体底物 insulin receptor substrate。图3 在应对瘦素及胰岛素时FoxO1及STAT3调控Agrp和Pomc基因转录的模式 Fig.3 Model for regulation of Pomc and Agrp gene transcription via FoxO1 and STAT3 in response to insulin and leptin[1] |
综上所述,中枢神经系统整合外周信号(主要包括胰岛素、瘦素及营养物质)调节动物采食量的分子机制可以总结为图4。
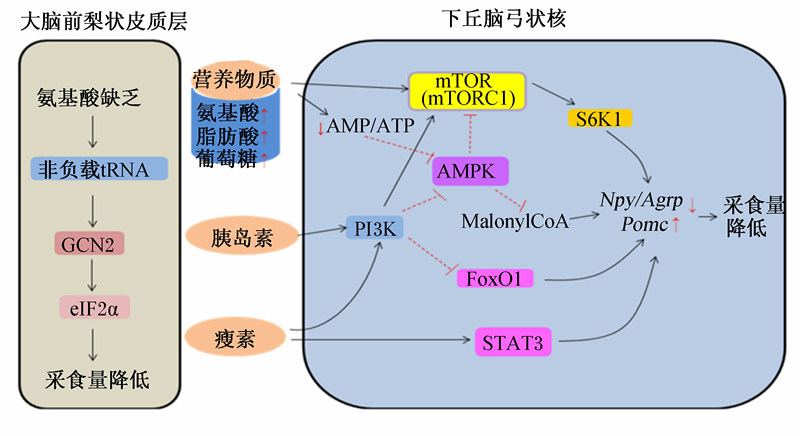 | MalonyCoA:丙二酰辅酶A。图4 中枢整合外界信号调节采食量的分子机制
Fig.4 Molecular mechanisms of integration of various signals by CNS to regulate feed intake |
动物采食量的调节是一个极其复杂的过程,其调节机制目前仍不是很清楚。目前普遍认为,采食量的调节过程主要包括外周组织(胃肠系统等)与中枢神经系统之间存在一系列精准的调节机制,是由众多调节因子组成的复杂网络调节系统。胃肠泌激素、肥胖信号(如胰岛素和瘦素)及营养物质等外周调节因子在采食量的调节中扮演重要的角色。而中枢神经系统是采食量调节的关键,复杂的食物信号在中枢得到整合及加工,并刺激摄食中枢兴奋引起动物的食欲发生变化。近年来对中枢神经系统调节采食量的分子机制认识已取得较大的进展,并鉴定出了一些关键的信号转导通路及转录因子:其中下丘脑mTOR在感受营养、激素及能量水平等外界刺激,引起采食量发生改变中起着重要的作用;APC神经元可通过GCN2感受氨基酸缺乏或不足激活GAAC应答通路,进而减少动物摄食。此外,FoxO1及STAT3等转录因子的发现为阐明中枢调节采食量的分子机制研究提供了有效的手段。营养物质是影响动物采食量的重要因素之一,这些信号通路及转录因子的相继发现为充分认识营养物质对采食量的影响机制提供了基础,有助于在生产实践中实施对动物采食量的调节,通过营养手段调节相关信号通路基因表达进而提高动物采食量、改善生产性能。
致谢:感谢华中农业大学动物科技学院魏宏逵老师对文稿所提的宝贵意见。
| [1] | MORTON G J,CUMMINGS D E,BASKIN D G,et al.Central nervous system control of food intake and body weight[J]. Nature,2006,443(7109):289-295. ( 9) 9)
|
| [2] | CUMMINGS D E,OVERDUIN J.Gastrointestinal regulation of food intake[J]. Journal of Clinical Investigation,2007,117:13-23. ( 5) 5)
|
| [3] | COTA D,PROULX K,BLAKE SMITH K A,et al.Hypothalamic mTOR signaling regulates food intake[J]. Science,2006,312:927-930. ( 8) 8)
|
| [4] | WOODS S C,SEELEY R J,COTA D.Regulation of food intake through hypothalamic signaling networks involving mTOR[J]. Annual Reviews,2008,28:295-311. ( 3) 3)
|
| [5] | HAO S Z,SHARP J W,ROSS-INTA C M,et al.Uncharged tRNA and sensing of amino acid deficiency in mammalian piriform cortex[J]. Science,2005,307:1776-1778. ( 3) 3)
|
| [6] | GIETZEN D W,HAO S Z,ANTHONY T G,et al.Mechanisms of food intake repression in indispensable amino acid deficiency[J]. Annual Review of Nutrition,2007,27:63-78. ( 3) 3)
|
| [7] | BLEVINS J E,SCHWARTZ M W,BASKIN D G.Evidence that paraventricular nucleus oxytocin neurons link hypothalamic leptin action to caudal brainstem nuclei controlling meal size[J]. American Journal of Physiology Regulatory,Integrative and Comparative Physiology,2004,287:R87-R96. ( 1) 1)
|
| [8] | KELLEY A E,BALDO B A,PRATT W E,et al.Corticostriatal-hypothalamic circuitry and food motivation:integration of energy,action and reward[J]. Physiology & Behavior,2005,86:773-795. ( 3) 3)
|
| [9] | KELLEY A E,BERRIDGE K C.The neuroscience of natural rewards:relevance to addictive drugs[J]. The Journal of Neuroscience,2002,22:3306-3311. ( 1) 1)
|
| [10] | GERAEDTS M C P,TTOOST F J,SARIS W H M.Gastrointestinal targets to modulate satiety and food intake[J]. Obesity Reviews,2010,12:470-477. ( 3) 3)
|
| [11] | KARHUNEN L J,JUVONEN K R,HUOTARI A,et al.Effect of protein,fat,carbohydrate and fibre on gastrointestinal peptide release in humans[J]. Regulatory Peptides,2008,149:70-78. ( 1) 1)
|
| [12] | HAHN T M,BREININGER J F,BASKIN D G,et al.Coexpression of Agrp and NPY in fasting-activated hypothalamic neurons[J]. Nature Neuroscience,1998,1:271-272. ( 1) 1)
|
| [13] | LUQUET S,PEREZ F A,HNASKO T S,et al.NPY/AgRP neurons are essential for feeding in adult mice but can be ablated in neonates[J]. Science,2005,310(5748):683-685. ( 1) 1)
|
| [14] | CONE R D.Anatomy and regulation of the central melanocortin system[J]. Nature Neuroscience,2005,8:571-578. ( 1) 1)
|
| [15] | FAN W,BOSTON B A,KESTERSON R A,et al.Role of melanocortinergic neurons in feeding and the agouti obesity syndrome[J]. Nature,1997,385:165-168. ( 2) 2)
|
| [16] | PORTE D Jr.,BASKIN D G,SCHWARTZ M W.Leptin and insulin action in the central nervous system[J]. Nutrition Reviews,2003,60:S20-S29. ( 1) 1)
|
| [17] | MURPHY K G,DHILLO W S,BLOOM S R.Gut peptides in the regulation of food intake and energy homeostasis[J]. Endocrine Reviews,2006,27(7):719-727. ( 1) 1)
|
| [18] | SUZUKI K,SIMPSON K A,MINNION J S,et al.The role of gut hormones and the hypothalamus in appetite regulation[J]. Endocrine Journal,2010,57(5):359-372. ( 2) 2)
|
| [19] | VAN DEN HEIDE L P,RAMAKERS M J,SMIDT M P.Insulin signaling in the central nervous system:learning to survive[J]. Progress in Neurobiology,2006,79:205-221. ( 1) 1)
|
| [20] | PARDRIDGE W M,EISENBERG J,YANG J.Human blood-brain barrier insulin receptor[J]. Journal of Neurochemistry,1985,44:1771-1778. ( 1) 1)
|
| [21] | HAVEL P J.Peripheral signals conveying metabolic information to the brain:short-term and long-term regulation of food intake and energy homeostasis[J]. Experimental Biology and Medicine,2001,226(11):963-977. ( 1) 1)
|
| [22] | SEAQUIST E R,DAMBERG G S,TKAC I,et al.The effect of insulin on in vivo cerebral glucose concentrations and rates of glucose transport/metabolism in humans[J]. Diabetes,2001,50(10):2203-2209. ( 1) 1)
|
| [23] | AIR E L,BENOIT S C,BLAKE SMITH K A,et al.Acute third ventricular administration of insulin decreases food intake in two paradigms[J]. Pharmacology Biochemistry and Behavior,2002,72:423-429. ( 1) 1)
|
| [24] | OBICI S,FENG Z H,KARKANIAS G,et al.Decreasing hypothalamic insulin receptors causes hyperphagia and insulin resistance in rats[J]. Nature Neuroscience,2002,5:566-572. ( 1) 1)
|
| [25] | FLIER J S.Obesity wars:molecular progress confronts an expanding epidemic[J]. Cell,2004,116:337-350. ( 1) 1)
|
| [26] | HAVEL P J,OWNSEND R,CHAUMP L,et al.High-fat meals reduce 24-h circulating leptin concentrations in women[J]. Diabetes,1999,48:334-341. ( 1) 1)
|
| [27] | KORBONITS M,TRAINER P J,LITTLE J A,et al.Leptin levels do not change acutely with food administration in normal or obese subjects,but are negatively correlated with pituitary-adrenal activity[J]. Clinical Endocrinology,1997,46:751-757. ( 1) 1)
|
| [28] | BANKS W A,KASTIN A J,HUANG W,et al.Leptin enters the brain by a saturable system independent of insulin[J]. Peptides,1996,17:305-311. ( 1) 1)
|
| [29] | FEI H,OKANO H J,LI C,et al.Anatomic localization of alternatively spliced leptin receptors (Ob-R) in mouse brain and other tissues[J]. Proceedings of the National Academy of Sciences of the United States of America,1997,94:7001-7005. ( 1) 1)
|
| [30] | CHEN H,CHARLAT O,TARTAGLIA L A,et al.Evidence that the diabetes gene encodes the leptin receptor:identification of a mutation in the leptin receptor gene in db/db mice[J]. Cell,1996,84:491-495. ( 1) 1)
|
| [31] | SCHWARTZ M W,WOODS S C,PORTE D,et al.Central nervous system control of food intake[J]. Nature,2000,404:661-671. ( 1) 1)
|
| [32] | LENARD N R,BERTHOUD H.Central and peripheral regulation of food intake and physical activity:pathways and genes[J]. Obesity,2008,16:S11-S22. ( 3) 3)
|
| [33] | OBICI S,FENG Z H,MORGAN K,et al.Central administration of oleic acid inhibits glucose production and food intake[J]. Diabetes,2002,51:271-275. ( 1) 1)
|
| [34] | HARDIE D G,CARLING D.The AMP-activated protein kinase-fuel gauge of the mammalian cell?[J]. European Journal of Biochemistry,1997,246:259-273. ( 1) 1)
|
| [35] | WULLSCHLEGER S,LOEWITH R,HALL M N.TOR signaling in growth and metabolism[J]. Cell,2006,124:471-484. ( 1) 1)
|
| [36] | MINOKOSHI Y,ALQUIER T,FURUKAWA N,et al.AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus[J]. Nature,2004,428:569-574. ( 1) 1)
|
| [37] | XUE B Z,KAHN B B.AMPK integrates nutrient and hormonal signals to regulate food intake and energy balance through effects in the hypothalamus and peripheral tissues[J]. The Journal of Physiology,2006,574(1):73-83. ( 1) 1)
|
| [38] | MORRISON C D,XI X C,WHITE C L,et al.Amino acids inhibit Agrp gene expression via an mTOR-dependent mechanism[J]. American Journal of Physiology Endocrinology and Metabolism,2007,293:E165-E171. ( 2) 2)
|
| [39] | ZONCU R,EFEYAN A,SABATINI D M.mTOR:from growth signal integration to cancer,diabetes and ageing[J]. Nature Reviews Molecular Cell Biology,2011,12:21-35. ( 1) 1)
|
| [40] | LAPLANTE M,SABATINI D W.mTOR signaling in growth control and disease[J]. Cell,2012,149:274-293. ( 1) 1)
|
| [41] | COTA D,MATTER E K,WOODS S C,et al.The role of hypothalamic mammalian target of rapamycin complex 1 signaling in diet induced obesity[J]. The Journal of Neuroscience,2008,28(28):7202-7208. ( 1) 1)
|
| [42] | WU Q,ZHANG Y,XU J,et al.Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102:13289-13294. ( 1) 1)
|
| [43] | DAGON Y,HUR E,ZHENG B,et al.p70S6 kinase phosphorylates AMPK on serine 491 to mediate leptin's effect on food intake[J]. Cell Metabolism,2012,16:104-112. ( 1) 1)
|
| [44] | SHARP J W,ROSS-INTA C M,HAO S Z,et al.Co-localization of phosphorylated extracellular signal-regulated protein kinases 1/2 (ERK1/2) and phosphorylated eukaryotic initiation factor 2α (eIF2α) in response to a threonine-devoid diet[J]. Journal of Comparative Neurology,2006,494:485-494. ( 1) 1)
|
| [45] | SOOD R,PORTER A C,OLSEN D,et al.A mammalian homologue of GCN2 protein kinase important for translational control by phosphorylation of eukaryotic initiation factor-2α[J]. Genetics,2000,154:787-801. ( 1) 1)
|
| [46] | ZHANG P,MCGRATH BC,REINERT J,et al.The GCN2 eIF2α kinase is required for adaptation to amino acid deprivation in mice[J]. Molecular and Cellular Biology,2002,22:6681-6688. ( 1) 1)
|
| [47] | DONG J S,QIU H F,GARCIA-BARRIO M,et al.Uncharged tRNA activates GCN2 by displacing the protein kinase moiety from a bipartite tRNA-binding domain[J]. Molecular Cell,2000,6:269-279. ( 1) 1)
|
| [48] | BLAIS A,HUNEAU J F,MAGRUM L J,et al.Threonine deprivation rapidly activates the system A amino acid transporter in primary cultures of rat neurons from the essential amino acid sensor in the anterior piriform cortex[J]. The Journal of Nutrition,2003,133:2156-2164. ( 1) 1)
|
| [49] | HUTSON S M,LIETH E,LANOUE K F.Function of leucine in excitatory neurotransmitter metabolism in the central nervous system[J]. The Journal of Nutrition,2001,131:846S-850S. ( 1) 1)
|
| [50] | SHARP J W,ROSS C M,KOEHNLE T J,et al.Phosphorylation of Ca2+/calmodulin dependent protein kinase type II and the α-amino-3-hydroxy-5-methyl-4-isoxazole propionate (AMPA) receptor in response to a threonine-devoid diet[J]. Neuroscience,2004,126:1053-62. ( 2) 2)
|
| [51] | WEK R C,JIANG H Y,ANTHONY T G.Coping with stress:eIF2 kinases and translational control[J]. Biochemical Society Transactions,2006,34:7-11. ( 1) 1)
|
| [52] | KITAMURA T,FENG Y,KITAMURA1 Y I,et al.Forkhead protein FoxO1 mediates Agrp-dependent effects of leptin on food intake[J]. Nature Medicine,2006,12:534-540. ( 2) 2)
|
| [53] | PLUM L,BELGARDT B F,BRUNING J C.Central insulin action in energy and glucose homeostasis[J]. Journal of Clinical Investigation,2006,116:1761-66. ( 1) 1)
|
| [54] | BATES S H,STEARNS W H,DUNDON T A,et al.STAT3 signalling is required for leptin regulation of energy balance but not reproduction[J]. Nature,2003,421:856-859. ( 1) 1)
|




