近年来,我国养牛业和养羊业迅速发展,大量的粗饲料被用于反刍动物饲粮中,占反刍动物饲粮的40%~80%,是宿主动物和瘤胃微生物重要的营养来源[1]。因此,如何更好的利用与提高粗饲料的利用率被广泛关注。
随着畜牧业的迅速发展,我国饲料行业也在飞速发展,然而饲料资源,尤其是蛋白质资源却成为制约我国饲料行业甚至畜牧业发展的瓶颈。到2020年,我国蛋白质饲料的供需缺口将达到4 800万t,而目前我国大豆和鱼粉等优质蛋白质饲料对进口的依存度已超过70%[2]。因此,提高我国现有蛋白质饲料资源利用率是缓解这一矛盾的关键环节。目前我国应用最广泛的蛋白质饲料为植物性饼粕类蛋白质饲料,如何提高它们的利用率及饲喂效果成为养殖业关心的大问题。
饲粮的组合效应实质上是指来自不同饲料源的营养性物质、非营养性物质以及抗营养物质之间互作的整体效应[3]。增加饲料间正组合效应,可有效提高反刍动物对饲草料尤其是低质粗饲料的采食量和利用率。自Menke等[4]成功应用体外瘤胃发酵法预测发酵底物的营养价值以来,因其方法简便、经济、快速而被广泛用于评定饲料的营养价值。本研究拟运用瘤胃体外发酵法,通过3个试验评价目前我国常用的10种粗饲料和5种饼粕类蛋白质饲料以及不同粗饲料和精料组合的体外发酵特性,以期找到蛋白质饲料与粗饲料的更合理搭配,为反刍动物饲粮中更合理的利用蛋白质饲料和粗饲料资源提供重要的理论与科学参数。
本试验所用10种粗饲料分别为麦壳、羊草、稻草、高能饲草、美国苜蓿、国产苜蓿、全株玉米青贮、花生秧青贮、玉米秸青贮和杂交高粱青贮,5种蛋白质饲料分别为豆粕、棉籽粕、菜籽粕、芝麻粕和棕榈粕。上述15种饲料样品均采集自安徽省凤阳县某奶牛场,参照《饲料分析及饲料质量检测技术》[5]测定各饲料的基本营养水平。10种粗饲料和5种蛋白质饲料的基本营养水平分别见表1和表2。
| 表1 10种粗饲料的基本营养水平(风干基础)
Table 1 Basic nutrient levels of 10 forages (air-dry basis) %
|
| 表2 5种蛋白质饲料的基本营养水平(风干基础) Table 2 Basic nutrient levels of 5 protein feeds (air-dry basis) % |
试验所用瘤胃液采自3头装有永久性瘤胃瘘管的去势波尔杂交公山羊,饲粮为青干草,同时补饲自配精料(玉米∶ 豆粕=7∶ 3),自由饮水。试验当日,于饲喂后2 h利用负压原理用塑料吸瓶从瘤胃瘘管抽取瘤胃内容物,保存于39 ℃预热并充满二氧化碳的塑料瓶内,迅速带回实验室,厌氧无菌条件下搅拌后4层纱布过滤,滤液用于接种。培养基参照Theodorou等[6]配制。
对粗饲料(试验1)、蛋白质饲料(试验2)及粗饲料与精料组合(试验3)分别进行体外发酵试验,以评定其营养价值。试验1,以1 g粗饲料作为单独底物进行发酵;试验2,以1 g蛋白质饲料作为单独底物进行发酵;试验3,以1 g粗饲料(0.30 g试验粗饲料+0.30 g玉米秸青贮)与精料(0.24 g玉米+0.12 g豆粕+0.04 g麸皮)组合作为底物混合发酵。试验3中粗饲料分别选用稻草、苜蓿、羊草和麦壳组成不同的饲料组合,不同饲料组合的基本营养水平见表3。以体积比1∶ 9的比例将瘤胃液和已预热至39 ℃的厌氧培养基混合,取100 mL混合后的培养液厌氧分装至含1 g底物的发酵瓶中,发酵瓶用橡胶塞和铝盖封口后,39 ℃下厌氧培养48 h,每个样品设4个重复。发酵过程中,定时测定产气量(gas production,GP):试验1分别于发酵2、4、6、8、10、12、24和48 h时测定并记录GP;试验2分别于发酵3、6、9、12、18、24、30、36和48 h时测定并记录GP;试验3分别于发酵2、4、6、9、12、18、24、36和48 h时测定并记录GP。试验1发酵结束后测定底物的干物质降解率(dry matter
degradability,DMD)、中性洗涤纤维降解率(neutral detergent fiber degradability,NDFD)、酸性洗涤纤维降解率(acid detergent fiber degradability,ADFD)以及发酵液pH和发酵液中挥发性脂肪酸(volatile fatty acid,VFA)浓度;试验2发酵结束后测定底物DMD、有机物降解率(organic matter degradability,OMD)以及发酵液pH和发酵液中氨氮(ammonia nitrogen,NH3-N)、微生物蛋白(microbial crude protein,MCP)浓度;试验3分别在发酵12、24和48 h时测定底物DMD、OMD以及发酵液中NH3-N、MCP和VFA浓度。
| 表3 不同饲料组合的基本营养水平(风干基础)
Table 3 Basic nutrient levels of different feed combinations (air-dry basis) %
|
营养物质降解率的测定参照《饲料分析及饲料质量检测技术》[5]的方法,GP的测定参照Theodorou等[6]和朱伟云等[7]的方法,VFA浓度的测定参照秦为琳[8]的方法,MCP浓度的测定参照Makkar等[9]的方法,NH3-N浓度的测定采用Broderick等[10]的苯酚-次氯酸钠比色法。
各试验数据经Excel 2007初步整理后,利用SPSS 20.0统计软件进行单因素方差分析和显著性检验,多重比较采用one-way ANOVA中的SNK法进行统计分析,试验结果以平均值±标准误表示,显著性水平为P<0.05。
10种粗饲料体外发酵48 h的GP动态变化曲线见图1。全株玉米青贮、玉米秸青贮、国产苜蓿和美国苜蓿的GP较高,发酵速度快;麦壳发酵的GP最低,发酵速度最慢。根据各粗饲料发酵产气集中时间的差异,可以将10组粗饲料分成3类:全株玉米青贮、玉米秸青贮、国产苜蓿和美国苜蓿为一类,它们的发酵时间主要在12~30 h;羊草和高能饲草为一类,它们的发酵时间主要在15~30 h;剩余的为一类,它们的发酵时间主要在18~36 h。
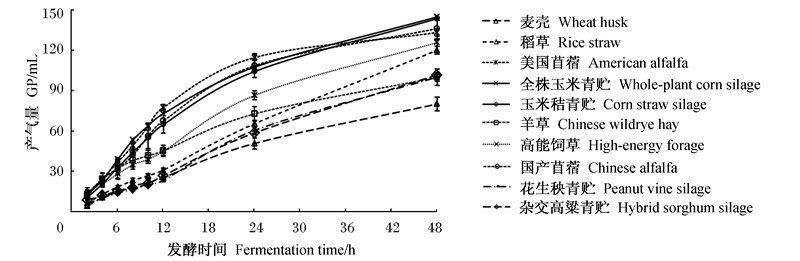 | 图1 不同粗饲料体外发酵48 h的GP动态变化曲线
Fig.1 Dynamic change curves of GP of different forages after 48 h in vitro fermentation |
表4为不同粗饲料体外发酵48 h的GP、营养物质降解率和pH的测定结果。10种粗饲料发酵48 h的GP在79.4~144.0 mL之间,其中,全株玉米青贮和玉米秸青贮发酵48 h的GP较高,分别为144.0和142.7 mL,显著高于除国产苜蓿和美国苜蓿外的其他6种粗饲料(P<0.05);而麦壳发酵48 h的GP最低,仅为79.4 mL,显著低于其他9种粗饲料(P<0.05)。10种粗饲料的DMD差异明显,最低的仅为33.04%(麦壳),而最高的则达到了65.45%(全株玉米青贮),全株玉米青贮的DMD显著高于除玉米秸青贮外的其他8种粗饲料(P<0.05),而麦壳的DMD则显著低于其他粗饲料(P<0.05)。不同粗饲料间的NDFD和ADFD也存在明显差异,玉米秸青贮的NDFD最高,达53.36%,麦壳的NDFD最低,仅为4.49%,两者相差近10倍;花生秧青贮的ADFD最高,为44.73%,显著高于其他粗饲料(P<0.05),麦壳的ADFD最低,仅为5.78%,显著低于其他粗饲料(P<0.05)。从表4中可以看出DMD、NDFD和ADFD的关系密切。对这3组数据的相关性分析表明,DMD与NDFD和ADFD存在正相关性,相关系数分别为0.827(P<0.01)和0.697(P<0.05),NDFD与ADFD之间也存在正相关性,相关系数为0.856(P<0.01)。发酵液pH结果显示,美国苜蓿的pH最高,显著高于其他粗饲料(P<0.05),玉米秸青贮的pH最低,显著低于其他粗饲料(P<0.05)。
| 表4 不同粗饲料体外发酵48 h的GP、营养物质降解率和pH
Table 4 GP, nutrient degradability and pH of different forages after 48 h in vitro fermentation
|
表5为不同粗饲料发酵结束时的VFA产量,可以看出:玉米秸青贮的总挥发性脂肪酸(total volatile fatty acid,TVFA)浓度最高,为61.98 mmol/L,显著高于除全株玉米青贮外的其他粗饲料(P<0.05);其丙酸浓度也最高,为22.78 mmol/L,显著高于其他粗饲料(P<0.05);同时,其乙酸/丙酸(A/P)最低,显著低于除全株玉米青贮外的其他粗饲料(P<0.05)。麦壳的TVFA、乙酸和丙酸浓度均最低,显著低于除羊草外的其他粗饲料(P<0.05);其丁酸的浓度也最低,显著低于除高能饲草外的其他粗饲料(P<0.05);然而,其A/P却显著高于除花生秧青贮和稻草外的其他粗饲料(P<0.05)。对TVFA浓度和DMD进行相关性分析表明,TVFA浓度和DMD存在正相关性,相关系数为0.889(P<0.01)。
| 表5 不同粗饲料体外发酵48 h的VFA产量
Table 5 VFA production of different forages after 48 h in vitro fermentation
|
图2为不同蛋白质饲料体外发酵48 h的GP动态变化曲线,可以看出:豆粕体外发酵48 h的GP最高,其发酵速度最快,产气集中在6~30 h。到达同一GP 62.3 mL的时间,豆粕至少比其他饼粕饲料提前了24 h。棕榈粕的延滞期最长,产气集中在发酵36 h以后,在发酵36 h之前,棕榈粕各时间点的GP均低于其他蛋白质饲料,而在发酵48 h时棕榈粕的GP已超过棉籽粕、菜籽粕和芝麻粕。
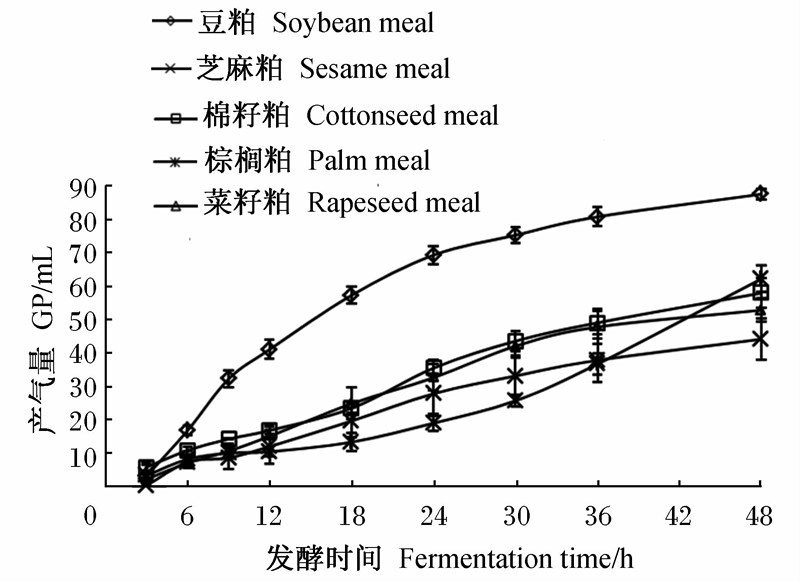 | 图2 不同蛋白质饲料体外发酵48 h的GP动态变化曲线 Fig.2 Dynamic change curves of GP of different protein feeds after 48 h in vitro fermentation |
表6为不同蛋白质饲料体外发酵48 h的发酵参数,可以看出:不同蛋白质饲料的OMD和DMD差异较大,以豆粕的OMD与DMD最高,显著高于其他蛋白质饲料(P<0.05);棉籽粕和棕榈粕的OMD和DMD均较低,显著低于其他蛋白质饲料(P<0.05)。菜籽粕的NH3-N浓度最高,达52.22 mg/dL,显著高于其他蛋白质饲料(P<0.05);豆粕的NH3-N浓度次之,为34.60 mg/dL,显著高于棉籽粕、芝麻粕和棕榈粕(P<0.05)。豆粕和棉籽粕的MCP浓度显著高于芝麻粕和棕榈粕(P<0.05)。不同蛋白质饲料的发酵液pH差异不显著(P>0.05)。
| 表6 不同蛋白质饲料体外发酵48 h的发酵参数
Table 6 Fermentation parameters of different protein feeds after 48 h in vitro fermentation
|
图3为不同饲料组合体外发酵48 h的GP动态变化曲线,可以看出:苜蓿组合在各发酵时间点的GP都高于其他组合。各组合的产气速度和延滞期基本一致,产气集中在12~36 h。相对于试验1和试验2单一饲料的GP,本试验各组合GP较多,且各组合GP比较接近,整体趋势相同。
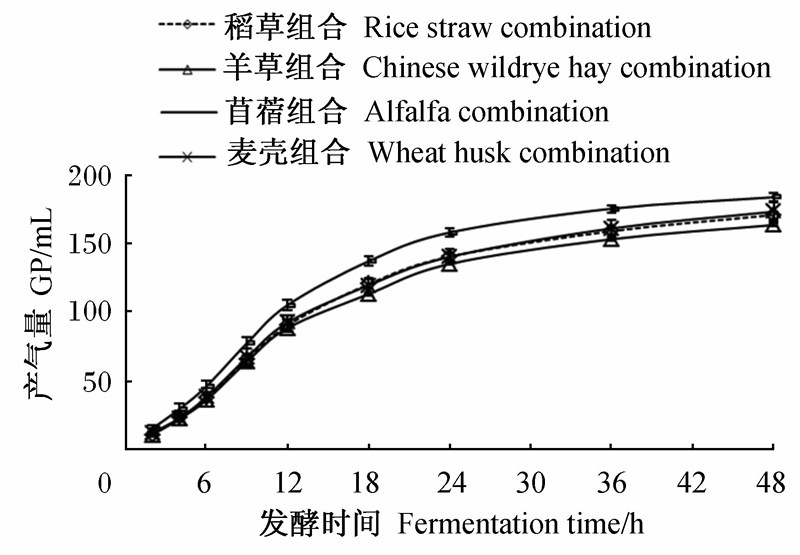 | 图3 不同饲料组合体外发酵48 h的GP动态变化曲线 Fig.3 Dynamic change curves of GP of different feed combinations after 48 h in vitro fermentation |
图4为不同饲料组合体外发酵12、24和48 h的DMD和OMD变化,可以看出:发酵12和24 h时,苜蓿组合的DMD最高,且显著高于其他组合(P<0.05);发酵48 h时,稻草组合和苜蓿组合的DMD显著高于羊草和麦壳组(P<0.05)。发酵12和24 h时,苜蓿组合的OMD最高,且显著高于其他组合(P<0.05);发酵48 h时,稻草组合和苜蓿组合的OMD显著高于其他组合(P<0.05)。各饲料组合的OMD和DMD变化趋势相同。
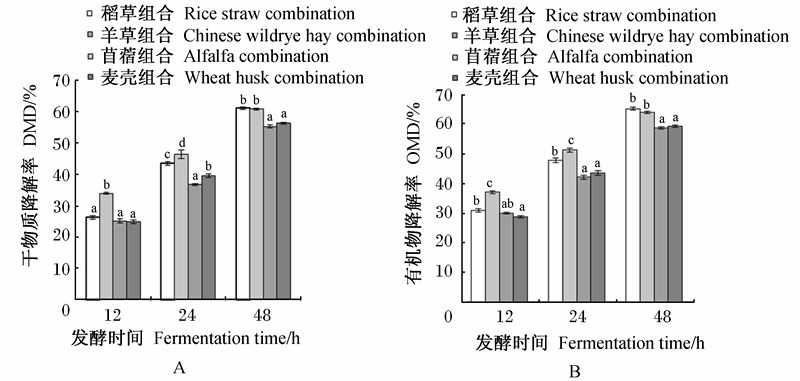 | 数据柱标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。图5同。 Value columns with no letter or the same letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P<0.05). The same as Fig.5.图4 不同饲料组合体外发酵12、24和48 h的DMD(A)和OMD(B)变化 Fig.4 DMD (A) and OMD (B) changes of different feed combinations after 12, 24 and 48 h in vitro fermentation |
图5为不同饲料组合体外发酵12、24和48 h的NH3-N和MCP浓度变化,可以看出:发酵12 h时,各组合的NH3-N浓度差异不显著(P>0.05);发酵24 h时,苜蓿组合的NH3-N浓度最高,为12.01 mmol/L,显著高于其他组合(P<0.05);发酵48 h时,苜蓿组合的NH3-N浓度依然为最高,达18.87 mmol/L,显著高于其他组合(P<0.05)。发酵12 h时,各组合的MCP浓度差异不显著(P>0.05);发酵24 h时,各组合的MCP浓度都有所升高,而苜蓿组合的MCP浓度升得最快,此时苜蓿组合和麦壳组合显著高于羊草组合(P<0.05);当发酵到48 h时,各组合的MCP浓度又恢复到差异不显著(P>0.05)。各饲料组合的NH3-N和MCP浓度的变化趋势在24 h之前是相似的。
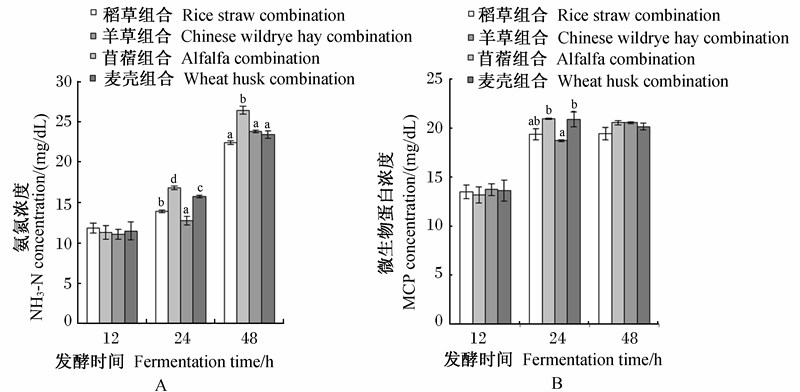 | 图5 不同饲料组合体外发酵12、24和48 h的NH3-N(A)和MCP(B)浓度变化 Fig.5 NH3-N (A) and MCP (B) concentration changes of different feed combinations after 12, 24 and 48 h in vitro fermentation |
表7为不同饲料组合体外发酵12、24和48 h的VFA浓度变化,可以看出:各组合TVFA浓度在发酵12 h时均达到较高水平,随着发酵时间的延长先降低再回升。发酵12 h时,稻草组合和苜蓿组合的TVFA显著高于羊草组合和麦壳组合(P<0.05);相对于发酵12 h时,发酵24 h时各组合TVFA浓度均有不同程度的下降,但各组合间无显著差异(P>0.05);相对于发酵24 h时,发酵48 h时各组合TVFA浓度均有不同程度的回升,但各组合之间仍无显著差异(P>0.05)。各组合乙酸浓度的变化趋势与TVFA浓度变化一致,在发酵12 h时,稻草组合和苜蓿组合的乙酸浓度显著高于羊草组合和麦壳组合(P<0.05);在发酵24和48 h时各组合之间乙酸浓度差异不显著(P>0.05)。在各时间点,各组合间丙酸和丁酸浓度以及A/P差异不显著(P>0.05)。
| 表7 不同饲料组合体外发酵12、24和48 h的VFA浓度变化
Table 7 VFA concentration changes of different feed combinations after 12, 24 and 48 h in vitro fermentation
|
不同类型的饲料原料作为底物在体外发酵时,其GP是有差异的。通常情况下,易发酵碳水化合物含量高的能量饲料在24 h之内GP就可达到最高峰,蛋白质饲料在48 h内GP可达到高峰,但含结构性碳水化合物较多的粗饲料的GP最高峰在48 h以后才出现[11]。试验1中发酵底物为粗饲料,底物的结构性碳水化合物含量高,各粗饲料的最高GP在48 h之后出现,玉米青贮(包括全株玉米青贮和玉米秸青贮)和苜蓿(包括国产苜蓿和美国苜蓿)的发酵启动时间短,这暗示这2类粗饲料相对其他粗饲料含有更多的易发酵碳水化合物,更易被微生物利用。试验2中豆粕发酵48 h的GP最高,这说明了豆粕含有的易发酵碳水化合物和可发酵成分高于其他蛋白质饲料。棕榈粕的发酵停滞期长,发酵速度慢,豆粕的发酵停滞期短,发酵速度快,原因可能是中性洗涤纤维(neutral detergent fiber,NDF)/粗蛋白质(crude protein,CP)影响了发酵停滞期和发酵速度。豆粕的NDF/CP为0.21,而棕榈粕的NDF/CP则高达3.85;CP为易发酵成分,NDF为不易发酵成分,当这个比例低时发酵停滞期短,发酵速度快,比例高时停滞期长,发酵速度慢。试验3的底物为粗饲料和精料(6∶ 4)的混合物,相对于试验1和试验2,各组合产气高峰提前,GP增多,且各组合GP接近,整体趋势相同,这可能是由于精粗料混合后,易发酵的营养成分和不易发酵的结构性碳水化合物的比例较单一饲料合理,因而更容易被瘤胃微生物利用,更适合微生物的生长。
不同粗饲料的DMD有一定的差异。本试验 中,玉米青贮和苜蓿的DMD偏高,玉米青贮的DMD在60%左右,苜蓿的DMD在55%左右。玉米青贮的DMD高主要是因为青贮后的玉米富含非结构性碳水化合物,可消化的有机物(organic matter,OM) 含量高,很容易被瘤胃微生物发酵利用。而苜蓿DMD高的原因可能是其碳氮比合适,更易被微生物利用。此外,玉米青贮和苜蓿的粗灰分(ash)和酸性洗涤纤维(acid detergent fiber,ADF)含量较低也是其DMD较高的原因。试验1中麦壳的DMD最低,这可能是因为麦壳中硅酸盐和蜡质含量较高[12],不适合微生物的附着和生长。
在以粗饲料为底物的体外消化试验中,NDFD往往能反映出DMD。本试验所测得的体外发酵48 h的NDFD和DMD之间存在强正相关性,NDFD和ADFD之间存在强正相关性。这与张桂杰等[13]的结果不一致,原因可能是试验所用底物和瘤胃液的来源不同。
VFA是反刍动物维持和生产的主要能量来源,当饲料类型不同时,VFA的浓度和组成都会有所改变。试验1中各粗饲料的VFA中皆以丙酸的浓度为最高;10种粗饲料中,玉米秸青贮的TVFA浓度最高,然而它的A/P却最低,而麦壳的TVFA浓度最低,它的A/P却较高;从营养成分来看,玉米秸青贮的NDF比麦壳的低许多,即玉米秸青贮的易发酵碳水化合物比麦壳多。相关性分析表明,体外发酵48 h时,TVFA与DMD存在强正相关性。
NH3-N是瘤胃内饲料蛋白质降解及微生物对NH3-N利用的综合反映。瘤胃中NH3-N浓度过高或过低都不利于微生物的生长繁殖。Murphy等[14]的研究显示微生物发酵的最佳NH3-N浓度为6.3~27.5 mg/dL。试验2中豆粕和菜籽粕发酵48 h时NH3-N浓度已经超出了微生物发酵的最佳浓度。在发酵瓶中NH3-N的主要来源为微生物对底物含氮物质的降解,而生成的NH3-N有2个主要去向,一部分被微生物用来合成MCP,另一部分溶解在发酵液中(发酵瓶不具有吸收和排出NH3-N的能力)。碳水化合物是限制瘤胃微生物利用NH3-N的主要因素。因此,豆粕和菜籽粕发酵48 h时NH3-N浓度超出最佳浓度的原因可能是:1)2种底物的CP含量高;2)2种底物的可发酵碳水化合物偏少,限制了微生物的活性和对NH3-N的摄取和转化。
MCP是反刍动物最主要的氮源供应者,能提供反刍动物蛋白质需要的40%~80%。当瘤胃中氨和能量不同步释放,可导致可发酵底物利用率下降和MCP合成量减少[15]。试验3中,各组合发酵24 h的MCP浓度相对于发酵12 h的MCP浓度增幅较大,而发酵48 h的MCP浓度相对于发酵24 h的MCP浓度却基本持平,这可能暗示在该试验发酵条件下瘤胃微生物的量已经达到动态平衡。尽管试验2中各底物的CP含量远高于试验3中各底物的CP含量,但是试验3中各底物发酵48 h的MCP浓度都高于试验2中各底物发酵48 h的MCP浓度,这可能是因为试验3通过精粗料的一定比例搭配提高了能量、碳架和氮源释放的同步性。
饲料中NDF/CP的不同既会影响体外发酵的特性,也会影响瘤胃的发酵特性。史良等[16]研究发现,随着NDF/CP的升高,发酵液中TVFA的浓度降低。陈福财等[17]的研究发现,玉米秸青贮与豆粕组合饲料的降解率一直随着蛋白质含量的增加而增加,未出现下降现象。通过对试验数据进行相关性分析,本试验发现饲料NDF/CP与DMD(R=-0.481,P=0.037)、TVFA(R=-0.651,P=0.012)均呈显著负相关。可能原因是:1)随着CP含量的增加,蛋白质降解生成的小肽、支链脂肪酸、氨基酸和NH3-N浓度升高,微生物合成的MCP的量也增加,微生物的代谢和繁殖加快,发酵瓶中微生物的数量迅速增加,因此DMD升高,同样的微生物发酵碳水化合物产生的TVFA也增加;2)NDF/CP的减小也可能是NDF含量下降所致,即中性洗涤可溶物(neutral detergent solubles,NDS)(蛋白质除外)含量的增加,NDS含量的增加可以提高TVFA的产量和DMD;3)底物的纤维含量较高,蛋白质含量未出现过剩,当蛋白质含量增加时,底物的能氮比更趋于平衡,从而更有利于微生物的生长和发酵,最终提高对底物的降解。
① 对于粗饲料,玉米青贮和苜蓿类饲料的体外发酵GP较高,发酵速度快;麦壳的体外发酵GP较低,发酵速度慢。
② 对于蛋白质饲料,豆粕在体外发酵48 h的GP、发酵速度和MCP浓度均高于其他蛋白质饲料。
③ 对于饲料组合,NDF/CP会影响饲料的体外发酵特性,表现为NDF/CP越小,其发酵延滞期越短、发酵速度越快、降解率越高。
| [1] | 雷冬至,金曙光,乌仁塔娜.用体外产气法评价不同粗饲料与相同精料间的组合效应[J]. 饲料工业,2009,30(3):30-33. ( 1) 1)
|
| [2] | 邓露芳,范学珊,王加启.微生物发酵粕类蛋白质饲料的研究进展[J]. 中国畜牧兽医,2011,38(6):26-27. ( 1) 1)
|
| [3] | 张子仪.中国饲料学[M]. 北京:中国农业出版社,2000:289-290. ( 1) 1)
|
| [4] | MENKE K H,RAAB L,SALEWSLI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. Journal of Agriculture Science,1979,93(1):217-222. ( 1) 1)
|
| [5] | 杨胜.饲料分析及饲料质量检测技术[M]. 北京:北京农业大学出版社,1993:58-64. ( 2) 2)
|
| [6] | THEODOROU M K,WILLIAMS B A,DHANOA M S,et al.A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J]. Animal Feed Science and Technology,1994,48(3/4):185-197. ( 2) 2)
|
| [7] | 朱伟云,毛胜勇,王全军,等.厌氧真菌体外发酵筛选技术的研究[J]. 南京农业大学学报,2001,24(3):44-48. ( 1) 1)
|
| [8] | 秦为琳.应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农学院学报,1982(4):110-116. ( 1) 1)
|
| [9] | MAKKAR H P S,SHAVMA O P,DAWRA R K,et al.Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science,1982,65(11):2170-2173. ( 1) 1)
|
| [10] | BRODERICK G A,KANG J H.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science,1980,63(1):64-75. ( 1) 1)
|
| [11] | ROCHA J L,BAKER J F,WOMACK J E,et al.Statistical associations between restriction fragment length polymorphisms and quantitative traits in beef cattle[J]. Journal of Animal Science,1992,70(11):3360-3370. ( 1) 1)
|
| [12] | 王成章,王恬.饲料学[M]. 北京:中国农业出版社,2003:151-154. ( 1) 1)
|
| [13] | 张桂杰,罗海玲,张英俊,等.应用体外产气与活体外消化率法评定盛花期白三叶牧草营养价值[J]. 中国农业大学学报,2010,15(2):53-57. ( 1) 1)
|
| [14] | MURPHY J J,KENNELLY J J.Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science,1987,70(9):1841. ( 1) 1)
|
| [15] | 马慧,苗树君,刘君,等.反刍动物日粮正组合效应的调控及优化配制[J]. 黄牛杂志,2005,31(6):47-50. ( 1) 1)
|
| [16] | 史良,刁其玉.体外产气法评定不同来源中性洗涤纤维与粗蛋白质间组合效应[J]. 中国饲料,2008(14):18-21. ( 1) 1)
|
| [17] | 陈福财,吴秋珏,周占琴.绵羊日粮中不同来源NDF与粗蛋白组合物的体外消化率和氨氮水平的研究[J]. 中国农学通报,2011,27(20):19-23. ( 1) 1)
|




