2. 广西大学动物科学技术学院, 南宁 530004
2. College of Animal Science and Technology, Guangxi University, Nanning 530004, China
仔猪自然断奶是一个逐步的过程,需要到10~12周龄才能完成。而在商业化生产条件下,为了缩短猪的生产周期来提高经济效益,普遍采用3~5周龄的早期断奶法。早期断奶使仔猪容易遭受致病菌侵袭和感染产生腹泻、生长受阻甚至死亡,给养猪生产造成巨大经济损失。断奶应激对肠道的影响最大,肠道形态结构和功能都受到了非常大的刺激而引发变化。肠道菌群是动物重要的屏障,对其健康和生长等起着重要作用[1, 2]。因此,理解断奶前后仔猪肠道菌群的变化相当重要。
近年来,研究者们应用了一系列分子生物学手段用于微生物群落结构分析,包括荧光原位杂交[3]、建克隆文库[4]、变性凝胶电泳[5]、末端限制性长度多态性[6]等方法。然而,由于这些传统的分子生物学方法固有的局限性,它们仍然不能完全反映整个微生物群落信息。与传统分子生物学技术相比,新一代测序技术描述微生物群落信息更全面、更准确[7]。目前,在微生物生态学研究中应用最广泛的是454焦磷酸测序技术。因此,本试验应用454焦磷酸测序技术研究断奶前后仔猪肠道菌群的变化,为深入了解猪胃肠道微生态信息以及该技术在猪胃肠道研究中的进一步应用提供基础。
随机选取胎次和出生时间相近的、体重差异不显著的健康“杜×长×大”外三元新生仔猪12头用于试验。整个试验期间由母猪按常规哺乳直到断奶(25日龄),母猪饲粮不含有抗生素。仔猪于12日龄开始饲喂教槽料,免疫程序及其他饲养管理方式按常规程序进行。
母猪饲粮参照NRC(1998)泌乳母猪营养需要进行配制,其组成及营养水平见表1。仔猪教槽料使用某品牌乳猪教槽代乳料,其原料组成为膨化玉米粉、进口鱼粉、去皮豆粕、乳清粉、食盐、石粉、磷酸氢钙、添加剂(5%喹烯酮预混剂、10%硫酸黏杆菌素预混剂、1%纳西肽预混剂、赖氨酸、蛋氨酸、苏氨酸、维生素预混料、硫酸铜、硫酸亚铁、硫酸锌、硫酸锰、亚硫酸锌、碘酸钙、油脂、酶制剂、酸化剂等),具体营养水平见表2。
| 表1 母猪饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the sow diet (air-dry basis) % |
| 表2 仔猪教槽料营养水平(风干基础) Table 2 Nutrient levels of the starting diet of piglets (air-dry basis) % |
试验过程中每天观察和记录仔猪的腹泻情况,计算腹泻率。
腹泻率(%)=[试验期内腹泻头次/(同组动物数×天数)]×100。于25日龄(断奶前)和32日龄(断奶后)分别随机挑选3头仔猪心脏放血屠宰,无菌采集盲肠内容物,装入经焦碳酸二乙酯(DEPC)处理过的Eppendorf管中,经液氮预冻后,-70 ℃保存。
断奶前后各取3个盲肠内容物样品提取DNA。DNA提取和PCR扩增参照Zhang等[8]。PCR产物割胶回收,测定DNA浓度。断奶前后样品的PCR产物,分别取100 ng等量混合。由上海同达科信生物技术发展有限公司通过高通量测序平台454 GS FLX Titanium对样品16S rRNA基因的V3区进行测序。
参照文献[9, 10, 11, 12],将获得的序列通过Mothur软件,删掉长度小于200 bp的序列,根据DNA barcode将序列确定到每个样品,并去除barcode和引物序列件。去杂后的数据与Sliva数据库比对,利用Mothur软件分别进行二次去杂和去除嵌合体。将相似度大于97%的DNA序列归为1个操作分类单元(OUT),利用Mothur软件对序列进行OUT聚类,用于样品间的相似性分析,并绘制样品的稀疏曲线,评估不同样品的多样性。将序列提交至RDP数据库得到每条序列的分类单元(RDP分类对属的域值为0.5),物种分类单元为6层(界、门、纲、目、科、属),并利用MEGAN4软件对样品的物种分类进行比较,分析断奶前后仔猪肠道菌群相对丰度。
采用SPSS 16.0统计软件,对数据进行t检验,显著水平P采用0.05,试验数据用平均值±标准误表示。
由表3可知,与断奶前相比,断奶后仔猪腹泻率显著增加(P<0.05)。
| 表3 断奶前后仔猪腹泻率 Table 3 Diarrhea rate of pre-weaning and post-weaning piglets % |
通过Mothur软件分析后,去除不合格序列,得到9 600条有效序列,得出OTU聚类分析图(图1)。由图1可见,断奶前后盲肠内容物样品在聚类图上各自聚为一簇,其中断奶前的2个样品(pre-2和pre-3)相似性最高,聚为一类后再与另外1个断奶前样品(pre-1)聚为一类;断奶后的2个样品(post-2和post-3)相似性最高,聚为一类后再与另外1个断奶后样品(post-1)聚为一类。说明来自同一处理的样品间其细菌群落组成十分相近,表明取样的稳定性。
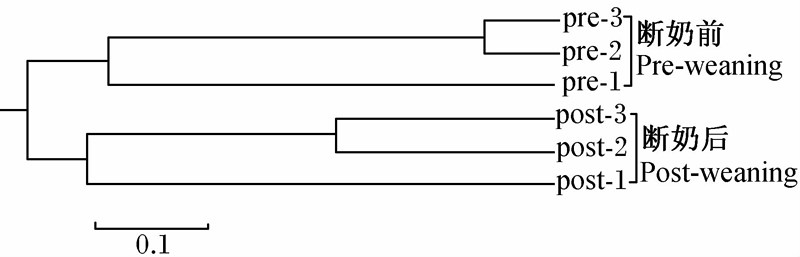 | 图1 断奶前后仔猪肠道菌群的聚类分析 Fig.1 Cluster analysis of intestinal microflora of pre-weaning and post-weaning piglets |
图2为断奶前后2条稀疏曲线,相同序列数时断奶后比断奶前的菌群OUT高,表明断奶后菌群多样性高于断奶前,说明断奶影响仔猪的肠道菌群多样性。
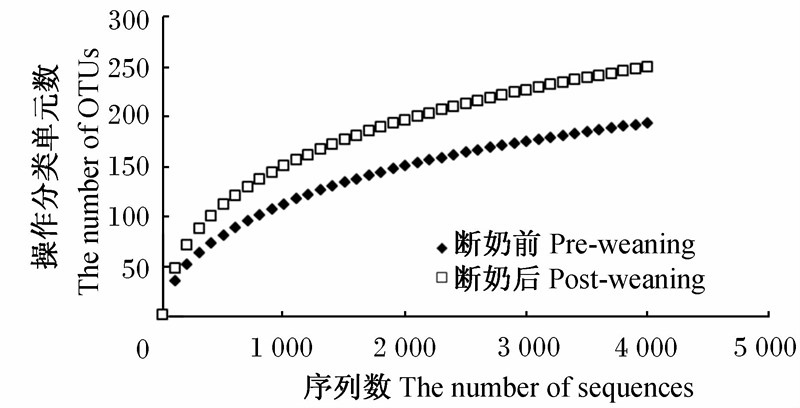 | 图2 断奶前后仔猪肠道菌群稀疏曲线分析 Fig.2 Rarefaction curve analysis of intestinal microflora of pre-weaning and post-weaning piglets |
由表4可知,断奶前后肠道中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)为优势菌,占菌群的70%以上。与断奶前相比,断奶后拟杆菌门(Bacteroidetes)含量变化不显著(P>0.05),厚壁菌门含量显著增加了63.95%(P<0.05),梭杆菌门(Fusobacteria)和变形菌门含量分别显著减少了100.00%和70.54%(P<0.05)。
| 表4 断奶前后仔猪肠道菌群结构 Table 4 Structure of intestinal microflora of pre-weaning and post-weaning piglets % |
由表5可知,对厚壁菌门含量进行深入分析发现,在纲的水平其组成也各不相同。与断奶前相比,断奶后肠道中梭菌纲(Clostridia)和芽孢杆菌纲(Bacilli)含量有减少的趋势(P>0.05),而Negativicutes纲、Erysipelotrichia纲和未知厚壁菌纲含量有增加的趋势(P>0.05)。
| 表5 断奶前后仔猪肠道厚壁菌纲水平组成 Table 5 Firmicutes composition by class in intestine of pre-weaning and post-weaning piglets % |
由图4可知,从门到属的水平,断奶前后肠道中各菌相对丰度不同。在属的水平上,断奶前后共同拥有17种菌,但有些菌是断奶前仔猪肠道特有的,如嗜胆菌属(Bilophila)、具核梭杆菌属(Fusobacterium nucleatum)、黄杆菌属(Flavobacteriaceae)等,有些菌是断奶后仔猪特有的,如费克蓝姆菌属(Facklamia)、八叠球菌属(Sarcina)等。
断奶过渡是个复杂的过程,此期间仔猪离开母猪并在新的环境中与其他仔猪生活,食物从易消化的奶向不易消化的固体食物转变,使其遭受应激。断奶应激严重影响肠道正常菌群的建立,加之食物残渣中的营养物质可促进致病菌生长和数量快速增加,此时胃肠道对感染性致病菌,尤其是对革兰氏阴性菌特别敏感,感染的机率显著上升,仔猪极易发生腹泻,造成生产上的严重损失[13, 14, 15]。瞿继跃等[16]试验表明,仔猪多在断奶后3~4 d开始腹泻,6~9 d腹泻达到高峰,3周内腹泻率可达79.3%。本研究也发现,断奶后1周仔猪腹泻率显著增加。
断奶应激导致肠道正常的微生态平衡失调,生物屏障功能遭到破坏,改变仔猪肠道菌群的组成和数量,使乳杆菌数量下降,肠杆菌与乳杆菌比例上升[14]。本研究发现,断奶1周后,肠道中梭杆菌门和变形菌门含量显著降低,厚壁菌门含量显著增加。芽孢杆菌纲是厚壁菌门的一纲,包含有芽孢杆菌目和乳杆菌目2目,其下包含有芽孢杆菌属等革兰氏阳性菌,在维持动物肠道健康中起重要作用。变形菌门是革兰氏阴性细菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌、沙门氏菌、弧菌、螺杆菌等种类[17]。左之才等[18]发现,仔猪肠道菌群改变主要表现为与健康仔猪相比,腹泻仔猪各肠段的类杆菌、大肠杆菌、梭菌数量显著升高,双歧杆菌、乳杆菌数量显著降低。何明清等[19]检测了仔猪菌群失调时的肠道菌群变化,除肠球菌、葡萄球菌、消化球菌、酵母菌、芽孢杆菌等8个菌群的数量无变化外,在空肠,大肠杆菌数量增加,类杆菌数量减少,双歧杆菌数量减少;在直肠,大肠杆菌数量增加,乳酸杆菌数量减少,类杆菌数量减少。这表明仔猪断奶腹泻时,大肠杆菌在空肠迅速繁殖,乳酸杆菌、双歧杆菌、类杆菌数量显著下降。拟杆菌门是哺乳动物肠道内第2大优势细菌类群,参与碳水化合物发酵、多糖代谢、胆汁酸和类固醇等养分代谢,维持肠道正常的生理功能和微生态平衡,对动物生长和健康有重要意义[17, 20]。研究表明,哺乳动物断奶后,由含脂肪相对较高的乳汁转变成富含碳水化合物的饲粮时,其肠道的多形拟杆菌开始大量增殖[21]。也有报道显示,多形拟杆菌能降解难被宿主消化的饲粮多糖,并促进宿主对这些养分的消化和吸收[22]。由此可见,整个肠道菌群的数量和适当的比例对于维持肠道内环境微生态平衡以及仔猪的健康状态等有重要意义。目前,许多学者研究采用人为因素调整仔猪肠道微生物平衡提高有益菌的数量,降低大肠杆菌、梭菌的数量,从而降低仔猪腹泻的发生率[18]。
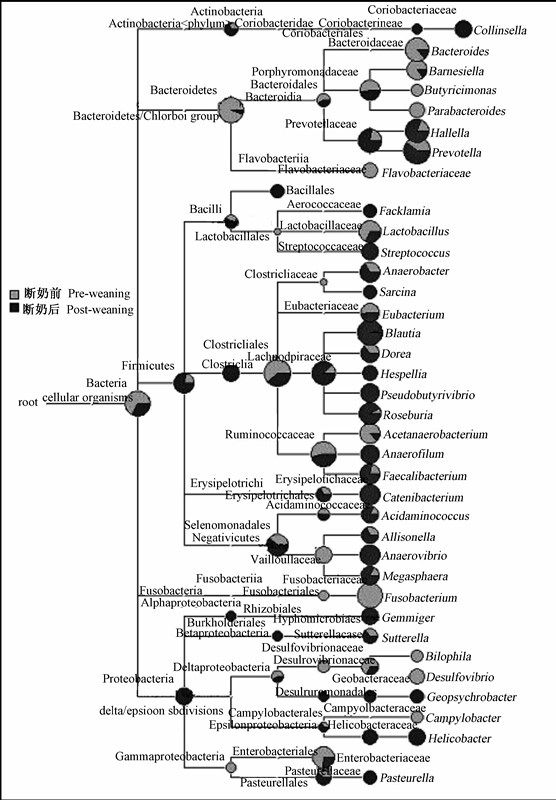 | 图3 断奶前后仔猪肠道菌群变化
Fig.3 Changes of intestinal microflora of pre-weaning and post-weaning piglets |
① 断奶后,仔猪腹泻率增加,肠道菌群多样性升高。
② 断奶前后肠道中厚壁菌门是优势菌,与断奶前相比,断奶1周后,梭杆菌门和变形菌门含量显著降低。
| [1] | BROOM L J,MILLER H M,KERR K G,et al.Effects of zinc oxide and Enterococcus faecium SF68 dietary supplementation on the performance,intestinal microbiota and immune status of weaned piglets[J]. Research in Veterinary Science,2006,80(1):45-54. ( 1) 1)
|
| [2] | MALLO J J,RIOPEREZ J,HONRUBIAA P.The addition of Enterococcus faecium to diet improves piglet's intestinal microbiota and performance[J]. Livestock Science,2010,133(1/2/3):176-178. ( 1) 1)
|
| [3] | EGLI K,LANGER C,SIEGRIST H R,et al.Community analysis of ammonia and nitrite oxidizers during start-up of nitritation reactors[J]. Applied and Environmental Microbiology,2003,69(6):3213-3222. ( 1) 1)
|
| [4] | FIFUEROLA E L M,ERIJMAN L.Bacterial taxa abundance pattern in an industrial wastewater treatment system determined by the full rRNA cycle approach[J]. Environmental Microbiology,2007,9(7):1780-1789. ( 1) 1)
|
| [5] | STAMPER D M,WALCH M,JACOBS R N.Bacterial population changes in a membrane bioreactor for graywater treatment monitored by denaturing gradient gel electrophoretic analysis of 16S rRNA gene fragments[J]. Applied and Environmental Microbiology,2003,69(2):852-860. ( 1) 1)
|
| [6] | WANG X H,WEN X H,YAN H J,et al.Bacterial community dynamics in a functionally stable pilot-scale wastewater treatment plant[J]. Bioresource Technology,2011,102(3):2352-2357. ( 1) 1)
|
| [7] | ROESCH L F,FULTHORPE R R,RIVA A,et al.Pyrosequencing enumerates and contrasts soil microbial diversity[J]. The ISME Journal,2007,1(4):283-290. ( 1) 1)
|
| [8] | ZHANG X P,FU L Q,DENG B,et al.Bacillus subtilis SC02 supplementation causes alterations of the microbial diversity in grass carp water[J]. World Journal of Microbiology Biotechnology,2013,29(9):1645-1653. ( 1) 1)
|
| [9] | SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology,2009,75:7537-7541. ( 1) 1)
|
| [10] | PRUESSE E,QUAST C,KNITTEL K,et al.SILVA:a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB[J]. Nucleic Acids Research,2007,35(21):7188-7196. ( 1) 1)
|
| [11] | WANG Q,GARRITY G M,TIEDJE J M,et al.Nave Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology,2007,73(16):5261-5267. ( 1) 1)
|
| [12] | HUSON D H,MITRA S,RUSCHEWEYH H J,et al.Integrative analysis of environmental sequences using MEGAN4[J]. Genome Research,2011,21(9):1552-1560. ( 1) 1)
|
| [13] | JOHNSON I R,BALL R O,BARACOS V E,et al.Glutamine supplementation influences immune development in the newly weaned piglet[J]. Developmental and Comparative Immunology,2006,30(12):1191-1202. ( 1) 1)
|
| [14] | CASTILLO M,MARTÍN-ORE S M,NOFRARÍAS M,et al.Changes in caecal microbiota and mucosal morphology of weaned pigs[J]. Veterinary Microbiology,2007,124(3/4):239-247. ( 2) 2)
|
| [15] | SU Y,YAO W,PEREZ-GUTIERREZ O N,et al.16S ribosomal RNA-based methods to monitor changes in the hindgut bacterial community of piglets after oral administration of Lactobacillus sobrius S1[J]. Anaerobe,2008,14(2):78-86. ( 1) 1)
|
| [16] | 瞿继跃,周志洪,储国华,等.仔猪断奶腹泻及断奶前期限饲对增重的影响[J]. 杭州农业科技,2000(3):72-74. ( 1) 1)
|
| [17] | BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册[M]. 8版.中国科学院微生物研究所,译.北京:科学出版社,1984:729-735. ( 2) 2)
|
| [18] | 左之才,刘兵,李莉,等.早期断乳应激性腹泻对仔猪肠道形态结构与肠道菌群的影响[J]. 中国兽医科学,2012,42(1):64-68 ( 2) 2)
|
| [19] | 何明清,廖德惠,谢镜怀,等.猪不同日龄及不同肠段正常肠菌群的研究[J]. 畜牧兽医学报,1985,16(1):67-42. ( 1) 1)
|
| [20] | SEARS C L.A dynamic partnership:celebrating our gut flora[J]. Anaerobe,2005,11(5):247-251. ( 1) 1)
|
| [21] | USHIJIMA T,TAKAHASHI M,TATEWAKI K,et al.A selective medium for isolation and presumptive identification of the Bacteriodes fragilis group[J]. Microbiology and Immunology,1983,27(12):985-993. ( 1) 1)
|
| [22] | HOOPER L V,WONG M H,THELIN A,et al.Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science,2001,291(5505):881-884. ( 1) 1)
|




