2. 农业部动物疾病临床诊疗技术重点实验室, 呼和浩特 010018;
3. 内蒙古医科大学, 呼和浩特 010110;
4. 内蒙古农牧业科学院动物营养研究所, 呼和浩特 010031
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease, Ministry of Agriculture, Hohhot 010018, China;
3. Inner Mongolian Medical University, Hohhot 010110, China;
4. Animal Nutrition Institute, Inner Mongolian Academy of Agriculture and Animal Sciences, Hohhot 010031, China
亚急性瘤胃酸中毒(SARA)是一种典型的能量代谢疾病,在饲养良好的奶牛和肉牛群尤为多见和频发,对动物的健康和高效生产极其不利。虽然有众多学者对其发病机理作了大量的研究,但关于SARA发生的具体机制至今仍存在较大分歧,需要更深入的研究。SARA是由于反刍动物长时间过食了大量的精料,精料中含有易发酵碳水化合物(淀粉和葡萄糖)从而引发的一种能量代谢性疾病,且瘤胃液pH长时间在5.5~5.8之间波动。SARA在临床上没有明显的特征表现,主要表现在瘤胃内挥发性脂肪酸增加,瘤胃液pH降低,瘤胃乳头大面积脱落,最终导致瘤胃乳头出血、发炎、溃疡,但这些症状对动物机体的损害是缓慢和逐渐加重的,使动物长期处于亚健康状态,引起了奶业从业者和科研人员的高度关注。近些年的研究发现,SARA可破坏瘤胃黏膜的完整性,其发病机制与瘤胃黏膜屏障功能破坏,通透性增加密切相关[1, 2]。细胞增殖与凋亡是细胞生命活动的2个重要过程,两者既对立又统一。正常组织的细胞处于不断增殖和不断凋亡的动态平衡状态,细胞增殖与凋亡必须同步协调,才能维持黏膜的完整性,从而确保其功能正常。目前关于胃肠上皮细胞增殖、凋亡与疾病之间关系的研究多集中于人类医学与单胃动物,在反刍动物的研究较少,关于SARA对瘤胃、瓣胃上皮细胞增殖与凋亡的研究在国内外更是鲜见报道。为此,本研究通过逐渐提高饲粮非纤维性碳水化合物与中性洗涤纤维比(NFC/NDF)的方式来诱导奶山羊发生SARA,通过测定瘤胃、瓣胃黏膜蛋白质、DNA和RNA含量增以及殖细胞核抗原(PCNA)和原位末端标记(TUNEL)阳性细胞数,探讨上皮细胞增殖与凋亡在瘤胃、瓣胃黏膜屏障损害中的作用,为从细胞增殖与凋亡角度深入了解SARA对瘤胃黏膜屏障功能的影响提供理论依据。
选取8只健康的处于泌乳期的关中奶山羊为试验动物,按体重、泌乳量相近原则随机分为对照组(n=2)、SARA组(n=3)和恢复组(n=3)。对照组饲喂基础饲粮(NFC/NDF为1.02);SARA组分为4期饲喂,通过饲喂NFC/NDF分别为1.02、1.24、1.63、2.58的试验饲粮诱导SARA发生,每期15 d;恢复组前期饲喂方法与SARA组相同,待SARA诱导成功后,让奶山羊自由采食青干草4周,使试验奶山羊逐渐恢复。整个试验期,试验动物采用单笼饲养,每天07:00和19:00分2次等量饲喂,自由饮水。
试验饲粮参照NRC(1981)奶山羊营养需求配制。试验饲粮组成及营养水平见表1。
| 表1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) % |
苏木素色精(福州迈新生物技术开发有限公司)、4%戊二醛、考马斯亮蓝G-250染料试剂、DNA提取试剂盒(天根公司)、总RNA提取试剂盒(天根公司)、TUNEL试剂盒(瑞士Roche公司)、免疫组化试剂盒(丹麦Dako公司)。
pH电极(450CD,美国Sensorex公司)、pH变送器(692,美国Jenco公司)、无纸记录仪(R4100)、可见光分光光度计(北京普析通用仪器有限责任公司)、荧光显微镜(BH-X5,日本Olympus公司)、病理图像分析仪、透射电子显微镜(JEM1230,日本JEOL公司)。
动态pH连续监测记录系统主要由pH电极、pH变送器和无纸记录仪组成。使用前先用pH 4.00和pH 7.00标准液进行标定,然后将pH电极通过瘤胃瘘管插入瘤胃内,同时电极下挂有一定的重物保证电极处于瘤胃腹囊中。通过变送器将信号输入到无纸记录仪上。无纸记录仪设定为每隔5 min记录1次pH,上传到计算机上进行数据分析。数据分析计算pH平均值、最大值、最小值,以及pH为5.2~(<5.5)所持续时间,该阶段视为试验动物处于SARA状态。
对照组、SARA组和恢复组试验奶山羊宰杀前禁食12 h,宰杀后立即取瘤胃后背盲囊、后腹盲囊、前腹盲囊、前背盲囊及瓣胃组织块,去肌层,剔除结缔组织,去掉内容物后用无菌生理盐水反复冲洗干净,然后以吸水纸吸干组织块表面水分,用载玻片刮取各部位并立即置于冻存管中,标记后置于-80 ℃冰箱中保存待用;取上述组织块(1 mm×1 mm×1 mm)置于4%戊二醛溶液中固定,用于电镜的观察;取组织块(1 cm×1 cm)若干放于10%的福尔马林中固定,进行PCNA和TUNEL的检测。
取瘤胃后背盲囊、后腹盲囊、前腹盲囊、前背盲囊及瓣胃组织块(1 mm×1 mm×1 mm)置于4%戊二醛溶液中固定,用于电镜切片的制作,分别观察对照组、SARA组及恢复组瘤胃及瓣胃上皮细胞中细胞器的变化及是否有凋亡小体的形成。
以牛血清白蛋白作为标准,参照Lowry等[3]的方法测定蛋白质含量;DNA和RNA含量测定采用二苯胺法[4],以小牛胸腺DNA作为标准,RNA含量通过测定260和332 nm处的吸光值,用Fleck-Begg公式[5]算出。
采用En-Vosion法免疫组织化学染色标记PCNA、PCNA一抗(英国Abcam公司)。
石蜡切片常规脱蜡至水→磷酸盐缓冲液(PBS)洗3次,每次3 min →细胞松弛素B(CB)热诱导修复,室温自然冷却→PBS洗3次,每次3 min→0.3%过氧化氢(H2O2)抑制内源性过氧化物酶室温孵育20 min→PBS洗3次,每次3 min→20%羊血清室温孵育30 min→滴加适当稀释特异性一抗37 ℃孵育2 h→PBS洗3次,每次3 min→En-Vision试剂(HRP-R/M)37 ℃孵育30 min→PBS洗3次,每次3 min→二氨基联苯胺(DAB)显色8~12 min,苏木素精衬染,热水蓝化→吹干后树脂封片→镜下观察。
参照许岸高等[6]的标准每张切片在普通光学显微镜下连续观察至少5个以上高倍视野计数阳性细胞数,细胞核着棕褐色即为阳性染色细胞。随机计数瘤胃、瓣胃上皮细胞总数和PCNA阳性细胞数,计算增殖指数,公式为:
增殖指数(%)=100×PCNA阳性细胞数/总细胞数。参考Gavrieli等[7]方法,应用TUNEL试剂盒,结合说明书的方法,稍有改动。
石蜡切片常规脱蜡至水→PBS洗3次,每次3 min→蛋白酶K(20 μg/mL)孵育20 min→PBS洗3次,每次3 min→4%多聚甲醛溶液孵育5 min→PBS洗3次,每次3 min→TUNEL混合液→PBS洗3次,每次3 min→1∶ 500辣根过氧化物酶标记链霉亲和素(streptavidin-HRP)孵育30 min→PBS洗3次,每次3 min→DAB+H2O2显色30 min→去离子水漂洗若干次→吹干、树脂封片→镜下观察。
每张切片在普通光学显微镜下连续观察至少5个以上高倍视野计数阳性细胞数,凋亡细胞即为细胞核中出现棕褐色颗粒或者细胞核质呈均匀的棕褐色者,随机计数瘤胃、瓣胃上皮细胞总数和TUNEL阳性细胞数,计算凋亡指数,公式为:
凋亡指数(%)=100×TUNEL阳性细胞数/总细胞数。试验数据用平均值±标准差表示,采用SAS 9.0软件中的ANOVA对数据进行方差分析,用Duncan氏法进行多重比较,P<0.05为差异显著。
由表2可以看出,随着饲粮NFC/NDF的增加,瘤胃液pH平均值、最大值及最小值均呈降低趋势,平均值从6.32降到5.64,最小值从5.64降至5.16;瘤胃液pH为5.5~(<5.8)和5.2~(<5.5)的持续时间呈显著性增加(P<0.05),分别由1.13和0 h逐渐延长到18.50和7.58 h,各饲粮NFC/NDF下均未出现瘤胃液pH<5.2。
| 表2 饲粮NFC/NDF对瘤胃液pH动态变化的影响 Table 2 Effects of dietary NFC/NDF on dynamic changes of rumen fluid pH |
随着饲粮NFC/NDF的增加,瘤胃内逐渐趋于酸化,瘤胃酸中毒的程度也逐步加深。当NFC/NDF达2.58时,瘤胃液pH在5.2~(<5.5)的持续时间达7.58 h,但并没有持续降到5.2以下,提示此时试验动物发生了SARA。
由图1和图2可以看出,对照组瘤胃及瓣胃上皮细胞微绒毛较整齐,细胞核较大,核染色质均匀,细胞器结构未见异常。SARA组上皮细胞微绒毛排列不整齐,线粒体肿胀、峭断裂,核固缩,核型不规则,核膜表面凸凹不平,染色质边集化,细胞核碎裂,胞浆浓缩,可见凋亡小体形成。
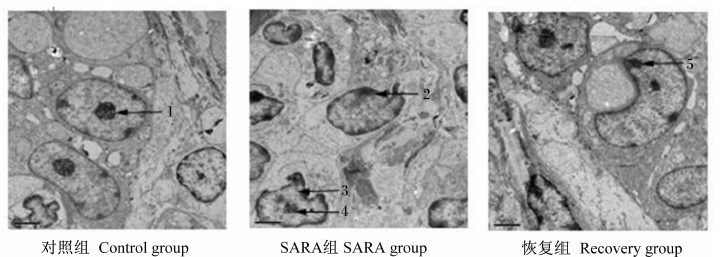 | 图1 瘤胃上皮细胞透射电镜检查结果 Fig.1 The results of transmission electron microscopy of rumen epithelial cells (5 000×) 1:细胞核 nuclear,2:核型不规则 cellular swelling non-regular shape of nuclear,3:细胞表面不整齐 untidily cell surface,4:核膜表面凸凹不平 rough and uneven in surface of nuclear membrane,5:细胞核碎裂 nuclear fragmentation。 |
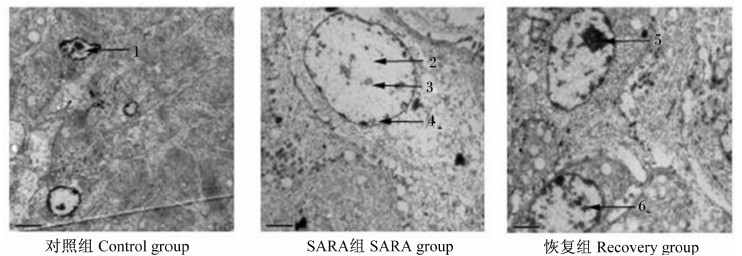 | 图2 瓣胃上皮细胞透射电镜检查结果 Fig.2 The results of transmission electron microscopy of omasum epithelial cells (5 000×) 1:细胞核 nuclear,2:细胞肿胀,3:核型不规则 non-regular shape of nuclear,4:染色质边集化 chromatin margination,5:核膜表面凸凹不平 rough and uneven in surface of nuclear membrane,6:细胞核碎裂 nuclear fragmentation。 |
由表3可以看出,SARA组瘤胃黏膜蛋白质含量显著低于对照组和恢复组(P<0.05),恢复组显著低于对照组(P<0.05)。SARA组和恢复组DNA含量显著低于对照组(P<0.05),SARA组和恢复组差异不显著(P>0.05)。SARA组RNA含量显著低于对照组和恢复组(P<0.05),对照组和恢复组间差异显著(P<0.05)。恢复组瘤胃黏膜RNA/DNA最高,SARA组最低,3组间差异均不显著(P>0.05)。
| 表3 SARA对瘤胃和瓣胃黏膜蛋白质、DNA和RNA含量的影响 Table 3 Effects of SARA on protein, DNA and RNA contents in rumen and omasum mucosa mg/g |
与对照组相比,SARA组和恢复组瘤胃黏膜蛋白质含量分别下降了44%和20%,DNA含量分别下降了51%和44%,RNA含量分别下降了94%和58%;与恢复组相比,SARA组蛋白质、DNA和RNA含量分别下降了30%、13%和88%。
恢复组瓣胃黏膜蛋白质含量显著低于对照组和SARA组(P<0.05),对照组与SARA组差异不显著(P>0.05)。恢复组瓣胃黏膜RNA/DNA最高,SARA组最低,3组间差异均不显著(P>0.05)。
与对照组相比,SARA组瓣胃黏膜蛋白质含量增加了3%,恢复组下降了55%;SARA组和恢复组DNA含量分别下降了1%和1%;SARA组和恢复组RNA含量分别下降了17%和7%。与恢复组相比,SARA组蛋白质含量提高了133%,RNA含量下降了3%,DNA含量无变化。
PCNA阳性细胞染色后呈棕褐色(图3)。由表4可以看出,SARA组瘤胃上皮细胞增殖指数为35.00%,显著低于对照组(64.67%)(P<0.05),恢复组为50.33%,与对照组差异不显著(P>0.05),显著高于SARA组(P<0.05)。
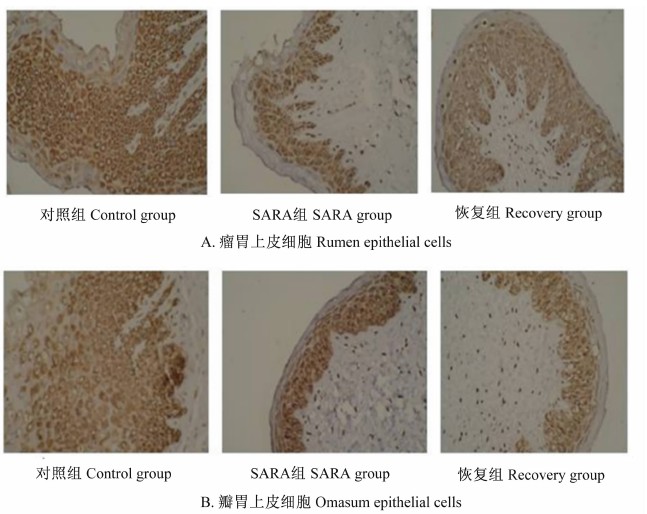 | 图3 瘤胃和瓣胃上皮细胞中PCNA阳性细胞 Fig.3 PCNA positive cells in rumen and omasum epithelial cells (200×) |
| 表4 SARA对瘤胃和瓣胃上皮细胞增殖指数的影响 Table 4 Effects of SARA on proliferation index of rumen and omasum epithelial cells % |
对照组、SARA组瓣胃上皮细胞增殖指数分别为64.67%、42.33%、42.67%,对照组显著高于恢复组和SARA组(P<0.05),SARA组与恢复组差异不显著(P>0.05)。
凋亡细胞(TUNEL阳性细胞)染色后细胞核,呈棕褐色,正常细胞细胞核呈绿色(图4)。
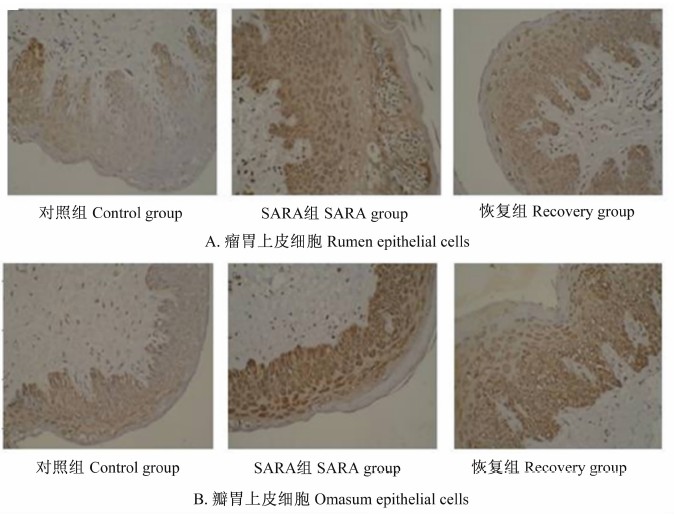 | 图4 瘤胃和瓣胃上皮细胞中TUNEL阳性细胞 Fig.4 TUNEL positive cells in rumen and omasum epithelial cells (200×) |
由表5可以看出,SARA组瘤胃上皮细胞凋亡指数为62.5%,显著高于对照组(14.50%)(P<0.05)。恢复组凋亡指数为42.00%,高于对照组,且低于SARA组,差异均显著(P<0.05)。
| 表5 SARA对瘤胃及瓣胃上皮细胞凋亡指数的影响 Table 5 Effects of SARA on apoptosis index of rumen and omasum epithelial cells % |
而对照组、SARA组及恢复组瓣胃上皮细胞凋亡指数分别为9.33%、58.00%、46.67%,SARA组与对照组相比差异显著(P<0.05),而与恢复组相比差异不显著(P>0.05)。
由表6可以看出,SARA组瘤胃上皮细胞AI/PI为1.78,显著高于对照组(0.23)(P<0.05)。恢复组为0.87,高于对照组,且低于SARA组,差异均显著(P<0.05)。
| 表6 SARA对瘤胃和瓣胃上皮细胞AI/PI的影响 Table 6 Effects of SARA on the ratio of apoptosis index and proliferation index of rumen and omasum epithelial cells |
对照组、SARA组及恢复组瓣胃上皮细胞AI/PI分别为0.14、1.45、1.11,SARA组与对照组相比差异显著(P<0.05),而与恢复组相比差异不显著(P>0.05)。
机体生长发育的基础是细胞数目的增殖和体积的增大,其中蛋白质、DNA和RNA又是细胞增殖的基础。从根本上讲动物机体的生长代谢是一些生物大分子(蛋白质、DNA和RNA)不断合成,又不断的代谢并最终降解的一个动态过程。机体的一切生理代谢都离不开这些生物大分子。蛋白质是构成动物机体组织、器官的主要成分,机体的生命活动离不开蛋白质。而蛋白质的合成又离不开RNA,无论是何种RNA(mRNA、tRNA或者是rRNA)都参与蛋白质的合成,因此,了解蛋白质的合成情况可以定量的测定RNA的含量变化,也可以通过RNA/DNA来更确切的了解蛋白质的合成情况。DNA是携带遗传信息的生物大分子,同时DNA又与细胞分化、细胞核体积大小密切相关。研究DNA含量就可以从单位组织中了解细胞的增殖情况。
本试验通过测定瘤胃和瓣胃黏膜蛋白质、DNA和RNA含量来揭示瘤胃和瓣胃上皮细胞增殖情况。本试验中,瘤胃黏膜RNA/DNA由高到低依次是对照组、恢复组、SARA组,而RNA/DNA更确切地反映蛋白质合成情况,因此,对照组瘤胃蛋白质合成强于恢复组,而SARA组最弱,这与直接测定蛋白质含量的结果相一致。DNA含量能够间接地反映细胞增殖情况,本试验研究发现,瘤胃黏膜DNA含量,对照组显著地高于恢复组,恢复组显著低于SARA组,证明对照组瘤胃细胞增殖量要高于恢复组和SARA组,SARA组最次。
目前,研究者普遍认为丁酸能够促进瘤胃上皮细胞的增殖。Sakata等[8]研究认为,瘤胃快速灌注丁酸后,瘤胃上皮细胞指数分裂提高,并认为丁酸能够刺激瘤胃上皮细胞进行分裂,最终引起增殖。黄智南[9]再次证明高营养水平饲粮对瘤胃上皮细胞增殖有促进作用。课题组前期研究[10]表明,奶山羊饲喂不同NFC/NDF饲粮,随着NFC/NDF增加,SARA组瘤胃丁酸浓度增加,并且高于对照组和恢复组。SARA组丁酸浓度最高,其细胞增殖反而弱于对照组和恢复组,这与黄智南[9]瘤胃灌注丁酸,瘤胃上皮细胞有增殖趋势相反。之所以出现截然不同的结果,可能与SARA模型建立方式不同,也可能是处于SARA阶段的奶山羊瘤胃内丁酸浓度过高,超出瘤胃对丁酸代谢作用,最终丁酸对瘤胃上皮细胞的增殖有抑制作用,但最主要的是SARA对瘤胃上皮细胞有损害作用。恢复组奶山羊在发生SARA后饲喂青干草,瘤胃上皮细胞增殖能力反而强于SARA组,但是与对照组相比较弱些,这可能是瘤胃丁酸浓度降低,或者是粗饲料能刺激瘤胃上皮细胞发育的原因。
本试验中,瓣胃黏膜DNA、RNA含量以及RNA/DNA各组间差异均不显著,从数值上看,对照组、恢复组、SARA组瓣胃RNA/DNA有依次降低趋势,但几乎接近,结果反映出蛋白质合成情况是:对照组瓣胃蛋白质合成略强于恢复组,而SARA组略低于恢复组。DNA含量能够间接地反映细胞增殖情况,3组奶山羊瓣胃黏膜DNA含量几乎接近,也说明了SARA对瓣胃上皮细胞增殖没有影响作用。此结论与Shen等[11]和黄智南[9]研究饲粮营养水平对瓣胃黏膜生长发育的影响不明显相一致。
细胞凋亡是机体细胞在内外环境改变的情况下,按照自身的程序,引起细胞主动性死亡,最后完成脱落、裂解而后被吞噬的过程。细胞凋亡是生命活动中的正常现象,为机体正常细胞的更新和异常细胞的清除提供了手段,对机体维持正常生理代谢功能具有重要的作用和意义。据Hall等[12]报道小肠黏膜每日每根绒毛有900~1 200个小肠上皮细胞发生凋亡,以维护肠道屏障的生理功能,确保新老细胞的更替。对于反刍动物瘤胃及瓣胃而言,上皮细胞的增殖与凋亡达到动态平衡,胃肠通透性才能保持完整,屏障功能处才能处于正常状态[13, 14, 15, 16]。近些年来,人们侧重于研究SARA对瘤胃内发酵产物影响,据胡红莲[17]、赵培厅[18]报道,SARA能引起瘤胃乳头大面积脱落。黄智南[9]研究认为,高营养饲粮能够降低瓣胃角质层细胞层数。本试验研究发现,SARA能引起瘤胃乳头脱落,降低瘤胃及瓣胃角质层厚度,结论也证实了前人的研究成果。但是人们却忽视了胃肠道上皮细胞凋亡对屏障功能的影响。本试验研究认为,瘤胃及瓣胃上皮细胞凋亡指数受饲粮NFC/NDF影响,处于SARA阶段的关中奶山羊瘤胃及瓣胃上皮细胞凋亡较对照组和恢复组显著增强,说明SARA时瘤胃及瓣胃上皮细胞发生过度凋亡。瘤胃及瓣胃上皮细胞发生过度凋亡,导致瘤胃及瓣胃屏障遭到损伤,尤其是机械屏障。瘤胃及瓣胃角质层构成了机械屏障,与胃内容物直接接触,因而受到损伤的几率最大。同时,当SARA发生时,瘤胃内挥发性脂肪酸(VFA)大量积累导致pH升高,瘤胃及瓣胃处于异常应激状态,造成瘤胃及瓣胃破损、出血及溃疡等[19],从而导致上皮细胞凋亡进一步增加,胃黏膜的通透性增高,引起屏障功能减弱,大量内毒素及细菌由瘤胃壁进入血液循环造成内毒素血症[20],进一步破坏瘤胃壁,加重了SARA的发展[21]。因而本试验可以推测SARA能促进瘤胃及瓣胃上皮细胞凋亡的发生,是导致瘤胃及瓣胃黏膜屏障功能障碍的一个重要因素。
PCNA是DNA聚合酶δ的一种辅助蛋白质,其分子质量为36 ku[22],在DNA复制过程中起着关键性作用,且仅存在于肿瘤细胞或者存在于正常增殖的细胞内。细胞的增殖状态及增殖周期与PCNA有着密切的联系,在细胞G1期,PCNA的表达快速增高,在G1/S期交界处PCNA的表达处于峰值状态,在整个细胞周期的S期PCNA表达处于持续高水平状态,到了细胞周期M期和G1早期PCNA的表达处于低水平状态。因此,PCNA被认为是细胞周期S期的特异性的分子学指标之一[23]。能够客观反映细胞的增殖程度,被研究人员作为一种理想的增殖细胞标志[24]。检测PCNA阳性细胞数(增殖指数)变化可以反映瘤胃及瓣胃黏膜损伤修复状况。本试验中,瘤胃上皮细胞增殖指数受饲粮NFC/NDF影响,SARA组瘤胃上皮细胞增殖指数显著降低,与对照组奶山羊比较差异显著,说明SARA时瘤胃上皮细胞PCNA表达减少,提示SARA对瘤胃细胞增殖有抑制作用,不利于损伤修复。恢复组增殖指数低于对照组,但显著高于SARA组,恢复组与对照组差异不显著。证明恢复组的恢复情况好于SARA组但不及对照组。3组间瓣胃上皮细胞增殖指数分别为64.67%、42.33%、42.67%,SARA组与对照组差异显著,证明SARA对瓣胃上皮细胞PCNA表达也有抑制作用,但SARA组与恢复组差异不显著。提示SARA对瓣胃上皮细胞增殖有抑制作用,不利于损伤修复。
PCNA是评价细胞增殖的重要指标,是反映细胞增殖状态的重要指标[25],细胞凋亡又是生命活动中的正常现象,为机体正常细胞的更新和异常细胞的清除提供了手段。细胞凋亡和细胞增殖必须同步协调,才能维持黏膜的完整性,从而确保胃肠屏障功能稳定发展,表现在细胞AI/PI处于定值[6],而AI/PI较凋亡指数更为准确的评价细胞动力学改变[26]。本试验中,SARA组瘤胃上皮细胞AI/PI显著高于对照组,恢复组AI/PI高于对照组且低于SARA组,而瓣胃上皮细胞AI/PI由高到底依次是SARA组、对照组、恢复组瘤胃和瓣胃上皮细胞。恢复组AI/PI略低于SARA组,但是又高于对照组,说明奶山羊在发生SARA后停止诱导其中毒,再次给予青干草可以缓解SARA症状,但是恢复不到对照组状态。因此,从AI/PI角度考虑,SARA对奶山羊瘤胃及瓣胃上皮细胞凋亡有促进作用,对增殖有抑制作用。
综上,处于SARA阶段奶山羊瘤胃及瓣胃上皮细胞凋亡指数明显要高于对照组和恢复组,而细胞增殖与凋亡指数呈现相反结果,即SARA组低于对照组和恢复组,恢复组高于SARA而低于对照组。上皮细胞的增殖与凋亡的相对平衡是维持屏障完整性的保障,因此,SARA对瘤胃及瓣胃上皮细胞增殖起到抑制作用而对凋亡起到促进作用,使其屏障功能遭到严重破坏,进而加重SARA发生。
① SARA对瘤胃及瓣胃上皮细胞凋亡有促进作用。
② SARA对瘤胃及瓣胃上皮细胞增殖有抑制作用。
| [1] | PENNER G B,OBA M,GÄBEL G,et al.A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term[J]. Journal of Dairy Science,2010,93(10):4838-4845. ( 1) 1)
|
| [2] | STEELE M A,DIONISSOPOULOS L,ALZAHAL O,et al.Rumen epithelial adaptation to ruminal acidosis in lactating cattle involves the coordinated expression of insulin-like growth factor-binding proteins and a cholesterolgenic enzyme[J]. Journal of Dairy Science,2012,95(1):318-327. ( 1) 1)
|
| [3] | LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265-275. ( 1) 1)
|
| [4] | BURTON K.A study of the conditions and mechanism of the diphenylamine reaction for the colorimetric estimation of deoxyribonucleic acid[J]. The Biochemical Journal,1956,62(2): 315-323. ( 1) 1)
|
| [5] | FLECK A,BEGG D.The estimation of ribonucleic acid using ultraviolet absorption measurements[J]. Biochimica et Biophysica Acta (BBA):Nucleic Acids and Protein Synthesis,1965,108(3):333-339. ( 1) 1)
|
| [6] | 许岸高,李韶光,刘集鸿,等.胃癌癌前病变演化与细胞凋亡和增殖的关系[J]. 中华医学杂志,1999(3):185-186. ( 2) 2)
|
| [7] | GAVRIELI Y,SHERMAN Y,BEN-SASSON S A.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J]. The Journal of Cell Biology,1992,119(3):493-501. ( 1) 1)
|
| [8] | SAKATA T,HIKOSAKA K,SHIOMURA Y,et al.Stimulatory effect of insulin on ruminal epithelium cell mitosis in adult sheep[J]. British Journal of Nutrition,1980,44(3):325-331. ( 1) 1)
|
| [9] | 黄智南.日粮营养对前胃上皮生长和组织形态的影响[D]. 硕士学位论文.南京:南京农业大学,2010. ( 4) 4)
|
| [10] | 邬宇航.亚急性瘤胃酸中毒对瘤胃、瓣胃上皮细胞增殖与凋亡的影响[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2013. ( 1) 1)
|
| [11] | SHEN Z,SEYFERT H M,LÖHRKE B,et al.An energy-rich diet causes rumen papillae proliferation associated with more IGF type 1 receptors and increased plasma IGF-1 concentrations in young goats[J]. The Journal of Nutrition,2004,134(l):11-17. ( 1) 1)
|
| [12] | HALL P A,COATES P J,ANSARI B,et al.Regulation of cell number in the mammalian gastrointestinal tract:the importance of apoptosis[J]. Journal of Cell Science,1994,107:3569-3577. ( 1) 1)
|
| [13] | ASSIMAKOPOULOS S F,SCOPA C D,ZERVONUDAKIS G,et al.Bombesin and neurotensin reduce endotoxemia,intestinal oxidative stress,and apoptosis in experimental obstructive jaundice[J]. Annals of Surgery,2005,241(5):159-167. ( 1) 1)
|
| [14] | ASSIMAKOPOULOS S F,SCOPA C D,CHARONIS A,et al.Experimental obstructive jaundice disrupts intestinal mucosal barrier by altering occludin expression:beneficial effect of bombesin and neurotensin[J]. Journal of the American College of Surgeons,2004,198(5):748-757. ( 1) 1)
|
| [15] | ASSIMAKOPOULOS S F,VAGIANOS C E,CHARONIS A S,et al.Experimental obstructive jaundice alters claudin-4 expression in intestinal mucosa:effect of bombesin and neurotensin[J]. World Journal of Gastroenterology,2006,12(21):3410-3415. ( 1) 1)
|
| [16] | SZALAY L,UMAR F,KHADEM A,et al.Increased plasma D-lactate is associated with the severity of hemorrhagic/traumatic shock in rats[J]. Shock,2003,20(3):245-250. ( 1) 1)
|
| [17] | 胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D]. 博士学位论文.呼和浩特:内蒙古农业大学,2008. ( 1) 1)
|
| [18] | 赵培厅.日粮不同NFC/NDF比对奶山羊瘤胃发酵功能和微生物区系变化的影响[D]. 硕士学位论文.呼和浩特:内蒙古农业大学,2011. ( 1) 1)
|
| [19] | 刘丹,吴跃明,陈建海.反刍动物瘤胃酸中毒及其防治研究进展[J]. 中国饲料,2004(4):8-10. ( 1) 1)
|
| [20] | 胡红莲,刘大程,卢德勋,等.日粮不同非纤维性碳水化合物与中性洗涤纤维的比值对奶山羊瘤胃液和血液中内毒素、组织胺含量的影响[J]. 中国畜牧兽医,2012,39(3):104-109. ( 1) 1)
|
| [21] | GOZHO G N,PLAIZIER J C,KRAUSE D O,et al.Subacute ruminal acidosis induces ruminal lipopolysaccharide endotoxin release and triggers an inflammatory response[J]. Journal of Dairy Science,2005,88(4):1399-1403. ( 1) 1)
|
| [22] | ALMENDRAL J M,HUAEBSCH D,BLUNDELL P A,et al.Cloning and sequence of the human nuclear protein cyclin:homology with DNA-binding proteins[J]. Proceedings of the National Academy of Sciences of the United States of America,1987,84(6):1575-1579. ( 1) 1)
|
| [23] | ZHANG Y,WANG C L.Significance of PTEN and PCNA's expression in human glioma[J]. Journal of Clinical and Experimental Medicine,2009,8(3):25-27. ( 1) 1)
|
| [24] | 王振辉,常晓彤,付小兵,等.不同发育阶段大鼠小肠上皮细胞C-jun、p38基因表达的特征及其与肠损伤修复的关系[J]. 中国危重病急救医学,2003,15(2):77-80. ( 1) 1)
|
| [25] | MATUNIS M J.On the road to repair:PCNA encounters SUMO and ubiquitin modifications[J]. Molecular Cell,2002,10(3):441-442. ( 1) 1)
|
| [26] | 郭玉庆,朱兆华,黎锦芳.流式细胞术分析胃癌及癌前病变中细胞凋亡与增殖[J]. 世界华人消化杂志,2000,8(9):983-987. ( 1) 1)
|




