牛磺酸(taurine,TAU)又称2-氨基乙磺酸,广泛存在于哺乳动物组织中,组织中的浓度在μmol/g湿重范围内,是可兴奋组织细胞内含量最丰富的游离氨基酸,在心肌细胞内含量占总游离氨基酸的50%~60%[1],具有调节心肌细胞渗透压、维持细胞钙稳态、调节线粒体细胞凋亡等多种作用[2]。牛磺酸是一种含硫氨基酸,早期研究表明食物中牛磺酸的匮乏会导致猫和狐狸的扩张性心肌病,经常吃富含含硫氨基酸的食物(比如鱼类)的人群患高血压和心血管疾病的概率较低[3, 4]。新近有关牛磺酸摄入水平和冠心病流行病学相关性的调查研究表明,牛磺酸可显著降低血清中胆固醇水平较高(>250 mg/dL)女性患冠心病的风险[5]。体外试验和动物试验研究表明,牛磺酸缺乏与心肌结构和功能紊乱相关[6],牛磺酸作为一种营养物质在临床具有预防和治疗糖尿病型心肌病、心律失常、缺血性心肌病、高血压和充血性心力衰竭的作用[7, 8, 9]。
哺乳动物的心肌中含有较高浓度的牛磺酸,并且在细胞内外存在一个高的浓度差[10],如大鼠心肌细胞的浓度比为200∶ 1,研究指出牛磺酸众多生物学效应的发挥主要依赖于它在细胞内的高浓度[11]。细胞内高浓度的牛磺酸可以通过2种方式聚集:细胞外转运和细胞内合成。其中牛磺酸转运体(taurine transporter,TauT)逆浓度梯度将血浆中牛磺酸跨膜主动转运至细胞内是胞内牛磺酸聚集的主要方式。目前,有关TauT在正常及损伤心肌细胞代谢中的确切作用及其机理尚未完全清楚。为此,本研究拟以大鼠心肌细胞系H9c2细胞为研究对象,研究短发夹RNA(shRNA)对TauT基因的影响,为进一步揭示TauT的功能和牛磺酸的生理作用奠定基础。
H9c2细胞系购自上海中科院细胞库,真核表达载体pRNAT-CMV3.2/Neo、RISOTM RNA提取试剂购自百奥生物技术(南通)有限公司,改良的Eagle培养基(Dulbecco’s modification of Eagle’s medium,DMEM)购自Hyclone公司,胎牛血清(FBS)购自杭州四季青生物工程材料有限公司,四唑盐(MTT)、二甲基亚砜(DMSO)购自上海生工生物工程技术服务有限公司,1-step qPCR mix购自英国Quantace公司,转染试剂LipofectamineTM 2000购自Invitrogen公司,其他国产分析纯试剂由本校设备处提供。
二氧化碳(CO2)培养箱(中国力康发展有限公司)、IQ5实时荧光定量PCR仪(美国Bio-Rad公司)、酶联免疫监测仪(美国Thermo公司)。
H9c2细胞培养于含10% FBS的高糖DMEM培养基中,于37 ℃、5% CO2条件下培养。
根据本实验室已克隆的大鼠心肌组织中TauT基因的cDNA序列设计并合成了(百奥生物技术有限公司)针对TauT基因的3条shRNAs片段和1条阴性对照序列,如表1所示。即利用化学合成法合成上述TauT基因正反序列,并且在5′端加上BamHⅠ酶切位点,在3′端加上XhoⅠ酶切位点,然后与pRNAT-CMV 3.2/Neo载体连接,构建了3个特异性针对TauT基因的RNA干扰质粒shRNA1#、shRNA2#、shRNA3#及阴性对照质粒(shRNA-Neg)。
| 表1 shRNAs序列 Table 1 shRNAs sequence |
H9c2细胞培养于6孔培养板中(细胞的汇合度在50%左右),转染前改用无抗生素含血清的DMEM培养基培养24 h。细胞分为对照组(未转染组)、shRNA-Neg组(阴性对照组)和3个转染组(shRNA1#组、shRNA2#组、shRNA3#组),每组3个重复。取4 μg转染质粒加入250 μL无血清DMEM培养基,轻轻混匀;另外取10 μL LipofectamineTM 2000加入250 μL无血清DMEM培养基,轻轻混匀,5 min内同稀释的质粒轻轻混匀,室温放置20 min。移去细胞中的培养基,每孔加入无血清培养基2 mL及上述复合物,摇动培养板,轻轻混匀。在37 ℃、5% CO2培养箱中培养6 h后换新鲜培养基培养。分别在转染24、48、72 h后收集细胞用于mRNA表达水平的检测。
H9c2细胞以1×105 个/mL的密度接种于6孔培养板中,每孔2 mL,分组和转染处理同上,转染24、48、72 h后用RISO试剂提取培养的H9c2细胞总RNA,紫外分光光度计定量后取4 μL 总RNA用1-step qPCR mix进行实时定量PCR扩增,设25 μL反应体系,逆转录反应条件为:42 ℃ 30 min,95 ℃ 10 min;继而进行PCR扩增反应:95 ℃ 20 s,55 ℃ 30 s,72 ℃ 30 s,45个循环;然后95 ℃ 1 min,55 ℃ 1 min。TauT引物为:正义链5′-GGCAAGGTTGTCTACTTCAC-3′,反义链5′-AAGGCGGCTGATGTTAGG-3′,扩增产物为129 bp。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,GAPDH的引物为:正义链5′-TGATTCTACCCACGGCAAGTT-3′,反义链5′-TGATGGGTTTCCCATTGATGA-3′,扩增产物为77 bp。数据分析用2-ΔΔCt法[12],通过2-ΔΔCt法计算出各试验组基因相对表达量的变化。
H9c2细胞以1×105 个/mL密度接种于96孔板中,每孔100 μL,用含10%FBS的DMEM培养液于37 ℃、5% CO2培养箱培养24 h。细胞分组及处理同1.3.3,每组5个平行样。在转染后0、24、48和72 h,分别取出培养板吸去培养液换成无血清培养液90 μL,并加入20 μL MTT(5 mg/mL),继续培养4 h。吸去培养液,每孔加入DMSO 150 μL,振荡10 min,使结晶物充分溶解。用酶标仪测定每孔在波长为570 nm时的吸光度值。细胞增殖比率为24、48和72 h各时段吸光度值与0 h吸光度值的相对比值,计算各组细胞不同时间点的增殖率。
试验所得数据采用SPSS 16.0软件进行统计分析,结果值均以平均值±标准误表示,采用Duncan氏法进行多重比较。
从图1中可知,与对照组相比,shRNA1#组和shRNA2#组细胞中TauT mRNA表达水平极显著降低(P<0.01),而shRNA3#组、shRNA-Neg组细胞中TauT mRNA表达水平与对照组相比差异不显著(P>0.05)。与shRNA-Neg组相比,shRNA1#组和shRNA2#组细胞中TauT mRNA表达水平极显著降低(P<0.01),shRNA3#组细胞中TauT mRNA表达水平差异不显著(P>0.05)。可见,重组质粒转染H9c2细胞24 h后,shRNA1#质粒和shRNA2#质粒显著抑制了H9c2细胞中TauT mRNA的表达,与对照组相比分别下降了23.47%和32.24%,即24 h时shRNA2#质粒的基因沉默效果最明显。
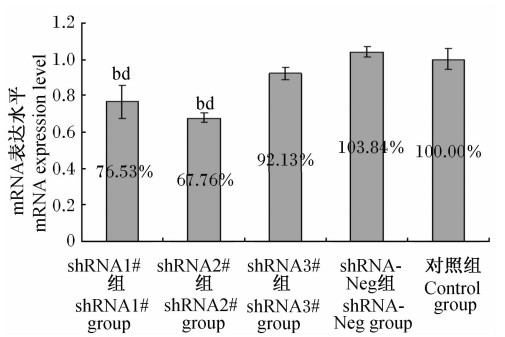 | 图1 转染24 h后TauT mRNA表达水平 Fig.1 The TauT mRNA expression level at 24 h after transfection (n=3) |
从图2中可知,与对照组相比,shRNA2#组细胞中TauT mRNA表达水平极显著降低(P<0.01),而shRNA1#组、shRNA3#组、shRNA-Neg组细胞中TauT mRNA表达水平与对照组相比差异均不显著(P>0.05)。与shRNA-Neg组相比,shRNA2#组细胞中TauT mRNA表达水平极显著降低(P<0.01),shRNA1#组和shRNA3#组细胞中TauT mRNA表达水平差异不显著(P>0.05)。可见,重组质粒转染H9c2细胞48 h后,shRNA2#质粒显著抑制了H9c2细胞中TauT mRNA的表达,与对照组相比下降了60.65%,即48 h时shRNA2#质粒的基因沉默效果最明显。
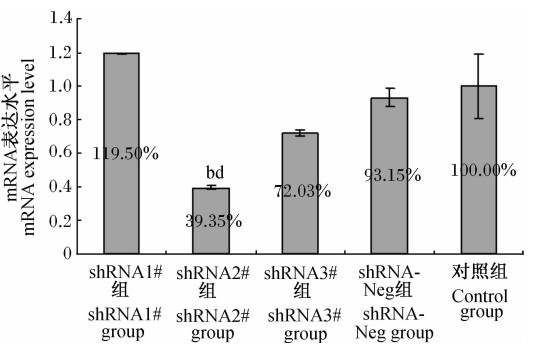 | 图2 转染48 h后TauT mRNA表达水平 Fig.2 The TauT mRNA expression level at 48 h after transfection (n=3) |
从图3中可知,与对照组相比,shRNA2#组、shRNA3#组细胞中TauT mRNA表达水平极显著降低(P<0.01),而shRNA1#组、shRNA-Neg组细胞中TauT mRNA表达水平与对照组相比差异不显著(P>0.05)。与shRNA-Neg组相比,shRNA1组细胞中TauT mRNA表达水平显著降低(P<0.05),shRNA2#组和shRNA3#组细胞中TauT mRNA表达水平极显著降低(P<0.01)。可见,重组质粒转染H9c2细胞72 h后,shRNA2#质粒和shRNA3#质粒显著抑制了H9c2细胞中TauT mRNA的表达,与对照组相比分别下降了67.83%和59.23%,即72 h时shRNA2#质粒的基因沉默效果最显著。
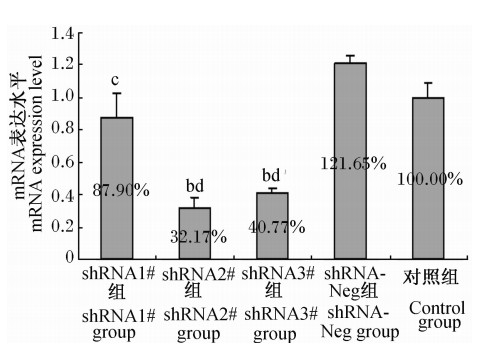 | 图3 转染72 h后TauT mRNA表达水平 Fig.3 The TauT mRNA expression level at 72 h after transfection (n=3) |
由表2可见,瞬时转染shRNA1#、shRNA2#、 shRNA3#质粒24、48、72 h后,转染组细胞增殖率与对照组、shRNA-Neg组相比差异均不显著(P>0.05)。
| 表2 24、48、72 h各组细胞增殖率 Table 2 The cell growth rate of groups at 24, 48 and 72 h (n=4) |
以往的研究表明,细胞内高浓度牛磺酸是牛磺酸发挥正常生物学效应的基础。在大多数哺乳动物组织细胞内牛磺酸的浓度约为10 mmol/kg,而在血浆中的浓度仅是20~100 μmol/L,由于细胞内牛磺酸的合成能力有限,所以细胞内庞大牛磺酸库主要通过TauT逆浓度梯度将牛磺酸从血浆中主动跨膜转运至细胞内[13]。TauT(SLC6a6)是一种钠离子及氯离子依赖性转运体,其在哺乳动物组织内广泛的表达。TauT蛋白质的表达和功能异常可能影响细胞内牛磺酸的浓度,从而导致机体的一系列异常。Shi等[14]发现利用异丙肾上腺素导致心肌缺血损伤时大鼠心肌的TauT基因表达水平显著降低,同时心肌组织中牛磺酸浓度极显著下降;同年研究报道指出敲除TauT基因的老鼠出现了严重的视网膜变性[15]。近几年的研究表明,TauT基因敲除小鼠表现出骨骼肌功能异常和年龄依赖性的心脏功能紊乱,并且心肌中检测不到牛磺酸的存在[2]。但也有研究指出,TauT基因敲除小鼠心肌中牛磺酸浓度降低却表现出正常的心肌功能[16],可见,有关TauT在心肌细胞中的作用值得进一步研究。因此,有效抑制心肌细胞TauT基因的表达是研究TauT及牛磺酸在心肌细胞代谢中作用的直接手段。
RNA干扰是利用基因对应的小分子双链RNA诱导同源mRNA降解,导致该基因表达沉默,阻断特定基因的表达[17],有高度的序列特异性。RNA干扰技术作为基因研究的强大工具,目前已经广泛地应用于众多领域,其中高效干扰靶基因的shRNA表达载体的构建是至关重要的。本研究利用pRNAT-CMV 3.2/Neo表达载体构建了1个编码阴性对照、3个编码TauT RNAi的重组质粒,转染24、48、72 h后实时荧光定量PCR检测结果表明,shRNA-Neg转染H9c2细胞后对TauT mRNA表达影响不显著;TauT shRNA1#质粒仅在转染细胞后的24 h显著抑制了TauT mRNA的表达,TauT shRNA2#质粒在转染细胞后的24、48、72 h均显著抑制了TauT mRNA的表达,TauT shRNA3#质粒则是在转染细胞后的72 h显著抑制了TauT mRNA的表达,可见转染抑制有着不稳定性,并且shRNA表达质粒在细胞内转录生成siRNA,其介导的RNAi效应可能具有一定的累积效应。结果证明本研究所构建的shRNA2#质粒能够在细胞内持续地表达shRNA,有效地抑制TauT基因表达。
除上述外,本试验结果表明shRNA-Neg组TauT mRNA的表达水平升高,这可能是干扰质粒作为异物侵染细胞刺激了细胞,在这种应激条件下细胞反射性的增加了TauT mRNA的表达水平,但目前尚无相关研究报道,具体机制还需进一步的研究。另外,H9c2细胞在转染TauT shRNA1#质粒48 h后,出现了TauT mRNA的表达水平升高现象,推测这一方面与瞬时转染的不稳定性有关,另一方面与细胞自身的应激反应有关,但具体机制尚需在以后研究中进一步探讨。
本试验中MTT测定显示转染TauT shRNA1#、shRNA2#、shRNA3#入H9c2细胞24、48、72 h后,细胞增殖均未受到影响。该结果提示干扰TauT基因短时间内不会影响H9c2细胞的正常生长。
本研究所构建的3个重组质粒中的TauT shRNA2#重组质粒能够有效地抑制大鼠TauT mRNA的表达,且在72 h内不影响细胞生长,为研究TauT的功能及揭示牛磺酸在心肌代谢中的作用提供了一种有效的手段。
| [1] | LOMBARDINI J B.Taurine depletion in the intact animal stimulates in vitro phosphorylation of an 44-kDa protein present in the mitochondrial fraction of the rat heart[J]. Journal of Molecular and Cellular Cardiology,1996,28(9):1957-1961. ( 1) 1)
|
| [2] | ITO T,KIMURA Y,UOZUMI Y,et al.Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy[J]. Journal of Molecular and Cellular Cardiology,2008,44(5):927-937. ( 2) 2)
|
| [3] | YAMORI Y,NARA Y,IKEDA K,et al.Is taurine a preventive nutritional factor of cardiovascular diseases or just a biological marker of nutrition?[J]. Advances in Experimental Medicine and Biology,1996,403:623-629. ( 1) 1)
|
| [4] | MIZUSHIMA S,MORIGUCHI E H,ISHIKAWA P,et al.Fish intake and cardiovascular risk among middle-aged Japanese in Japan and Brazil[J]. Journal of Cardiovascular Risk,1997,4(3):191-199. ( 1) 1)
|
| [5] | WÓJCIK O P,KOENIG K L,ZELENIUCH-JACQUOTTE A,et al.Serum taurine and risk of coronary heart disease:a prospective,nested case-control study[J]. European Journal of Nutrition,2013,52(1):169-178. ( 1) 1)
|
| [6] | ITO T,OISHI S,TAKAI M,et al.Cardiac and skeletal muscle abnormality in taurine transporter-knockout mice[J]. Journal of Biomedical Science,2010,17(Suppl.1):S20. ( 1) 1)
|
| [7] | ALLARD M L,JEEJEEBHOY K N,SOLE M J.The management of conditioned nutritional requirements in heart failure[J]. Heart Fail Reviews,2006,11(1):75-82. ( 1) 1)
|
| [8] | EBY G,HALCOMB W W.Elimination of cardiac arrhythmias using oral taurine with L-arginine with case histories:hypothesis for nitric oxide stabilization of the sinus node[J]. Medical Hypotheses,2006,67(5):1200-1204. ( 1) 1)
|
| [9] | XU Y J,ARNEJA A S,TAPPIA P S,et al.The potential health benefits of taurine in cardiovascular disease[J]. Experimental and Clinical Cardiology,2008,13(2):57-65. ( 1) 1)
|
| [10] | HUXTABLE R J.Physiological actions of taurine[J]. Physiological Reviews,1992,72(1):101-163. ( 1) 1)
|
| [11] | PASANTES-MORALES H,HERNÁNDEZ-BENÍTEZ R.Taurine and brain development:trophic or cytoprotective actions?[J]. Neurochemical Research,2010,35(12):1939-1943. ( 1) 1)
|
| [12] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408. ( 1) 1)
|
| [13] | REYMOND I,BITOUN M,LEVILAIN O,et al.Regional expression and histological localization of cysteine sulfinate decarboxylase mRNA in the rat kidney[J]. Journal of Histochemistry & Cytochemistry,2000,48(11):1461-1468. ( 1) 1)
|
| [14] | SHI Y R,BU D F,QI Y F,et al.Dysfunction of myocardial taurine transport and effect of taurine supplement in rats with isoproterenol-induced myocardial injury[J]. Acta Pharmacological Sinica,2002,23(10):910-918. ( 1) 1)
|
| [15] | HELLER-STILB B,VAN ROEYEN C,RASCHER K,et al.Disruption of the taurine transporter gene (taut) leads to retinal degeneration in mice[J]. The Journal of the Federation of American Societies for Experimental Biology,2002,16(2):231-233. ( 1) 1)
|
| [16] | WARSKULAT U,FLÖGEL U,JACOBY C,et al.Taurine transporter knockout depletes muscle taurine levels and results in severe skeletal muscle impairment but leaves cardiac function uncompromised[J]. The Journal of the Federation of American Societies for Experimental Biology,2004,18(3):577-579. ( 1) 1)
|
| [17] | FIRE A,XU S Q,MONTGOMERY M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature,1998,391(6669):806-811. ( 1) 1)
|




