瘤胃是反刍动物对养分消化和吸收的主要场所,瘤胃微生物发酵能力对反刍动物生产影响很大。有关瘤胃发酵的调控技术研究一直是反刍动物营养研究的重点。研究表明,抗生素离子载体的使用可以成功降低因瘤胃发酵所引起的能量与蛋白质的损失[1]。然而,在饲料中添加抗生素可能会在畜产品中残留和产生耐药菌而不被大众所接受。基于此,动物营养学家开始研究抗生素的替代物来调控瘤胃发酵,其中包括酵母、有机酸、植物提取物等。其中,植物提取物——精油具有天然无耐药性、毒副作用小等优势,近年来被广泛应用于反刍动物瘤胃调控研究中。
广藿香,又名藿香,味辛微温,具有芳香化浊、开胃止呕、发表解暑的功能,是消化系统疾患及暑湿时令之常用中药。现代药理研究表明,广藿香有抗菌、抗氧化、改善消化道功能等[2]。广藿香水提物、挥发油以及去油其他部分均能不同程度地增加胃酸分泌,提高胃蛋白酶活性,增强胰腺分泌淀粉酶的功能,提高血清淀粉酶活力[3]。但是,目前关于广藿香精油对瘤胃微生物发酵的影响和机理的报道很少。本试验以南方的地方品种锦江黄牛为研究对象,采用体外批次培养法,研究广藿香精油对锦江黄牛瘤胃发酵功能及养分降解率的影响,为植物精油在反刍动物生产中的应用提供理论依据和参考。
选用3头体重为(300±15) kg安装有永久性瘤胃瘘管的健康锦江黄牛,以供瘤胃液的采集。试验动物每天饲喂2 次(08:00和18:00),自由饮水。基础饲粮为玉米-麦麸-稻草型,精粗比为20∶ 80,基础饲粮组成及营养水平见表1。试验预试期14 d,第15天开始采集瘤胃液供体外培养。体外批次培养底物组成与瘤胃液供体牛饲粮组成完全相同。
| 表1 基础饲粮组成及营养水平(风干基础)
Table 1 Composition and nutrient levels of the basal diet (air-dry basis) % |
广藿香精油购自吉安盛大香料油有限公司,其主要成分为广藿香酮、广藿香醇以及萜类、黄酮类、醇、酚、酮、醛等物质。百秋李醇对照品购自中国药品生物制品检定所。
采用体外批次培养法。其装置参照戈婷婷等[4]的方法进行。此装置主体为恒温数显水浴摇床,其水浴温度和震荡速率均可调。培养瓶为150 mL的玻璃瓶,瓶口安装有橡皮塞,且橡皮塞上接有带三通阀的橡胶管,三通阀可打开和关闭,三通阀另一端与20 mL医用玻璃注射器相连,注射器用于体外培养过程中产气量的测定。
于晨饲前由3头锦江黄牛瘤胃内上、下、左、右(背囊、背盲囊、腹囊、腹盲囊)不同位点采集足量瘤胃液,灌入经预热达39 ℃并通有CO2的灭菌清洁广口瓶中,广口瓶置于装有39 ℃蒸馏水的保温瓶中,灌满后立即盖好保温瓶盖子,迅速返回实验室,经4层纱布过滤后持续通入CO2气体5 min,然后迅速分装至已预热好并装有培养底物(粉碎过40目的基础饲粮2 g、人工培养液40 mL及对应比例的广藿香精油)的培养瓶内,每个培养瓶加20 mL瘤胃液。接通培养瓶和注射器,打开振荡开关,开始培养。
根据培养底物中广藿香精油添加水平的不同,分为5组,精油添加水平分别为0(对照组)、0.50%、1.00%、1.50%和2.00%,每组设4个重复。
从培养开始,每隔30 min左右记录1次产气量,每次记录完之后先关闭三通阀,放掉注射器中的气体,使注射器的刻度为0后,再打开三通阀重新培养,累计24 h的产气量之和即为总产气量。培养24 h后采集样品,立即用S-320型酸度计测定pH。将培养物用4层纱布过滤,将滤渣无损失地转移入100 mL大坩埚中,置于65 ℃烘箱中烘干,测定干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)等指标,其测定方法参照袁缨主编的《动物营养学实验教程》[5]进行。滤液则转移至100 mL离心管中,以120×g离心15 min,去除原虫和饲料大颗粒。离心之后的上清液在-20 ℃保存,用于测定氨态氮(NH3-N)、菌体蛋白(MCP)、挥发性脂肪酸(VFA)浓度和广藿香精油成分分析(采用GC-1690气相色谱仪)[6]。
基本数据处理采用Excel 2003,试验结果分析采用SPSS 17.0中的one-way ANOVA程序进行方差、线性和二次型分析,多重比较采用Ducan氏法。
条件如下:火焰离子检测器(FID),OV-1701型毛细管(30.00 m×0.32 mm×0.50 um),2 000色谱数据工作站,内标分析法,内标物为正十八烷。采用程序升温,初温150 ℃,初时25 min,升速10 ℃/min,终温250 ℃,终时8 min;进样室温度280 ℃,检测器温度280 ℃;柱前压力0.1 MPa,氮气作为载气。在该色谱条件下,百秋李醇能达到基线分离(图1)。
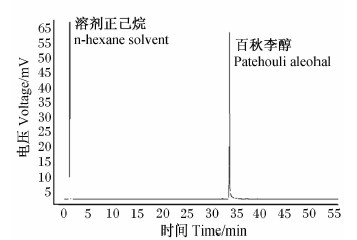 | 图1 标准品气相色谱图
Fig.1 The gas chromatogram of standard preparation |
精密量取百秋李醇对照品溶液0.05、0.10、0.15、0.20、0.25 mL分别置于2 mL量瓶中,注入内标溶液0.2 mL,稀释至刻度,取0.001 mL注入气相色谱仪,以百秋李醇与内标物峰面积比(Y)对百秋李醇含量(X)作回归计算,得回归方程:Y=0.534 9X +0.571 4,R2=0.998 6。结果表明,百秋李醇含量在0.87~5.13 mg/mL范围内呈良好线性关系。
准确移取广藿香精油0.2 mL置于4 mL量瓶中,注入内标溶液0.4 mL,定容至刻度,作为供试品溶液,按上述色谱条件进样0.001 mL,记录峰面积,计算得到广藿香精油中百秋李醇含量为46.43 mg/mL(图2)。
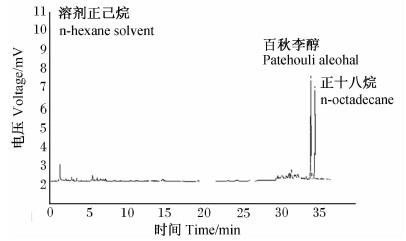 | 图2 广藿香精油色谱图
Fig.2 The gas chromatogram of Pogostemon cablin essential oil |
由表2可知,添加广藿香精油培养24 h后,各组瘤胃液pH均处于6.08~6.17之间,符合瘤胃微生物正常生长范围。总产气量:与0组(对照组)比较,1.00%组的总产气量提高了34.06%(P<0.05),其他试验组无显著变化(P>0.05)。MCP浓度:添加广藿香精油后均呈现增加趋势,其中1.00%组瘤胃MCP浓度最高,比对照组提高了47.73%(P<0.01),其余试验组与对照组相比差异均不显著(P>0.05)。NH3-N浓度:添加广藿香精油后瘤胃液中NH3-N浓度呈下降趋势,其中1.00%组瘤胃液中的NH3-N浓度最低,比对照组减少了22.78%(P>0.05)。VFA浓度:与对照组相比,0.50%组各VFA浓度及乙酸/丙酸均无显著性变化(P>0.05);1.00%组乙酸浓度提高了12.50%(P<0.01),乙酸/丙酸增加了30.59%(P<0.01),丙酸浓度减少了13.81%(P<0.01),丁酸浓度减少了20.70%(P<0.01),但是TVFA浓度却没有显著变化(P>0.05);1.50%组乙酸、丙酸、丁酸及总挥发性脂肪酸(TVFA)浓度分别下降了13.28%、20.44%、20.06%、17.63%(P<0.01),但是乙酸/丙酸没有显著变化(P>0.05);2.00%组的乙酸、丙酸、丁酸、TVFA浓度及乙酸/丙酸均极显著低于对照组(P<0.05)。
| 表2 广藿香精油对锦江黄牛瘤胃体外发酵指标的影响
Table 2 Effects of Pogostemon cablin essential oil on rumen fermentation indices in vitro of Jinjiang yellow cattle |
由表3可知,各广藿香精油组瘤胃中培养底物的DM和NDF降解率与对照组相比呈现上升趋势,但差异均不显著(P>0.05);与对照组相比,1.50%组ADF降解率比对照组提高了19.23%(P<0.01),0.50%、1.00%、2.00%组分别提高了15.38%(P<0.05)、11.54%(P>0.05)、15.38%(P<0.05);0.50%、1.50%组的CP降解率分别比对照组提高了38.24%、44.12%(P<0.05),1.00%、2.00%组与对照组差异不显著(P>0.05)。
| 表3 广藿香精油对锦江黄牛瘤胃体外养分降解率的影响
Table 3 Effects of Pogostemon cablin essential oil on rumen nutrient degradability in vitro of Jinjiang yellow cattle |
本研究表明,饲粮中添加适宜水平的广藿香精油,提高了锦江黄牛瘤胃对饲料含氮物质和纤维素的降解率,促进了瘤胃对NH3-N的利用和MCP的合成,对体外瘤胃发酵模式产生了一定的影响。广藿香以芳香除秽,疏通中州,恢复脾胃受纳、运化之能为功效。广藿香富含挥发油成分,如广藿香酮、广藿香醇,及萜类、黄酮类、醇、酚、酮、醛等物质。在本研究中检测广藿香精油中百秋李醇的含量是因为广藿香醇即百秋李醇作为广藿香挥发油的主要成分,是历版《中华人民共和国药典》规定的用于评价广藿香药材及广藿香精油质量的指标。现代药理试验表明,广藿香醇(百秋李醇)具有抗炎、抗病毒、抑菌、抗雏虫、抗氧化,而且百秋李醇是广藿香精油最重要的成分之一,因此作者推测对瘤胃起作用的是百秋李醇,具体原因还有待进一步的试验验证。试验研究证实,广藿香挥发油成分有良好的抗菌作用[7, 8],协调和促进胃肠运动功能,促进消化吸收[9]。这提示广藿香的主要成分挥发油可能对调整动物胃肠运动,促进胃肠道消化吸收功能有一定作用。
瘤胃作为反刍动物营养成分消化的主要场所,在营养物质消化吸收过程中发挥着至关重要的作用。饲料瘤胃降解率代表着该饲料被微生物转化和利用的能力,也是影响DM采食量的一个主要因素,降解率越高,动物利用的也可能就越好[10]。
Molero等[11]报道,植物精油能提高饲粮中DM和CP降解率。本试验中,饲粮添加广藿香精油,可显著提高培养残渣中ADF和CP的降解率。这可能与广藿香精油对瘤胃微生物菌群调控作用有关,瘤胃微生物能分泌纤维素酶、半纤维素酶,以分解植物纤维。
瘤胃液pH是综合反映瘤胃发酵内环境的重要指标之一,可以反映瘤胃内部的环境状况及饲料在瘤胃内的发酵程度和模式。适宜pH是瘤胃微生物正常活动所必需的,pH过高或过低都不利于微生物发酵,甚至可能导致微生物死亡。瘤胃MCP合成的最适pH范围为6.0~7.0[12]。本试验中,培养24 h后的瘤胃液pH在6.08~6.17变动,这提示添加一定水平的广藿香精油不会改变瘤胃液pH环境。体外发酵产气量反映了底物被瘤胃微生物利用的程度,与饲料碳水化合物消化率高低有关,是反刍动物瘤胃发酵的一个重要指标[11]。本研究中,广藿香精油可显著提高体外发酵的总产气量,这可能表明广霍香精油添加后对饲料消化利用有一定的正面效应。
瘤胃细菌是瘤胃微生物最主要的组成部分,瘤胃中MCP代谢是瘤胃微生物区系营养代谢的重要组成部分[13]。本研究在适宜范围内随精油浓度升高,MCP浓度呈上升趋势,这可能是添加适宜浓度的广藿香精油促进了瘤胃微生物的增殖,合成了更多的MCP有关。瘤胃液中NH3-N浓度反映饲粮蛋白质的降解程度,其浓度过高、过低或释放不均匀都会对瘤胃微生物产生不利的影响。因此,瘤胃内适宜的NH3-N浓度是保证MCP合成效率的重要条件。有研究认为,符合瘤胃微生物生长的最适NH3-N浓度范围5~28 mg/dL[14, 15]。本研究各组NH3-N浓度均在适宜范围内,添加广藿香精油可引起瘤胃中NH3-N浓度下降,这可能与瘤胃细菌利用NH3-N合成MCP效果增强有关。Benchaar等[16]报道了植物精油对奶牛瘤胃发酵的影响,研究表明,麝香和牛至的有效成分瑞香草酚可以抑制脱氨作用,降低瘤胃液中的氨基酸氮。Busquet等[12]报道了丁香油能影响瘤胃体外发酵、降低TVFA和NH3-N浓度,这些与本研究的结果一致。
有关植物精油对瘤胃液TVFA的调控结果并不一致。Cardozo等[17]报道,在精粗比为90∶ 10(粗料为秸秆)的肉牛饲粮中,pH 7.0条件下添加辣椒素降低了TVFA和NH3-N的浓度,提高了乙酸/丙酸。Busquet等[18]采用双外流连续培养发酵系统研究了每升瘤胃液分别添加31.2、312.0 mg肉桂醛对瘤胃发酵的影响。结果表明,降低了乙酸浓度,提高了丙酸和丁酸的浓度。Busquet等[19]关于大蒜油对奶牛瘤胃发酵影响(精粗比为40∶ 60)的试验结果表明,大蒜油可以降低乙酸和支链脂肪酸的比例,提高丙酸和丁酸的比例。本试验表明,饲粮中添加1.00%广藿香精油可以显著提高锦江黄牛瘤胃乙酸浓度和乙酸/丙酸,显著降低丙酸和丁酸浓度,但是对TVFA浓度影响不显著。这说明广藿香挥发油可以通过调节瘤胃内微生物菌群,来改变瘤胃内丙酮酸的代谢途径,TVFA浓度差异不显著可能提示产生的丙酮酸量未发生改变,只是发酵类型改变。目前,有关广藿香精油对瘤胃发酵类型的影响尚未见报道,本研究中添加1.00%广藿香精油后瘤胃液乙酸/丙酸显著高于对照组,分析可能是添加广藿香精油对瘤胃发酵模式产生了一定的影响。
饲粮添加1.00%的广藿香精油能够稳定锦江黄牛瘤胃内环境,增加瘤胃液中MCP浓度,调控瘤胃发酵类型。添加1.50%的广藿香精油能够提高瘤胃ADF和CP降解率。
| [1] | 乔国华,张怀山,周学辉,等.植物精油对奶牛和肉牛瘤胃发酵的影响研究进展[J]. 中国畜牧杂志,2011,47(3):74-78. ( 1) 1)
|
| [2] | 中华人民共和国卫生部药典委员会.中华人民共和国药典[M]. 北京:化学工业出版社,2005:30-31. ( 1) 1)
|
| [3] | 杜一民,陈汝筑,胡本荣.广藿香的化学成分及其药理作用研究进展[J]. 中药新药与临床药理,1998,9(4):238-241. ( 1) 1)
|
| [4] | 戈婷婷,瞿明仁,张晖,等.功能性寡糖对锦江黄牛瘤胃发酵及微生物生长效率的影响[J]. 动物营养学报,2012,24(3):1-6. ( 1) 1)
|
| [5] | 袁缨.动物营养学实验教程[M]. 北京:中国农业大学出版社,2006:12-28. ( 1) 1)
|
| [6] | 刘乡乡,黄晓玲,宋力飞,等.GC法测定广藿香提取物中百秋李醇和广藿香酮的含量[J]. 中药材,2005,28(1):30-31. ( 1) 1)
|
| [7] | 苏镜娱,张广文,李核,等.广藿香精油化学成分分析与抗菌活性研究(Ⅰ)[J]. 中草药,2001,32(3):204-205. ( 1) 1)
|
| [8] | 张广文,蓝文键,苏镜娱,等.广藿香精油化学成分分析与其抗菌活性(Ⅱ)[J]. 中草药,2002,33(3):210-212. ( 1) 1)
|
| [9] | 李永渝,魏玉,李莉娟,等.藿香、大黄等CCB中药影响胃肠运动功能的机制探讨[J]. 中国中西医结合外科杂志,1997,3(3):187-190. ( 1) 1)
|
| [10] | 闵力,瞿明仁,戈婷婷,等.不同组合功能性寡糖对稻草在锦江黄牛瘤胃降解率的影响[J]. 江西农业大学学报,2012,34(3):550-555. ( 1) 1)
|
| [11] | MOLERO R,IBARS M,CALSAMIGLIA S,et al.Effects of a specific blend of essential oil compounds on dry matter and crude protein degradability in heifers fed diets with different forage to concentrate ratios[J]. Animal Feed Science and Technology,2004,114(1/2/3/4):91-104. ( 2) 2)
|
| [12] | BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Screening for effects of plant extracts and active compounds of plants on dairy cattle rumen microbial fermentation in a continuous culture system[J]. Animal Feed Science and Technology,2005,124(2):597-613. ( 2) 2)
|
| [13] | FRASER G R,CHAVES A V,WANG Y,et al.Assessment of the effects of cinnamon leaf oil on rumen microbial fermentation using two continuous culture systems[J] Journal of Dairy Science,2007,90(5):2315-2328. ( 1) 1)
|
| [14] | WANAAPAT M,PIMPA O.Effect of ruminal NH3-N levels on ruminal fermentation,purine derivatives,digestibility and rice straw intake in swamp Buffaloes[J]. Asian-Australasian Journal of Animal Science,1999,12(6):904. ( 1) 1)
|
| [15] | PERDOK H B,LENG R A,BIRD G,et al.Improving livestock production from straw-based diets[M]//Increasing small ruminant productivity in semi-arid areas.Netherlands:Kluwer Academic Publishers,1998:81-91. ( 1) 1)
|
| [16] | BENCHAAR C,PETIT H V,BERTHIAUME R,et al.Effects of addition of essential oils and monensin premix on digestion,ruminal fermentation,milk production,and milk composition in dairy cows[J]. Journal of Dairy Science,2006,89(11):4352-4364. ( 1) 1)
|
| [17] | CARDOZO P W,CALSAMIGLIA S,FERRET A,et al.Effects of alfalfa extract,anise,capsicum,and a mixture of cinnamaldehyde and eugenol on ruminal fermentation and protein degradation in beef heifers fed a high-concentrate diet[J]. Journal of Animal Science,2006,84(10):2801-2808. ( 1) 1)
|
| [18] | BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Effect of garlic oil and four of its compounds on rumen microbial fermentation[J]. Journal of Dairy Science,2005,88(12):4393-4404. ( 1) 1)
|
| [19] | BUSQUET M,CALSAMIGLIA S,FERRET A,et al.Plant extracts affect in vitro rumen microbial fermentation[J]. Journal of Dairy Science,2006,89(2):761-771. ( 1) 1)
|




