2. 东北农业大学理学院, 哈尔滨 150030;
3. 东北农业大学生命科学学院, 哈尔滨 150030
2. College of AnimalScience, Northeast Agricultural University, Harbin 150030, China;
3. College of Science, Northeast Agricultural University, Harbin 150030, China
蛋白质是反刍动物最重要的营养物质之一,有关蛋白质的各类研究也一直是比较热门的课题。分析蛋白质的传统方法是用化学分析来测定蛋白质的化学组成,从而预测蛋白质的营养价值。然而,传统的化学分析方法破坏了蛋白质空间结构,不能够揭示蛋白质的分子结构与其营养特性的关系[1, 2]。饲料蛋白质的营养价值和降解特性与其二级结构有密切的联系[3]。蛋白质二级结构包括α-螺旋、β-折叠、β-转角及无规则卷曲,Yu等[4]研究结果显示,不同的蛋白质源具有不同比例和百分率的α-螺旋、β-折叠。研究蛋白质的二级结构才能全面揭示蛋白质的降解特性[5]。
傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)是近年来才发展起来的一种蛋白质二级结构分析测试新技术,它具有快速、直接、不破坏样品化学结构等特点[6]。目前用该方法测定饲料化学组成,建立饲料蛋白质二级结构与饲料降解特性的研究还是很少的,并且前人都只研究了单一饲料原料的分析测定,关于混合饲料研究还鲜有报道。因此,本试验探讨干酒糟及其可溶物(DDGS)和豆粕混合饲料蛋白质二级结构与瘤胃降解特性的关系,为研究蛋白质二级结构和蛋白质营养价值关系提供参考。
选取3头健康、体重为(500±10) kg、装有永久性瘤胃瘘管的干奶期中国荷斯坦奶牛为试验动物。试验牛的饲粮参照我国《奶牛饲养标准》(NY/T 34—2004)配制,试验饲粮组成及营养水平见表1。试验期间,每日饲喂2次(08:00和16:00),自由饮水,单槽饲养。
| 表1 试验饲粮组成及营养水平(风干基础)
Table 1 Composition and nutrient levels of the experimental diet (air-dry basis) % |
豆粕和DDGS采购于市场,产地均为黑龙江省哈尔滨市。DDGS和豆粕置于65 ℃烘干至恒重,粉碎过2 mm孔筛。将DDGS、豆粕按照不同比例[DDGS∶ 豆粕分别为100∶ 0(D组)、70∶ 30(D70S30组)、50∶ 50(D50S50组)、30∶ 70(D30S70组)、0∶ 100(S组)]充分混匀,形成5组混合饲料样品。
准确称取4 g样品放入已经称重的尼龙袋中,每组样品3个重复,以投入每头牛瘤胃瘘管的2个尼龙袋为1个重复。将尼龙袋经瘘管全部投入瘤胃中,在瘤胃中培养0、2、4、8、16、24、48 h后取出。取出的尼龙袋用流水缓慢冲洗,直到水澄清为止,于65 ℃烘干至恒重,将尼龙袋中的残余物磨碎(通过1 mm筛网),测定粗蛋白质(CP)的含量。
称量2 mg干燥的饲料样品,加入适量溴化钾至200 mg左右,用玛瑙研钵研成粉末,充分混匀,用红外专用压片机压成薄片。用傅里叶变换红外光谱仪(FTIR-8400S)(日本岛津公司)扫描样品,扫描波段4 000~400 cm-1,分辨率为4 cm-1,扫描次数64。
待测饲料CP降解率参照Φrskov等[7]提出的瘤胃动力学数学指数模型计算:
Y=a+b×(1-e-ct)。式中:Y为尼龙袋在瘤胃中滞留t时间后的饲料CP降解率(%),a为快速降解部分(%),b为慢速降解部分(%),c为b的降解速率(%/h),t为瘤胃中滞留时间(h)。下式同。
CP有效降解率的计算公式为:
P=a+[b×c/(c+k)]。式中:P为饲料CP有效降解率(%),k为待测饲料的瘤胃流通速率常数(%/h),此处取6%/h[8]。
非降解部分的计算公式为:
w=1-(a+b)。式中:w为非降解部分(%)。
用岛津公司的IRSolution 1.10数据处理软件分析位于1 700~1 600 cm-1波段属于酰胺Ⅰ带特征峰的图谱,进行基线校正,并做二阶导数和傅里叶去卷积图谱。用Origin 8软件对样品的二阶导数和去卷积图谱进行曲线拟合,各子峰的峰位由二阶导数图谱确定。各子峰与二级结构对应关系:1 658~1 650 cm-1为α-螺旋;1 640~1 610 cm-1为β-折叠;1 700~1 660 cm-1为β-转角;1 650~1 640 cm-1为无规则卷曲[9]。根据各二级结构组分指定的子峰的积分面积计算其含量(相对百分含量)。
用SAS 9.13软件非线性回归(NLIN)程序计算a、b、c值,利用软件包中的平衡试验设计进行方差分析,运用Duncan氏法进行多重比较,结果以平均值±标准差表示。
由表2可知,5组饲料样品CP在瘤胃中的动态降解参数及有效降解率存在一定差异。饲料CP有效降解率按D组、D70S30组、D50S50组、D30S70组、S组的顺序依次增高,从23.09%增长到54.19%,这是因为豆粕的比例逐渐上升,而DDGS的比例逐渐下降。
| 表2 饲料粗蛋白质的瘤胃降解参数及有效降解率 Table 2 Rumen degradation parameters and efficient degradation rate of CP in feeds |
对样品的原谱曲线进行拟合,蛋白质酰胺Ⅰ带的拟合结果如图1所示,据此计算得出的蛋白质二级结构4种构型的含量见表3。可知,D组、D70S30组α-螺旋含量较低,分别为15.73%、17.09%,显著低于其他3组(P<0.05)。D30S70组和S组的β-折叠含量较高,分别为28.50%和31.02%,显著高于其他3组(P<0.05)。α-螺旋/β-折叠从D组到S组呈上升趋势,变化范围在0.74~1.15之间,除D70S30组和D50S50组差异不显著(P>0.05)外,其他各组之间差异均显著(P<0.05)。
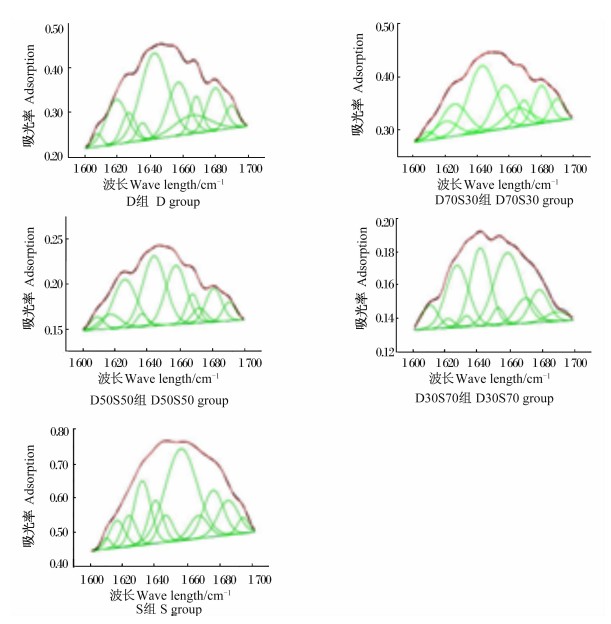 | 图1 蛋白质酰胺Ⅰ带拟合结果
Fig.1 The amide Ⅰ band curve-fitting results of proteins |
| 表3 蛋白质二级结构4种构型的含量
Table 3 The content of four types of protein secondary structure % |
由表4可见,饲料样品蛋白质α-螺旋/β-折叠与蛋白质快速降解部分、慢速降解部分和非降解部分都不相关,与蛋白质慢速降解部分的降解速率呈显著程度的正相关(r=0.981 1,P=0.003 1),与饲料CP有效降解率呈显著程度的正相关(r=0.976 5,P=0.004 3)。结果表明,蛋白质α-螺旋/β-折叠越大,CP慢速降解部分的降解速率越小,饲料CP有效降解率越高。
| 表4 饲料蛋白质α-螺旋/β-折叠与粗蛋白质瘤胃降解参数相关性
Table 4 Correlation between α-helix/β-sheet of protein and rumen degradation parameters of CP in feeds |
众所周知,羽毛的蛋白质含量高达80%以上,但是其降解率和其他蛋白质原料大麦、燕麦、小麦相比却非常低。Yu等[4]研究结果显示,羽毛含有高达88%的β-折叠和低至4%的α-螺旋,但是其他蛋白质原料却有较低的β-折叠和较高的α-螺旋,如大麦含有17%的β-折叠和71%的α-螺旋。传统方法测得的CP含量是饲料化学含量,并未涉及饲料内部结构,是不能完全说明饲料蛋白质营养价值,饲料蛋白质的营养价值不仅与CP含量有关,更与其二级结构有关。
Yu[10]对亚麻籽和肥优若黎籽的蛋白质二级结构各组分比例以及其相互之间的关系做了详尽的比较分析,也说明了不同蛋白质源饲料的内部结构是不同的。虽然蛋白质的营养价值、降解率和利用率并非直接依赖蛋白质的α-螺旋和β-折叠,但是蛋白质的类型和其对水解酶的敏感性却和蛋白质所固有的结构高度相关,即使含有相同含量蛋白质,而蛋白质二级结构的α-螺旋/β-折叠如果不同的话,它们的营养价值也不尽相同[11]。
Yu[12]分别测定了生亚麻籽和烘焙过亚麻籽的二级结构,发现烘焙加热处理降低了α-螺旋的比例(从47.1%到36.1%),且提高了β-折叠的比例(从37.2%到49.8%),α-螺旋/β-折叠从1.3降低到了0.7,而烘焙加热过程对蛋白质的价值和利用产生了负面影响,说明了α-螺旋/β-折叠越高,蛋白质的营养价值和利用率越高。焦培鑫等[13]探究了5种精料(豆粕、棉籽粕、菜籽粕、DDGS、玉米)蛋白质二级结构和饲料CP瘤胃降解参数及有效降解率的相关性,得出α-螺旋/β-折叠和CP有效降解率呈高度正相关关系(r=0.952 8,P=0.012 2)。
本试验将DDGS和豆粕按不同比例混合,获得了蛋白质二级结构中各组分比例不同的混合饲料。试验结果显示混合组(D70S30组、D50S50组、D30S70组)的蛋白质二级结构各组分比例和D组、S组还是有很大差异的。S组α-螺旋/β-折叠显著高于D组,混合组中也显示出豆粕所占比例越高,α-螺旋/β-折叠也越高,说明混合饲料α-螺旋/β-折叠与混合比例有关,α-螺旋/β-折叠高的饲料组分所占的比例越大,混合饲料的α-螺旋/β-折叠越大,反之亦然。Yu等[14]的研究结果显示,小麦DDGS、玉米DDGS及其混合DDGS(小麦DDGS∶ 玉米DDGS=70∶ 30)的α-螺旋/β-折叠分别为1.04、1.03和0.99。本试验测得DDGS α-螺旋/β-折叠为0.74,可能与原料加工工艺和产地不同有关。
5组样品CP瘤胃降解参数及有效降解率也有很大差异。试验结果显示,混合组中除非降解部分外,其他各组分含量之间差异都显著。总体上看,5组样品随着豆粕所占比例的增大,CP有效降解率显著升高。Zhang等[15]将无壳大麦和混合DDGS(小麦DDGS∶ 玉米DDGS=70∶ 30)按不同比例混合(100∶ 0、75∶ 25、50∶ 50、25∶ 75、0∶ 100),测得其CP快速降解部分、慢速降解部分和非降解部分各组之间差异都不显著,而CP有效降解率却从67.5%(无壳大麦∶ 混合DDGS=100∶ 0)降低至46.7%(无壳大麦∶ 混合DDGS=0∶ 100)。这与本试验结果基本一致,2种蛋白质饲料混合后,CP有效降解率会随着高降解率饲料比例增加而升高。
通过对蛋白质二级结构(α-螺旋/β-折叠)与饲料CP瘤胃降解参数及有效降解率的相关性分析可得,蛋白质二级结构的α-螺旋/β-折叠和饲料CP有效降解率有高度相关性。其中α-螺旋/β-折叠和CP有效降解率呈显著正相关关系,该结果与焦培鑫等[13]的结果一致。说明不仅单一饲料中α-螺旋/β-折叠越大,CP有效降解率越高,在混合饲料中同样适用。通过测定饲料蛋白质二级结构来预测CP有效降解率对于混合饲料同样适用。然而该领域的研究报道仍然很少,还需要进一步对饲料蛋白质二级结构的研究。
综合得出,可以通过测定蛋白质二级结构来预测混合饲料粗蛋白质有效降解率,蛋白质α-螺旋/β-折叠越高,饲料粗蛋白质有效降解率越高。
| [1] | YU P Q,JONKER A,GRUBER M.Molecular basis of protein structure in proanthocyanidin and anthocyanin-enhanced Lc-transgenic alfalfa in relation to nutritive value using synchrotron-radiation FTIR microspectroscopy:a novel approach[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2009,73(5):846-853. ( 1) 1)
|
| [2] | YU P.Application of advanced synchrotron radiation-based Fourier transform infrared (SR-FTIR) microspectroscopy to animal nutrition and feed science:a novel approach[J]. British Journal of Nutrition,2004,92(6):869-885. ( 1) 1)
|
| [3] | YU P Q,MCKINNON J J,CHRISTENSEN C R,et al.Using synchrotron-based FTIR microspectroscopy to reveal chemical features of feather protein secondary structure:comparison with other feed protein sources[J]. Journal of Agricultural and Food Chemistry,2004,52(24):7353-7361. ( 1) 1)
|
| [4] | YU P,CHRISTENSEN D A,CHRISTENSEN C R,et al.Use of synchrotron FTIR microspectroscopy to identify chemical differences in barley endosperm tissue in relation to rumen degradation characteristics[J]. Canadian Journal of Animal Science,2004,84(3):523-527. ( 2) 2)
|
| [5] | DYSON H J,WRIGHT P E.Peptide conformation and protein folding[J]. Current Opinion in Structural Biology,1993,3(1):60-65. ( 1) 1)
|
| [6] | WETZEL D L,EILERT A J,PIETRZAK L N,et al.Ultraspatially-resolved synchrotron infrared microspectroscopy of plant tissue in situ[J]. Cellular and Molecular Biology,1998,44(1):145-168. ( 1) 1)
|
| [7] | ØRSKOV E R,DE HOVELL F D B,MOULD F.The use of the nylon bag technique for the evaluation of feed stuffs[J]. Tropical Animal Production,1980,5(3):195-213. ( 1) 1)
|
| [8] | TAMMINGA S,VAN STRAALEN W M,SUBNEL A P J,et al.The dutch protein evaluation system:the DVE/OEB-system[J]. Livestock Production Science,1994,40(2):139-155. ( 1) 1)
|
| [9] | XIE M X,LIU Y.Studies on the hydrogen bonding of aniline's derivatives by FT-IR[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2002,58(13):2817-2826. ( 1) 1)
|
| [10] | YU P Q.Modeling protein structures in feed and seed tissues using novel synchrotron-based analytical technique[J]. Animal Feed Science and Technology,2008,140(1):199-206. ( 1) 1)
|
| [11] | YU P Q.Protein molecular structures,protein subfractions,and protein availability affected by heat processing:a review[J]. American Journal of Biochemistry and Biotechnology,2007,3(2):70-90. ( 1) 1)
|
| [12] | YU P Q.Protein secondary structures (α-helix and β-sheet) at a cellular level and protein fractions in relation to rumen degradation behaviours of protein:a new approach[J]. British Journal of Nutrition,2005,94(5):655-665 ( 1) 1)
|
| [13] | 焦培鑫,刘大森,郑帅,等.饲料原料蛋白质二级结构对奶牛瘤胃降解特性的影响[J]. 饲料工业,2012,33(13):48-51. ( 2) 2)
|
| [14] | YU P Q,NUEZ-ORTÍN W G.Relationship of protein molecular structure to metabolisable proteins in different types of dried distillers grains with solubles:a novel approach[J]. British Journal of Nutrition,2010,104(10):1429-1437. ( 1) 1)
|
| [15] | ZHANG X W,YU P Q.Using ATR-FT/IR molecular spectroscopy to detect effects of blend DDGS inclusion level on the molecular structure spectral and metabolic characteristics of the proteins in hulless barley[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,95:53-63. ( 1) 1)
|




