2. 长沙学院生物工程与环境科学系, 长沙 410003;
3. 湖南农业大学动物科技学院, 长沙 410128
2. Department of Biotechnology & Environment Science, Changsha University, Changsha 410003, China;
3. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China
蛋白质是决定鱼类生长的关键营养物质,也是饲料成本花费最大的部分。水产养殖动物大多数都要求较高的饲料蛋白质水平,一般蛋白质原料在水产动物饲料配方中的比重占到50%以上。鱼类对饲料中蛋白质的消化吸收水平不仅会影响鱼类的生长性能,而且还关系到鱼类粪便中氮的含量以及对环境的污染程度。因此,研究开发能提高鱼类对饲料中蛋白质的消化吸收能力,从而使饲料配方得到优化的新型饲料添加剂具有重要的科学意义和应用前景。研究发现,在断奶仔猪饲粮中添加一定剂量的丁酸钠,对仔猪蛋白质代谢相关血清生化指标有一定的影响[1]。大量研究也已报道,在畜禽饲料中添加丁酸钠能提高摄食量和增重率,降低饲料系数,调节肠道微生态系统和提高免疫功能[2, 3, 4, 5, 6, 7, 8, 9, 10]。同时,丁酸钠由于无污染、无残留和无耐药性,成为较具潜力的抗生素替代品之一[11, 12]。丁酸钠的有效成分是短链挥发性脂肪酸丁酸,为了避免其在饲料加工及贮存投喂过程中具有的游离性、挥发性和特殊气味等缺点,通常采用包膜技术处理丁酸钠,将之制备成包膜产品。目前丁酸钠对水产动物蛋白质代谢相关血清生化指标及其相关基因表达的研究尚未见报道。本研究拟在饲料中添加不同剂量的包膜丁酸钠,利用生长试验,探讨丁酸钠对湘云鲫血清生化指标、血清游离氨基酸含量及肠道蛋白质代谢相关基因氨肽酶N(APN)和谷氨酸脱氢酶(GDH)表达的影响,以期为丁酸钠在鲫鱼营养中的应用及其作用机理提供理论参考。
参照鲫鱼的营养参数和商品饲料配方,以豆粕和鱼粉作为蛋白质源,豆油和鱼油作为脂肪源,面粉和淀粉作为糖源配制基础饲料。参考张淞琳等[13]的方法,在基础饲料中分别添加0(对照)、1.0、2.5、5.0和7.5 g/kg的丁酸钠(由浙江康德权科技有限公司提供,30%微囊包膜丁酸钠),制成5种等氮等能的试验饲料。饲料原料经粉碎过40目筛,微量成分采取逐级扩大法混合均匀后,添加鱼油等脂肪源,经充分混合,最后加水混合,经SLX-80型软颗粒饲料机制成直径为2.5 mm的硬颗粒,自然风干后置于-20 ℃冰柜中保存备用。基础饲料组成及营养水平见表1。
| 表1 基础饲料组成及营养水平(干物质基础)
Table 1 Composition and nutrient levels of the basal diet (DM basis) % |
选用初始体质量为(6.02±0.16) g、大小规格一致和体质健壮的同批孵化湘云鲫(由湖南湘云生物科技有限公司提供)作为试验对象,进行7周的摄食生长试验。对应5种试验饲料,设5个组,每个组设3个重复,每个重复30尾鱼。养殖试验在长沙学院产学研基地进行,以重复为单位放养于室内循环流水控温玻璃水族缸中,水族缸规格为120 cm×80 cm×80 cm。试验开始后,每日于08:30、12:30和16:30各投喂1次,养殖过程均采用鱼体质量3%~5%的投喂量投喂,饲料在投喂20 min后基本被摄食完全。试验期间水族缸24 h不间断充气,水温26 ℃,pH 6.5~7.5。每天记录水温、投喂量和摄食情况等。
养殖试验结束后,停止喂食24 h,每缸随机取3尾湘云鲫,尾静脉取血,将所采血液置于EP管中4 ℃静置过夜,5 000 r/min离心10 min,取上层血清置于-80 ℃超低温冰箱中保存待测。随后将所采血清一部分送至中国人民解放军第163医院用日立7170A型自动生化测定仪检测血清白蛋白和转氨酶等蛋白质代谢相关指标。
将1.3.1所采血清的另一部分送至中南大学湘雅医学院,经处理去除蛋白质,稀释后用氨基酸自动分析仪测定天冬氨酸、苏氨酸和赖氨酸等游离氨基酸含量。
试验结束后,每缸随机取3尾湘云鲫,在冰盘上解剖并分离出肠道,3尾鱼肠道组织合为1个样品,迅速投入RNA fixer保存液中,用于基因表达的分析。
从GenBank中查询并下载鲫鱼的APN和GDH基因特异序列,用Primer Premier 5.0软件设计实时荧光定量PCR(RT-qPCR)特异引物,参照金鱼管家基因β-肌动蛋白(β-actin,GenBank登录号:AB039726)设计内参引物,作为RT-qPCR的内参基因(表2)。
| 表2 RT-qPCR的引物序列
Table 2 Primer sequences for RT-qPCR |
按照总RNA提取试剂盒(E.Z.N.A.TM Total RNA KitⅡ试剂盒,购自OMEGA公司)说明书提取肠道组织总RNA,将每个处理的总RNA样品编号。DNA酶消化总RNA样品(3 μg总RNA/1 μL DNase)。cDNA第1链的合成(RevertAidTM First Strand cDNA Synthesis Kit试剂盒,购自Fermentas公司):RNA模板1 μL、0.5 μg/μL Oligo(dT)18引物1 μL,用焦碳酸二乙酯(DEPC)处理的双蒸水(ddH2O)补足至12 μL,65 ℃水浴5 min。然后立即放在冰上1 min,加入5×Reaction Buffer 4 μL、40 U/μL RNase Inhibitor 1 μL、10 mmol/L dNTP Mix 2 μL、Transcriptase 1 μL,随后立即42 ℃水浴60 min,70 ℃终止反应10 min,-20 ℃保存。
根据Livak等[14]设计的比较阈值法来测定目的基因的相对表达量,按照SYBR Green Ⅱ染料法要求,二步法进行RT-qPCR(SYBR Premix Ex Taq TM Ⅱ试剂盒,购于TaKaRa),使用仪器为Stratagene Mx3000p RT-qPCR仪。反应体系:Takara SYBR Premix Ex Taq 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA 2 μL,ddH2O加至25 μL。每个样品做3个重复。反应程序:95 ℃ 30 s、95 ℃ 3 s、55 ℃ 25 s、72 ℃ 11 s,共40个循环,95 ℃ 1 min、55 ℃ 30 s、95 ℃ 30 s 终止,4 ℃保存。RT-qPCR结束后,从扩增曲线得出Ct值(每个反应管内的荧光信号到达设定的域值时所经历的循环数),根据Ct值计算基因引物的扩增效率并绘制熔解曲线,以确定引物和扩增参数达到进行RT-qPCR检测组织相对表达量的要求。各样品引物PCR扩增的Ct值由各自的扩增曲线分别得出,用公式2-ΔΔCt[ΔΔCt=(Ct目的基因-Ct管家基因)-ΔCt校准样]计算目的基因的相对表达量,然后作图。
所有试验数据以平均值±标准差表示,并用Excel 2003和SPSS 16.0进行统计和分析,在单因素方差分析(one-way ANOVA)的基础上,采用Duncan氏法多重比较检验组间差异,以P<0.05为显著性判断标准。
由表3可知,饲料中添加1.0~7.5 g/kg的丁酸钠均显著提高了湘云鲫血清总蛋白、白蛋白、球蛋白含量(P<0.05),以5.0 g/kg丁酸钠组血清总蛋白、白蛋白、球蛋白含量最高,分别比对照组提高了147.80%、233.96%、113.18%,同时5.0 g/kg丁酸钠组血清葡萄糖含量亦较对照组有显著提高(P<0.05),但各添加组间血清总蛋白、白蛋白、球蛋白和葡萄糖含量差异不显著(P>0.05)。2.5和5.0 g/kg丁酸钠组血清白球比均显著高于对照组(P<0.05),其他组间差异不显著(P>0.05)。血清谷草转氨酶活性在丁酸钠添加水平为2.5 g/kg时达到最高,比对照组提高了146.91%(P<0.05),比1.0 g/kg丁酸钠组提高了148.40%(P<0.05)。饲料中添加2.5 g/kg丁酸钠时,有增加湘云鲫血清谷丙转氨酶活性和降低血清尿素氮含量的趋势,但差异不显著(P>0.05)。
| 表3 丁酸钠对湘云鲫血清生化指标的影响
Table 3 Effects of sodium butyrate on serum biochemical indices of triploid crucian carp |
饲料中添加不同水平的丁酸钠对湘云鲫血清各游离非必需氨基酸含量的影响趋势不尽相同,随着丁酸钠添加水平的增加表现为先降低后升高的有血清天冬氨酸、组氨酸和丙氨酸等,先升高后降低的有谷氨酸、丝氨酸和精氨酸等(表4)。从图1可见,湘云鲫血清中各游离必需氨基酸(除赖氨酸外)的含量随着饲料中丁酸钠添加水平的增加基本上都表现为先增加后降低,在丁酸钠添加水平为2.5 g/kg时均达到最高,此时缬氨酸、亮氨酸和异亮氨酸的增幅最大,比对照组分别提高了38.36%、41.64%和61.04%;而赖氨酸则表现为一直下降。但是,添加高水平(5.0、7.5 g/kg)丁酸钠时湘云鲫血清各游离必需氨基酸含量降幅都比较大,基本上只有对照组含量的1/2。
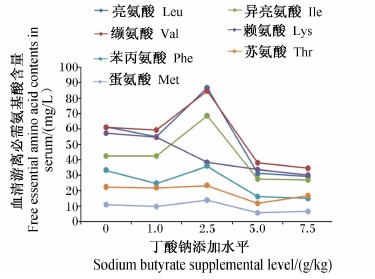 | 图1 丁酸钠对湘云鲫血清游离必需氨基酸含量的影响 Fig.1 Effects of sodium butyrate on serum free essential amino acid contents of triploid crucian carp |
| 表4 丁酸钠对湘云鲫血清游离非必需氨基酸含量的影响
Table 4 Effects of sodium butyrate on serum non-essential free amino acid contents of triploid crucian carp mg/L |
随着饲料中丁酸钠添加水平的增加,湘云鲫肠道APN基因的相对表达量表现为先下降后升高的趋势(图2),其中1.0和2.5 g/kg丁酸钠组显著低于对照组(P<0.05),而5.0和7.5 g/kg丁酸钠组则与对照组没有显著差异(P>0.05)。湘云鲫肠道GDH基因的相对表达量随饲料中丁酸钠添加水平的增加先升高,但当添加水平达到5.0 g/kg后开始出现下降趋势(图3)。5.0 g/kg丁酸钠组湘云鲫肠道GDH基因的相对表达量最高,比对照组提高了139.00%(P<0.05),与2.5 g/kg丁酸钠组差异不显著(P<0.05)。
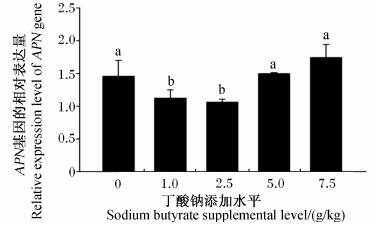 | 图2 丁酸钠对湘云鲫肠道APN基因相对表达量的影响
Fig.2 Effects of sodium butyrate on APN gene relative expression level in intestine of triploid crucian carp
数据柱标注不同字母表示差异显著(P<0.05),相同
或无字母表示差异不显著(P>0.05)。下图同。 Data columns with different letters mean significant difference (P<0.05), while with the same or no letters mean no significant differences (P>0.05). The same as below. |
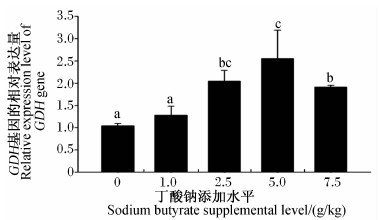 | 图3 丁酸钠对湘云鲫肠道GDH基因相对表达量的影响 Fig.3 Effects of sodium butyrate on GDH gene relative expression level in intestine of triploid crucian carp |
血清中一些生理生化指标可以反映鱼类机体蛋白质代谢的状况。血清总蛋白、白蛋白和球蛋白的含量与机体蛋白质的吸收和代谢状况有关;谷草转氨酶和谷丙转氨酶是广泛存在于鱼类线粒体中重要的氨基酸转氨酶,当鱼类肝脏细胞没有被损伤时,谷草转氨酶和谷丙转氨酶活性的提高可反映出机体蛋白质合成和分解代谢的增强。徐振飞等[1]研究表明,在断奶仔猪饲粮中添加包膜丁酸钠,对仔猪一些血清生化指标有增加的趋势。在本试验中发现,饲料中添加丁酸钠增加了湘云鲫血清中总蛋白、白蛋白、球蛋白、葡萄糖的含量以及谷草转氨酶的活性,这与上述研究结果相似。5.0 g/kg丁酸钠组湘云鲫血清总蛋白、白蛋白、球蛋白和葡萄糖含量最高,但丁酸钠添加水平继续增加后其含量又有所降低,这说明丁酸钠对上述血清生化指标的影响具有剂量适度原则。该研究的生长试验结果表明,随着丁酸钠添加水平的增加,湘云鲫干物质表观消化率与蛋白质表观消化率同样表现为先升高后下降,在5.0 g/kg丁酸钠组达到最高[15],这可能与丁酸钠提高了湘云鲫上述血清生化指标有关。2.5 g/kg丁酸钠组血清白球比和谷草转氨酶活性显著高于对照组,但1.0 g/kg丁酸钠组与对照组差异不显著。在生长指标中,当丁酸钠添加水平为2.5 g/kg时,湘云鲫增重率、特定生长率、蛋白质效率和肥满度最高,显著高于对照组,比对照组分别提高了25.76%、16.46%、28.91%和8.37%,但7.5 g/kg丁酸钠组湘云鲫增重率、特定生长率和蛋白质效率与对照组差异不显著;各组湘云鲫饲料系数差异不显著,但2.5 g/kg丁酸钠组湘云鲫饲料系数最低,较对照组提高饲料效率12.32%[15]。上述不同添加水平丁酸钠对湘云鲫生长指标的影响变化趋势与湘云鲫上述血清生化指标的变化趋势相似,由此说明丁酸钠对湘云鲫的促生长作用与上述血清生化指标被提高有关,具体原因还有待相关研究进一步证实。同时,动物血液中谷丙转氨酶和谷草转氨酶活性变化与肝细胞的炎症、变性和坏死等密切相关,是反映肝细胞受损的主要敏感指标[16]。目前鲫鱼血液生化指标含量的范围尚无标准,研究结论大多是根据试验结果的差异性进行比较而得出。本试验中摄食含丁酸钠饲料的湘云鲫血清谷丙转氨酶和谷草转氨酶活性升高,是否暗示湘云鲫的肝细胞受到伤害,需要进一步的试验验证。饲料中的蛋白质在鱼体肠道中经过消化分解成小肽或氨基酸后,被鱼类吸收进入血液中。只有被吸收进血液的氨基酸才能被鱼体再利用和参与机体的代谢,因此,血清中游离氨基酸的含量在一定程度上反映了鱼体蛋白质代谢的水平。在本研究中发现饲料中添加一定水平的丁酸钠影响了湘云鲫血清中游离氨基酸的含量,但各种氨基酸含量变化趋势不一,有增有减,唯独赖氨酸表现为持续下降。这可能是由于鱼体氨基酸合成体蛋白质的作用得到加强,因赖氨酸是第一限制性氨基酸,随着蛋白质合成作用的加强,赖氨酸的利用增强,从而使得血清中赖氨酸的含量降低。血清中其他各种必需氨基酸基本上都表现为先增加后降低,在丁酸钠添加水平为2.5 g/kg时达到最高,继续增加丁酸钠添加水平其含量又降低的趋势,这说明丁酸钠对湘云鲫血清游离氨基酸含量的影响也具有剂量适度原则。此外,丁酸钠促进湘云鲫的生长也与其提高了鱼体蛋白质合成能力有关,其作用机理还有待相关研究进一步证实。
近年来,本研究室筛选出了在鲫鱼消化吸收饲料蛋白质过程中发挥重要作用的APN和GDH基因,并成功克隆了其序列。APN在机体蛋白质消化中主要负责在N端多肽链水解释放出游离氨基酸,是鱼类肠道食物中各种蛋白质水解消化的一种关键酶,在鱼类消化系统中发挥重要作用[17]。GDH是机体氨基酸代谢中发生脱氨基作用的一种关键酶,在鱼类氨基酸代谢中扮演重要角色[18]。本试验结果表明,丁酸钠对湘云鲫肠道APN和GDH基因的表达有显著影响,随丁酸钠添加水平的增加,APN基因的相对表达量表现为先下降后升高,GDH基因的相对表达量表现为持续升高后又显著下降,这也许与基因表达的阻遏调控有关。本研究结果表明,饲料中添加2.5 g/kg丁酸钠显著上调了湘云鲫肠道GDH基因的表达,具体的作用机理还有待进一步深入研究。
饲料中添加适量的丁酸钠提高了湘云鲫蛋白质代谢水平及其相关基因的表达,结合生长指标和生产成本,推荐添加剂量为2.5 g/kg。
| [1] | 徐振飞,陈国顺,徐长辉.不同剂型丁酸钠对断奶仔猪生长性能和血清指标的影响[J]. 湖南农业科学,2011(15):162-164,168. ( 2) 2)
|
| [2] | GÁLFI D,BOKORI J.Feeding trial in pigs with a diet containing sodium n-butyrate[J]. Acta Veterinaria Hungarica,1990,38(1/2):3-17. ( 1) 1)
|
| [3] | SCHEPPACH W.Effects of short chain fatty acids on gut morphology and function[J]. Gut,1994,35:S35-S38. ( 1) 1)
|
| [4] | GAUBATZ U,RUDECKI P,SCHIEMANN S,et al.Population transfer between molecular vibrational levels by stimulated Raman scattering with partially overlapping laser fields.A new concept and experimental results[J]. The Journal of Chemical Physics,1990,92:5363-5376. ( 1) 1)
|
| [5] | ROEDIGER W E.Utilization of nutrients by isolated epithelial cells of the rat colon[J]. Gastroenterology,1982,83(2):424-429. ( 1) 1)
|
| [6] | BIAQI G,PIVA A,MOSCHINI M,et a1.Performance,intestinal microflora,and wall morphology of weanling pigs fed sodium butyrate[J]. Journal of Animal Science,2007,85:1184-1191. ( 1) 1)
|
| [7] | 邹杨,杨在宾,杨维仁,等.不同剂型丁酸钠与抗生素对肉仔鸡生产性能、肠道pH及挥发性脂肪酸含量的影响[J]. 动物营养学报,2010,22(3):675-681. ( 1) 1)
|
| [8] | 郭传珍,曹兵海.丁酸钠对肉鸡肠道pH值、微生物菌群和挥发性脂肪酸的影响研究[J]. 中国家禽,2009,31(21):16-17,21. ( 1) 1)
|
| [9] | SAUER J,RICHTER K K,POOL-ZOBEL B L.Physiological concentrations of butyrate favorably modulate genes of oxidative and metabolic stress in primary human colon cells[J]. The Journal of Nutritional Biochemistry,2007,18(11):736-745. ( 1) 1)
|
| [10] | 刘丽华,张卫辉,夏新成,等.丁酸钠对肉仔鸡生产性能及免疫功能的影响[J]. 中国粮油学报,2009,24(10):84-88. ( 1) 1)
|
| [11] | 王继凤,陈耀星,王子旭,等.丁酸钠对断奶仔猪小肠黏膜形态结构的影响[J]. 中国兽医科技,2005,35(4):298-301. ( 1) 1)
|
| [12] | MANZANILLA E G,NOFRARÍAS M,ANGUITA M,et al.Effects of butyrate,avilamycin,and a plant extract combination on the intestinal equilibrium of early-weaned pigs[J]. Journal of Animal Science,2006,84:2743-2751. ( 1) 1)
|
| [13] | 张淞琳,常建波,叶继丹,等.丁酸钠对美洲鳗鲡摄食、生长性能和抗氧化能力的影响[J]. 福建农业学报,2011,26(4):549-551. ( 1) 1)
|
| [14] | LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods,2001,25(4):402-408. ( 1) 1)
|
| [15] | 孙浪,刘臻,周玲,等.丁酸钠对鲫鱼生长和肠细胞增殖的影响[J]. 中国水产科学,2013,20(4):893-901. ( 2) 2)
|
| [16] | 康格菲.临床生物化学[M]. 北京:人民卫生出版社,1989:73-96. ( 1) 1)
|
| [17] | NAKANISHI K,YAOI K,NAGINO Y,et al.Aminopeptidase N isoforms from the midgut of Bombyx mori and Plutella xylostella—their classification and the factors that determine their binding specificity to Bacillus thuringiensis CrylA toxin[J]. FEBS Letters,2002,519:215-220. ( 1) 1)
|
| [18] | 王镜岩,朱圣庚,徐长法,等.生物化学下册[M]. 3版.北京:高等教育出版社,2002:303-306. ( 1) 1)
|




