2. 中国科学院东北地理与农业生态研究所, 长春 130102
2. Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China
闭合蛋白(occludin)是细胞紧密连接蛋白中的重要的组成成分。上皮细胞之间通过occludin使细胞间的空隙封闭,形成机体渗透屏障,保持细胞两侧的物质差异,维持机体的正常生理功能。occludin的功能及其相关调控机制与多种疾病的发生有关,因此,本文就occludin的研究进展进行综述。
occludin的命名源自于拉丁字母Occludere,含义是封闭、阻挡。Furuse等[1]最早从鸡肝脏中发现了occludin,并陆续揭示了occludin的结构[2]。occludin的相对分子质量是64×103,含有504个氨基酸组成的4个跨膜结构域。
occludin的结构如图1所示,它由4个跨膜区域、2个细胞外环状结构和3个细胞浆区域组成。细胞浆区域主要包括细胞内的短环结构、1个短的氨基末端和1个长的羧基末端组成的区域。2个细胞外环状结构含有大量的酪氨酸残基,并且具有超过1/2以上的酪氨酸和甘氨酸残基。
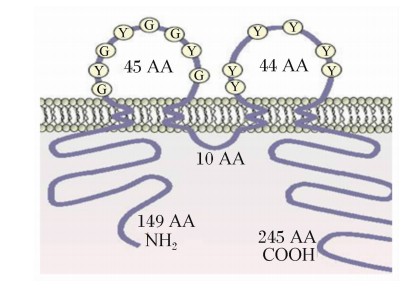 | 图1 occludin的结构 Fig.1 The structure of occludin[3] AA氨基酸 amino acid。 |
早期研究发现,在转染的狗肾细胞中,C-末端缩短的occludin能够准确的定位于紧密连接上[4]。以非洲爪蟾蜍胚胎为模型的研究表明,C-末端缩短的occludin的表达不仅会破坏紧密连接的屏障功能,而且在occludin结构的内部信号能够准确定位细胞与细胞间的连接。含有occludin突变体的紧密连接中常会出现漏洞,而这个由C-末端缩短的occludin引起漏洞可以通过转染完整occludin的mRNA给予纠正。因此完整的occludin的C-末端对纠正紧密连接的分布与功能具有重要意义[5]。
另一项相关研究显示,occludin在胞质内的C-末端能够调节基底膜上的转运蛋白,并且在碳端区域对基底膜目标信号进行合并,同时调节细胞的内吞作用[6]。
Bamforth等[7]研究表明,N-末端缩短的occludin位于小鼠上皮细胞系CSG 120/7上。通过电生理学测定结果显示,N-末端缩短结构会对紧密连接的屏障功能产生不利影响。进一步通过冷冻断裂电子显微镜观察到,N-末端缩短的occludin在紧密连接相关的原生质小叶处出现一个裂口。因此,N-末端缩短的occludin很好的解释了这一现象。由此得出,除去N-末端和细胞外区域会破坏紧密连接的封闭和屏障的特性[7]。
Wong等[8]研究揭示,occludin-1和occludin-2这2个细胞外区域的多肽与2个细胞外occludin区域有关,并且具有调节A6细胞中紧密连接的作用。第2个胞外区域肽occludin-2会可逆性地破坏紧密连接屏障的完整性,同时,occludin-2会减少紧密连接中occludin的含量,但是对其他紧密连接蛋白或者黏附链接蛋白E-钙黏素等没有影响。因此,occludin第2个胞外区域相关的肽对紧密连接的屏障功能具有较为特殊的调节意义。另一则研究采用Ca2+添加或者除去的方法研究occludin-1和occludin-2对A6细胞紧密连接重排的影响,跨上皮细胞电阻值(trans epithelial electrical resistance,TEER)结果显示,这2个肽会抑制紧密连接的封闭功能[9]。随后研究表明,第2个细胞外环是occludin在紧密连接中定位所必需的[10]。当缺少1个或者2个细胞外环会引起occludin的缩短,并在马丁达比狗细胞中表达。因此,第2个胞外区域对调节occludin在紧密连接中的分布具有重要的作用。
occludin的胞外或者跨膜区域对调节紧密连接的屏障功能具有重要的意义[10]。此外,occludin是紧密连接微丝的组成成分,并且其含量与维持上皮细胞极性的程度有关[11]。Furuse等[12]研究发现,当被感染的细胞缺乏紧密连接时,occludin具有形成紧密连接微丝的能力。Fujimoto[13]通过电镜观察发现,occludin主要存在于紧密连接原纤维中。
occludin的C-末端与纤维肌动蛋白直接结合,但是需要支架蛋白对纤维肌动蛋白结合进行调解,这是occludin区别于其他整合蛋白所特有性质。occludin能够通过羧基片段与紧密连接蛋白ZO-1[2]、ZO-2[14, 15]和ZO-3[16]蛋白结合。
紧密连接的电镜观察结果显示,在相邻细胞膜间存在着一系列“亲吻式”的连接点,正是由于这些连接点,使相邻细胞间的空隙被完全的阻塞[3]。因此,紧密连接具有2个主要功能:一是可以维持上皮细胞极性,形成上皮细胞游离面与基底面膜蛋白与膜脂分子侧向扩散的屏障,保证细胞的正常生理功能;二是形成机体渗透屏障,阻止蛋白质和大分子物质从上皮细胞一侧通过胞外间隙扩散到另一侧。除了这2个主要的功能外,紧密连接还具有维护细胞信号,连接细胞运输小泡的作用[17, 18]。
研究表明,如果上皮细胞中occludin突变体过度表达,会引起紧密连接屏障和通道功能的改变[4, 7, 19]。而且,上皮细胞中与合成多肽相关的occludin细胞外环的变化会引起紧密连接的缺失,抑制细胞黏附[9, 10, 20]。肠道研究试验发现,敲除上皮细胞中occludin基因,动物机体会出现炎症性肠炎等病理变化[21]。并且在溃疡性肠炎病人和克罗恩病人中occludin mRNA和蛋白质的表达水平呈显著性降低,由此推断,occludin可能参与了炎症性肠病的发病过程[22]。用线虫感染小鼠肠道上皮细胞后,会引起空肠上皮细胞中occludin基因表达的下调和移位,继而破坏肠道免疫屏障功能[23]。相反,当益生菌黏附细胞后,会诱导上皮细胞occludin基因表达,从而保护肠道黏膜屏障[24]。通过进一步研究发现,某些特定的益生菌会保护早期急性重症胰腺炎病人肠道的黏膜,但是对于器官功能性障碍的病人来讲,则加重肠道黏膜的损伤[25]。野生型致病大肠杆菌会引起结肠和回肠中occludin的重置,破坏肠道黏膜细胞的屏障功能[26]。上皮细胞系高度磷酸化的occludin分子会选择性的集中在紧密连接上面,而非磷酸化或者弱磷酸化的occludin则位于细胞质中[27, 28, 29]。在间皮细胞中,剪切力会显著降低occludin的含量,增加酪氨酸磷酸化,同时伴有上皮细胞渗透性的增强[30]。对不同氨基酸残基的磷酸化会存在不同的结果,因此,occludin的磷酸化在某种程度上对不同生物系统会产生一定的负面影响。
通过各种生理和病理学的刺激,对紧密连接的形成、分解和对维持紧密连接的结构进行调节。主要通过蛋白激酶C(protein kinase C,PKC)、有丝分裂原蛋白激酶(mitogen-activated protein kinase,MAPK)、肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、鸟苷三磷酸激酶(GTP ase)等对跨膜蛋白和肌动球蛋白的控制来完成紧密连接的调控。
occludin存在磷酸化和去磷酸化2种形式,磷酸化是其活性形式,去磷酸化的occludin主要存在于细胞质内,因此磷酸化对occludin的功能调控过程起到重要的作用。研究显示,只有当occludin磷酸化后才能与紧密连接结合[31]。其中对丝氨酸或者苏氨酸的磷酸化较为重要。酪氨酸磷酸化主要发生在occludin的C-末端,而C-末端主要与ZO-1蛋白结合,磷酸化的C-末端与ZO-1、ZO-2和ZO-3蛋白的片段结合能力低于非磷酸化酪氨酸的羧基片段,因此大大增加了细胞间的通透性[32]。酪氨酸磷酸化对紧密连接完整性的调控作用受ATP水平的影响。当ATP水平降低时,会破坏细胞内钙平衡,继而破坏紧密连接的完整性,使纤维性肌动蛋白重新排列,导致上皮细胞通透性增强。
Ma等[33]研究显示。肠致病性大肠杆菌感染肠上皮细胞后,使occludin去磷酸化,降低TEER,然而,用庆大霉素治疗上述细胞后,能够逆转occludin的去磷酸化,使TEER恢复正常水平。
PKC是一类磷脂依赖性蛋白激酶,通过催化蛋白质的磷酸化,调节细胞的生长、分化及代谢。一些特殊的PKC亚基会增加或降低小肠上皮细胞的TEER[34]。PKC能够调节受体2通路(Toll-like receptor 2,TLR2),当刺激TLR2通路时会使PKCα和PKCδ激活,继而引起TEER的增加[35]。
除了紧密连接磷酸化的信号通路,细胞骨架的完整性也会对紧密连接的调节起到重要的作用[36]。骨架蛋白主要通过肌动蛋白微丝与细胞质膜结合。采用细胞松弛素D破坏肌动蛋白细胞骨架,增加钠和甘露醇的通透性,该试验揭示了骨架蛋白完整性对调节紧密连接功能的重要性。
Ca2+依赖的E-钙黏素位于细胞紧密连接的下方,通过α-、β-、γ-链蛋白及锚蛋白、黏着斑蛋白和α辅肌蛋白与肌动蛋白结合,继而维持上皮细胞紧密连接的屏障功能。
细胞外Ca2+对紧密连接PKC通路具有调节作用。胞内Ca2+会改变ZO-1与肌动蛋白结合,继而改变occludin在细胞内的位置。低钙环境会破坏细胞的紧密连接。若在低钙环境下加入PKC激活剂,会引起occludin磷酸化,使紧密连接重组。二磷酸磷脂酰肌醇经过磷脂酶C水解后产生的三磷酸肌醇(inositol triphosphate,IP3),它会与内质网中的IP3结合,使Ca2+通道开启,细胞内Ca2+浓度升高,使MLCK磷酸化,引起肌纤蛋白一肌球蛋白环周边连接的收缩,引起紧密连接的松弛。Yamaguch等[37]研究表明,加压素会引起细胞内钙离子和MLC磷酸化的增加的,继而增加旁细胞通透性。
Ca2+螯合剂会消耗细胞外的Ca2+,减少E钙黏素所需要的Ca2+,使occludin分解,引起旁细胞通透性增强。
Rho酶通过调节细胞内肌动蛋白和肌球蛋白,继而对紧密连接蛋白occludin进行调节。将occludin的cDNA转染至内皮细胞后,会观察到环形的肌动蛋白[38]。Rho家族的鸟苷三磷酸酶(Rho GTPases)是一类小分子的G蛋白酶,相对分子质量为20×103~30×103,是Ras超家族中的一类,受PKC的调节[39],可作为信号分子调节细胞骨架相关的信号转导途径。激活Rho会使肌球蛋白磷酸化,使occludin在紧密连接处定位降低。
Rho GTPase,RhoA,Rac和Cdc42对紧密连接的结构、功能和肌动蛋白环具有重要的调节作用。Rho失活会引起occludin在细胞膜中重新排布,引起TEER降低,增加细胞通透性[40]。增加Rho的活化作用,使肌动球蛋白环紧缩,破坏紧密连接的结构[41]。抑制Rho活性并同时消除ATP,在转染细胞中会出现严重的紧密连接成分丢失的现象[42]。紧密连接形成过程中,Rho激酶对细胞骨架发挥重要的调节作用。同时,Rho激酶抑制剂可破坏紧密连接的屏障功能。
除此之外,动物正常的生理调节会改变紧密连接的通透性,因为不同组织中紧密连接的生理性调节与其生理功能是相关联的。当动物采食后,为了吸收葡萄糖和氨基酸,小肠上皮细胞紧密连接的通透性会增强。
综上所述,通过以上调控途径对紧密连接蛋白occludin进行调节,因此研究以上途径中的关键因子及相关激酶的表达量或磷酸化程度,探明不同生理条件下,调节不同组织或细胞中紧密连接蛋白occludin的表达通路,通过控制occludin的通路调节occludin的表达量,为occludin在疾病治疗和动物营养中的应用提供重要的理论基础。
随着电镜技术和细胞分子技术的广泛应用,对紧密连接的研究也在不断地深入。目前,occludin在人类和动物疾病中的作用和相关调节机制已经成为研究热点。occludin是紧密连接中的关键蛋白质,对旁细胞通路起到重要的调节作用。因此可以通过检测动物或者人类上皮细胞中occludin的分布和相对表达量,继而判断动物机体细胞屏障功能是否发生变化,反映机体的健康状态,肠道中某种紧密连接蛋白的缺失或者移位的症状可能为溃疡性肠炎、腹泻等。同样,可以通过诱导上调occludin的表达量,保护机体的屏障功能。陈德龙等[43]就是利用嗜酸乳杆菌上调上皮细胞紧密连接蛋白occludin,对霍乱沙门菌感染的猪空肠上皮细胞进行模拟治疗。occludin通过紧密连接蛋白、ZO-1与细胞质相连,保证细胞之间的连接力,防止肿瘤细胞的发生和转移。当细胞通透性增强后,可能会影响抗癌药物对癌症患者的治疗效果,但是可通过研制某种药物,调节occludin的表达量进而改善癌症的发生发展。脑缺血是常见的临床脑血管疾病,而导致脑缺血疾病的主要原因之一是血脑屏障完整性的破坏,所以只要掌握脑缺血早期血脑屏障通透性的变化就可以提早的预防并治疗脑缺血等疾病。有研究报道,脑缺血时引起血脑屏障通透性增加的可能与紧密连接蛋白occludin表达量的下降有关[44]。因此,检测机体免疫屏障中的主要蛋白质对提早发现疾病和深入研究疾病治疗提供了新的药物靶点。
occludin在动物生产及营养中的应用也较为广泛。刘海萍等[45]在早期断奶仔猪肠道通透性变化的研究中发现,早期断奶引起的肠道屏障功能的损伤和细胞通透性的改变可能是由于肠上皮紧密连接蛋白occludin mRNA的表达水平显著降低所致。可以通过在饲粮中添加高剂量的氧化锌来上调occludin mRNA的表达量,抑制细菌在肠道黏膜上的黏附,起到保护肠黏膜屏障的功能[46]。同时也可以通过改善肠道内occludin mRNA的表达量,保护肠道细胞膜屏障的完整性,维持肠道健康,最终提高动物对营养物质的吸收能力。Roselli等[47]研究显示,乳酸菌能够增加肠道内occludin mRNA的表达量,继而保护肠黏膜免受损伤。在饲粮中添加低聚乳果糖会增加肠道紧密连接蛋白occludin等的基因表达量,保护断奶大鼠肠道屏障功能,对断奶大鼠的生长发育具有良好的促进作用[48]。因此,在动物对营养物质消化吸收的研究中,通过检测occludin等紧密连接蛋白基因表达量的变化,继而反映出动物肠道屏障功能的完整性,从而揭示动物对营养物质消化利用的程度,并且通过在饲粮中添加某种营养物质,提高动物肠道的健康状态。
occludin是由4个跨膜区域、2个细胞外环状结构和3个细胞浆区域构成的紧密连接蛋白,对维持上皮细胞极性,形成机体渗透屏障具有重要的作用。虽然关于occludin结构、功能和调控机制已经进行了部分的研究,但是从营养的角度,研究食物或饲料中某种物质对机体occludin结构和表达等方面的影响可以为深入揭示occludin功能提供数据支持,并且从生理、病例变化中研究其结构的改变,为研究occludin在疾病治疗和动物营养中的应用提供重要的理论基础。
| [1] | FURUSE M,HIRASE T,ITOH M,et al.Occludin:a novel integral membrane protein localizing at tight junctions[J]. The Journal of Cell Biology,1993,123(6):1777-1788. ( 1) 1)
|
| [2] | FURUSE M,ITOH M,HIRASE T,et al.Direct association of occludin with ZO-1 and its possible involvement in the localization of occludin at tight junctions[J]. The Journal of Cell Biology,1994,127(6):1617-1626. ( 2) 2)
|
| [3] | GONZALEZ-MARISCAL L,BETANZOS A,NAVA P,et al.Tight junction proteins[J]. Progress in Biophysics & Molecular Biology,2003,81(1):1-44. ( 2) 2)
|
| [4] | BALDA M S,ALDA J A,WHITNEY C,et al.Functional dissociation of paracellular permeability and transepithelial electrical resistance and disruption of the apical-basolateral intramembrane diffusion barrier by expression of a mutant tight junction membrane protein[J]. The Journal of Cell Biology,1996,134(4):1031-1049. ( 2) 2)
|
| [5] | CHEN Y H,MERZDORF C,PAUL D L,et al.COOH terminus of occludin is required for tight junction barrier function in early Xenopus embryos[J]. The Journal of Cell Biology,1997,138(4):891-899. ( 1) 1)
|
| [6] | MATTER K,BALDA M S.Biogenesis of tight junctions:the C-terminal domain of occludin mediates basolateral targeting[J]. Journal of Cell Science,1998,111(Pt 4):511-519. ( 1) 1)
|
| [7] | BAMFORTH S D,KNIESEL U,WOLBURG H,et al.A dominant mutant of occludin disrupts tight junction structure and function[J]. Journal of Cell Science,1999,112(Pt 12):1879-1888. ( 3) 3)
|
| [8] | WONG V,GUMBINER B M.A synthetic peptide corresponding to the extracellular domain of occludin perturbs the tight junction permeability barrier[J]. Journal of Cell Biology,1997,136(2):399-409. ( 1) 1)
|
| [9] | LACAZ-VIERA F,JAEGER M M M,FARSHORI P,et al.Small synthetic peptides homologous to segments of the first external loop of occludin impair tight junction resealing[J]. Journal of Membrane Biology,1999,168(3):289-297. ( 2) 2)
|
| [10] | MEDINA R,RAHNER C,MITIC L L,et al.Occludin localization at the tight junction requires the second extracellular loop[J]. Journal of Membrane Biology,2000,178(3):235-247. ( 3) 3)
|
| [11] | GONZALEZ-MARISCAL L,NAMORADO M C,MARTIN D,et al.Tight junction proteins ZO-1,ZO-2,and occludin along isolated renal tubules[J]. Kidney International,2000,57(6):2386-2402. ( 1) 1)
|
| [12] | FURUSE M,SASAKI H,FUJIMOTO K,et al.A single gene product,claudin-1 or-2,reconstitutes tight junction strands and recruits occludin in fibroblasts[J]. The Journal of Cell Biology,1998,143(2):391-401. ( 1) 1)
|
| [13] | FUJIMOTO K.Freeze-fracture replica electron microscopy combined with SDS digestion for cytochemical labeling of integral membrane proteins.Application to the immunogold labeling of intercellular junctional complexes[J]. Journal of Cell Science,1995,108(Pt 11):3443-3449. ( 1) 1)
|
| [14] | ITOH M,MORITA K,TSUKITA S.Characterization of ZO-2 as a MAGUK family member associated with tight as well as adherens junctions with a binding affinity to occludin and alpha catenin[J]. Journal of Biological Chemistry,1999,274(9):5981-5986. ( 1) 1)
|
| [15] | WITTCHEN E S,HASKINS J,STEVENSON B R.Protein interactions at the tight junction.Actin has multiple binding partners,and ZO-1 forms independent complexes with ZO-2 and ZO-3[J]. Journal of Biological Chemistry,1999,274(49):35179-35185. ( 1) 1)
|
| [16] | WITTCHEN E S,HASKINS J,STEVENSON B R.Protein interactions at the tight junction.Actin has multiple binding partners,and ZO-1 forms independent complexes with ZO-2 and ZO-3[J]. Journal of Biological Chemistry,1999,274(49):35179-35185. ( 1) 1)
|
| [17] | SCHNEEBERGER E E,LYNCH R D.The tight junction:a multifunctional complex[J]. American Journal of Physiology:Cell Physiology,2004,286(6):C1213-C1228. ( 1) 1)
|
| [18] | SHIN K,FOGG V C,MARGOLIS B.Tight junctions and cell polarity[J]. Annual Review of Cell and Developmental Biology,2006,22(1):207-235. ( 1) 1)
|
| [19] | MCCARTHY K M,SKARE I B,STANKEWICH M C,et al.Occludin is a functional component of the tight junction[J]. Journal of Cell Science,1996,109(Pt 9):2287-2298. ( 1) 1)
|
| [20] | VAN ITALLI C M,ANDERSON J M.Occludin confers adhesiveness when expressed in fibroblasts[J]. Journal of Cell Science,1997,110:1113-1121. ( 1) 1)
|
| [21] | HERMISTON M L,GORDON J I.Inflammatory bowel disease and adenomas in mice expressing a dominant negative N-cadherin[J]. Science,1995,270:1203-1207. ( 1) 1)
|
| [22] | KUCHARZIK T,WALSH S V,CHEN J,et al.Neutrophil transmigration in inflammatory bowel disease is associated with differential expression of epithelial intercellular junction proteins[J]. American Journal of Pathology,2001,159(6):2001-2009. ( 1) 1)
|
| [23] | MCDERMOTT J R,BARTRAM R E,KNIGHT P A,et al.Mast cells disrupt epithelial barrier function during enteric nematode infection[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(13):7761-7766. ( 1) 1)
|
| [24] | 张中伟,秦环龙.乳酸菌对感染肠上皮细胞通透性及紧密连接蛋白表达的影响[J]. 肠外与肠内营养,2007,14(4):193-200. ( 1) 1)
|
| [25] | BESSELINK M G,VAN SANTYOORT H C,RENOOIJ W,et al.Intestinal barrier dysfunction in a randomized trial of a specific probiotic composition in acute pancreatitis[J]. Annals of Surgery,2009,250(5):712-719. ( 1) 1)
|
| [26] | SHIFFLETT D E,CLAYBURGH D R,KOUTSOURIS A,et al.Enteropathogenic E.coli disrupts tight junction barrier function and structure in vivo[J]. Laboratory Investigation,2005,85(10):1308-1324. ( 1) 1)
|
| [27] | ANDREEVA A Y,KRAUSE E,MULLER E C,et al.Protein kinase C regulates the phosphorylation and cellular localization of occludin[J]. Journal of Biological Chemistry,2001,276(42):38480-38486. ( 1) 1)
|
| [28] | SAKAKIBARA A,FURUSE M,SAITOU M,et al.Possible involvement of phosphorylation of occludin in tight junction formation[J]. The Journal of Cell Biology,1997,137(6):1393-1401. ( 1) 1)
|
| [29] | TSUKAMOTO T,NIGAM S K.Role of tyrosine phosphorylation in the reassembly of occludin and other tight junction proteins[J]. American Journal of Physiology,1999,276(5 Pt 2):F737-F750. ( 1) 1)
|
| [30] | DEMAIO L,CHANG Y S,GARDNER T W,et al.Shear stress regulates occludin content and phosphorylation[J]. American Journal of Physiology:Heart and Circulatory Physiology,2001,281(1):H105-H113. ( 1) 1)
|
| [31] | WONG V.Phosphorylation of occludin correlates with occludin localization and function at the tight junction[J]. American Journal of Physiology,1997,73(6 Pt 1):C1859-C1867. ( 1) 1)
|
| [32] | KALE G,NAREN A P,SHETH P,et al.Tyrosine phosphorylation of occludin attenuates its interactions with ZO-1,ZO-2,and ZO-3[J]. Biochemical and Biophysical Research Communications,2003,302(2):324-329. ( 1) 1)
|
| [33] | MA T Y,TRAN D,HOA N,et al.Mechanism of extracellular calcium regulation of intestinal epithelial tight junction permeability:role of cytoskeletal involvement[J]. Microscopy Research and Technique,2000,51(2):156-168. ( 1) 1)
|
| [34] | SONG J C,HANSON C M,TSAI V,et al.Regulation of epithelial transport and barrier function by distinct protein kinase C isoforms[J]. American Journal of Physiology:Cell Physiology,2001,281(2):C649-C661. ( 1) 1)
|
| [35] | PLOTNIKOV A,ZEHORAI E,PROCACCIA S,et al.The MAPK cascades:signaling components,nuclear roles and mechanisms of nuclear translocation[J]. Biochimica Biophysica Acta,2011,1813(9):1619-1633. ( 1) 1)
|
| [36] | FUJIMOTO K.Freeze-fracture replica electron microscopy combined with SDS digestion for cytochemical labeling of integral membrane proteins.application to the immunogold labeling of intercellular junctional complexes[J]. Journal of Cell Science,1995,108(Pt 11):3443-3449. ( 1) 1)
|
| [37] | YAMAGUCH Y,DALLE-MOLLE E,HARDISON W G.Vasopressin and A23187 stimulate phosphorylation of myosin light chain-1 in isolated rat hepatocytes[J]. American Journal of Physiology,1991,261(2):G312-G319. ( 1) 1)
|
| [38] | MATSUDA M,KUBO A,FURUSE M,et al.A peculiar internalization of claudins,tight junction-specific adhesion molecules,during the intercellular movement of epithelial cells[J]. Journal of Cell Science,2004,117:1247-1257. ( 1) 1)
|
| [39] | 秦环龙,高志光.肠上皮细胞紧密连接在肠屏障中的作用研究进展[J]. 世界华人消化杂志,2005,13(4):443-447. ( 1) 1)
|
| [40] | NUSRAT A,GIRY M,TUNER J R,et al.Rho protein regulates tight junctions and perijunctional actin organization in polarized epithelia[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(23):10629-10633. ( 1) 1)
|
| [41] | BRUEWER M,HOPKINS A M,HOBERT M E,et al.Rho A.Rac1,and Cdc42 exert distinct effects on epithelial barrier via selective structural and biochemical modulation of junctional proteins and F-actin[J]. American Journal of Physiology:Cell Physiology,2004,287(2):C327-C335. ( 1) 1)
|
| [42] | WALSH S V,HPOKINS A M,CHEN J,et al.Rho kinase regulates tight junction function and is necessary for tight junction assembly in polarized intestinal epithelia[J].Gastroenterology,2001,121(3):566-579. ( 1) 1)
|
| [43] | 陈德龙,朱宏亮,许光勇,等.乳酸菌对IPEC J2细胞黏着斑激酶磷酸化及紧密连接蛋白 Occludin 表达的影响[J].畜牧兽医学报,2013,44(2):283-288. ( 1) 1)
|
| [44] | 王静娥,田国萍,周进,等.大鼠脑缺血时紧密连接相关蛋白 Occludin 和 claudin-5表达的变化[J].解剖科学进展,2010,16(2):149-152. ( 1) 1)
|
| [45] | 刘海萍,胡彩虹,徐勇.早期断奶对仔猪肠通透性和肠上皮紧密连接蛋白 Occludin mRNA表达的影响[J].动物营养学报,2008,20(4):442-446. ( 1) 1)
|
| [46] | 胡彩虹,钱仲仓,刘海萍,等.高锌对早期断奶仔猪肠黏膜屏障和肠上皮细胞紧密连接蛋白表达的影响[J].畜牧兽医学报,2009,40(11):1638-1644. ( 1) 1)
|
| [47] | ROSELLI M,FINAMORE A,BRITTI M S,et al.The novel porcine Lactobacillus sobrius strain protects intestinal cells from enterotoxigenic Escherichia coli K88 infection and prevents membrane barrier damage[J].The Journal of Nutrition,2007,137(12):2709-2716. ( 1) 1)
|
| [48] | 黄小流.低聚乳果糖对断奶应激大鼠肠道紧密连接及屏障功能的影响[D].硕士学位论文.南昌:南昌大学,2012:22-23. ( 1) 1)
|




