二十二碳六烯酸(docosahexaenoic acid,DHA)是一种对动物非常重要的ω-3系列长链多不饱和脂肪酸,俗称“脑黄金”。自从1978年Dyerberg等[1]发现爱斯基摩人摄入了大量的海洋脂类物质,而他们心脑血管病的发生率较低开始到现在,人类对DHA已进行了几十年的深入研究。研究发现DHA具有治疗癌症、促进大脑发育、降低心脑血管病的发生、抑制炎症等功能。人体中的DHA必须通过摄取食物来获得,富含DHA的食物主要有深海藻类、深海高脂肪鱼类、鱼油、家禽及蛋类等。如今,人们的保健意识越来越强,人们对保健产品的需求也越来越多。因此,开发含DHA等的功能性产品成为现代畜牧生产上研究的主要方向。本文综述了DHA的生物功能、DHA的生产以及其在动物营养中的应用。
DHA的分子式为C22H30O2,相对分子质量为328.48,分子结构式见图1。纯品DHA为无色、无味,常温下呈液态,且具有脂溶性,易溶于有机溶剂,不溶于水,熔点为-45.5~-44.1 ℃,所以在低温下仍然能保持较高的流动性。一般情况下,DHA为顺式,但在异构酶的作用下可变成反式。另外,DHA中含有活泼的亚甲基,而亚甲基极易在光、氧、过热、金属元素(如铁、铜)及自由基的影响下,产生氧化、酸败、聚合、双键共轭等化学反应,进而产生以羰基化合物为主的鱼臭物质[2]。
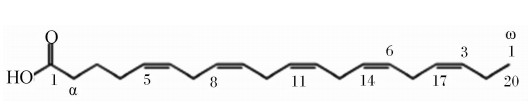 | 图1 DHA分子结构式
Fig.1 The molecular structure of DHA[3] |
DHA的主要来源是海洋鱼类和海藻,还有部分贝类和甲壳类中也含有丰富的DHA。但是,由于分离技术等因素的限制以及提取的鱼油有相当大的部分被氧化和消耗掉,真正可用于分离DHA的鱼油仅占少部分。再者,利用鱼类生产DHA会导致鱼类失去生态平衡,甚至灭亡[4]。因此,现在人们开始利用海藻中的金藻类、甲藻类、硅藻类、红藻类、褐藻类、绿藻类及隐藻类等提取DHA。除此之外,许多低级的真菌中也含有较多的DHA,其中藻状菌类的DHA含量尤为丰富,是进行DHA商业性开发的潜在来源。
在动物体内,DHA是构成动物生物膜的重要组成部分以及动物体内一些激素的主要前体,其主要以磷脂形式存在,游离脂肪酸很少。一旦DHA被动物吸收后,绝大部分与甘油三酯进行结合。虽然DHA是一种脂肪酸,但并不作为机体的主要能量来源,当机体中其他脂肪酸被大量利用、消耗后,DHA才被氧化分解来供能[5]。
鱼类中的沙丁鱼、金枪鱼、黄金鱼和肥壮金枪鱼等的鱼油中富含DHA,但DHA含量高且可作为提取DHA原料的是金枪鱼和铿鱼油。鱼类中DHA的提取一般从鱼眼窝脂肪酸中获得,其工艺如下:鱼头—摘出眼窝脂肪—煮沸抽提—油层分离—脱腊—脱色—脱臭—精制DHA。但是随着鱼类的过度捕捞,全球渔业资源日渐紧缺,因此在鱼油中获取DHA存在一些问题:1)鱼油中被提取出来的DHA胆固醇含量较高,且具有鱼腥味,严重影响DHA的品质;2)不同种类鱼的鱼油中DHA的含量不同,而且鱼油中DHA含量会因季节、捕捞的地理位置和时间等条件的不同而存在差异;3)从鱼油中提取DHA的加工过程中,因进行氢化处理,降低了鱼油中的DHA产量,造成了DHA的浪费;4)鱼油中的DHA含有大量其他饱和及低不饱和的脂肪酸,造成其浓缩困难,导致加工处理过程复杂,进而提高了DHA生产的成本;5)鱼油中提取的DHA不适合素食主义者,另外,鱼类脂肪中积累了大量的有机污染物[6]。因此,从鱼油中提取分离得到的DHA,在数量和质量上均不能满足社会的需求。另外,纯化鱼油中的DHA存在一定的难度。寻找更安全,可靠的原料来源提取DHA的生物资源已经受到国内外广大学者的广泛关注[7, 8]。
随着DHA研究的不断深入,发现海洋中多种微藻和真菌均能自身合成DHA,并且其DHA相对含量远高于鱼油。研究发现,海洋中的金藻、甲藻、隐藻、硅藻等微藻和真菌中的破囊壶菌和裂殖壶菌中富含DHA,且主要以储存油和膜脂形式存在[9, 10, 11]。
当前,从微藻中提取DHA的工艺仍处于实验室研究阶段,一般采取以下的步骤:藻体收集—冷冻干燥—脂肪酸萃取—脂肪酸转酯化—分离—纯化。利用真菌发酵生产 DHA的研究主要集中在破囊壶菌和裂殖壶菌,二者均来自海洋,是具有色素和光刺激生长特性的真菌。利用真菌发酵生产DHA可以人为控制影响因素,可以稳定生产DHA,并保持其产量和含量。另外,真菌发酵生产的DHA中一般含有少量的其他多不饱和脂肪酸,这样利于DHA的分离、浓缩,制备出高纯度DHA[12, 13]。
利用微生物发酵生产DHA虽取得一定的进展,但还是存在一些问题:1)缺乏能够大量生产DHA的菌种,而且菌体在发酵过程中生长速率太低,其DHA含量不高;2)还不能利用微生物发酵进行大规模工业化生产DHA,现在只停留在实验室研究阶段;3)从微生物发酵液中提取DHA的方法还有待于进一步改进,以适应于工业化的需要;4)尚需探索微生物可利用的廉价底物,以降低其生产成本。因此,当前最迫切的任务是从自然界微生物资源中筛选高产DHA的优质菌种,加强对DHA的发酵条件、代谢调控和工艺的研究[14, 15, 16]。
DHA被细胞吸收后进入细胞膜,使细胞膜的磷脂聚集,改变细胞膜的性能,使细胞横跨膜蛋白与其配体的微环境发生改变,影响膜结合蛋白与其他多蛋白复合物参与的细胞信号系统,进而调节脂质的代谢。另外,细胞内的DHA能够充当一些细胞核受体[如过氧化物酶体增殖物激活受体(PPARs)、固醇调节元件结合蛋白1c(SREBP-1c)和肝细胞核-a]的配体,影响炎症反应和脂质的代谢。除此之外,细胞内的应激源与跨膜受体相作用,启动细胞内与G蛋白相关的反应,促使磷脂酶A2(PLA2)的活性增加,水解DHA,并在细胞内酯化产生磷脂,再经环加氧酶(COX)、脂氧合酶(LOX)等酶的作用下生成具有影响细胞的代谢的类花生酸,从而改变细胞离子通道的活性,导致细胞膜电位发生改变,进而发挥调节脂质代谢的作用[17, 18, 19, 20, 21]。试验结果表明,DHA能够降低血清中甘油三酯、低密度脂蛋白、极低密度脂蛋白的含量,增加高密度脂蛋白含量,促进胆固醇的分解,抑制内源性胆固醇的合成,被誉为血管的“清道夫”[22, 23, 24]。一氧化氮(NO)是维持心肌正常生理活动的重要分子,具有扩张血管,抑制血小板聚集等功能。DHA能够通过增加血管内皮细胞沉默信息调节因子1(SIRT1)基因的表达,减少一氧化氮合成酶脱乙酰作用,从而增加NO的生成。另外,血小板生成的血栓素具有对血小板促凝和收缩血管的作用,而血管内皮产生的前列环素作用与之相反,两者之间平衡具有调节血小板和血管的功能。DHA能够抑制血栓素的形成,抑制血小板凝集,增强血管舒张作用,减少血栓的形成[25, 26]。因此,DHA具有预防和治疗动脉硬化、高血压、心肌梗塞等疾病的作用。
前列腺素(PG)是一种二十碳不饱和脂肪酸,在体内由花生四烯酸(AA)合成。前列腺素H2(PGH2)是一种促炎因子,而前列腺素H3(PGH3)是一种抗炎因子。一般情况下,它们之间处于平衡状态。当失去稳态时,会导致炎症的产生,而ω-3系列脂肪酸的二十碳五烯酸(EPA)和DHA被吸收后,产生PGH3来进行抗炎。另外,过敏性慢反应物质(SRSA)在过敏性反应中具有调节支气管收缩和血管通透性的作用,是三种特异的白三烯(LT)。白三烯B4(LTB4)有促炎的作用,AA促进其生成,而DHA和EPA能够与AA竞争,促进几乎无生理活性的白三烯B5(LTB5)形成,从而起到抗炎的作用[27, 28]。
DHA在人脑中主要以磷脂的形式存在,存在于大脑灰、白质部,对脑细胞的形成和构造起重要作用[29]。胎儿自身不能产生DHA,需要从母体中获得,如果母体提供的DHA不足,会导致胎儿的脑细胞生长和发育缓慢,严重时会导致胎儿中枢神经系统发育不全,影响自身代谢[30]。另外,DHA对脑细胞具有刺激作用,能使脑细胞突触延长,加强神经细胞之间的联系,促使信息的传递更迅速,记忆力提高[31, 32]。组胺是机体内的活性物质之一,当机体受到理化的刺激或发生过敏反应时,就会导致组胺释放。抑郁症、老年痴呆症、神经衰弱等病会导致脑中组胺H1受体减少。研究表明,补充DHA会抑制组胺H1受体减少[33]。因此,DHA还可以防治抑郁症、老年痴呆症等疾病。
眼睛视网膜细胞中的DHA含量最高,研究发现,眼睛视网膜细胞中的DHA不足时,使视神经灵敏度降低,说明DHA具有保护视网膜和改善视力的作用。DHA能使视网膜与大脑之间保持良好的联系,从而阻止视力减退。另外,充足的DHA能防止视网膜血栓的产生,阻止脂质渗出,从而保护视网膜,改善视力[34]。
细胞内的活性氧(ROS)会破坏细胞蛋白质、脂质和核酸,导致细胞损伤。DHA是一种多不饱和脂肪酸,含有多个双键,容易发生非酶的脂质过氧化,使细胞内的ROS处于高水平,引起细胞线粒体膜电位的下降,释放细胞色素C,随后激活Caspase家族的若干蛋白,导致肿瘤细胞凋亡[35, 36, 37]。前列腺素E2(PGE2)是一种重要的细胞生长和调节因子,能够诱导细胞增殖,促进抑制细胞凋亡的B淋巴细胞瘤-2(Bcl-2)蛋白的合成,导致细胞凋亡和增殖之间失去平衡,从而促进肿瘤的发生。另外,PGE2还能促进细胞外基质降解和血小板聚集,利于肿瘤细胞的侵袭和转移。DHA能够抑制PGE2的产生,从而发挥抑制肿瘤生长的作用[38, 39]。除此之外,DHA具有促进T淋巴细胞的增殖功能,提高肿瘤坏死因子a(TNF-a)、白细胞介素6(IL-6)等细胞因子的mRNA转录,以及下调T淋巴细胞表面的死亡受体Fas,减少T淋巴细胞的凋亡,增强T淋巴细胞的抗肿瘤作用[40, 41]。
断奶仔猪的主要能量来源,依赖于肠道吸收的葡萄糖。研究表明,饲粮中添加DHA可改善断奶仔猪肠道葡萄糖的吸收,提高肌糖原的含量,提高断奶仔猪的日增重[42, 43]。刘玉兰等[44]研究发现,DHA可能通过促进淋巴细胞NO、环磷酸腺苷(cAMP)的产生,提高cAMP/环磷酸鸟苷(cGMP)和抑制蛋白激酶C(PKC)的活性而抑制淋巴细胞转化,进而影响断奶仔猪的免疫力。Li等[45, 46]研究发现,在小猪的饲粮中添加DHA,可显著增加脑、肝脏和肌肉三磷酸鸟苷环化水解酶的活性、四氢生物蝶呤(BH4)和还原型辅酶Ⅱ(NADPH)的浓度以及增强脑和肌肉的一氧化氮合酶活性,促进新生仔猪的生长和发育;降低肝脏、肌肉和血浆中谷氨酸、丝氨酸、苏氨酸、谷氨酰胺和蛋氨酸等氨基酸含量,提高甘氨酸和赖氨酸的含量,影响仔猪组织的生长。此外,富含DHA的饲粮能增加骨骼肌胰岛素(INS)浓度和胰岛素样生长因子1(IGF-1)基因的表达,进而增加生长猪骨骼肌蛋白质的形成,促进其生长;改变成年猪睾丸磷脂平衡、脂肪组织和影响睾丸睾酮和雌二醇的浓度,影响其繁殖能力[47, 48]。除此之外,在育肥猪的饲粮中添加富含DHA的鱼油,可以提高育肥猪脂肪、肌肉中DHA、EPA的含量,但不影响猪的生产性能和肉质,可以生产EPA、DHA含量高的功能性猪肉[49]。
在蛋鸡的饲粮中添加富含DHA的添加剂,能够提高蛋鸡的生产性能,改善鸡蛋品质。彭瑛等[50]研究发现,在蛋鸡的饲粮中添加DHA复合添加剂,可提高平均蛋重量和哈氏单位,但对产蛋率、料蛋比和蛋形指数无影响,显著提高鸡蛋中的DHA含量。另外,蛋鸡饲粮中添加富含DHA的鱼油,对蛋鸡的产蛋性能没有影响,但会增加蛋黄中长链ω-3脂肪酸含量,降低共轭亚油酸、饱和脂肪酸和长链ω-6脂肪酸含量[51, 52]。这也为开发富含DHA的功能性鸡蛋提供了科学依据。在肉鸡上,Li等[53]研究饲粮添加DHA对肉鸡生长和脂肪代谢基因转录的后效作用,结果发现,肉鸡的日增重和饲料转化率增加,腹脂率及血清中的总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量降低,高密度脂蛋白胆固醇含量增加;使肝脏PPARα和肉碱酰基转移酶(CPT-1)mRNA、腹脂和腿肌的乙酰辅酶A羧化酶(ACC)、Fas和CPT-1 mRNA表达提高,抑制肝脏、腿肌和胸肌的Fas mRNA及腹脂和胸肌的脂蛋白脂酶(LPL)mRNA表达。DHA能够抑制肝脏、腿肌和胸肌脂肪的合成,促进脂肪组织中脂肪的合成与分解。Hall等[54]发现母鸡饲粮中添加富含DHA的饲料,孵出的小鸡脾脏和法氏囊的DHA含量较高,血小板中产生大量LTB5,结果表明,DHA能够调节小鸡LT的产生,进而降低小鸡炎症的发生。另外,Patricia等[55]研究发现,小鸡饲粮中添加DHA能够通过诱导氧化应激来抵抗盲肠的艾美球虫,结果提示,DHA具有预防鸡艾美球虫病的作用。
牛奶乳脂中含有大量能够引起肥胖、诱导产生心血管病等的棕榈酸、月桂酸和豆蔻酸。摄入过多对身体有害。研究发现,奶牛饲粮中添加DHA能降低乳脂含量,增加乳脂中二十三碳脂肪酸(C23∶ 0)的含量,但对乳蛋白质和乳糖含量以及乳脂中总饱和脂肪酸含量无显著影响,同时可降低乳脂中总单不饱和脂肪酸/多不饱和脂肪酸和产奶量[56]。说明DHA改变了牛奶中乳脂脂肪酸的组成和比例,提高牛奶的品质。纤维物质是奶牛重要的营养物质之一,其在瘤胃内降解和吸收影响奶牛的生产性能,瘤胃内纤维物质的降解主要由微生物提供的包括纤维素酶等在内的多种纤维酶来完成的。研究发现,在饲粮中添加DHA可以提高水杨苷酶、木聚糖酶和羧甲基纤维素酶活性[57]。除此之外,改变饲粮添加EPA/DHA,可改变奶牛瘤胃发酵模式,影响不饱和脂肪酸的瘤胃氢化过程,使脂肪酸组成发生改变,为采用新的营养措施调控反刍动物产品中共轭亚油酸的含量提供理论依据;饲粮中添加亚油酸和DHA可协同影响瘤胃原虫中奇数碳链脂肪酸的含量,影响瘤胃原虫的活性,进而影响营养物质在瘤胃中的分解和吸收[58, 59]。
饲料中长链多不饱和脂肪酸(如DHA和EPA)是虾蟹类的必需脂肪酸,对蟹的生长、发育和生殖具有重要的作用。汪留全等[60]研究发现,在饲料中添加0.3%的DHA和EPA具有提高幼蟹的增重,增加幼蟹的摄食率、饲料转化率和对蛋白质的转化率的作用。汪倩等[61]研究不同饲料对三疣梭子蟹卵巢发阶段的肝胰腺指数、卵巢指数和肝胰腺组织结构的影响,发现当DHA/EPA为2时,卵巢发育较好,肝胰腺指数大,利于营养物质储存。以上研究结果说明,添加DHA和EPA具有促进幼蟹生长、提高饲料转化率和改善繁殖性能的作用。另外,在DHA对鲤抗氧化能力的影响的研究中发现,在DHA直接或短期作用下,鲤肝脏、胰脏和干细胞处于氧化应激的状态,抗氧化能力诱导性得到提高;在正常油脂水平下,长期饲喂DHA,机体能够适应氧化应激,而高油脂水平下,机体抗氧化能力会下降[62]。王桂芹等[63, 64]研究发现,在建鲤基础饲料中加入维生素E和DHA,能够提高建鲤的生产性能和饲料利用率,提高建鲤的抗氧化、免疫力和抗病力,进而促进其生长,降低个体分化。在高密度、集约化养殖模式中,可作为一种免疫增强剂进行适量添加。
随着人们生活水平的提高,人们对健康和保健日益重视,而DHA因具有预防心脑血管疾病、防治癌症、抑制发炎以及预防老年痴呆等作用而备受关注。利用鱼油提取DHA,会影响鱼类生态平衡;用微生物来提取,则生产工艺还不适合工业化生产。研究表明,在动物饲粮中添加富含DHA的鱼油、微藻能够显著提高动物产品中DHA的含量,转化为动物产品中的DHA的营养价值不会受到影响,容易保存,且去除了DHA本生的腥臭味,提高了食用价值。因此,在开发富含DHA的动物产品上具有广阔的市场。另外,饲粮中添加DHA还能够改善动物的生产性能,提高饲料转化率,提高繁殖性能。在生产实践中,一般利用鱼油、微藻等原料配制富含DHA的饲粮。目前,鱼油、微藻等的价格较高,饲粮中添加过多不仅会增加饲料成本,而且还会因其含有丰富的多不饱和脂肪酸而易氧化,容易导致饲料变质,影响适口性。再者,动物摄入过多的DHA会导致动物产品中产生不好的气味,影响动物产品的质量[65],还会对动物产生副作用,如导致免疫力下降等。因此,在实际应用过程中要注意使用量。
| [1] | DYERBERG J,BANG H O,STOFFERSOM E,et al.Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis?[J]. Lancet,1978,2(8081):117-119. ( 1) 1)
|
| [2] | SCHUCHARDT J P,HAHN A.Bioavailability of long-chain omega-3 fatty acids[J]. Prostaglandins,Leukotrienes and Essential Fatty Acids,2013,89(1):1-8. ( 1) 1)
|
| [3] | STROBEL C,JAHREIS G,KUHNT K.Survey of n-3 and n-6 polyunsaturated fatty acids in fish and fish products[J]. Lipids in Health and Disease,2012,11(1):144. ( 1) 1)
|
| [4] | DULVY N K,SADOVY Y,REYNOLDS J D.Extinction vulnerability in marine populations[J]. Fish and Fisheries,2003,4(1):25-64. ( 1) 1)
|
| [5] | CALDER P C.Mechanisms of action of (n-3) fatty acids[J]. The Journal of Nutrition,2012,142(3):592-599. ( 1) 1)
|
| [6] | WORM B,BARBIER E B,BEAUMONT N,et al.Impacts of biodiversity loss on ocean ecosystem services[J]. Science,2006,314:787-790. ( 1) 1)
|
| [7] | MAHAFFEY K R,CLICKNER R P,JEFFRISE R A.Methylmercury and omega-3 fatty acids:co-occurrence of dietary sources with emphasis on fish and shellfish[J]. Environmental Research,2008,107(1):20-29. ( 1) 1)
|
| [8] | LENIHAN-GEELS G,BISHOP K,FERGUSON L.Alternative sources of omega-3 fats:can we find a sustainable substitute for fish?[J]. Nutrients,2013,5(4):1301-1315. ( 1) 1)
|
| [9] | MARTIN E S,LOLKE S,JACK T P.High-cell-density fed-batch cultivation of the docosahexaenoic acid producing marine alga Crypthecodinium cohnii[J]. Biotechnology and Bioengineering,2003,81(6):666-672. ( 1) 1)
|
| [10] | BURJA A M,RADIANINGTYAS H,WINDUST A,et al.Isolation and characterization of polyunsaturated fatty acid producing Thraustochytrium species:screening of strains and optimization of omega-3 production[J]. Applied Microbiology and Biotechnology,2006,72(6):1161-1169. ( 1) 1)
|
| [11] | ZHU L Y,ZHANG X C,JI L,et al.Changes of lipid content and fatty acid composition of Schizochytrium limacinum in response to different temperatures and salinities[J]. Process Biochemistry,2007,42(2):210-214. ( 1) 1)
|
| [12] | SIJTSMA L,DE SWAAF M E.Biotechnological production and applications of the ω-3 polyunsaturated fatty acid docosahexaenoic acid[J]. Applied Microbiology and Biotechnology,2004,64(2):146-153. ( 1) 1)
|
| [13] | QU L,REN L J,SUN G N,et al.Batch,fed-batch and repeated fed-batch fermentation processes of the marine thraustochytrid Schizochytrium sp.for producing docosahexaenoic acid[J]. Bioprocess and Biosystems Engineering,2013,doi:10.1007/s00449-013-0966-7. ( 1) 1)
|
| [14] | SCHUHMANN H,LIM D K Y,SCHENK P M.Perspectives on metabolic engineering for increased lipid contents in microalgae[J]. Biofuels,2012,3(1):71-86. ( 1) 1)
|
| [15] | SUBHADRA B G.Sustainability of algal biofuel production using integrated renewable energy park (IREP) and algal biorefinery approach[J]. Energy Policy,2010,38(10):5892-5901. ( 1) 1)
|
| [16] | BOELEN P,VAN DIJK R,SINNINGHE D J S,et al.On the potential application of polar and temperate marine microalgae for EPA and DHA production[J]. AMB Express,2013,3(1):26. ( 1) 1)
|
| [17] | STILLWELL W,WASSALL S R.Docosahexaenoic acid:membrane properties of a unique fatty acid[J]. Chemistry and Physics of Lipids,2003,126(1):1-27. ( 1) 1)
|
| [18] | MA D W,SEO J,SWITZER K C,et al.n-3 PUFA and membrane microdomains:a new frontier in bioactive lipid research[J]. The Journal of Nutritional Biochemistry,2004,15(11):700-706. ( 1) 1)
|
| [19] | LI Q R,WANG M,TAN L,et al.Docosahexaenoic acid changes lipid composition and interleukin-2 receptor signaling in membrane rafts[J]. The Journal of Lipid Research,2005,46(9):1904-1913. ( 1) 1)
|
| [20] | LEAF A,KANG J X,XIAO Y F,et al.Clinical prevention of sudden cardiac death by n-3 polyunsaturated fatty acids and mechanism of prevention of arrhythmias by n-3 fish oils[J]. Circulation,2006,107(21):2646-2652. ( 1) 1)
|
| [21] | CORRALES G P,RIVERO N L,CULEBRAS-FERNÁNDEZ J M.Role of omega-3 fatty acids in cardiovascular disease prevention[J]. Nutrición Hospitalaria,2013,28(1):1-5. ( 1) 1)
|
| [22] | PARK Y,HARRIS W S.Omega-3 fatty acid supplementation accelerates chylomicron triglyceride clearance[J]. The Journal of Lipid Research,2003,44(3):455-463. ( 1) 1)
|
| [23] | SINGHAL A,JULIE L,STORRY C,et al.Docosahexaenoic acid supplementation,vascular function and risk factors for cardiovascular disease:a randomized controlled trial in Young adults[J]. Journal of the American Heart Association,2013,2(4):e000283. ( 1) 1)
|
| [24] | PIRILLO A,CATAPANO A L.Omega-3 polyunsaturated fatty acids in the treatment of hypertriglyceridaemia[J]. International Journal of Cardiology,2013,doi:10.1016/j.ijcard.2013.06.040. ( 1) 1)
|
| [25] | JUNG S B,KWON S K,KWON M,et al.Docosahexaenoic acid improves vascular function via up-regulation of SIRT1 expression in endothelial cells[J]. Biochemical and Biophysical Research Communications,2013,437(1):114-119. ( 1) 1)
|
| [26] | LORENTE C S,COSTA A G,NAVAS C S,et al.Role of omega-3 fatty acids in obesity,metabolic syndrome,and cardiovascular diseases:a review of the evidence[J]. Journal of Physiology and Biochemistry,2013,69(3):633-651. ( 1) 1)
|
| [27] | CALDER P C.Polyunsaturated fatty acids,inflammation,and immunity[J]. Lipids,2001,36(9):1007-1024. ( 1) 1)
|
| [28] | CALDER P C.n-3 polyunsaturated fatty acids,inflammation,and inflammatory diseases[J]. American Journal of Clinical Nutrition,2006,83(Suppl.6):1505S-1519S. ( 1) 1)
|
| [29] | KYRATKO C N,BARRETT E C,NELSON E B,et al.The relationship of docosahexaenoic acid (DHA) with learning and behavior in healthy children:a review[J]. Nutrients,2013,5(7):2777-2810. ( 1) 1)
|
| [30] | FORSYTH J S,CARLSON S.Long-chain polyunsaturated fatty acids in infant nutrition:effects on infant development[J]. Current Opinion in Clinical Nutrition and Metabolic Care,2001,4(2):123-126. ( 1) 1)
|
| [31] | YURKO M K,MCCARTHY D,ROM D,et al.Beneficial effects of docosahexaenoic acid on cognition in age-related cognitive decline[J]. Alzheimers & Dement,2010,6(6):456-464. ( 1) 1)
|
| [32] | CRUPI R,MARINO A,CUZZOCREA S.n-3 fatty acids:role in neurogenesis and neuroplasticity[J]. Current Medicinal Chemistry,2013,20(24):2953-2963. ( 1) 1)
|
| [33] | WU Z X,YU Y H,WU Y Z,et al.Ruduction of histamine H1 receptor binding induced by high-fat diet can be prevented by DHA and dietary fiber in specific brain areas of male rats[J]. Brain Research Bulletin,2013,97:119-125. ( 1) 1)
|
| [34] | JENSEN C L,VOIGT R G,PRAGER T C,et al.Effects of maternal docosahexaenoic acid intake on visual function and neurodevelopment in breastfed term infants[J]. American Journal of Clinical Nutrition,2005,82(1):125-132. ( 1) 1)
|
| [35] | GLEISSMAN H,JOHNSEN J I,KOGNER P.Omega-3 fatty acids in cancer,the protectors of good and the killers of evil?[J]. Experimental Cell Research,2010,316(8):1365-1373. ( 1) 1)
|
| [36] | DAI J F,SHEN J H,PAN W S,et al.Effects of polyunsaturated fatty acids on the growth of gastric cancer cells in vitro[J]. Lipids in Health and Disease,2013,12(1):71-85. ( 1) 1)
|
| [37] | SHIN S,JING K P,JEONG S,et al.The omega-3 polyunsaturated fatty acid DHA induces simultaneous apoptosis and autophagy via mitochondrial ROS-mediated Akt-mTOR signaling in prostate cancer cells expressing mutant p53[J]. BioMed Research International,2013,doi:10.1155/2013/568671. ( 1) 1)
|
| [38] | GRANCI V,CAI F,LECUMBERRI E,et al.Colon cancer cell chemosensitisation by fish oil emulsion involves apoptotic mitochondria pathway[J]. British Journal of Nutrition,2013,109(7):1188-1195. ( 1) 1)
|
| [39] | ABRAHAO A C,CASTILHO R M,SQUARIZE C H,et al.A role for COX2-derived PGE2 and PGE2-receptor subtypes in head and neck squamous carcinoma cell proliferation[J]. Oral Oncology,2010,46(12):880-887. ( 1) 1)
|
| [40] | JUMAN S,HASHIMOTO M,KATAKURA M,et al.Effects of long-term oral administration of arachidonic acid and docosahexaenoic acid on the immune functions of young rats[J]. Nutrients,2013,5(6):1949-1961. ( 1) 1)
|
| [41] | DA BETIATI D S B,DE OLIVEIRA P F,DE CAMARGO C Q,et al.Effects of omega-3 fatty acids on regulatory T cells in hematologic neoplasms[J]. Revista Brasileira de Hematologia e Hemoterapia,2013,35(2):119-125. ( 1) 1)
|
| [42] | GABLER N K, SPENCER J D, WEBEL D M,et al.In utero and postnatal exposure to long chain (n-3) PUFA enhances intestinal glucose absorption and energy stores in weanling pigs[J]. The Journal of Nutrition,2007,137(11):2351-2358. ( 1) 1)
|
| [43] | LEONARD S G,SWEENEY T,BAHAR B,et al.Effect of dietary seaweed extracts and fish oil supplementation in sows on performance,intestinal microflora,intestinal morphology,volatile fatty acid concentrations and immune status of weaned pigs[J]. Nutritional Immunology,2011,105(4):549-560. ( 1) 1)
|
| [44] | 刘玉兰,李德发,龚利敏,等.EPA和DHA对断奶仔猪淋巴细胞转化和细胞内信号分子的影响[J]. 畜牧兽医学报,2007,38(10):1060-1065. ( 1) 1)
|
| [45] | LI P,KIM S W,LI X L,et al.Dietary supplementation with cholesterol and docosahexaenoic acid increases the activity of the arginine-nitric oxide pathway in tissues of young pigs[J]. Nitric Oxide,2008,19(3):259-265. ( 1) 1)
|
| [46] | LI P,KIM S W,LI X L,et al.Dietary supplementation with cholesterol and docosahexaenoic acid affects concentrations of amino acids in tissues of young pigs[J]. Amino Acids,2009,37(4):709-716. ( 1) 1)
|
| [47] | WEI H K,ZHOU Y F,JIANG S Z,et al.Feeding a DHA-enriched diet increases skeletal muscle protein synthesis in growing pigs:association with increased skeletal muscle insulin action and local mRNA expression of insulin-like growth factor 1[J]. British Journal of Nutrition,2013,110(4):671-680. ( 1) 1)
|
| [48] | CASTELLANO C A,AUDET I,LAFOREST J P,et al.Fish oil diets alter the phospholipid balance,fatty acid composition,and steroid hormone concentrations in testes of adult pigs[J]. Theriogenology,2011,76(6):1134-1145. ( 1) 1)
|
| [49] | 吕玉丽,久保长政,刘建新,等.饲料中添加鱼油对肥育猪脂肪酸组成的影响[J]. 浙江农业学报,2008,20(6):484-486. ( 1) 1)
|
| [50] | 彭瑛,占今舜,李丽立,等.饲粮中添加DHA复合添加剂对蛋鸡生产性能和蛋品质的影响[J]. 华南农业大学学报:自然科学版,2012,33(4):539-543. ( 1) 1)
|
| [51] | ALVAREZ C,CACHALDORA P,MÉ NDEZ J,et al.Effects of dietary conjugated linoleic acid and fish oil supplementation on performance and egg quality in laying hens[J]. British Poultry Science,2004,45(4):524-529. ( 1) 1)
|
| [52] | CACHALDORA P,GARCíA-REBOLLAR P,ALVAREZ C,et al.Effect of type and level of fish oil supplementation on yolk fat composition and n-3 fatty acids retention efficiency in laying hens[J]. British Poultry Science,2006,47(1):43-49. ( 1) 1)
|
| [53] | LI Y,SUN C.The later effects of DHA in diet on regulating transcription of lipid genes of broiler[J]. Agricultural Sciences in China,2011,10(4):611-618. ( 1) 1)
|
| [54] | HALL J A,JHA S,SKINNER M M,et al.Maternal dietary n-3 fatty acids alter immune cell fatty acid composition and leukotriene production in growing chicks[J]. Prostaglandins,Leukotrienes and Essential Fatty Acids,2007,76(1):19-28. ( 1) 1)
|
| [55] | ALLEN P C, DANFORTH H D.Effects of dietary supplementation with n-3 fatty acid ethyl esters on coccidiosis in chickens[J]. Poultry Science,1998,77(11):1631-1635. ( 1) 1)
|
| [56] | 刘仕军,卜登攀,王加启,等.日粮添加LA和DHA对乳脂脂肪酸含量及比值的影响[J]. 动物营养学报,2008,20(5):515-521. ( 1) 1)
|
| [57] | 王蕾,王加启,卜登攀,等.奶牛日粮添加共轭亚油酸和二十二碳六烯酸对瘤胃纤维素酶活性的影响[J]. 东北农业大学学报,2009,40(4):65-68. ( 1) 1)
|
| [58] | 刘亮,王加启,卜登攀,等.EPA/DHA对体外发酵及瘤胃液脂肪酸组成的影响[J]. 中国畜牧兽医,2008,35(7):5-11. ( 1) 1)
|
| [59] | 王蕾,王加启,李发弟,等.日粮添加亚油酸和二十二碳六烯酸对奶牛瘤胃原虫奇数碳链脂肪酸和支链脂肪酸的影响[J]. 甘肃农业大学学报,2010,45(1):12-15. ( 1) 1)
|
| [60] | 汪留全,胡王,李海洋,等.饲料中DHA与EPA水平对幼蟹生长和饲料利用率的影响[J]. 渔业现代化,2003(6):39-40,33. ( 1) 1)
|
| [61] | 汪倩,丰浪,刘智俊,等.饲料中DHA/EPA对三疣梭子蟹肝胰腺组织结构的影响[J]. 广东农业科学,2012,39(15):147-149. ( 1) 1)
|
| [62] | 吉红,周继术,曹福余,等.DHA对鲤抗氧化能力影响的初步研究[J]. 上海海洋大学学报,2009,18(2):142-149. ( 1) 1)
|
| [63] | 王桂芹,牛小天,卢洪梅,等.饲料中添加VE和DHA对不同养殖密度建鲤生长、摄食和分化的影响[J]. 吉林农业大学学报,2010,32(5):548-554. ( 1) 1)
|
| [64] | 王桂芹,牛小天,卢洪梅,等.不同维生素E和DHA水平对建鲤免疫力和抗病力的影响[J]. 中国畜牧杂志,2012,48(3):52-55. ( 1) 1)
|
| [65] | MORENO-INDIAS I,SÁNCHEZ-MACíAS D,MARTíNEZ-DE LA P J,et al.The effect of diet and DHA addition on the sensory quality of goat kid meat[J]. Meat Science,2012,90(2):393-397. ( 1) 1)
|




