近年来,反刍家畜肉和奶生产中对环境的污染问题日益受到关注[1]。Meta分析表明,决定奶牛粪污总氮排出的主要因素是饲粮氮摄入量[2],牛对饲粮氮的有效利用率只有23%,瘤胃代谢已被确定为反刍动物氮利用效率低的最重要原因[3]。瘤胃内产生的氨除被微生物用于合成菌体蛋白外,其余的氨经消化道上皮吸收入门静脉,随血液进入肝脏合成尿素。肝脏中产生的尿素91%可通过再循环重新进入消化道内[4],这就形成了反刍动物尿素氮的再循环利用。这种氮的再循环对维持反刍动物体内氮的平衡,尤其是在低氮饲粮条件下具有重要意义。研究表明,低氮饲粮条件下,再循环至瘤胃的尿素氮显著增加[5]。探明氮再循环过程中尿素转运的调控机制有利于采取针对性措施提高不同饲粮和生理条件下反刍动物的氮利用[6]。
尿素转运因子(urea transporters,UTs)是高选择性快速通透尿素的膜通道蛋白分子,在牛瘤胃中表达的尿素转运因子B(UT-B)通过参与尿素在瘤胃上皮细胞(ruminal epithelium cell,REC)中的跨膜转运,构成了牛瘤胃尿素氮再循环过程的重要部分,对于维持其氮平衡至关重要[7]。UT-B介导的经上皮细胞的尿素转运是经刺激后产生的,且不受已知尿素转运因子A(UT-A)调控因子的影响[8]。由于尿素氮再循环对于氮的再利用起关键作用,所以亟待阐明瘤胃发酵参数和内环境指标对于反刍动物尿素氮再循环的调控机制[9]。为此,本文旨在就UT-B基因对牛瘤胃尿素氮再循环的作用机理进行综述。
反刍动物瘤胃尿素氮循环是指,瘤胃内产生的氨除被微生物用于合成菌体蛋白外,其余的氨经消化道上皮吸收入门静脉,随血液进入肝脏合成尿素。尿素是反刍动物体内氨和氨基酸代谢的主要终产物。在肝脏中形成的内源尿素有3条去路:一部分尿素经血液分泌于唾液内,随唾液重新进入瘤胃;一部分通过消化道上皮扩散进入消化道内;多余的尿素作为废物排出体外。牛以尿素形式从血液到消化道转运循环利用大量的氮。循环氮对总氮具有重要意义。据报道,反刍动物循环氮约为饲粮可消化氮的25%[10]。肝脏中合成的尿素有一部分进入消化道内降解成氨。大部分氨被重新吸收进入肝脏以合成尿素,这就形成了反刍动物瘤胃尿素氮再循环利用的机制(表1和图1)[11, 12]。
| 表1 不同动物种类及人体内尿素氮再循环的动态特征 Table 1 Characteristics of urea-N recycling kinetics of different animal species and human[11] g/d |
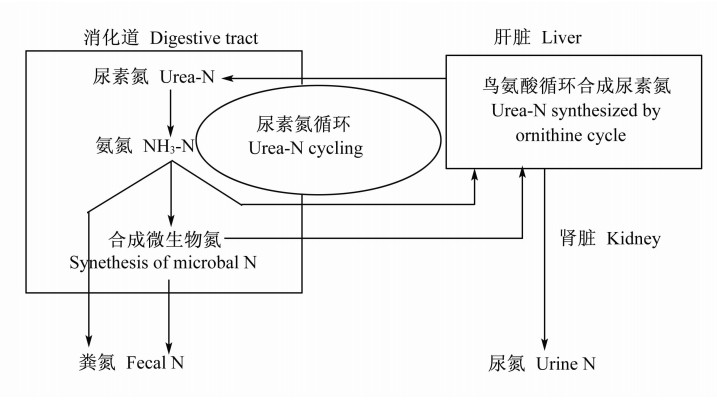 | 图1 反刍动物体内尿素氮循环代谢过程
Fig.1 Cycling process of urea-N in ruminants[12] |
对于大多数哺乳动物而言,肝脏中合成的尿素氮被转移到胃肠道吸收和利用是一种普遍存在的现象。但对于牛而言,肝脏中合成的内源尿素氮中,40%~80%可通过再循环重新进入消化道内,为瘤胃微生物提供氮源,进而为宿主动物提供氨基酸营养[13]。据报道,牛肝脏内产生的尿素,随尿液排出的占33%,进入消化道的占67%,后者又有10%随粪便排出,而尿氮中95%都是尿素[14]。
这种氮的再循环对维持反刍动物体内氮的平衡,尤其是在低氮饲粮条件下具有重要意义[15]。Firkins等[16]对生长牛和泌乳牛进行了315批次检测,结果表明,进入门静脉的氨态氮的净吸收量随着饲粮氮摄入量的增加而升高,二者存在线性回归关系,以氨态氮形式吸收的氮量占饲粮氮摄入量的42%。研究表明,当饲喂反刍动物低氮饲粮时,肾脏重新吸收和贮存尿素的能力增加,且进入到消化道的尿素清除率加快,尿素氮的循环利用能力增强,保证了家畜适应低氮水平的饲粮[17]。
最近的研究表明,当给反刍动物连续间隔1~3 d饲喂不含有蛋白质的饲粮与每天饲喂含蛋白质饲粮相比,并没有对家畜氮的沉积和排泄产生不良影响。而且当给反刍动物饲喂氮水平不断变化的饲粮时氮沉积也会增加[18]
UTs是高选择性快速通透尿素的膜通道蛋白分子,介导尿素顺浓度梯度的跨膜转运,首先从兔肾髓质成功克隆[19],其由UT-A(SLC14A2)基因和UT-B(SLC14A1)基因编码[20]。根据目前牛的基因组图谱(NCBI,2013)[21],牛SLC14A1基因(Gene ID:493988)位于24号染色体,该基因(GenBank:AY838799.1)大小为27 657 bp,包含10个外显子[22]。
近年来,UTs的研究主要集中在肾脏,其在尿液浓缩中的关键作用[23]已被探明。UT-B广泛表达于肾脏、心脏、脑等组织器官,且在多个物种的胃肠道均有表达,包括:鼠[24]、人[25]、绵羊[26]和牛[27]。
UTs对于胃肠道中尿素氮的再循环过程起着关键的调控作用[11]。Simmons等[7]以利木赞杂交牛为对象通过免疫组织化学方法发现瘤胃上皮层存在UT-B,UT-B对于进入到胃肠道的尿素起关键作用。Stewart等[27]在牛的瘤胃中检测到3.7 kb的UT-B基因,其对肝脏合成的尿素进入瘤胃起着关键作用,UT-B存在2个拼接变异体:UT-B1和UT-B2,其中UT-B2是牛瘤胃中的主要形式。因此,UT-B介导牛瘤胃中尿素的转运,构成了牛瘤胃尿素氮再循环过程的重要机制,对于维持其氮平衡至关重要[7]。体外研究表明,短时间(90 min)培养条件下,瘤胃上皮细胞和十二指肠黏膜细胞(duodenal mucosal cells,DMC)可合成尿素[28]。
UT-B介导的经上皮细胞的尿素转运是经刺激后产生的,且不受已知UT-A调控因子的影响[8]。目前,关于反刍动物UT-B调控因子的研究认为:饲粮氮水平及瘤胃发酵参数和内环境指标[如挥发性脂肪酸(VFA)、氨态氮等的浓度]调控反刍动物瘤胃尿素氮转运,但因畜种、研究条件等不同,研究结果并不一致,由于尿素氮再循环对于氮的再利用起关键作用,亟待阐明瘤胃发酵参数和内环境指标对于反刍动物瘤胃尿素氮再循环的调控机制[9]。
Tickle等[8]以犬肾细胞系(MDCK)为对象研究认为,UT-B2介导的经上皮细胞的尿素转运为组成性激活,且不受已知的肾脏UT-A调控因子,如细胞内环化腺苷酸(cAMP)、钙(Ca)及蛋白激酶活性等的影响。
研究表明,牛瘤胃UT-B表达水平受饲粮的调控[7]。其中,饲粮氮摄入水平可改变牛瘤胃UT-B mRNA表达丰度和UT-B表达水平[15, 29]。且随着饲粮中瘤胃降解蛋白(rumen degradable protein,RDP)的添加,瘤胃腹囊N-糖基化UT-B的表达水平提高,表明UT-B可能对尿素的排出起关键作用,而非尿素到胃肠道的再循环[26]。
Thorlacius等[30]首次通过培养分离的瘤胃组织证实了CO2对经瘤胃的尿素氮转运有刺激效应。Abdoun等[31]利用尤斯灌流(Ussing chamber)方法离体培养瘤胃上皮组织表明,随着CO2供给量增加,经瘤胃上皮转运的尿素氮量亦增加;与pH为7.4时相比,当pH为6.4时尿素氮的转运量增加最多。就目前关于CO2对瘤胃尿素氮转运的影响而言,均是采用体外技术进行研究,虽然有证据表明CO2对瘤胃尿素氮转运存在影响,但其是否受UT-B基因调控,尚有待于进一步在活体试验中加以探明[30, 31]。
Abdoun等[31]离体研究表明,当黏膜pH从7.4降至5.4时,从浆膜至黏膜的尿素氮转运量呈钟形曲线,当pH为6.0~6.4时,尿素氮的转运率最高;体试验表明,pH为6.0~6.4时,改变瘤胃因子(如VFA浓度)对再循环至瘤胃的尿素氮有显著影响。
瘤胃VFA,特别是丁酸浓度,对经瘤胃的尿素氮转运有刺激效应。Simmons等[7]研究表明,与饲喂青贮型饲粮相比,饲喂精料型饲粮的利木赞杂交牛瘤胃UT-B2 mRNA表达和蛋白质水平均较高,且瘤胃丁酸水平亦较高(11.7%的总VFA中9.3%为丁酸)。可见,丁酸可能影响了UT-B2的表达,进而提高了进入瘤胃的尿素氮。
而Oba等[32]对绵羊瘤胃上皮细胞进行了90 min的体外培养,结果表明,VFA浓度及丙酸乙酸比未对瘤胃上皮细胞尿素合成产生影响;精氨酸增加了瘤胃上皮细胞尿素的合成。
目前,关于反刍动物瘤胃尿素氮再循环的调控因子的研究认为:饲粮氮水平及瘤胃发酵参数和内环境指标(如VFA、氨态氮浓度等)调控反刍动物瘤胃尿素氮转运,但研究结果并不一致,由于尿素氮再循环对于氮的再利用起关键作用,所以亟待阐明瘤胃因子对于反刍动物瘤胃尿素氮再循环的调控机制[9]。
UT-B在牛瘤胃尿素氮转运中起关键作用,对于提高牛对饲粮氮的有效利用率具有重要意义,其基因表达受饲粮氮水平和瘤胃发酵参数及内环境指标等因素影响。UT-B对于牛瘤胃尿素氮再循环的具体调控机制尚有待于进一步研究。
| [1] | FAO.Livestock's long shadow:environmental issues and options.http://www.fao.org/docrep/010/a0701e/a0701e00.HTM. ( 1) 1)
|
| [2] | YAN T,FROST J P,AGNEW R E,et al.Relationships among manure nitrogen output and dietary and animal factors in lactating dairy cows[J]. Journal of Dairy Science,2006,89(10):3981-3991. ( 1) 1)
|
| [3] | KOHN R A,DINNEEN M M,RUSSEK-COHEN E,et al.Using blood urea nitrogen to predict nitrogen excretion and efficiency of nitrogen utilization in cattle,sheep,goats,horses,pigs,and rats[J]. Journal of Animal Science,2005,83(4):879-889. ( 1) 1)
|
| [4] | MARINI J C,SANDS J M,VAN AMBURGH M E.Urea transporters and urea recycling in ruminants[M]//SEJRSEN K,HVELPLUND T,NIELSEN M O.Ruminant physiology.Wageningen, Netherlands:Wageningen Academic Publishers,2006:155-171. ( 1) 1)
|
| [5] | DORANALLI K,PENNER G B,MUTSVANGWA T.Feeding oscillating dietary crude protein concentrations increases nitrogen utilization in growing lambs and this response is partly attributable to increased urea transfer to the rumen[J]. The Journal of Nutrition,2011,141(4):560-567. ( 1) 1)
|
| [6] | SUNNY N E,OWENS S L,BALDWIN R L,et al.Salvage of blood urea nitrogen in sheep is highly dependent on plasma urea concentration and the efficiency of capture within the digestive tract[J]. Journal of Animal Science,2007,85(4):1006-1013. ( 1) 1)
|
| [7] | SIMMONS N L,CHAUDHRY A S,GRAHAM C,et al.Dietary regulation of ruminal bovine UT-B urea transporter expression and localization[J]. Journal of Animal Science,2009,87(10):3288-3299. ( 5) 5)
|
| [8] | TICKLE P,THISTLETHWAITE A,SMITH C P,et al.Novel bUT-B2 urea transporter isoform is constitutively activated[J]. American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2009,297(2):R323-R329. ( 3) 3)
|
| [9] | KIRAN D.Factors regulating urea-nitrogen recycling in ruminants.Ph.D.Thesis.Saskatoon SK:University of Saskatchewan,2010:131.( 3) 3)
|
| [10] | OBARA Y,DELLOW D W,NOLAN J V.Effects of energy-rich supplements on nitrogen kinetics in ruminants[M]//TSUDA T,SASAKI Y,KAWASHIMA R.Physiological aspects of digestion and metabolism in ruminants.San Diego:Academic Press,1991:515-539. ( 1) 1)
|
| [11] | STEWART G S,SMITH C P.Urea nitrogen salvage mechanisms and their relevance to ruminants,non-ruminants and man[J]. Nutrition Research Reviews,2005,18(1):49-62. ( 2) 2)
|
| [12] | 张莹,郭旭生,丁路明,等.反刍动物尿素氮再循环利用的研究进展[J]. 动物营养学报,2009,21(5):609-616. ( 1) 1)
|
| [13] | LAPIERRE H,LOBLEY G E.Nitrogen recycling in the ruminant:a review[J]. Journal of Dairy Science,2001,84(Suppl.):E223-E236 ( 1) 1)
|
| [14] | 徐红蕊,时建青,赵国琦.反刍动物体内尿素氮代谢研究进展[J]. 畜牧兽医杂志,2006,25(1):23-24,27. ( 1) 1)
|
| [15] | REYNOLDS C K,KRISTENSEN N B.Nitrogen recycling through the gut and the nitrogen economy of ruminants:an asynchronous symbiosis[J]. Journal of Animal Science,2008,86(Suppl.):E293-E305. ( 2) 2)
|
| [16] | FIRKINS J L,REYNOLDS C K.Whole animal nitrogen balance in cattle[C]//PFEFFER E,HRISTOV A N.Nitrogen and phosphorus nutrition of cattle.Wallingford,UK:CAB Int.,2005:167-186. ( 1) 1)
|
| [17] | ISOZAKI T,GILLIN A G,SWANSON C E,et al.Protein restriction sequentially induces new urea transport processes in rat initial IMCD[J]. The American Journal of Physiology,1994,266(5pt2):F756-F761. ( 1) 1)
|
| [18] | ARCHIBEQUE S L,FREETLY H C,FERRELL C L,et al.Net portal and hepatic flux of nutrients in growing wethers fed high-concentrate diets with oscillating protein concentrations[J]. Journal of Animal Science,2007,85(4):997-1005. ( 1) 1)
|
| [19] | YANG B X,BANKIR L,GILLESPIE A,et al.Urea-selective concentrating defect in transgenic mice lacking urea transporter UT-B[J]. The Journal of Biological Chemistry,2002,277(12):10633-10637. ( 1) 1)
|
| [20] | SMITH C P,ROUSSELET G.Facilitative urea transporters[J]. The Journal of Membrane Biology,2001,183(1):1-14. ( 1) 1)
|
| [21] | ZIMIN A V,DELCHER A L,FLOREA L,et al.A whole-genome assembly of the domestic cow,Bos taurus[J]. Genome Biology,2009,10(4):R42. ( 1) 1)
|
| [22] | NCBI.Bos taurus urea transporter (SLC14A1) gene,complete cds,alternatively spliced.GenBank:AY838799.1,2005.http://www.ncbi.nlm.nih.gov/nuccore/AY838799.1. ( 1) 1)
|
| [23] | UCHIDA S,SOHARA E,RAI T,et al.Impaired urea accumulation in the inner medulla of mice lacking the urea transporter UT-A2[J]. Journal of Molecular and Cellular Biology,2005,25(16):7357-7363. ( 1) 1)
|
| [24] | INOUE H,KOZLOWSKI S D,KLEIN J D,et al.Regulated expression of renal and intestinal UT-B urea transporter in response to varying urea load[J]. American Journal of Physiology.Renal Physiology,2005,289(2):F451-F458. ( 1) 1)
|
| [25] | INOUE H,JACKSON S D,VIKULINA T,et al.Identification and characterization of a kidd antigen/UT-B urea transporter expressed in human colon[J]. American Journal of Physiology:Renal Physiology,2004,287(1):C30-C35. ( 1) 1)
|
| [26] | LUDDEN P A,STOHRER R M,AUSTIN K J,et al.Effect of protein supplementation on expression and distribution of urea transporter-B in lambs fed low-quality forage[J]. Journal of Animal Science,2009,87(4):1354-1365. ( 2) 2)
|
| [27] | STEWART G S,GRAHAM C,CATTELL S,et al.UT-B is expressed in bovine rumen:Potential role in ruminal urea transport[J]. American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2005,289(2):R605-R612. ( 2) 2)
|
| [28] | OBA M,BALDWIN Ⅵ R L,OWENS S L,et al.Metabolic fates of ammonia-N in ruminal epithelial and duodenal mucosal cells isolated from growing sheep[J]. Journal of Dairy Science,2005,88(11):3963-3970. ( 1) 1)
|
| [29] | RØJEN B A,POULSEN S B,THEIL P K,et al.Short communication:effects of dietary nitrogen concentration on messenger RNA expression and protein abundance of urea transporter-B and aquaporins in ruminal papillae from lactating Holstein cows[J]. Journal of Dairy Science,2011,94(5):2587-2591. ( 1) 1)
|
| [30] | THORLACIUS S O,DOBSON A,SELLERS A F.Effect of carbon dioxide on urea diffusion through bovine ruminal epithelium[J]. The American Journal of Physiology,1971,220(1):162-170. ( 2) 2)
|
| [31] | ABDOUN K,STUMPFF F,RABBANI I,et al.Modulation of urea transport across sheep rumen epithelium in vitro by SCFA and CO2[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,298(2):G190-G202. ( 2) 2)
|
| [32] | OBA M,BALDWIN Ⅵ R L,OWENS S L,et al.Urea synthesis by ruminal epithelial and duodenal mucosal cells from growing sheep[J]. Journal of Dairy Science,2004,87(6):1803-1805. ( 1) 1)
|




