2. 重庆市万州水产研究所, 重庆 404020
2. Wanzhou Fisheries Research Institute, Chongqing 404020, China
岩原鲤(Procypris rabaudi)属鲤科,原鲤属,分布于长江上游及其支流[1],生长缓慢[2],是长江上游特有的名贵经济鱼类,其肉质细嫩,味道鲜美,无肌间刺,具有很高的食用价值[3]。由于过度捕捞,岩原鲤自然资源受到严重破坏,加上三峡水利工程的修建,进一步加剧了该鱼种资源的下降,在《中国濒危动物红皮书》[4]中该鱼种已被列为易危物种。岩原鲤的人工养殖已取得了成功,但缺乏岩原鲤养殖专用人工配合饲料。目前,对岩原 鲤的研究主要集中在人工繁殖、养殖及遗传分类 等方面[5, 6, 7],而对岩原鲤营养饲料开发的研究甚少,仅对岩原鲤消化能力、营养价值[2]及离体消化力[8]进行了初步的研究。基于此,本试验以岩原鲤幼鱼为研究对象,通过设计6个饲料蛋白质水平,拟研究饲料蛋白质水平对岩原鲤幼鱼生长性能、体组成、肠道消化酶活性、抗氧化能力及肝功能几个方面的影响,以确定岩原鲤饲料的最适蛋白质水平,并探讨蛋白质水平影响岩原鲤生长的作用机制,为岩原鲤专用配合饲料的配制提供科学依据。
根据岩原鲤的肌肉氨基酸模式[9],以酪蛋白和明胶(4∶ 1)为蛋白质源配制蛋白质水平分别为25.1%、30.3%、34.8%、40.4%、44.8%、49.7%的6种纯化试验饲料,其中蛋白质水平的增减用糊精调节。按SC/T 1026—2004中鲤鱼鱼种(10~100 g/尾)的脂肪需求,各试验饲料的脂肪水平设置在7%左右。将各原料粉碎过60目筛,称重后混匀,少量的组分采用逐级扩大法混合,用面条机制成直径为2 mm的成品饲料,自然风干后,过筛,选取颗粒大小适宜者用胶袋密封,置于4 ℃冰箱中冷藏备用。试验饲料组成及营养水平见表1。
| 表1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) % |
岩原鲤鱼种由重庆万州区水产研究所购回后用3%的食盐溶液消毒,用药饵投喂3 d,再用基础饲料驯养10 d。摄食正常后选取体质健壮、规格整齐的均重为(7.93±0.16) g的岩原鲤幼鱼540尾,随机分成6组,每组设3个重复,每个重复30尾鱼,以重复为单位放入已编号的循环水族缸(体积200 L,水体5~6 h交换1次)中。每天投喂3次(08:30、13:00和17:00),投喂率1.0%~2.0%,并根据水温和鱼体生长情况调整投饲量。试验期98 d,试验期间水温24~28 ℃,pH 6.4~7.2,溶氧浓度大于5 mg/L,氨氮浓度小于0.05 mg/L。
试验开始前,选取10尾鱼于-20 ℃冰箱保存待测初始鱼常规营养成分。饲养试验结束后,饥饿24 h,统计每缸中鱼的数量并称总重量,计算其增重率、特定生长率、饲料系数和蛋白质沉积率。然后每组随机选取60尾鱼,其中10尾用于测定全鱼营养成分;20尾取尾静脉血混合后,在3 000 r/min下离心15 min后吸取上层血清备用;剩下的30尾进行解剖,分离出肝胰脏、肠道后取背部两侧白肌,将从30尾鱼体中分离出的肝胰脏、肠道及白肌分别混合装袋并于-80 ℃冰箱保存待测。
饲料和试验鱼常规营养成分分析:干物质含量的测定采用105 ℃干燥恒重法;粗蛋白质含量的测定采用凯氏定氮法;粗脂肪含量的测定采用索氏提取法;粗灰分含量的测定采用马福炉550 ℃灼烧法。肌肉RNA/DNA参照齐治家[10]的方法测定。肠道消化酶活性的测定:采用南京建成生物工程研究所生产的试剂盒的组织匀浆方法制备酶液;蛋白酶活性采用福林-酚法测定;胰蛋白酶活性采用N-苯甲酰-L-精氨酸乙酯(BAEE)法测定;脂肪酶活性采用聚乙烯醇橄榄乳化液水解法测定;淀粉酶活性采用碘-淀粉比色法测定。肝功能及抗氧化指标的测定:谷草转氨酶(GOT)、谷丙转氨酶(GPT)、谷氨酸脱氢酶(GDH)、超氧物歧化酶(SOD)活性及总抗氧化能力(T-AOC)、丙二醛(MDA)含量均采用比色法测定。以上指标测定所用试剂盒均为南京建成生物工程研究所生产。
数据均以平均值±标准差(mean±SD)表示,用SPSS 18.0统计软件进行方差分析,用Duncan氏法进行多重比较,以P<0.05为差异显著;对增重率、饲料系数、肌肉RNA/DNA与饲料蛋白质水平的关系进行回归分析。
由表2可知,随着饲料蛋白质水平的增加,岩原鲤幼鱼的终末尾均重、增重率、特定生长率和蛋白质沉积率均呈先增后降的趋势,在40.4%组达到最大值,且除蛋白质沉积率外均显著高于其他各组(P<0.05);饲料系数则相反,表现为随饲料蛋白质水平的增加呈先降后增的趋势,在40.4%组达到最小值,并显著低于其他各组(P<0.05)。
| 表2 饲料蛋白质水平对岩原鲤幼鱼生长性能的影响 Table 2 Effects of dietary protein level on growth performance of juvenile rock carp |
以饲料蛋白质水平为自变量(x),分别以增重率(y1)、饲料系数(y2)为因变量进行回归分析(图1和图2),得回归方程为:y1=-0.269 6x2+ 20.798x-248.87(R2=0.828 3);y2=0.003 3x2- 0.255 2x+6.454 6(R2=0.850 5)。由回归方程得出,增重率、饲料系数达最佳值时的饲料蛋白质水平分别为38.57%、38.67%。
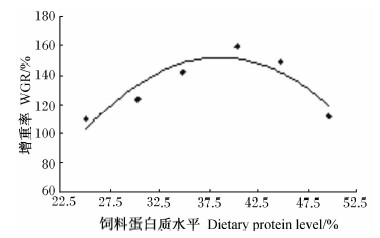 | 图1 饲料蛋白质水平与岩原鲤幼鱼增重率与的回归分析 Fig.1 Regression analysis between dietary protein level and WGR of juvenile rock carp |
由表3可知,随饲料蛋白质水平的增加,岩原鲤幼鱼全鱼水分和粗灰分含量没有产生显著变化 (P>0.05)。岩原鲤幼鱼全鱼粗蛋白质含量在饲 料蛋白质水平从25.1%上升到49.7%时呈先增后降的趋势,而粗脂肪含量则呈相反趋势,且均在40.4%组达到极值(最高或最低值),粗蛋白质含量显著高于除44.8%组外的其他各组(P<0.05),粗脂肪含量显著低于其他各组(P<0.05)。
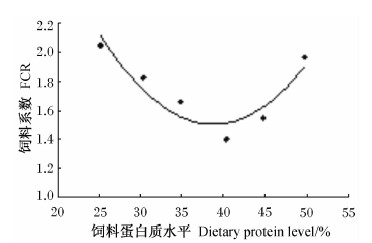 | 图2 饲料蛋白质水平与岩原鲤幼鱼饲料系数的回归分析 Fig.2 Regression analysis between dietary protein level and FCR of juvenile rock carp |
| 表3 饲料蛋白质水平对岩原鲤幼鱼体组成的影响(鲜重基础) Table 3 Effects of dietary protein level on body composition of juvenile rock carp (fresh weight basis) % |
由表4可知,随着饲料蛋白质水平的增加,岩原鲤幼鱼肌肉DNA含量无显著变化(P>0.05),而RNA含量和RNA/DNA则呈先升后降趋势,在40.4%组达到最大值,且显著高于其他各组(P<0.05)。
| 表4 饲料蛋白质水平对岩原鲤幼鱼肌肉RNA/DNA的影响
Table 4 Effects of dietary protein level on muscle RNA/DNA of juvenile rock carp
|
经回归分析(图3),肌肉RNA/DNA(y3)与饲料蛋白质水平(x)呈二次曲线关系:y3=-0.010 8x2+0.869 3x-12.645(R2=0.919 9),与增重率有相同趋势,肌肉RNA/DNA达到最大值时的饲料蛋白质水平为40.25%。
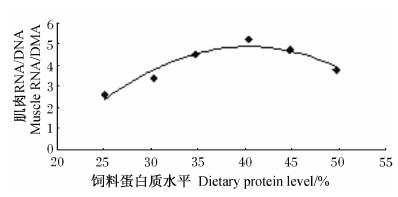 | 图3 饲料蛋白质水平与岩原鲤幼鱼肌肉RNA/DNA的回归分析 Fig.3 Regression analysis between dietary protein level and muscle RNA/DNA of juvenile rock carp |
由表5可知,随着饲料蛋白质水平的增加,岩原鲤幼鱼肠道蛋白酶、胰蛋白酶、脂肪酶活性均呈先升后降的趋势,在40.4%组达到最大值,显著高于其他各组(P<0.05);而肠道淀粉酶活性则呈先 降后升的趋势,在40.4%组达到最小值,显著低于其他各组(P<0.05)。
由表6可知,随着饲料蛋白质水平的增加,岩原鲤幼鱼肝脏的T-AOC和SOD活性均呈先升后降的趋势,在40.4%组达到最大值,除与44.8%组的T-AOC差异不显著(P>0.05)外,显著高于其他各组(P<0.05);而血清MDA含量则呈先降后升的趋势,在40.4%组达到最小值,显著低于其他各组(P<0.05)。
由表7可知,随着饲料蛋白质水平的增加,岩原鲤幼鱼血清GOT、GPT活性和GOT/GPT以及肝脏GDH活性均呈先降后升的趋势,最小值均出现在40.4%组,其血清GOT、GPT活性显著低于其他各组(P<0.05),血清GOT/GPT以及肝脏GDH活性显著低于除44.8%组外的其他各组(P<0.05)。
| 表5 饲料蛋白质水平对岩原鲤幼鱼肠道消化酶活性的影响 Table 5 Effects of dietary protein level on intestinal digestive enzyme activities of juvenile rock carp U/mg prot |
| 表6 饲料蛋白质水平对岩原鲤幼鱼抗氧化指标的影响
Table 6 Effects of dietary protein level on antioxidant indices of juvenile rock carp
|
| 表7 饲料蛋白质水平对岩原鲤幼鱼肝功能指标的影响
Table 7 Effects of dietary protein level on liver function indices of juvenile rock carp
|
饲料中适宜的蛋白质水平可以促进鱼类生长和提高饲料利用率[11, 12, 13]。本试验设计的6个饲料蛋白质水平中,40.4%组岩原鲤幼鱼的生长性能指标(增重率、特定生长率、饲料系数)均达到最佳,表明饲料中适宜的蛋白质水平能够促进岩原鲤的生长和饲料的利用,缺乏和过量均不利于生长。这是因为,饲料中蛋白质供给不足时,饲料蛋白质中用以满足机体组织基础代谢的比例增大,而用于生长的比例相对减少,鱼体增重较慢,甚至会导致体重负增长。而饲料中蛋白质供给过多时,一方面,多余的蛋白质将转移到肝脏,合成糖原和脂肪,过多的脂肪增加肝脏代谢负担,影响鱼体健康生长,鱼体生长速度下降;另一方面,过多的蛋白质增加了蛋白质作为能源消耗的比例,蛋白质利用率亦下降,饲料系数增高,甚至还有发生氨中毒的可能[14],从而进一步抑制鱼类的生长。本试验中,肌肉RNA、DNA含量以及肌肉RNA/DNA均在40.4%组达到最大值,这与岩原鲤幼鱼的生长趋势一致,进一步说明了40.4%组的饲料蛋白质水平较其他组更适合岩原鲤幼鱼的生长。此外,在本试验中各组试验鱼的增重率均未达到300%(鱼类营养学试验中规定生长速度较快的鱼类在养殖试验周期中必须有1个试验组增重率达到300%),一方面是因为岩原鲤生长缓慢,自然界中3龄岩原鲤均重仅为0.5 kg[15];另一方面是因为岩原鲤属夜间摄食鱼类[16],人工驯化为白天投喂,其摄食量较小。
饲料蛋白质水平对鱼体组成有影响,但其对不同组分的影响程度不一。Lee等[17]认为鱼体蛋白质含量不受饲料蛋白质水平的影响;Brown等[18]认为鱼体蛋白质和脂肪含量均随饲料蛋白质水平的增加而减少;Mohantay等[19]则认为鱼体蛋白质含量随饲料蛋白质水平的增加呈先升后降的趋势,脂肪含量呈先降后升的趋势,而水分和粗灰分含量则不受饲料蛋白质水平的影响。本试验中,40.4%组全鱼粗蛋白质含量最高,粗脂肪含量最低,水分及粗灰分含量各组无显著差异。其规律与Mohantay等[19]的研究结果相似,说明过高和过低的饲粮蛋白质水平均会导致鱼体蛋白质含量的降低及脂肪含量的升高。其原因在于,一方面,在适宜饲料蛋白质水平下,适宜的能蛋比促进了鱼类体蛋白质的合成,抑制了脂肪在鱼体内的堆积;另一方面,饲料蛋白质水平可以通过调控鱼类能量代谢关键酶(脂肪酸合成酶、脂蛋白酯酶)基因的表达来影响鱼类体脂沉积[20]。而前人对这一研究结果的差异可能与试验鱼的种类、生理特点以及饲料蛋白质水平的设置等因素有关。
饲料蛋白质水平影响鱼类的肠道消化酶活性。大量研究认为,在最适饲料蛋白质水平下肠道蛋白酶活性最高[21, 22, 23]。而对肠道脂肪酶和淀粉酶的研究现有结果存在明显差异:钱曦等[24]认为饲料蛋白质水平对鱼类肠道脂肪酶活性有显著影响,石英等[25]则认为无显著影响;孙海涛等[26]认为鱼类肠道淀粉酶活性随饲料蛋白质水平的增加而下降,钱曦等[24]则认为饲料蛋白质水平的变化不会引起鱼类肠道淀粉酶活性的变化。本试验中,在40.4%蛋白质水平下,肠道蛋白酶、脂肪酶活性达到最大,而淀粉酶活性则最小,与前人的研究结果部分一致。这说明,在一定范围内,饲料中的蛋白质可以诱导鱼体内蛋白酶的分泌[27],以提高对饲料蛋白质的消化吸收,促进鱼体内蛋白质的合成,从而有利于其生长[21],而过高的饲料蛋白质可能会对蛋白酶的分泌产生负反馈调节[23]。对肠道脂肪酶和肠淀粉酶活性研究结果不一致可能与饲料蛋白质水平的设置和试验研究对象的种类、食性及生理特点等因素有关。至于肠道消化酶活性变化的具体机制,则需通过对消化酶基因表达的研究来进一步探讨。
饲料适宜蛋白质水平可以增强鱼类的抗氧化能力,如蔡春芳等[28]对异育银鲫和张桐等[29]对德国镜鲤的研究。本试验中,40.4%组岩原鲤幼鱼达到最佳抗氧化能力,说明适宜的饲料蛋白质水平可以通过增强岩原鲤幼鱼抗氧化酶清除氧自由基的能力,减少脂质过氧化产物MDA的产生来提高其抗氧化能力。饲料中蛋白质含量不足可能导致合成抗氧化物酶的蛋白质所需的氨基酸得不到足够的补充,超过了机体的生理补偿能力。而当饲料中蛋白质含量超过鱼体需要量时,过多的蛋白质水解产生过多的活性氧自由基[30],导致自由基代谢平衡遭到破坏,氧化与抗氧化失衡,蛋白质代谢紊乱,从而阻碍正常抗氧化能力的发挥。此外,脂类物质在动物肝脏和组织内沉积过多,将对机体的抗氧化能力产生决定性影响,如SOD活性与体脂的含量呈强相关[31]。
当肝细胞轻度损伤时胞浆酶(GOT、GPT等)将从肝细胞中释放出来,因此GOT、GPT可作为肝脏损伤严重程度及急性肝坏死的判断指标[32]。本试验中,岩原鲤血清GOT、GPT及GOT/GPT均在40.4%组达到最小值。过低和过高的饲料蛋白质水平下肝功能指标均上升,说明饲料蛋白质水平影响了鱼类的肝功能。当饲料蛋白质水平过高时,饲粮中的蛋白质超过了鱼类的需要量,过剩的蛋白质则经过一系列转化而合成脂肪并储存在肝脏中,导致中性脂质不能被有效地转运到肝外器官[33],肝脏脂质积累大量增加,肝脏受损,大量GOT、GPT外溢,使得血清GOT、GPT活性升高。此外,过量的蛋白质水解产生的自由基攻击肝细胞也会使肝脏受损。
GDH主要分布于肝脏、心肌和肾等器官组织,以肝细胞含量最为丰富,且只存在于线粒体基质内,为肝线粒体特异性酶,它和转氨酶的联合脱氨基作用是肝脏氨基酸分解代谢的主要途径[34]。文华等[35]及汪福保等[36]均已证明肝脏GDH活性与试验鱼的增重率之间存在负相关关系,本试验也证明了这一点。这是因为GDH活性的降低可以使肝脏氨基酸分解代谢减慢,从而使蛋白质合成增多。
综上,适宜饲料蛋白质水平可以调控鱼类肠道蛋白酶、脂肪酶及淀粉酶活性,调节鱼体体脂沉积,增强鱼类的抗氧化能力及肝功能,实现对生长性能和饲料利用率的提高。以增重率(反映生长速率)、饲料系数(反映饲料利用效率)、肌肉RNA/DNA(反映蛋白质合成速率[35])为效应指标,岩原鲤幼鱼饲料的适宜蛋白质水平分别为38.57%、38.67%、40.25%,与同属于鲤科鱼类的鲤鱼蛋白质需求量(38%)相近[37]。
岩原鲤幼鱼饲料的适宜蛋白质水平为38.57%~40.25%,该适宜蛋白质水平可以提高岩原鲤幼鱼的生长性能、饲料转化率,增加体蛋白质沉积,减少体脂蓄积,促进蛋白质、脂肪的消化,增强鱼体抗氧化能力和肝功能。
| [1] | 丁瑞华.四川鱼类志[M]. 成都:四川科学技术出版社,1994. ( 1) 1)
|
| [2] | 施白南.岩原鲤的生活习性及其资源保护[J]. 西南师范学院学报:自然科学版,1980(2):93-103. ( 2) 2)
|
| [3] | 叶元土,罗莉,林仕梅,等.岩原鲤消化能力和营养价值的初步研究[J]. 四川动物,1998,17(1):7-10. ( 1) 1)
|
| [4] | 乐佩琦,陈宜渝.中国濒危动物红皮书(鱼类卷)[M]. 北京:科学出版社,1998. ( 1) 1)
|
| [5] | YUE H,YUAN H,ZHANG X Y.Fifteen novel polymorphic microsatellites in rock carp,Procypris rabaudi (Tchang),an endemic fish species in the upper reaches of the Yangtze river drainage[J]. Conservation Genetics,2009,10(3):539-542. ( 1) 1)
|
| [6] | ZHANG X Y,YUE B S,JIANG W X,et al.The complete mitochondrial genome of rock carp Procypris rabaudi (Cypriniformes:cyprinidae) and phylogenetic implications[J]. Molecular Biology Reports,2009,36(5):981-991. ( 1) 1)
|
| [7] | 谭国良,刘本祥,蒋明,等.岩原鲤人工繁殖技术研究[J]. 淡水渔业,2005,35(2):40-41. ( 1) 1)
|
| [8] | 林仕梅,罗莉.岩原鲤对7种饲料消化力离体研究[J]. 中国水产科学,2008,15(4):637-643. ( 1) 1)
|
| [9] | 李正友,黄辉,周路,等.岩原鲤肌肉营养成分分析[J]. 水生态学杂志,2009,2(1):126-127. ( 1) 1)
|
| [10] | 齐治家.生物化学[M]. 上海:上海技术出版社,1985. ( 1) 1)
|
| [11] | ABDEL-TAWWAB M,AHMAD M H,KHATTAB Y A E,et al.Effect of dietary protein level,initial body weight,and their interaction on the growth,feed utilization,and physiological alterations of Nile tilapia,Oreochromis niloticus(L.)[J]. Aquaculture,2010,298(3/4):267-274. ( 1) 1)
|
| [12] | YANG S D,LIOU C H,LIU F G.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch(Bidyanus bidyanus)[J]. Aquaculture,2002,213(1/2/3/4):363-372. ( 1) 1)
|
| [13] | COUTINHO F,PERES H,GUERREIRO I,et al.Dietary protein requirement of sharpsnout sea bream (Diplodus puntazzo,Cetti 1777)juveniles[J]. Aquaculture,2012,356/357:391-397. ( 1) 1)
|
| [14] | 李勇,王雷,蒋克勇,等.水产动物营养的生态适宜与环保饲料[J]. 海洋科学,2004,28(3):76-78. ( 1) 1)
|
| [15] | 刁晓明,苏胜齐.一种具有养殖潜力的经济鱼类-岩原鲤[J]. 水产养殖,1993(6):22. ( 1) 1)
|
| [16] | 冯宪斌,杨德国,李茜,等.人工养殖条件下岩原鲤幼鱼排空率与摄食量[J]. 中国水产科学,2012,19(4):654-661. ( 1) 1)
|
| [17] | LEE J K,CHO S H,KIM K D,et al.Dietary protein requirement for young turbot (Scophthalmus maximus L.)[J]. Aquaculture Nutrition,2003,9(4):283-286. ( 1) 1)
|
| [18] | BROWN P B,DABROWSKI K,GARLING D L.Nutrition and feeding of yellow perch (Perca flavescens)[J]. Applied Ichthyolgy,1996,12(3/4):171-174. ( 1) 1)
|
| [19] | MOHANTY S S,SAMANTARAY K.Effect of varying levels of dietary protein on the growth performance and feed conversion efficiency of snakehead Channa striata fry[J]. Aquaculture,1996,2(2):89-94. ( 2) 2)
|
| [20] | 高婷婷,李勇,张家国,等.蛋白质在鱼虾免疫能力中的作用[J]. 动物营养学报,2011,23(9):1459-1465. ( 1) 1)
|
| [21] | YANG S D,LIOU C H,LIU F G.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch (Bidyanus bidyanus) [J]. Aquaculture,2002,213:363-372. ( 2) 2)
|
| [22] | NG W K,ABDULLAH N,DE SILVA S S.The dietary protein requirement of the Malaysian mahseer,Tor tambroides (Bleeker),and the lack of protein-sparing action by dietary lipid[J]. Aquaculture,2008,284(1/2/3/4):201-206. ( 1) 1)
|
| [23] | ESPINÓS F J,TOMAS A,PÉREZ L M,et al.Growth of dentex fingerlings (Dentex dentex) fed diets containing different levels of protein and lipid[J]. Aquaculture,2003,218(1/2/3/4):479-490. ( 2) 2)
|
| [24] | 钱曦,王桂芹,周洪琪,等.饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J]. 动物营养学报,2007,19(2):182-187. ( 2) 2)
|
| [25] | 石英,冷向军,李小勤,等.饲料蛋白水平对血鹦鹉幼鱼生长、体组成和肠道蛋白消化酶活性的影[J]. 水生生物学报,2009,33(5):874-880. ( 1) 1)
|
| [26] | 孙海涛,吉红.饲料蛋白水平对匙吻鲟幼鱼肌肉营养成分及消化酶活力的影响[J]. 水产科学,2011,30(12):721-725. ( 1) 1)
|
| [27] | UYS W,HECHT T,WALTERS M.Changes in digestive enzyme activities of Clarias gariepinus (Pisces:clariidae) after feeding[J]. Aquaculture,1987,63(1/2/3/4):243-250. ( 1) 1)
|
| [28] | 蔡春芳,吴康,潘新法,等.蛋白质营养对异育银鲫生长和免疫力的影响[J]. 水生生物学报,2001,25(6):590-595. ( 1) 1)
|
| [29] | 张桐,徐奇友,许红,等.不同温度下不同蛋白水平对镜鲤(Cyprinus carpio L.)非特异性免疫的影响[J]. 东北农业大学学报,2010,41(12):80-85. ( 1) 1)
|
| [30] | 谷春梅,施用晖,乐国伟.过量食入蛋白对小鼠胰腺的氧化损伤[J]. 安徽农业科学,2010,38(25):13730-13731. ( 1) 1)
|
| [31] | KIRON V,WATANABE T,FUKUDA H,et al.Protein nutrition and defence mechanisms in rainbow trout Oncorhynchus mykiss[J]. Comparative Biochemistry and Physiology Part A:Physiology,1995,111(3):351-359. ( 1) 1)
|
| [32] | SHETH S G,FLAMM S L,GORDON F D,et al.AST/ALT ratio predicts cirrhosis in patients with chronic hepatitis C virus infection[J]. The American Journal of Gastroenterology,1998,93(1):44-48. ( 1) 1)
|
| [33] | 曹俊明,关国强,郑文晖,等.饲料蛋白质水平影响草鱼肝胰脏脂肪酸组成[J]. 中山大学学报:自然科学版,1997,36(5):64-68. ( 1) 1)
|
| [34] | WAES L V.Glutamate dehydmgenase:a reliable marker of live cell necrosis in clcoholie[J]. British Medical Journal,1997,2:1058-1060. ( 1) 1)
|
| [35] | 文华,高文,罗莉,等.草鱼幼鱼的饲料苏氨酸需要量[J]. 中国水产科学,2009,16(2):238-247. ( 2) 2)
|
| [36] | 汪福保,罗莉,文华,等.镁对草鱼生长、形体、肝功能和糖代谢的影响[J]. 淡水渔业,2011,41(2):57-62. ( 1) 1)
|
| [37] | OGINO C,SAITO K.Protein nutrition in fish.1.The utilization of dietary protein by young carp[J]. Bulletin of the Japanese Society of Scientific Fisheries,1970,36(3):250-254. ( 1) 1)
|




