2. 河南农业大学生命科学学院, 郑州 450002
2. College of Life Science, Henan Agricultural University, Zhengzhou 450002, China
microRNA(miRNA)是一类小的非编码RNA,在转录后调节基因表达,对动物发育和具体的生物学过程如细胞的增殖、分化、凋亡起重要的调节作用[1]。从首个miR-lin-4发现至今,越来越多的研究者投身于microRNA的研究领域[2]。乳腺是动物成年后历经增殖、分化、凋亡的唯一器官,过去也有许多学者对乳腺发育的复杂调节机制进行了广泛的研究。近些年,microRNA作为细胞功能重要调节子的作用在多种器官的研究中受到广泛关注。然而,大部分microRNA的研究都集中于病理状态下,例如乳腺癌[3, 4],只有少数报道是关于microRNA在正常乳腺发育过程中的作用[5]。本文主要就近些年乳腺发育和与泌乳相关microRNA的研究进行综述,以期为奶牛乳腺发育和泌乳机理的研究提供帮助。
正常发育乳腺的microRNA表达谱分析有利于我们理解乳腺的生物学功能。microRNA的表达谱检测分析是理解泌乳机理的重要步骤。Liu等[6]对人和小鼠的组织进行microRNA的表达谱分析,发现某些microRNA的表达是具有组织特异性的。在检测的161种microRNA中,人乳腺特异表达23种microRNA,包括miR-let-7a-1、miR-let-7b、miR-023a、miR-023b、miR-024-2、miR-026a、miR-026b、miR-030b、miR-030c、miR-030d、miR-092-1、miR-092-2、miR-100-1/2、miR-103-1、miR-107、miR-146、miR-191、miR-197、miR-205、miR-206、miR-213、miR-214及miR-221[6]。在检测的22种microRNA中,小鼠乳腺特异表达9种microRNA,包括miR-let-7a、miR-let-7b、miR-let-7c、miR-26a、miR-26b、miR-24-2、miR-145、miR-30b及miR-30d[7]。本实验室对牛乳腺上皮细胞中microRNA进行了研究,发现了388个已知的microRNA和38个已有资料未发现的microRNA,其中包括bta-U21在内的7个新出现的microRNA具有组织表达特异性[8]。不同物种乳腺特异microRNA表达谱的研究为后续乳腺发育及泌乳生物学的研究提供了新的视角和研究基础。
最初人们仅仅在小鼠中研究过不同泌乳阶段乳腺的microRNA表达谱。Avril-Sassen等[9]首次报道了综合性的小鼠乳腺microRNA表达谱,分别检测了幼年期、青少年期、成熟期、妊娠期、泌乳期和退化期乳腺中microRNA的表达谱。这项研究为将来个体的microRNA功能特性研究提供了有价值的资源。Wang等[10]对我国小鼠乳腺不同发育阶段microRNA进行研究发现,乳腺每一个发育阶段都有它自己的microRNA表达谱;与乳腺青春期和退化期相比,在妊娠期和泌乳期miR-138和miR-431表达下调,miR-133表达上调[10]。随后,有研究奶山羊干奶期和泌乳高峰期乳腺组织microRNA的表达谱,结果如表1所示,miR-451、miR-2478的表达在泌乳的4个阶段(产羔后30、75、200、320 d)呈梯度增加趋势,而miR-145、miR-222、miR-128的表达在泌乳的4个阶段呈梯度降低[11]。这项研究有助于理解奶山羊泌乳生理和乳腺发育的分子机制。
鉴于大动物取样的困难性,奶牛乳腺microRNA的研究还处在起步阶段,但不断有新的研究成果。为了研究奶牛泌乳启动阶段microRNA的表达变化,Wang等[12]通过实时定量PCR检测奶牛干奶期、初乳期、泌乳早期阶段乳腺组织中13种microRNA的表达。结果发现:除了miR-31之外,其他检测的microRNA在干奶期和初乳期表达量都增加了;在这些上调的microRNA中,miR-221的表达在泌乳早期阶段增加的更多,提示miR-221在控制内皮细胞增殖或血管再生中发挥作用;而miR-223的表达虽然在泌乳早期阶段降低了,但仍然远远高于干奶期,提示了miR-223可能在乳腺应答分娩后病原体感染方面起一定的作用;miR-31是一种能够抑制细胞周期蛋白基因表达并受激素调节的microRNA,它的表达量在泌乳早期远远高于干奶期;相比于干奶期,miR-33b在泌乳早期阶段的持续上调,提示这个microRNA可能在乳腺组织中起着控制脂肪生长的作用[12]。泌乳启动阶段是奶牛机体发生重要改变的时期,对这一时期乳腺microRNA的研究有助于泌乳机理的阐释。泌乳期和非泌乳期奶牛乳腺的microRNA表达谱也有了相关报道,Li等[13]对泌乳相关的microRNA进行鉴定分析,并使用EGAN软件构建了microRNA与预测靶基因的泌乳网络。他们通过Solexa测序的方法在乳腺组织中检测出884个microRNA,其中有544个是2个阶段都表达的;另外,有56个microRNA在泌乳与非泌乳阶段表达存在显著不同,41个microRNA在2个阶段都表达,9个microRNA仅仅在泌乳阶段高表达,6个microRNA在非泌乳阶段高表达(表1)[13]。
| 表1 不同泌乳期乳腺组织microRNA表达谱
Table 1 MicroRNA expression profile in mammary gland in different lactation stages[13]
|
目前认为1个microRNA能调节多个靶基因,而1个靶基因也能被1个或多个microRNA调节[14]。南雪梅等[15]总结了目前能够对microRNA靶基因进行预测的数据库和软件,主要包括miRbase(http://mirbase.org/index.shtml)、targetScan (http://www.targetscan.org/)、microRNA.org(http://www.microrna.org/microrna/home.do)、starBase(http://starbase.sysu.edu.cn)、PITA(http://genie.weizmann.ac.il/pubs/mir07/mir07_data.html)、PicTar(http://pictar.mdc-berlin.de/)、RNA22(http://cbcsrv.watson.ibm.com/rna22.html)、miRGator(http://mirgator.kobic.re.kr:8080/MEXWebApp/)、miRDB(http://mirdb.org/miRDB/)、RNAhybrid(http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/)、miRecords(http://mirecords.biolead.org/),这些生物学数据库和软件为microRNA的靶标验证指引了方向。乳腺发育和泌乳相关microRNA功能研究还在进行当中,当前只有有限的数据(表2)。
| 表2 已经验证的与乳腺发育和泌乳相关的microRNA及其靶标
Table 2 Validated microRNA and its target associated with mammary gland development and lactation
|
乳腺发育主要受局部促分裂素,例如表皮生长因子,以及内分泌激素,如雌激素、孕酮、催乳素的控制[24]。而编码这些激素的受体的mRNA可以由具体的microRNA直接靶向。如表1中的miR-126-3p可以直接下调孕酮受体,miR-138可以下调催乳素受体,miR-221可以下调生长激素受体。以上靶标是经过试验验证的与乳腺发育和泌乳相关的基因。从表2来看,当前的研究多集中于激素受体靶标的验证,且验证的物种主要是小鼠。仅有1篇报告是关于奶牛乳腺靶标验证的,即bta-miR-15a靶向GHR基因[23]。
microRNA的定向表达可以作为消除奶中某一蛋白成份的方法。在转基因犊牛的研究中Jabed等[25]人将一个或几个microRNA的组合导入乳腺中,制作转基因犊牛,敲除了β-乳球蛋白基因,结果表明,乳中不表达β-乳球蛋白,但酪蛋白(CSN)的产量增加,并且证实了microRNA可以改变家畜特性[25]。此外,microRNA还能直接调控编码乳成分基因的表达,例如miR-214可以调节人和小鼠乳腺上皮细胞中乳铁蛋白的表达[26]。最近microRNA靶基因结合位点的多态性成为研究的热点,例如Zidi等[27]对25头山羊的酪蛋白基因(CSN1S1、CSN1S2、CSN2、CSN3)的3′UTR进行重测序,发现了5个单核苷酸多态性(single nucleotide polymorphism,SNP)位点,并且这些位点正好位于预测的多种microRNA种子序列的互补区,推测此区域的突变可能造成乳中各种酪蛋白含量的差异。可见,虽然microRNA的功能研究刚刚起步,大量的靶标还未被发现,但就目前的研究报道来看,通过microRNA来调节乳成份及乳品质具有可行性。最近的基因组范围的关联分析显示复杂的特性常常极显著相关于非编码的SNP位点[28]。考虑到microRNA在基因表达中的作用,一个可能的解释是SNP位点属于microRNA结合位点或者microRNA的序列(图1)。因此,将来microRNA研究的另一方向是鉴定microRNA结合位点的SNP及microRNA序列的SNP,并将其与动物的产品特性及健康特性相关联,在奶牛上就是与产奶特性及乳成分相关联,这一研究可以为将来的奶牛选育和乳品质改善提供帮助。
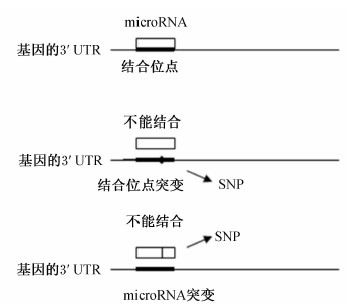 | 图1 microRNA结合位点和microRNA序列的SNP位点 Fig.1 SNP sites in binding site of microRNA and microRNA sequence |
还有一些microRNA的具体靶标没有被证实,但是试验证明其对乳腺发育和泌乳起到一定的作用。例如miR-200a能够维持乳腺上皮细胞表型,并且促进激素诱导的乳腺细胞的分化[29];在转基因小鼠乳腺组织中过表达miR-30b可引起泌乳缺陷,并且推迟乳腺退化[30]。
近些年,在人奶microRNA相关研究的推动下,人们也开始关注牛奶microRNA的特性。牛奶是奶牛乳腺分泌的特殊产物,最近发现牛奶中含有稳定的microRNA和mRNA,对牛奶中microRNA的研究有助于对泌乳机理的探索[31]。Chen等[32]、Hata等[33]、Izumi等[31]相继报道在牛奶中发现了microRNA。首先有研究学者对初乳和常乳中的microRNA进行研究,通过microRNA芯片在牛奶中检测到102种microRNA,100种microRNA存在于初乳中,53种microRNA存在于常乳中,51种microRNA为两者兼有;与常乳相比,初乳中含有更多的与免疫相关的microRNA,这可能与提高新生动物的抵抗能力相关[30]。牛奶中microRNA的研究具有重要的意义,一方面,由于microRNA的特性,推测其可作为一种营养素对新生儿的发育起到一定的作用;另一方面,牛奶中的microRNA可以作为一种牛奶本身的特性,用于鉴别牛奶真伪;此外,由于乳腺是乳的分泌器官,作者推测牛奶中的microRNA可能与乳腺中的microRNA具有一定的相关性,可以为乳腺泌乳机理的研究提供便利材料。
乳房炎严重影响产奶量,过去人们对乳房炎奶牛乳腺组织mRNA的表达已经进行了大量的研究,近期其microRNA方面也有了文献报道。Naeem等[34]检测了患乳房炎奶牛乳腺组织中的14个microRNA,其中涉及先天免疫调节和乳腺上皮细胞对链球菌的抵抗等。感染组织与未感染组织相比,miR-181a、miR-16、miR-31上调了3~5倍,而miR-223下调至大约原有的1/5;miR-31靶基因涉及这些生物学路径,如细胞生长、死亡,细胞交流等,而对脂质代谢有显著的抑制作用;而miR-223的靶基因对脂质代谢也有抑制影响;miR-181a的预测靶对免疫球蛋白G Fc段受体(FcγR)介导的内吞作用、Toll受体信号、抗原加工递呈有强烈的影响。总的来说,某些microRNA对于组织应答于感染是必需的。
随着新的microRNA的发现、功能的验证,使我们明白生物体存在着一种全新的调控模式。就奶牛方面,microRNA的文献报道相对有限,但是处于研究热点。microRNA在奶牛乳腺发育和泌乳机理方面的研究才刚刚起步,这一领域的研究依赖于生物信息学预测的准确性及试验验证材料的积累。从目前文献报道上看,该类分子可能具有更广阔、更重要的作用。在不远的将来,microRNA一定能为奶牛乳腺发育和泌乳机理的揭示提供新的解释。
| [1] | FILIPOWICZ W, BHATTACHARYYA S, SONENBERG N.Mechanisms of post-transcriptional regulation by microRNAs:are the answers in sight[J]. Nature Reviews Genetics, 2008, 9:102-114. ( 1) 1)
|
| [2] | AMBROS V, BARTEL B, BARTEL D P, et al.A uniform system for microRNA annotation[J]. RNA, 2003, 9(3):277-279. ( 1) 1)
|
| [3] | LEIDNER R S, LI L, THOMPSON C L, et al.Dampening enthusiasm for circulating MicroRNA in breast cancer[J]. PLoS One, 2013, 8(3):e57841. ( 1) 1)
|
| [4] | ZHOU J, TIAN Y, LI J, et al.MiR-206 is down-regulated in breast cancer and inhibits cell proliferation through the up-regulation of cyclinD2[J]. Biochemical and Biophysical Research Communications, 2013, 433(2):207-212. ( 1) 1)
|
| [5] | COCHRANE D R, SPOELSTRA N S, RICHER J K.The role of miRNAs in progesterone action[J]. Molecular and Cellular Endocrinology, 2012, 357(1/2):50-59. ( 1) 1)
|
| [6] | LIU C G, CALIN G A, MELOON B, et al.An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101:9740-9744. ( 2) 2)
|
| [7] | SILVERI L, TILLY G, VILOTTE J L, et al.MicroRNA involvement in mammary gland development and breast cancer[J]. Reproduction Nutrition Delelopment, 2006, 46:549-556. ( 1) 1)
|
| [8] | NAN X M, BU D P, WANG J Q, et al.Identification and characterization of microRNAs in a dairy cattle mammary gland epithelial cell line[J].Journal of Animal Science, 2013, 91(Suppl.2):257-258. ( 1) 1)
|
| [9] | AVRIL-SASSEN S, GOLDSTEIN L D, STINGL J, et al.Characterisation of microRNA expression in post-natal mouse mammary gland development[J]. BMC Genomics, 2009, 10:548. ( 1) 1)
|
| [10] | WANG C M, LI Q Z.Identification of differentially expressed microRNAs during the development of Chinese murine mammary gland[J]. Journal of Genetics and Genomics, 2007, 34(11):966-973. ( 2) 2)
|
| [11] | LI Z J, LAN X Y, GUO W J, et al.Comparative transcriptome profiling of dairy goat microRNAs from dry period and peak lactation mammary gland tissues[J]. PLoS One, 2012, 7(12):e52388. ( 1) 1)
|
| [12] | WANG M, MOISA S, KHAN M J, et al.MicroRNA expression patterns in the bovine mammary gland are affected by stage of lactation[J]. Journal of Dairy Science, 2012, 95(11):6529-6535. ( 2) 2)
|
| [13] | LI Z, LIU H Y, JIN X L, et al.Expression profiles of microRNAs from lactating and non-lactating bovine mammary glands and identification of miRNA related to lactation[J]. BMC Genomics, 2012, 13:731. ( 2) 2)
|
| [14] | BAEK D, VILLEN J, SHIN C, et al.The impact of microRNAs on protein output[J]. Nature, 2008, 455:64-71. ( 1) 1)
|
| [15] | 南雪梅, 王加启, 陈海燕, 等.MicroRNAs与脂类代谢[J]. 生物化学与生物物理进展, 2013, 40(2):118-129. ( 1) 1)
|
| [16] | IBARRA I, ERLICH Y, MUTHUSWAMY S K, et al.A role for microRNAs in maintenance of mouse mammary epithelial progenitor cells[J]. Genes & Development, 2007, 21:3238-3243. ( 1) 1)
|
| [17] | GREENE S B, GUNARATNE P H, HAMMOND S M, et al.A putative role for microRNA-205 in mammary epithelial cell progenitors[J]. Journal of Cell Science, 2010, 123:606-618. ( 1) 1)
|
| [18] | TANAKA T, HANEDA S, IMAKAWA K, et al.A microRNA, miR-101a, controls mammary gland development by regulating cyclooxygenase-2 expression[J]. Differentiation, 2009, 77:181-187. ( 1) 1)
|
| [19] | CUI W, LI Q Z, FENG L, et al.MiR-126-3p regulates progesterone receptors and involves development and lactation of mouse mammary gland[J]. Molecular and Cellular Biochemistry, 2011, 355:17-25. ( 1) 1)
|
| [20] | WANG C M, LI Q Z, LI Y.MiR-138 function and its targets on mouse mammary epithelial cells[J]. Progress in Biochemistry and Biophysics, 2008, 35(7):834-838. ( 1) 1)
|
| [21] | LU L M, LI Q Z, WANG C M, et al.Impact of miR-221 on mouse mammary epithelial cells and lactation[J]. Chinese Journal of Biochemistry and Molecular Biology, 2009, 25:454-458. ( 1) 1)
|
| [22] | UCAR A, VAFAIZADEH V, JARRY H, et al.MiR-212 and miR-132 are required for epithelial stromal interactions necessary for mouse mammary gland development[J]. Nature Genetics, 2010, 42:1101-1108. ( 1) 1)
|
| [23] | LI H M, WANG C M, LI Q Z, et al.MiR-15a decreases bovine mammary epithelial cell viability and lactation and regulates growth hormone receptor expression[J]. Molecules, 2012, 17(10):12037-12048. ( 2) 2)
|
| [24] | ANDERSON E.The role of oestrogen and progesterone receptors in human mammary development and tumorigenesis[J]. Breast Cancer Research, 2002, 4:197-201. ( 1) 1)
|
| [25] | JABED A, WAGNER S, MCCRACKEN J, et al.Targeted microRNA expression in dairy cattle directs production of β-lactoglobulin-free, high-casein milk[J]. Proceedings of National Academy of Sciences of the United Stated of America, 2012, 109(42):16811-16816. ( 2) 2)
|
| [26] | LIAO Y, DU X, LONNERDAL B.MiR-214 regulates lactoferrin expression and pro-apoptotic function in mammary epithelial cells[J]. The Journal of Nutrition, 2010, 140(9):1552-1556. ( 1) 1)
|
| [27] | ZIDI A, AMILLS M, TOMÀS A, et al.Short communication:genetic variability in the predicted microRNA target sites of caprine casein genes[J]. Journal of Dairy Science, 2010, 93(4):1749-1753. ( 1) 1)
|
| [28] | ELLINOR P T, LUNETTA K L, GLAZER N L, et al.Common variants in KCNN3 are associated with lone atrial fibrillation[J]. Nature Genetics, 2010, 42:240-244. ( 1) 1)
|
| [29] | NAGAOKA K, ZHANG H, WATANABE G, et al.Epithelial cell differentiation regulated by microRNA-200a in mammary glands[J]. PLoS One, 2013, 8(6):e65127. ( 1) 1)
|
| [30] | LE GUILLOU S, SDASSI N, LAUBIER J, et al.Overexpression of miR-30b in the developing mouse mammary gland causes a lactation defect and delays involution[J]. PLoS One, 2012, 7(9):e45727. ( 2) 2)
|
| [31] | IZUMI H, KOSAKA N, SHIMIZU T, et al.Bovine milk contains microRNA and messenger RNA that are stable under degradative conditions[J]. Journal of Dairy Science, 2012, 95(9):4831-4841. ( 1) 1)
|
| [32] | CHEN X, GAO C, LI H J, et al.Identification and characterization of microRNAs in raw milk during different periods of lactation, commercial fluid, and powdered milk products[J]. Cell Research, 2010(10):1128-1137. ( 1) 1)
|
| [33] | HATA T, MURAKAMI K, NAKATANI H, et al.Isolation of bovine milk-derived microvesicles carrying mRNAs and microRNAs[J]. Biochemical and Biophysical Research Communications, 2010, 396(2):528-533. ( 1) 1)
|
| [34] | NAEEM A, ZHONG K, MOISA S J, et al.Bioinformatics analysis of microRNA and putative target genes in bovine mammary tissue infected with Streptococcus uberis[J]. Journal of Dairy Science, 2012, 95(11):6397-6408. ( 1) 1)
|




