2. 太仓市畜牧兽医站, 太仓 215400;
3. 扬州市康源乳业有限公司, 扬州 225000
2. Taicang Animal Husbandry &. Veterinary Station, Taicang 215400, China;
3. Kangyuan Dairy Company of Yangzhouhou, Yangzhou 222500, China
色氨酸(tryptophan,Trp)是家禽的重要限制性氨基酸,其代谢产物5-羟色胺(5-HT)具有“激素样”特性,对心血管系统功能具有重要的调节作用。研究表明,饲粮中Trp水平与动物的采食量相关[1, 2, 3]。在低Trp水平饲粮中添加适当的Trp能够提高机体蛋白质的沉积,进而促进动物的健康生长和发育[4, 5, 6, 7, 8]。目前,有关功能性氨基酸调控蛋白质代谢的研究主要集中在精氨酸(Arg)、亮氨酸(Leu)等氨基酸上[9, 10, 11],而针对Trp对蛋白质代谢的研究报道较少,尤其是关于鹅的Trp 需求方面的研究鲜有报道。同时研究过于强调Trp本身的作用,而忽视了其调控采食量这一重要的因素。因此,本试验以扬州鹅为试验动物,研究饲粮Trp水平和饲喂方式对扬州鹅机体蛋白质代谢的影响,为进一步阐明Trp在鹅蛋白质沉积方面的作用提供依据。
选取同一批出雏、体质健壮、体重接近、饲养管理一致的21日龄扬州鹅公鹅270只,随机分成6组,每组3个重复,每个重复15只。试验鹅从基础饲粮经过7 d过渡(22~24日龄,替换1/3基础饲粮;25~26日龄,替换1/2基础饲粮;27~28日龄,替换2/3基础饲粮)为正式试验饲粮,29日龄开始正式试验,试验期42 d。舍内地面平养,自由饮水,控制舍内温度、湿度、光照,定期清洁鹅舍及周围环境,其他饲养管理以及有关免疫程序、卫生消毒、定期驱虫等按照常规方法进行。
试验采用2×3双因子完全随机设计,饲喂方式分为自由采食和限制饲喂,全期限制饲喂组鹅饲料供给量为前1天自由采食组饲料消耗量的90%。在总结长期生产经验的基础上,参考现有关于鹅营养需要量的有关资料[12, 13]以及NRC(1994)饲养标准,试验饲粮Trp设3个水平。L-Trp(纯度为99%)的添加水平分别为0、0.08%和0.16%,加上基础饲粮本底Trp水平(0.14%),饲粮Trp水平分别为0.14%(Ⅰ组)、0.22%(Ⅱ组)和0.30%(Ⅲ组)。基础饲粮组成及营养水平见表1。
将120只19日龄、体重相近的扬州公鹅随机分成3组,每组4个重复,每个重复10只。试验鹅从基础饲粮经过7 d过渡为正式试验饲粮,26日龄开始正式试验,为期4 d。采用单因子试验设计,3组试验饲粮同1.2。
试验鹅饲养至28日龄,在饲喂试验饲粮3.5 h后,各组按平均体重选取4只鹅,采用一次性大剂量注射法从腿部静脉注射L-[15N]-苯丙氨酸(Phe)溶液(120 μmol/mL,98%,购自Sigma公司),注射剂量为每100 g体重1 mL。注射完成后,准确记录注射结束到组织样品冷冻的时间。
试验鹅在28日龄时,分别于注射同位素示踪物后20 min内处死,分离胸肌、腿肌和肝脏,并称取其重量,然后迅速取出胸肌、腿肌、肝脏少量样品投入液氮中速冻,-70 ℃保存,用于蛋白质合成率(FSR)的分析。
在同位素注射试验的前后2 d(26和30日龄),每重复按平均体重选取3只鹅宰杀,取出胸肌、腿肌、肝脏并称重,参照GB 5009.5—2010用凯氏定氮法测定粗蛋白质(CP)含量,用于蛋白质生长率(FGR)的分析。
胸肌、腿肌和肝脏组织中水分及CP含量的测定分别采用105 ℃常温干燥法及凯氏定氮法,具体参照GB 5009.3—2010和GB 5009.5—2010,干物质含量通过水分含量即可换算得出。组织蛋白质沉积量的计算公式如下:
组织蛋白质沉积量(g/d)=[(70日龄组织重×干物质含量×CP含量)-(28日龄组织重×干物质含量×CP含量)]/(试验天数×70日龄体重)。式中:70日龄体重单位为kg;70日龄组织重单位为g;试验天数单位为d。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) % |
70日龄时,分别从各重复中随机取3只试验鹅进行屠宰。采血前禁食12 h,采血后静置2 h,以3 000 r/min离心15 min,析出的血清-20 ℃保存备测。血清氨基酸含量的测定利用高效液相色谱仪(岛津LC-15C),Venusil AA氨基酸分析方法组件包购自天津博纳艾杰尔科技有限公司。
皮质醇(Cort)含量的测定采用美国Groundwork Biotechnology Diagnosticate公司酶联免疫吸附测定(ELISA)试剂盒法。总蛋白(total protein,TP)、白蛋白(albumin,ALB)和尿酸(uric acid,UA)含量的测定按照相应的试剂盒进行测定,试剂盒购自中生北控生物科技股份有限公司,运用RA-1000型全自动生化分析仪进行测定。
组织样品游离库和结合库中L-[15N]-Phe丰度测定的前处理在参考Mackenzie[14]、宾石玉[15]方法的基础上做相应的改进,利用Trace DSQ型气质联用仪(Thermo,USA;TR-5MS色谱柱,30.00 m×0.25 mm×0.25 μm)测定。
组织FSR计算方法参考Garlick等[16],通过凯氏定氮法测定组织中CP含量后,运用以下公式计算FGR和蛋白质降解率(FDR):
FGR(%)=(组织蛋白质沉积量/组织蛋白质平均重量)×100; 组织蛋白质沉积量=[(30日龄组织重量×CP含量)-(26日龄组织重量×CP含量)]/4; 组织蛋白质平均重量=[(30日龄组织重量×CP含量)+(26日龄组织重量×CP含量)]/2; FDR(%)=FSR-FGR。试验数据用Excel 2003建立数据库,通过SAS 9.1.3软件中的ANOVA模块进行单因素和双因素方差分析,运用Duncan氏法进行多重比较,P<0.05为差异显著,结果以平均值±标准差表示。
由表2可以看出,饲喂方式显著影响鹅胸肌、腿肌蛋白质沉积量和肝脏CP含量(P<0.05),但对于其他各项指标的影响不显著(P>0.05)。Ⅱ组和Ⅲ组腿肌CP含量显著高于Ⅰ组(P<0.05),Ⅱ组腿肌蛋白质沉积量显著高于Ⅰ组(P<0.05)。Trp水平和饲喂方式对肝脏CP含量有显著交互作用(P<0.05),而对胸肌、腿肌CP含量和蛋白质沉积量均不存在显著交互作用(P>0.05)。
| 表2 饲粮色氨酸水平和饲喂方式对鹅组织蛋白质沉积的影响
Table 2 Effects of dietary tryptophan level and feeding regimen on tissue protein deposition of goslings
|
由图1可以看出,自由采食组饲粮Trp水平对血清中Trp/大分子中性氨基酸(LNAAs)值无显著影响(P>0.05);Ⅲ组血清Trp/LNAAs值显著高于Ⅰ组(P<0.05),Ⅱ组与Ⅰ组和Ⅲ组间差异不显著(P>0.05)。饲粮Trp水平和饲喂方式间对鹅血清Trp/LNAAs值不存在显著交互作用(P>0.05)。
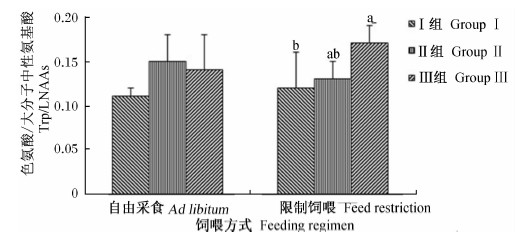 | 图1 饲粮色氨酸水平和饲喂方式对70日龄鹅血清色氨酸/大分子中性氨基酸的影响 Fig.1 Effects of dietary tryptophan level and feeding regimen on Trp/LNAAs in serum of goslings at 70 days of age 饲喂方式feeding regimen:P=0.4461;色氨酸水平tryptophan level:P=0.0108;饲喂方式×色氨酸水平feeding regimen×tryptophanlevel:P=0.2108. 柱形图标注不同小写字母表示差异显着(P<0.05),相同或无字母表示差异不显着(P>0.05). Histogram with different small letter superscripts mean significant difference(P<0.05),while with the same or noletter superscripts mean no significant difference(P>0.05). |
由表3可以看出,自由采食组血清TP含量显著高于限制饲喂组(P<0.05)。与Ⅰ组相比,Ⅱ组和Ⅲ组血清TP含量显著提高了9.6%和12.6%(P<0.05),而Trp水平则对血清ALB含量无显著影响(P>0.05)。Ⅲ组血清UA含量显著低于Ⅰ组(P<0.05),Ⅱ组与其他各组无显著差异(P>0.05)。Ⅱ组和Ⅲ组血清Cort含量比Ⅰ组分别降低了14.31%(P<0.05)和11.18%(P>0.05)。饲粮Trp水平和饲喂方式对血清生化指标不存在显著交互作用(P>0.05)。
| 表3 饲粮色氨酸水平和饲喂方式对70日龄鹅血清生化指标的影响
Table 3 Effects of dietary tryptophan level and feeding regimen on serum biochemical parameters of goslings at 70 days of age
|
由表4可以看出,饲粮Trp水平对鹅肝脏FSR、FGR和FDR的影响不显著(P>0.05),即Trp不影响肝脏蛋白质周转速率。Trp水平对鹅胸肌FSR、FGR和FDR的影响不显著(P>0.05),Ⅰ组FGR最高,与其他2组差异不显著(P>0.05)。饲粮Trp水平对于腿肌FSR和FGR有影响,其中,Ⅱ组和Ⅲ组FSR和FGR都显著高于Ⅰ组(P<0.05),但是Ⅱ组和Ⅲ组之间差异不显著(P>0.05)。
| 表4 饲粮色氨酸水平对28日龄鹅蛋白质周转代谢的影响
Table 4 Effects of dietary tryptophan level on protein turnover of goslings at 28 days of age %/d
|
蛋白质是动物体内除水分外含量最多的营养物质,约占机体干物质的50%,其不仅是动物机体的重要组成成分,而且在体内执行着各种各样的生物学功能。有关饲粮Trp水平对畜禽蛋白质沉积的影响,国内外学者进行了一些研究。Lin等[17]在小鼠上的研究表明,Trp除了作为蛋白质合成的底物以外,还具有调节肌肉蛋白质合成的作用。Ponter等[1]在猪方面的研究表明,在Trp缺乏的饲粮中,添加Trp可提高蛋白质的沉积,尤其是背最长肌和肝脏蛋白质的合成。任建波等[7]在猪方面的研究发现,随着饲粮中Trp水平由1.2 g/kg提高到1.7、2.2和2.7 g/kg,机体氮沉积和氮的生物学利用率显著提高。席鹏彬等[6]研究表明,饲粮Trp缺乏时,黄羽肉鸡体蛋白质沉积较低,额外补充晶体Trp可使公鸡、母鸡体蛋白质沉积量分别提高21.0%~31.8%和5.4%~27.9%。以上的相关报道表明,在低Trp水平饲粮中,补充Trp有利于提高畜禽体组织蛋白质的沉积。腿肌和胸肌是鹅体蛋白质沉积的主要部位,其组织含量的多少可直接反映机体蛋白质沉积的程度。本研究结果表明,随着饲粮Trp水平的增加,胸肌和腿肌中CP含量和蛋白质沉积量均呈现不同程度的提高,这与以往的研究结果基本一致。表明在低Trp水平饲粮中补充Trp可以提高鹅肌肉组织蛋白质的沉积。
Trp作为动物体内一种代谢非常活跃的氨基酸,同时也是大脑组织中一种重要神经递质5-HT的前体物。5-HT通过作用于下丘脑的采食中枢起到对动物采食量的调节作用[18]。Li等[19]研究表明,脑组织中Trp含量的变化是由于血浆中Trp/LNAAs值的变化引起的,进而使得5-HT含量发生变化。Henry等[20]、Sainio等[21]同样研究表明,Trp在进入脑中转变为5-HT时,必须首先通过血脑屏障,由于和LNAAs通过血脑屏障的途径相同,这使得二者在通过血脑屏障时存在相互间的竞争。因此,LNAAs对Trp转变为5-HT有抑制作用,Trp/LNAAs值直接影响5-HT的含量,进而影响到动物的采食量。苏有健[22]、Andrew等[4]研究表明,Trp缺乏会导致肉仔鸡的增重和采食量受到抑制,推测其原因可能是当Trp严重缺乏时,大脑中5-HT耗竭,导致采食量急剧下降。本研究发现,随着饲粮Trp水平的增加,血清Trp/LNAAs值呈现不同程度增加,通过血脑屏障的Trp分子增加,脑中5-HT的含量也会随之增加,进而表现为促进动物采食量的增加。有关Trp调节动物采食量的问题还有待于进一步研究探讨。
血清TP和ALB含量可以作为衡量动物机体营养状况和蛋白质代谢水平的指示物。一般来说,动物机体的营养状况好,蛋白质合成旺盛,血清TP和ALB含量升高。饶巍等[23]、周斌等[24]在蛋鸡上研究发现,血清TP和ALB含量变化趋势基本一致,0.20%Trp水平组显著高于其他各组。马玉娥等[25]研究表明,与对照组相比(Trp水平为0.16%),饲粮中0.18%Trp水平组可以显著提高血清TP和ALB含量,较对照组分别提高了13.40%和4.02%。本试验发现,随着饲粮Trp水平的增加,血清TP含量显著增加,ALB含量呈现增加的趋势,与饶巍等[23]、周斌等[24]研究结果基本相一致。UA是动物蛋白质、氨基酸等含氮物质代谢的主要终产物,可以较准确地反映出动物体内蛋白质代谢和氨基酸平衡的状况。马玉娥等[25]研究表明,与对照组(Trp水平为0.16%)相比,各试验组(Trp水平分别为0.18%、0.20%和0.22%)肉种鸡血清UA含量有降低的趋势。本试验发现,Ⅲ组血清UA含量显著降低,Ⅱ组较Ⅰ组有降低的趋势。结合本试验中组织蛋白质含量和沉积量、血清TP和ALB含量可以发现,在Trp缺乏的饲粮中,适当额外补充Trp可以促进机体氨基酸平衡和蛋白质的利用效率,增强蛋白质的合成,缓解机体蛋白质分解代谢的强度,使得机体蛋白质代谢旺盛,蛋白质沉积量增加。
Cort是肾上腺皮质束状带所分泌的类固醇激素,对调节动物机体蛋白质代谢有着重要的作用。Simmons等[26]研究表明,Cort影响蛋白质代谢的作用机制是促进动物体内蛋白质分解,抑制蛋白质合成,使得动物机体处于负氮平衡状态,进而表现为蛋白质过度消耗。Guzik等[27]同样研究发现,与对照组(饲喂基础饲粮,Trp水平为0.16%)相比,在基础饲粮中额外连续5 d添加0.5%Trp可以极显著降低急性应激猪血浆Cort含量,并推测Cort含量降低可能是5-HT合成量增加的结果。张括等[28]研究发现,饲喂Trp水平为0.252%~0.269%的饲粮能显著降低试验鸭血浆Cort含量。本研究发现,与Ⅰ组相比,Ⅱ组血清Cort含量显著降低,Ⅲ组有小幅降低的趋势,这与以往的研究结果相一致。这表明在低Trp水平饲粮中,通过额外补充Trp可抑制动物体内蛋白质的降解,一定程度上提高蛋白质的利用率,使得动物机体处于正氮平衡状态,表现为动物机体蛋白质沉积的增加和生长加速。
蛋白质周转速率可以反映动物机体内蛋白质的动态变化规律,由机体FSR和FDR所共同决定的蛋白质沉积率对于动物的生长发育起着至关重要的作用。肝脏是动物机体中蛋白质、氨基酸代谢非常活跃的组织器官,相对于其他组织器官而言,大部分氨基酸在肝脏组织进行代谢且周转速率非常高。Cortamira等[29]在猪方面研究表明,Trp可以增加肝脏组织蛋白质的合成。Sidransky等[30]研究发现,在鼠上利用放射性同位素[14C]-Leu技术,通过导管单独灌注Trp能够促进肝脏蛋白质的合成速率增加83%,然而当Leu/Trp值为9.6,丙氨酸(Ala)/Trp值为2.1或4.0时则显著降低肝脏蛋白质的合成速率。本研究发现,Trp对扬州鹅肝脏蛋白质周转速率(FSR、FGR和FDR)影响差异不显著。产生这种差异的主要原因可能是由于研究方法、物种、营养水平等因素的不同所产生的,具体原因还有待于进一步的探讨。
正常营养状态下,肌肉是动物体内蛋白质最大的贮存库,占全身的40%~50%,因而在很大程度上决定机体整体的蛋白质沉积量。Lin等[17]通过在体外检测进入组织蛋白质[14C]-Phe的变化发现,不同肌肉类型之间蛋白质的合成能力没有显著区别,而肌肉核糖体蛋白质合成能力与饲粮Trp水平呈正相关。由此说明,Trp除了作为蛋白质的合成底物以外,还具有调节肌肉蛋白质合成的作用。目前,有关Trp水平对于家禽组织蛋白质周转速率影响的研究尚未见报道。本研究表明,对于扬州鹅胸肌而言,随着Trp水平的提高,FSR呈现增加的趋势,而FDR则以Ⅰ组最高,Ⅱ组最低,Ⅲ组处于中间。产生的这种原因可能是由于本研究采用的试验动物鹅在28日龄时,胸肌发育不完全,在剥离胸肌的过程中产生的较大误差导致。对于鹅腿肌而言,Trp可以显著提高腿肌的FSR和FGR,一定程度上有提高FDR的趋势,且FSR的提高幅度远大于FDR。这表明在鹅腿肌组织蛋白质的沉积过程中,相对于FDR而言,FSR起着主导作用,其原理这还需要利用分子生物学等技术进一步的探讨研究。
在低Trp水平饲粮中添加Trp可以提高鹅机体蛋白质的沉积。
| [1] | ANDREW A F, FRANK H, MARKUS R.Estimates of individual factors of the tryptophan requirement based on protein and tryptophan accretion responses to increasing tryptophan supply in broiler chickens 8 to 21 days of age[J]. Archives of Animal Nutrtiton, 2005, 59(3):181-190. ( 2) 2)
|
| [2] | ROSA A P, PESTI G M, EDWARDS H M, Jr, et al.Tryptophan requirements of different broiler genotypes[J]. Poultry Science, 2001, 80(12):1718-1722. ( 1) 1)
|
| [3] | CORZO A, MORAN E T, Jr, HOEHLER D, et al.Dietary tryptophan need of broiler males from forty-two to fifty-six days of age[J]. Poultry Science, 2005, 84(2):226-231. ( 1) 1)
|
| [4] | PONTER A A, CORTAMIRA N O, SEVE B, et al.The effects of energy source and tryptophan on the rate of protein synthesis and on hormones of the entero-insular axis in the piglet[J]. British Journal of Nutrition, 1994, 71(5):661-674. ( 2) 2)
|
| [5] | SAWADOGO M L, PIVA A, PANCIROLI A, et al.Marginal efficiency of free or protected crystalline L-tryptophan for tryptophan and protein accretion in early-weaned pigs[J]. Journal of Animal Science, 1997, 75(6):1561-1568. ( 1) 1)
|
| [6] | 席鹏彬, 林映才, 蒋宗勇, 等.饲粮色氨酸对43-63日龄黄羽肉鸡生长、胴体品质、体成分沉积及下丘脑5-羟色胺的影响[J]. 动物营养学报, 2009, 21(2):137-145. ( 2) 2)
|
| [7] | 任建波, 赵广永, 李元晓, 等.日粮色氨酸水平对生长猪的氮利用效率、血浆类胰岛素生长因子-Ⅰ、生长激素及胰岛素的影响[J]. 动物营养学报, 2007, 19(3):264-268. ( 2) 2)
|
| [8] | MA H, ZHANG W, ZHU X P, et al.Effects of rumen-protected tryptophan on growth performance, fibre characteristics, nutrient utilization and plasma essential amino acids in Cashmere goats during the cashmere slow growth period[J]. Livestock Science, 2010, 131(2):227-233. ( 1) 1)
|
| [9] | LANG C H.Elevated plasma free fatty acids decrease basal protein synthesis, but not the anabolic effect of leucine, in skeletal muscle[J]. American Journal of Physiology:Endocrinology and Metabolism, 2006, 291(3):E665-E674. ( 1) 1)
|
| [10] | SUGAWARA T, ITO Y, NISHIZAWA N, et al.Supplementation with dietary leucine to a protein-deficient diet suppresses myofibrillar protein degradation in rats[J]. Journal of Nutritional Science and Vitaminology, 2007, 53(6):552-556. ( 1) 1)
|
| [11] | YOSHIZAWA F.Regulation of protein synthesis by branched-chain amino acids in vivo[J]. Biochemical and Biophysical Research Communications, 2004, 313(2):417-422. ( 1) 1)
|
| [12] | 施寿荣, 王志跃, 杨海明, 等.日粮能量和蛋白质水平对5-10周龄仔鹅生产性能的影响[J]. 饲料工业:自然科学版, 2006, 27(23):39-42. ( 1) 1)
|
| [13] | 闵育娜, 侯水生, 高玉鹏, 等.5-8周龄肉鹅能量和蛋白质营养需要量研究[J]. 西北农林科技大学学报, 2006, 34(12):34-40. ( 1) 1)
|
| [14] | MACKENZIE S L.Gas chromatographic analysis of amino acids as the N-heptafluorobutyryl isobutyl esters[J]. Journal of the Association of Official Analytical Chemists, 1987, 70(1):151-160. ( 1) 1)
|
| [15] | 宾石玉.日粮淀粉来源对断奶仔猪生产性能、小肠淀粉消化和内脏组织蛋白质合成的影响.博士学位论文.雅安:四川农业大学, 2005:31-34. ( 1) 1)
|
| [16] | GARLICK P J, FERN M, PREEDY V R.The effect of insulin infusion and food intake on muscle protein synthesis in postabsorptive rats[J]. Biochemical Journal, 1983, 210(3):669-676. ( 1) 1)
|
| [17] | LIN F D, SMITH T K, BAYLEY H S.A role for tryptophan in regulation of protein synthesis in porcine muscle[J]. The Journal of Nutrition, 1988, 118(4):445-449. ( 2) 2)
|
| [18] | PEISKER M, SIMMINS P H.Tryptophan as a feed intake stimulant[J]. Feed Mix, 1998, 6(1):8-12. ( 1) 1)
|
| [19] | LI E T S, ANDERSON G H.Amino acids in the regulation of food intake[J]. Nutrition Abstracts and Reviews in Clinical Nutrition Series A, 1983, 53:169-181. ( 1) 1)
|
| [20] | HENRY Y, SEVE B, COLLÉAUX Y, et al.Interactive effects of dietary levels of tryptophan and protein on voluntary feed intake and growth performance in pigs, in relation to plasma free amino acids and hypothalamic serotonin[J]. Journal of Animal Science, 1992, 70(6):1873-1887. ( 1) 1)
|
| [21] | SAINIO E L, PULKKI K, YOUNG S N.L-tryptophan:biochemical, nutritional and pharmacological aspects[J]. Amino Acids, 1996, 10(1):21-47. ( 1) 1)
|
| [22] | 苏有健.在低蛋白日粮中添加色氨酸对仔猪生产性能和下丘脑5-羟色胺水平的影响.博士学位论文.北京:中国农业大学, 2004:28-29. ( 1) 1)
|
| [23] | 饶巍, 王玥, 周斌, 等.日粮色氨酸水平对蛋鸡生产性能及蛋白质代谢的影响[J]. 中国畜牧杂志, 2011, 47(15):38-41. ( 2) 2)
|
| [24] | 周斌, 李慧, 邹晓庭, 等.色氨酸对产蛋鸡脂肪代谢的影响[J]. 中国畜牧杂志, 2011, 47(7):50-53. ( 2) 2)
|
| [25] | 马玉娥, 占秀安, 朱巧明, 等.饲粮色氨酸水平对黄羽肉种鸡生产性能、抗氧化功能及血清生化指标的影响[J]. 动物营养学报, 2011, 23(12):2177-2182. ( 2) 2)
|
| [26] | SIMMONS P S, MILES J M, GERICH J E, et al.Increased proteolysis:an effect of increases in plasma cortisol within the physiologic range[J]. Journal of Clinical Investigation, 1984, 73(2):412-420. ( 1) 1)
|
| [27] | GUZIK A C, MATTHEWS J O, KERR B J, et al.Dietary tryptophan effects on plasma and salivary cortisol and meat quality in pigs[J]. Journal of Animal Science, 2006, 84(8):2251-2259. ( 1) 1)
|
| [28] | 张括, 王安, 刘洋景.12-17周龄金定蛋鸭色氨酸适宜需要量的研究[J]. 饲料工业, 2011, 32(20):6-9. ( 1) 1)
|
| [29] | CORTAMIRA N O, SEVE B, LEBRETON Y, et al.Effect of dietary tryptophan on muscle, liver and whole-body protein synthesis in weaned piglets:relationship to plasma insulin[J]. British Journal of Nutrition, 1991, 66(3):423-435. ( 1) 1)
|
| [30] | SIDRANSKY H, VERNEY E.Effect of amino acid imbalances on the stimulatory effect of L-tryptophan on hepatic protein synthesis[J]. Amino Acids, 1997, 12(3/4):205-212. ( 1) 1)
|




