2. 广西农业职业技术学院, 南宁 530007;
3. 南京农业大学, 南京 210095
2. Guangxi Agricultural Vocational and Technical College, Nanning 530007, China;
3. Nanjing Agricultural University, Nanjing 210095, China
半胱胺(cysteamine,Cs)为半胱氨酸的脱羧产物,是辅酶A分子的组成部分,是动物体内的生物活性物质,是促进动物生长的较为理想的物质,可作为一种生长促进剂应用于动物生产中。半胱胺是调节生长激素水平的有效制剂,可以提高动物体内生长激素的水平,促进动物生长,还具有抗氧化、增强免疫功能的作用,且动物对其不会产生依赖性,不存在残留和污染问题。半胱胺能提高反刍动物生产性能,应用效果显著,且具有无种属特异性、使用方法简便、生产成本相对低廉等众多优点,在动物生产中的应用已受到人们的关注。半胱胺作为一种新型饲料添加剂具有良好的市场开发前景。
目前,有许多研究学者在瘤胃甲烷调控方面做了相关研究。张春梅等[1]研究添加富含十八碳不饱和脂肪酸的植物油对体外瘤胃发酵和甲烷产量的影响,结果表明,添加7%豆油显著抑制了甲烷生成,而所有添加亚麻油的试验组的甲烷产量与对照组相比均显著降低。李玉珠等[2]研究饲粮中添加中链脂肪酸对体外发酵甲烷产量的影响,结果表明,与不添加脂肪酸的对照相相比,添加50 mg未酯化月桂酸及以3∶ 2组合的月桂酸和肉豆蔻酸的混合物可分别使甲烷产量降低22.2%和11.8%;添加50 mg未酯化肉豆蔻酸可使甲烷产量降低3.4%。张春梅等[3]利用人工瘤胃体外产气法研究添加亚油酸与亚麻酸不同比例混合物对瘤胃发酵和甲烷生成的影响,结果表明,与未添加脂肪酸的对照组相比,所有添加脂肪酸的试验组甲烷产量均显著降低。由上述调控甲烷产量的试验可知,饲喂多不饱和脂肪酸可通过改变瘤胃微生物的组成等来调控瘤胃甲烷产量。近年来,已有许多研究学者在半胱胺对动物生产性能的影响等方面做了一些研究报道。梁贤威等[4]用半胱胺饲喂泌乳水牛,结果表明,饲粮中添加半胱胺可提高泌乳水牛生产性能,提高水牛奶中乳脂共轭亚油酸(CLA)的含量。添加半胱胺的3组(半胱胺添加量分别为占精饲料0.2%、0.4%和0.6%)与对照组相比较,乳脂中月桂酸(C12∶ 0)、豆蔻酸(C14∶ 0)、棕榈酸(C16∶ 0)和棕榈油酸(C16∶ 1 c-9)、硬脂酸(C18∶ 0)、油酸(C18∶ 1 c-9)、亚油酸(C18∶ 2)和CLA含量均有不同程度的提高,添加半胱胺有增加水牛奶中CLA含量的趋势。乳脂脂肪酸组成的改变主要是通过瘤胃微生物对其氢化作用。一般认为,长链脂肪酸影响甲烷产量的机制一是作为氢的受体,改变了氢还原二氧化碳的代谢通路;二是对瘤胃微生物的直接毒害作用。中链脂肪酸抑制甲烷生成的作用可能是由于其抑制原虫和直接抑制甲烷菌的双重作用等。由此,本试验试图初步探索具有改变乳脂脂肪酸组成的半胱胺是否也具有改变瘤胃甲烷生成的能力。
目前,半胱胺在对山羊瘤胃微生物体外发酵和瘤胃消化代谢方面已有一些报道,但添加半胱胺对水牛瘤胃发酵参数,尤其是瘤胃甲烷产量的影响尚未见报道,开展这方面更深层次的应用研究工作十分重要。因此,本试验利用人工瘤胃体外产气的方法,在体外条件下研究精饲料中添加不同水平的半胱胺对水牛瘤胃发酵参数和甲烷产量的影响,进一步确定饲粮中半胱胺添加的最佳水平,为今后开展半胱胺在反刍动物营养研究应用中提供理论依据。
试验所用豆粕、玉米、啤酒糟、木薯渣、象草、美国苜蓿均采自广西水牛研究所,经65 ℃烘干制成风干样后,粉碎过40目筛用于体外发酵。
半胱胺盐酸盐产品由上海华扩生化科技研发有限公司生产,有效成分含量为30%,常温下呈淡黄色,细颗粒状。
设计发酵底物的精粗比为32.5∶ 67.5,原料分为精饲料(玉米25.00%、豆粕7.50%)和粗饲料(象草26.25%、木薯渣18.75%、啤酒糟22.50%,试验粗饲料营养水平见表1)。半胱胺在精饲料中的添加水平分别为0(对照)、0.2%、0.4%、0.6%、0.8%、1.0%(干物质基础)。
试验设1个对照组和1个标准干草美国苜蓿组,标准干草美国苜蓿组用于校正试验差异。在所有时间点的产气试验结束后,对所测的结果都采用标准干草标准的测定值进行校正,以消除试验误差。此外,如果试验标准干草的实际测定值与标准值差异很大时,要重新进行发酵培养。
| 表1 试验粗饲料营养水平(干物质基础) Table 1 Nutrient levels of experimental roughages (DM basis) % |
本试验采用Mauricio等[5]的压力读取式体外产气系统进行体外瘤胃发酵,厌氧人工瘤胃缓冲液的配制按Theodorou等[6]方法。体外培养装置主体为恒温水浴摇床,水浴温度和振荡频率可调。培养的底物为750 mg(干物质基础),培养时间为72 h。
选择3头体重约为(400±5) kg安装永久性瘤胃瘘管的水牛作为瘤胃液的供体动物。瘘管牛的饲粮水平参照广西水牛研究所的日常饲养配方配制,精粗比为30.0∶ 70.0(风干基础),粗饲料为象草。饲粮营养水平为:粗蛋白质含量13.72%,产奶净能6.44 MJ/kg,钙含量0.72%,磷含量0.48%。瘘管牛采用拴系式饲养,每日于08:00和17:00分2次饲喂,自由饮水,常规光照、驱虫及管理。
产气量测定方法参考文献6,培养2、4、6、9、12、24、36、48、72 h时,用压力传感器读取产气瓶内压力,并放气。根据公式计算出产气量。
GPt= (Pt-Pt空白)×(V0-100) 101.3×W 。式中:GPt为样品在t时刻的产气量(mL/g);Pt为样品在t时刻读取的压力(MPa);Pt空白为空白对照在t时刻的产气压力(MPa);V0为容器体积;101.3为标准大气压(MPa);W为样品干物质含量(g)。
产气过程的积累产气量为各时间段产气量之和。
根据以下公式计算出各部分产气量。
GP=a+b(1-exp-ct)。式中:a为快速降解部分的产气量(mL/g);b为慢速降解部分的产气量(mL/g);c为产气速率常数(%/h),a+b为潜在产气量(mL/g)。
以200 mg样品(干物质基础)为每单位作为底物时,根据体外产气法发酵24 h后得到的产气量计算可消化有机物,计算公式如下。
DOM=(7.65±0.062)×GP24 h+ (353±0.59)[7]。式中:DOM为可消化有机物(g/kg);GP24 h为24 h累积产气量(mL)。
根据下列公式计算代谢能。
DO=17.04+1.108 5×GP24 h; ME=-0.20+0.141 0×DO[8]。式中:DO为有机物消化率(%);ME为代谢能(MJ/kg)。
取体外发酵培养24 h后的培养液5 mL,经过3 000×g离心10 min,取上清液,采用Searle[9]、冯宗慈等[10]改进方法,用氯化铵作标准品,采用紫外可见分光光度计(PE Lambda 35型,美国)在700 nm波长条件下比色,根据光密度值和标准曲线求出氨态氮的浓度。
取体外发酵培养24 h后的培养液8 mL,采用嘌呤法测定体外微生物蛋白浓度,经过处理后的待测液以0.5 mol/L盐酸溶液作参比,采用紫外可见分光光度计(PE Lambda 35型,美国)在260 nm下比色,根据光密度值和标准曲线求出RNA测定值;根据以下公式计算微生物蛋白浓度。
微生物蛋白(mg/mL)=[(RNA测定值(mg/mL)× RNA含氮量)/细菌氮中RNA含氮量]×稀释倍数×6.25[8]。式中:RNA含氮量为17.83%;细菌氮中RNA含氮量为10%。
取体外发酵培养24 h后的上清液1 mL,加入等体积8.2%的偏磷酸,4 ℃ 20 000×g下离心10 min,取离心后的上清液加入内标物巴豆酸,仪器为Agilent 7890A型气相色谱仪,色谱柱为HP-INNOWAX(19091N-133)毛细管柱,规格为30 m×0.25 mm×0.25 μm。测定上清液中乙酸、丙酸、丁酸的浓度。
在6、12、24 h抽取10 μL气体测定甲烷产量,测定仪器为Agilent 7890A型气相色谱仪,色谱柱为HP-INNOWAX(19091N-133)毛细管柱,规格为30 m×0.25 mm×0.25 μm。
试验数据用Excel软件进行处理,然后用SPSS 16.0软件进行方差分析,Duncan氏法进行多重比较,试验数据用“平均值±标准误”表示,以P<0.05作为差异显著性判断的标准。
由图1和表2可知,72 h内,各组产气量变化一致,均呈逐渐升高趋势。半胱胺对72 h累积产气量影响不显著(P>0.05)。可消化有机物含量和代谢能这2个指标在半胱胺添加水平为0.8%时最高,之后下降,0.8%半胱胺组的可消化有机物含量和代谢能均显著高于对照组和0.2%、0.4%、0.6%半胱胺组(P<0.05),且极显著高于1.0%半胱胺组(P<0.01)。
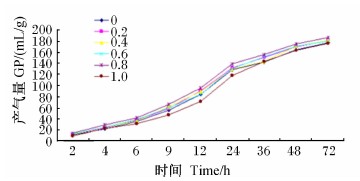 | 图1 半胱胺对体外发酵72 h产气量动态变化的影响 Fig.1 Effects of cysteamine on the dynamic change of GP in 72 h of in vitro fermentation |
由表3可知,添加半胱胺对快速降解部分产气量、慢速降解部分产气量、潜在产气量和产气速率常数均没有显著影响(P>0.05)。
由表4可知,半胱胺对氨态氮没有显著影响(P>0.05),0.8%半胱胺组氨态氮浓度最高;对于微生物蛋白浓度,试验组均比对照组高,0.8%半胱胺组显著或极显著高于其余各组(P<0.05或P<0.01)。
由表5可知,半胱胺对乙酸和丙酸浓度没有显著影响(P>0.05),0.8%半胱胺组乙酸浓度最高;随着半胱胺添加水平的增加,丁酸浓度有不同程度的降低,1.0%半胱胺组丁酸浓度最低,显著低于对照组、0.2%半胱胺组(P<0.05);总挥发性脂肪酸浓度没有显著性变化(P>0.05)。随着半胱胺添加水平的增加,乙酸/丙酸有不同程度的增加,其中添加0.6%半胱胺可显著增加乙酸/丙酸(P<0.05)。
| 表2 半胱胺对体外发酵72 h累积产气量、可消化有机物含量和代谢能的影响 Table 2 Effects of cysteamine on accumulation of GP in 72 h, digestible organic matter content and metabolisable energy of in vitro fermentation |
由表6可知,添加0.4%、0.6%、0.8%和1.0%的半胱胺,可使瘤胃发酵6和12 h甲烷产量显著减少(P<0.05)。0.4%、0.6%、0.8%半胱胺组的24 h甲烷产量显著或极显著低于对照组(P<0.05或P<0.01)。
| 表3 半胱胺对体外发酵各组份产气量的影响 Table 3 Effects of cysteamine on GP of each component of in vitro fermentation |
| 表4 半胱胺对体外发酵氨态氮、微生物蛋白质浓度的影响 Table 4 Effects of cysteamine on the concentrations of ammonia nitrogen and microbial protein of in vitro fermentation |
| 表5 半胱胺对体外发酵挥发性脂肪酸浓度的影响 Table 5 Effects of cysteamine on the concentrations of volatile fatty acids of in vitro fermentation |
产气量作为综合反映饲料的可发酵程度的指标,它不仅能表现瘤胃中微生物活动的总体趋势,还能反映饲料蛋白营养价值的综合指标[11]。产气量的大小反映了饲草的可消化性的大小。它与饲料中有机物的降解程度呈正相关,饲料的可降解性越强,瘤胃中微生物的活性越高,产气量就越大,反之则越少。王全军等[12]研究饲粮中添加不同水平的半胱胺对山羊瘤胃微生物体外发酵特性的影响,结果表明,添加半胱胺可提高发酵总产气量,体外发酵总产气量比对照组提高了11.4%。本试验72 h累积产气量各组间差异不显著,但是随着半胱胺水平的增加,0~72 h累积产气量逐渐增加。本试验72 h累积产气量添加半胱胺组比对照组高,这与上述研究结果相一致。可消化有机物含量和代谢能是根据24 h累积产气量计算而得,它们与24 h累积产气量成正比关系,因而,这2个指标也是各组之间依次增加。半胱胺添加水平为0.8%时,可消化有机物含量和代谢能这2个指标最高。产气量中快速降解部分产气量、慢速降解部分产气量、潜在产气量及产气速率常数各组间无显著差异。
| 表6 半胱胺对体外发酵甲烷产量的影响 Table 6 Effects of cysteamine on methane production of in vitro fermentation mmol/L |
氨态氮是瘤胃内饲料肽、氨基酸、蛋白质、尿素、氨化物及其他非蛋白氮化合物分解的终产物,同时也是瘤胃微生物合成蛋白质的主要原料[13]。瘤胃中氨态氮的浓度过高或过低都不利于微生物的生长繁殖,因此保持瘤胃液中最适氨态氮浓度是保证微生物蛋白合成的首要条件。王子荣等[14]研究饲粮中添加半胱胺饲喂装有瘤胃瘘管的山羊对瘤胃消化代谢的影响,结果表明,山羊食入半胱胺8 d后,氨态氮浓度上升了18.13%。王子荣等[15]研究包膜半胱胺投入装有瘤胃瘘管的水牛瘤胃中对其消化代谢的影响,结果表明,投入半胱胺3 d时,氨态氮浓度升高了13.22%。本试验添加半胱胺对氨态氮没有显著影响。但是添加半胱胺的试验组氨态氮浓度比对照组高,这与上述研究结果相一致。
微生物蛋白是反刍动物最主要的氮源供应者,能提供蛋白需要的40%~80%。微生物蛋白浓度的大小反映了微生物利用氨态氮的能力;微生物蛋白的浓度也间接地反应了培养体系中微生物种群的数量。徐军等[16]研究饲粮中添加半胱胺饲喂装有瘤胃瘘管的辽宁绒山羊对瘤胃环境的影响,结果表明,添加半胱胺的试验组总蛋白浓度较对照组提高了22.76%,且差异显著,该研究表明添加半胱胺后可改变瘤胃内环境,有利于瘤胃微生物蛋白的合成。沈向真等[17]研究半胱胺投入装有瘤胃瘘管的水牛瘤胃中对水牛瘤胃消化代谢的影响,结果表明,投入半胱胺对瘤胃代谢有显著的促进作用,投入3 d时,微生物蛋白浓度半胱胺组比对照组高21.43%,差异显著。本试验中,添加半胱胺的各组的微生物蛋白浓度都比对照组的高,且0.8%半胱胺组显著高于其余各组,这与上述研究结果相一致。
瘤胃碳水化合物发酵的主要产物是乙酸、丙酸和丁酸等挥发性脂肪酸。它们是反刍动物主要的能量来源及合成乳脂和体脂的原料。挥发性脂肪酸的产量及其比例可显著影响反刍动物对营养物质的吸收、利用和生产能力的发挥。王子荣等[14]研究饲粮中添加半胱胺饲喂装有瘤胃瘘管的山羊对瘤胃消化代谢的影响,结果表明,饲喂半胱胺总挥发性脂肪酸浓度提高了18.86%,乙酸浓度提高了2.05个百分点,丙酸浓度降低了2.45个百分点,乙酸/丙酸由4.87上升到5.84。本试验添加半胱胺对乙酸浓度没有显著性影响,0.8%半胱胺组乙酸浓度最高;随着半胱胺添加水平的增加,丙酸浓度有不同程度的降低;而乙酸/丙酸有不同程度的增加,其中0.6%半胱胺组可显著增加乙酸/丙酸,这与上述研究结果相一致。本试验中总挥发性脂肪酸浓度没有显著变化,这与上述研究结果稍有不同,可能是试验动物品种不同造成的。
瘤胃有机物发酵产生的产物之一便是甲烷。瘤胃内甲烷的生成不仅造成能量损失,还造成温室效应。它增加温度的潜力是二氧化碳的62倍[18]。已有研究结果显示,添加半胱胺能增加脂肪酸含量,如梁贤威等[4]用半胱胺饲喂泌乳水牛,结果表明,饲粮中添加半胱胺可提高水牛奶中乳脂CLA的含量。韩正强[19]研究添加半胱胺对山羊肌内CLA含量与脂肪酸组成的影响,结果表明,半胱胺能够有效提高羊肉中CLA含量,半胱胺处理组半腹肌肌内脂肪中CLA含量与对照组相比增加26.5%。邱会政[20]探讨半胱胺对大鼠组织中脂肪酸组成的影响的,结果表明,与对照组相比,半胱胺处理组大鼠肝脏组织中饱和脂肪酸C14∶ 0的相对含量提高,不饱和脂肪酸C18∶ 1、C18∶ 2、亚麻酸(C18∶ 3)相对含量也有提升;半胱胺组大鼠半犍肌内脂肪酸C14∶ 0的相对含量显著升高,C18∶ 2的相对含量显著升高;半胱胺还可以提高背长肌中不饱和脂肪酸C18∶ 1的相对含量。
添加脂肪酸能抑制瘤胃甲烷的产生。长链脂肪酸特别是长链不饱和脂肪酸可有效抑制甲烷的产生。主要的机制是:长链脂肪酸对瘤胃微生物和饲料颗粒有包被作用,可影响微生物对饲料的降解;另一方面,不饱和脂肪酸在瘤胃中的氢化作用,可造成产甲烷过程所需的氢减少,结果导致瘤胃中甲烷产量的减少[21]。并且,添加脂肪酸对瘤胃微生物有毒害作用,使微生物的活性和数量减少,从而使瘤胃甲烷产量降低。Lovett等[22]和Machmüller等[23]报道,饲粮补充脂肪使瘤胃液中的原虫数量显著减少。由于脂肪的生物氢化作用及对甲烷菌和原虫的毒害作用[24],在反刍动物饲料中添加脂肪被认为是抑制甲烷生成的自然而有效的手段[25]。张春梅等[1]研究添加亚油酸与亚麻酸不同比例混合物对瘤胃发酵和甲烷生成的影响,结果表明,与未添加脂肪酸组相比,所有添加脂肪酸组的甲烷产量均显著降低。李玉珠等[2]研究饲粮中添加中链脂肪酸对体外发酵甲烷产量的影响,结果表明,与不添加酸的对照相比,添加脂肪酸能显著抑制甲烷产量。孙德成等[26]研究脂肪酸添加剂对奶牛瘤胃甲烷的影响,结果表明,饲粮中每天添加150~200 g/头复合脂肪酸,显著降低奶牛的甲烷释放量。
本试验中添加0.4%、0.6%、0.8%和1.0%的半胱胺,可使发酵6、12和24 h甲烷产量显著减少。添加半胱胺的各试验组甲烷产量均比对照组要低,也说明具有增加脂肪酸含量作用的半胱胺,同时也具有降低甲烷产量的作用。这与上述研究结果相一致。
体外产气法测定半胱胺添加水平为0.8%时能很好地促进水牛瘤胃微生物发酵和降低甲烷产量。
| [1] | 张春梅, 易贤武, 苑志朋, 等.富含十八碳不饱和脂肪酸的植物油对体外瘤胃发酵和甲烷生成的影响[J]. 畜牧与兽医, 2009, 41(12):16-19. ( 2) 2)
|
| [2] | 李玉珠, 刘发央, 龙瑞, 等.中链脂肪酸对体外发酵甲烷产量的影响[J]. 家畜生态学报, 2007, 28(1):52-54. ( 2) 2)
|
| [3] | 张春梅, 易贤武, 苑志朋, 等.添加不同比例的亚油酸和亚麻酸对体外瘤胃发酵和甲烷生成的影响[J]. 动物营养学报, 2008, 20(2):223-227. ( 1) 1)
|
| [4] | 梁贤威, 韦升菊, 卢雪芬, 等.半胱胺对水牛乳脂脂肪酸组成的影响[J]. 畜牧与兽医, 2012, 44(8):40-42. ( 2) 2)
|
| [5] | MAURICIO R M, MOULD F L, DHANOA M S, et al.A semi-automated in vitro gas production technique for ruminant feedstuff evaluation[J]. Animal Feed Science and Technology, 1999, 79(4):321-330. ( 1) 1)
|
| [6] | THEODOROU M K, WILLIAMS B A, DHANOA M S, et al.A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feed[J]. Animal Feed Science and Technology, 1994, 48(3/4):185-197. ( 1) 1)
|
| [7] | MENKE K H, RAAB L, SALEWSKI A, et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1):217-222. ( 1) 1)
|
| [8] | MENKE K H, STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28:7-55. ( 2) 2)
|
| [9] | SEARLE P L.The berthelot or indophenol reaction and its use in the analytical chemistry of nitrogen:a review[J]. The Analyst, 1984, 109(5):549-568. ( 1) 1)
|
| [10] | 冯宗慈, 高民.通过比色法测定瘤胃液氨态氮含量方法的改进[J]. 内蒙古畜牧科学, 1993(4):40-41. ( 1) 1)
|
| [11] | 王丽凤.日粮中添加甲烷抑制剂对绵羊瘤胃中甲烷产量影响的研究[D]. 硕士学位论文.呼和浩特:内蒙古农业大学, 2004. ( 1) 1)
|
| [12] | 王全军, 毛胜勇, 张红霞, 等.半胱胺对山羊瘤胃微生物体外发酵的影响[J]. 华中农业大学学报, 2002, 21(6):535-539. ( 1) 1)
|
| [13] | 沈美英.日粮内不同粗饲料品质对绵羊瘤胃发酵功能和微生物区系的影响[D]. 硕士学位论文.呼和浩特:内蒙古农业大学, 2006. ( 1) 1)
|
| [14] | 王子荣, 胥清富, 任明强, 等.半胱胺对山羊瘤胃消化代谢的影响[J]. 草食家畜, 2002, 12(4):42-45. ( 2) 2)
|
| [15] | 王子荣, 任明强, 胥清富, 等.包膜半胱胺对水牛瘤胃消化代谢的影响[J]. 新疆农业大学学报, 2002, 25(2):42-47. ( 1) 1)
|
| [16] | 徐军, 于长江, 孙运刚, 等.半胱胺对绒山羊瘤胃及盲肠内环境的影响[J]. 中国饲料, 2010(7):26-28. ( 1) 1)
|
| [17] | 沈向真, 朱祖康, 陆天水, 等.海南霉素和半胱胺对水牛瘤胃消化代谢与增重的影响[J]. 江苏农业科学, 2003(5):78-82. ( 1) 1)
|
| [18] | MOSS A R, JOUANY J P, NEWBOLD J, et al.Methane production by ruminants:its contribution to global warming[J]. Annalesde Zootechnie, 2000, 49(3):231-253. ( 1) 1)
|
| [19] | 韩正强.半胱胺和海南霉素对山羊肌内共轭亚油酸含量与脂肪酸组成的影响及其机理研究[D]. 硕士学位论文.南京:南京农业大学, 2006. ( 1) 1)
|
| [20] | 邱会政.半胱胺对大鼠组织中脂肪酸组成的影响的及其机理研究[D]. 硕士学位论文.南京:南京农业大学, 2009. ( 1) 1)
|
| [21] | 刘亮.体外法研究苹果酸和十八碳脂肪酸对瘤胃脂肪酸代谢及甲烷产量的影响[D]. 硕士学位论文.北京:中国农业科学院, 2008. ( 1) 1)
|
| [22] | LOVETT D, LOVELL S, STACK L, et al.Effect of forage:concentrate ratio and dietary coconut oil level on methane output and performance of finishing beef heifers[J]. Livestock Production Science, 2003, 84(2):135-146. ( 1) 1)
|
| [23] | MACHMVLLER A, SOLIVA C R, KREUZER M.Effect of coconut oil and defaunation treatment on methanogenesis in sheep[J]. Reproduction Nutrition Development, 2003, 43(1):41-55. ( 1) 1)
|
| [24] | BROUDISCOU L, VAN NEVEL C J, DEMEYER D I, et al.Incorporation of soya oil hydrolysate in the diet of defaunated or refaunated sheep:effect of rumen fermentation in vitro[J]. Archives of Animal Nutrition Archiv fÜr Tierernhrung, 1990, 40(4):329-337. ( 1) 1)
|
| [25] | SPEARS J W.Beef nutrition in the 21st century[J]. Animal Feed Science and Technology, 1996, 581/2):29-35.( 1) 1)
|
| [26] | 孙德成, 赵智力, 魏曼琳, 等.脂肪酸添加剂对奶牛瘤胃挥发性脂肪酸和甲烷的影响[J]. 畜牧与兽医, 2008, 40(11):21-24. ( 1) 1)
|




