2. 广西大学动物科学技术学院, 南宁 530005
2. Animal Science and Technology College, Guangxi University, Nanning 530005, China
方格星虫(Sipunculus nudus Linnaeus),隶属于星虫动物门,多分布于我国低纬度海域,以北部湾地区最盛[1],是广西盛产的海珍品种之一,也是我国重要的渔业资源之一。由于方格星虫肉质脆嫩、味道鲜美,营养和药用价值高,素有海里的“冬虫夏草”美誉。近年来,随着广西海洋研究所方格星虫人工育苗技术的突破,开始掀起了方格星虫养殖的热潮。目前,已有学者针对方格星虫的营养需求在糖水平[2]、糖源[3]、脂肪水平[4]、蛋白质水平[5, 6]等方面做了相关研究,但有关方格星虫稚虫饲料适宜糖脂比的研究尚未见报道。
水产动物营养中一般是由饲料蛋白质水平带来最佳生长率,而人工配合饲料的可用性又要从经济方面来考虑。由于当前国际上鱼粉价格日益飙升,饲料蛋白质源愈来愈昂贵,而相对价格低廉的饲料糖源和脂肪源又具有节约蛋白质源的作用,结合这2个方面,在饲料中添加适当水平的非蛋白质能量来源(糖类、脂肪)是非常可行的。此外,这2种能量来源还能提高饲料中蛋白质的利用率[7]。然而,很多水产动物人工配合饲料都具有最适糖水平和最适脂肪水平,方格星虫的最适糖水平为18.52%[2],最适脂肪水平为8.70%[4],过低或过高的饲料糖水平和脂肪水平都不利于方格星虫的成长,找出最适糖脂比对设计科学合理的方格星虫稚虫人工配合饲料具有重大意义。因此,本试验是在已有研究的基础上,通过研究饲料糖脂比对方格星虫稚虫生长、 体成分和消化酶活性的影响,确定方格星虫稚虫饲料中适宜的糖脂比。
以白鱼粉、酪蛋白为蛋白质源,糊化玉米淀粉 为糖源,鱼油为脂肪源,褐藻酸钠为微黏合剂,调节饲料中糊化玉米淀粉和鱼油的比例依次配制成糖脂比为0.68、1.02、1.62、2.61、4.35的等氮等能饲料(表1)。所有固体原料被粉碎后,严格按照配方中设定比例混合拌匀,然后与鱼油和水充分混匀,将混匀的混合物制粒,置于45 ℃烘箱中20 min后过筛,制成150目的微颗粒饲料[8],标号装袋备用。
| 表1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) % |
养殖试验于2012年8—10月在广西海洋研究所海水增养殖试验基地进行。试验所用方格星虫稚虫取自广西海洋研究所自主研发培育的同批人工孵化苗种。正式试验前先驯养,将5种试验饲料混合后投喂试验用方格星虫稚虫14 d,使之逐渐适应试验饲料和养殖环境。驯养结束后,挑选出体格健壮、体重[(16.77±0.40)mg]相近的方格星虫稚虫,随机分成5组,每组3个重复,分配于15个底层铺沙(沙厚为3~4 cm)的水槽(65 cm×55 cm×45 cm)中,每个水槽放养400条。每天换水2次(08:30和17:30),每次换水约1/3。每次换水0.5 h后开始投喂,采用稍过量投喂,保持底层沙表面有少量剩饵,每周彻底清理试验水槽1次,养殖试验持续8周。养殖所用海水经室外蓄水池沉淀,2级砂滤池过滤,进水槽前再经250目滤袋过滤。试验期间,连续充气,采用自然光照周期,水温维持在26~30 ℃,盐度维持在18~22,溶解氧大于5.0 mg/L。
饲养试验结束后,将方格星虫稚虫以重复为单位转移至水深为10~15 cm、底部无沙的水槽内2~3 d进行吐沙,待其消化道内沙子完全排净之后,收集各水槽中的方格星虫稚虫,称重并记录存活数,用于计算各组稚星虫的成活率(survival rate,SR)、增重率(weight gain rate,WGR)及特定生长率(specific gain rate,SGR)。
成活率(%)=100×Nt/N0; 增重率(%)=100×(Wt-W0)/W0; 特定生长率(%/d)=100×(lnWt-lnW0)/t。式中:N0为初始条数;Nt为终末条数;W0为初始体重;Wt为终末体重;t为试验天数。
每个重复取100条方格星虫稚虫用于体成分的测定。采用AOAC(1995)[9]的方法分析测定方格星虫稚虫的体成分,具体为:采用105 ℃烘箱恒重干燥法测定水分含量;采用凯氏定氮法(Kjeltec 8400,Sweden)测定粗蛋白质含量;采用索氏抽提法(Soxtec 2050,Switzerland)测定粗脂肪含量;采用550 ℃高温灼烧法测定粗灰分含量。
每个重复取30条方格星虫稚虫用于消化酶活性的测定。因为方格星虫稚虫过小,肠道组织不易收集,消化酶活性的测定采用方格星虫稚虫整体匀浆法。所有待测样品在分析前均放在4 ℃冰箱中解冻,解冻后的鲜样按1∶ 1的比例加入pH=7的磷酸盐缓冲液,置于玻璃匀浆器内匀浆,匀浆液于4 ℃条件下3 000 r/min 离心10 min,取上清液作为待测酶液。蛋白酶活性采用福林-酚法测定,脂肪酶和淀粉酶活性采用南京建成生物工程研究所生产的试剂盒测定。以牛血清蛋白作为标准,用考马斯亮蓝法测定酶液中蛋白质含量。酶活性单位用比活力(U/mg prot)表示。
试验数据采用“平均值±标准误”表示。采用SPSS 15.0软件进行统计分析,若差异达到显著水平(P<0.05),则进行Tukey’s多重比较。
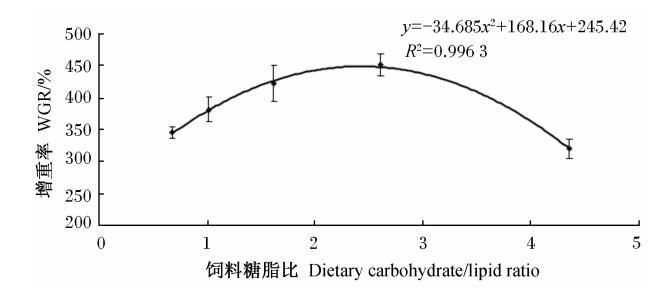
由表2可知,饲料糖脂比对方格星虫稚虫的成活率无显著影响(P>0.05),各组方格星虫稚虫的成活率相差不大。饲料糖脂比对方格星虫稚虫的增重率和特定生长率有显著影响(P<0.05)。其中,糖脂比为2.61(糖含量为20.64%,粗脂肪含量为7.92%)的组方格星虫稚虫的增重率和特定生长率最高,显著高于糖脂比为0.68(糖含量为10.48%,粗脂肪含量为15.43%)和4.35(糖含量为24.56%,粗脂肪含量为5.64%)的组(P<0.05)。通过回归分析(图1),增重率与饲料糖脂比之间存在二次曲线关系,增重率(y)与饲料糖脂比(x)的回归方程为:y=-34.685x2+168.16x+245.42(R2=0.996 3)。由回归方程可知,饲料糖脂比为2.42时能获得最大的增重率。
| 表2 饲料糖脂比对方格星虫稚虫生长的影响 Table 2 Effects of dietary carbohydrate/lipid ratio on growth of juvenile peanut worm, Sipunculus nudus Linnaeus |
|
图1 饲料糖脂比与方格星虫稚虫增重率的回归分析 Fig 1 Regression analysis between dietary carbohydrate/lipid ratio and WGR of juvenile peanut worm, Sipunculus nudus Linnaeus |
由表3可知,饲料糖脂比对虫体水分、粗蛋白质和粗脂肪含量均有显著影响(P<0.05),而对虫体粗灰分含量无显著影响(P>0.05)。虫体水分和粗蛋白质含量均随着饲料糖脂比的增大而增加,均在饲料糖脂比为4.35时达到最大值,且水分含量显著高于饲料糖脂比为0.68和1.02(糖含量为13.27%,粗脂肪含量为13.02%)时(P<0.05),粗蛋白质含量显著高于饲料糖脂比为0.68时(P<0.05)。虫体粗脂肪含量随着饲料糖脂比的增大而降低(P<0.05),当糖脂比为4.35时,粗脂肪含量最低,仅为2.95%,并显著低于饲料糖脂比为0.68和1.02时(P<0.05)。
| 表3 饲料糖脂比对方格星虫稚虫体成分的影响 Table 3 Effects of dietary carbohydrate/lipid ratio on body composition of juvenile peanut worm, Sipunculus nudus Linnaeus % |
由表4可知,饲料糖脂比对方格星虫稚虫蛋白酶活性无显著影响(P>0.05)。随着饲料糖脂比的增大,方格星虫稚虫淀粉酶活性呈先升后降的趋势,在饲料糖脂比为2.61时达到最高值(1.71 U/mg prot),显著高于饲料糖脂比为0.68时。方格星虫稚虫脂肪酶活性随着饲料糖脂比的增大而降低,当糖脂比为4.35时,脂肪酶活性最低,仅为1.07 U/mg prot,并显著低于饲料糖脂比为0.68和1.02时(P<0.05)。
| 表4 饲料糖脂比对方格星虫稚虫消化酶活性的影响 Table 4 Effects of dietary carbohydrate/lipid ratio on digestive enzyme activities of juvenile peanut worm, Sipunculus nudus Linnaeus U/mg prot |
Johnston等[10]用4种不同糖脂比(0.8、2.0、4.8和17.4)的饲料喂养红岩龙虾(Jasus edwardsii)84 d后发现各组龙虾的增重率显著不同,饲料糖脂比为2.0(糖含量27.00%,粗脂肪含量13.50%)的试验组的增长率显著高于其他各组。Erfanullah等在对3种鲤科鱼类(Catla catla、Labeo rohita和Cirrhinus mrigala)[11]及蟾胡子鲶(Clarias batrachus)[12]的研究中发现,饲料糖脂比可以显著影响试验鱼的增重率和特定生长率。当饲料糖脂比由0.02上升到8.93时,3种鲤科鱼类的增重率和特定生长率均显著不同,并呈先增后降的趋势[11]。随着饲料糖脂比的增大,蟾胡子鲶的增重率和特定生长率也呈先增后降的趋势,且二者均在糖脂比为3.38时达到最大[12]。这一现象在其他学者对瓦氏黄颡鱼(Pelteobagrus vachelli)幼鱼[13]上的研究中也同样出现。本试验中,方格星虫稚虫的增重率和特定生长率随着饲料糖脂比的增大先升高后降低,与在其他水产动物上的研究得到的结论是一致的。
已有研究表明,采用适宜糖脂比的饲料饲养鱼类,有利于充分利用饲料中的脂肪和糖类并产生协同效应[14],从而提高饲料效率[15]。此外,Cowey等[16]对鲽鱼(Pleuronectes platessa)的研究表明,饲料同时添加糖类和脂肪比单纯只添加脂肪更有利于鲽鱼的生长。本研究中所使用的方格星虫稚虫饲料差异主要在非蛋白质能量来源上,8周后各组之间生长状况显著不同,这表明方格星虫稚虫对不同糖脂比的饲料适应能力不同。从各组的增重率和特定生长率来看,方格星虫稚虫能适应饲料糖水平的增高,并将这种适应能力体现在增重率和特定生长率上,这与蟾胡子鲶[12]、瓦氏黄颡鱼[13]以及罗非鱼(Tilapia zilli)[17]的适应能力相似。另外,由于方格星虫是通过吞食沙子及黏附于沙子表面的饲料来获取营养的,并且方格星虫稚虫的吻部较短,因此对饲料粉碎度的要求极高。而低糖脂比饲料中过高的脂肪含量使饲料成形困难,在投喂过程中饲料颗粒不能均匀分散在水中,在等量投喂的情况下,观察到低糖脂比(糖脂比为0.68和1.02)饲料的2个组沙子表面出现未食用的残饵的量比其他组多。已有研究表明方格星虫饲料的最适脂肪含量为8.70%[4],而最高糖脂比饲料的脂肪含量仅为5.64%,其低增重率和特定生长率可能与饲料中必需脂肪酸的供应有限相关[4]。另外,低糖脂比中所含的脂肪水平和高糖脂比饲料中所含的脂肪水平均分别高于最适脂肪水平和最适糖水平,方格星虫利用这2种非蛋白质能量来源的能力有限,并且高糖水平和高脂肪水平都将影响饲料的适口性,这可能也是低糖脂比和高糖脂比组方格星虫稚虫生长状况较差的原因之一。
Erfanullahd等[12]在蟾胡子鲶的研究中发现,不同糖脂比的饲料对鱼体干物质、粗蛋白质和粗脂肪含量均有显著影响。随着饲料中糖脂比的升高,鱼体粗蛋白质含量显著升高,干物质和粗脂肪含量显著降低[12]。本试验中,方格星虫稚虫的水分(干物质含量与水分含量成反比)和粗蛋白质含量均随着饲料糖脂比的增大而增加,而粗脂肪含量则随着糖脂比的增大而减少,与上述研究结果类似。饲料中非蛋白质能量来源有节约蛋白质的作用,方格星虫稚虫粗蛋白质含量越高表明饲料中蛋白质的消化率越高。早在1995年,Kaushik[18]就通过研究发现鱼类(尤其是鲤科鱼类)比较善于利用饲料中的糖源作为能量来源。瓦氏黄颡鱼[13]、大菱鲆(Scophthalmus maximus L.)[19]、尖齿胡子鲶(Clarias gariepinus)[20]等鱼类全鱼粗脂肪含量也是随着饲料糖脂比的增大而降低。本研究中的结果与上述学者研究一致,饲料糖脂比和方格星虫稚虫虫体粗脂肪含量之间呈反比关系,降低饲料脂肪水平的同时增加饲料糖水平并未产生不良的脂肪堆积在虫体内,这说明在饲料等蛋白质水平下,方格星虫稚虫更适应高糖水平而非高脂肪水平。饲料糖脂比与方格星虫稚虫虫体粗脂肪含量的这种关系表明:相较于脂肪源,方格星虫稚虫更趋向于利用饲料中的糖源作为能量来源,并且饲料高脂肪水平比较容易导致方格星虫体内脂肪堆积[21]。
本试验共检测了方格星虫稚虫体内的蛋白酶、淀粉酶和脂肪酶3种消化酶活性。消化酶活性的高低往往能反映出生物体对该营养物质的消化吸收能力,虽然评判一种饲料的优劣并不完全由消化酶的活性来决定,但从消化酶活性的大小高低可以判断水产动物对饲料的适应性。饲料糖脂比的改变一方面是改变饲料中的脂肪水平,另一方面是改变饲料中糖水平,饲料糖脂比的改变意味着饲料糖水平和脂肪水平的同时变化。由表4可知,各组方格星虫稚虫的蛋白酶活性都比较高,且不随饲料糖脂比的变化发生显著变化。分析其原因可能在于,饲料中糖脂比虽变化,但是其2种非蛋白质能量来源互相补充,足以满足方格星虫稚虫的日常能量需求,并在一定程度上产生协同作用使得饲料中的蛋白质能充分被消化吸收。已有的研究报道了饲料糖水平对方格星虫稚虫的淀粉酶活性影响显著[2],而饲料脂肪水平对其淀粉酶活性并无显著影响[4]。本试验中,饲料糖脂比对方格星虫稚虫淀粉酶活性有显著的影响,且当饲料糖脂比为2.61时,其糖含量为20.64%,最接近方格星虫稚虫的最适糖水平(18.52%),该组淀粉酶活性最高,这种结果可能也是由饲料糖水平不同造成的。而脂肪酶活性方面,活性最高的组为糖脂比最低也就是脂肪含量最高的组,已有的研究表明饲料糖水平的改变对方格星虫稚虫的脂肪酶活性并无显著影响[2],因此影响它的可能是饲料中脂肪水平的改变[4]。Mohanta等[22]研究指出,饲料脂肪水平会对水产动物的脂肪酶活性产生显著影响。在对厚唇弱棘 的研究中发现,肠道脂肪酶活性会随着饲料脂肪水平的升高而显著增强[23],这也在方格星虫稚虫的研究中得到了证实[4]。当饲料中某种营养物质增加时,消化道内相应的消化酶往往会有适应性分泌,因此脂肪酶活性的升高很可能是方格星虫稚虫为适应高脂肪水平的饲料进行的自我调节,以更好的吸收饲料中的营养[24]。
① 以增重率为评价标准,方格星虫稚虫饲料中最适糖脂比为2.42。
② 在2种非蛋白质能量来源中,方格星虫稚虫更趋向于利用饲料糖作为能量来源,适当提高饲料糖脂比有利于提高虫体的蛋白质含量并降低虫体脂肪含量。
| [1] | 李凤鲁, 孔庆兰, 史贵田, 等.中国沿海方格星虫属(星虫动物门)的研究[J]. 青岛海洋大学学报, 1990, 20(1):93-99. ( 1) 1)
|
| [2] | 许明珠, 张琴, 童万平, 等.饲料糖水平对方格星虫稚虫生长、体组成和消化酶活性的影响[J]. 动物营养学报, 2013, 25(3):534-542. ( 4) 4)
|
| [3] | 许明珠.方格星虫对饲料中糖源利用研究[D]. 硕士学位论文.南宁:广西大学, 2013. ( 1) 1)
|
| [4] | 张琴, 童万平, 董兰芳, 等.饲料中脂肪水平对方格星虫稚虫生长性能、体组成及消化酶活性的影响[J]. 渔业科学进展, 2011, 32(6):99-106. ( 7) 7)
|
| [5] | 张琴, 童万平, 董兰芳, 等.饲料蛋白水平对方格星虫稚虫生长和体组成的影响[J]. 渔业科学进展, 2012, 33(1):86-92. ( 1) 1)
|
| [6] | 张琴, 童潼, 童万平, 等.饲料蛋白水平对方格星虫稚虫日增重和消化酶活性的影响[J]. 渔业现代化, 2012, 39(2):41-46. ( 1) 1)
|
| [7] | WILSON R P, HALVER J E.Protein and amino acid requirements of fishes[J]. Annual Reviews in Nutrition, 1986, 6:225-244. ( 1) 1)
|
| [8] | BLAIR T, CASTELL J, NELL S, et al.Evaluation of microdiets versus live feeds on growth, survival and fatty acid composition of larval haddock (Melanogrammus aeglefinus)[J]. Aquaculture, 2003, 225:451-461. ( 1) 1)
|
| [9] | AOAC.Official methods of analysis of official analytical Chemists international[S]. 16th ed.Arlington, V.A.:Association of Official Analytical Chemists, 1995. ( 1) 1)
|
| [10] | JOHNSTON D J, CALVERT K A, CREAR B J, et al.Dietary carbohydrate/lipid ratios and nutritional condition in juvenile southern rock lobster, Jasus edwardsⅡ[J]. Aquaculture, 2003, 220:667-682. ( 1) 1)
|
| [11] | ERFANULLAH, JAFRI A K.Growth rate, feed conversion, and body composition of Catla catla, Labeo rohita, and Cirrhinus mrigala fry fed diets of various carbohydrate-to-lipid ratios[J]. Journal of the World Aquaculture Society, 1998, 29(1):84-91. ( 2) 2)
|
| [12] | ERFANULLAH, JAFRI A K.Effect of dietary carbohydrate-to-lipid ratio on growth and body composition of walking catfish (Clarias batrachus)[J]. Aquaculture, 1998, 161(14):159-168. ( 5) 5)
|
| [13] | 张世亮.饲料中糖结构、糖水平及糖脂比对瓦氏黄颡鱼幼鱼生长及糖代谢的影响[D]. 硕士学位论文.青岛:中国海洋大学, 2011. ( 3) 3)
|
| [14] | GAO W, LIU Y J, TIAN L X, et al.Effect of dietary carbohydrate-to-lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2010, 16(3):327-333. ( 1) 1)
|
| [15] | GARLING JR D L, WILSON R P.Effects of dietary carbohydrate-to-lipid ratios on growth and body composition of fingerling channel catfish[J]. The Progressive Fish-Culturist, 1977, 39:43-47. ( 1) 1)
|
| [16] | COWEY C B, ADRON J W, BROWN D A, et al.Studies on the nutrition of marine flatfish.The metabolism of glucose by plaice (Pleuronectes platessa) and the effect of dietary energy source on protein utilization in plaice[J]. British Journal of Nutrition, 1975, 33:219-231. ( 1) 1)
|
| [17] | EL-SAYED A M, GARLING D L, Jr.Carbohydrate-to-lipid ratios in diets for Tilapia zillⅡ fingerlings[J]. Aquaculture, 1988, 73:157-163. ( 1) 1)
|
| [18] | KAUSHIK S J.Nutrient requirements, supply and utilization in the context of carp culture[J]. Aquaculture, 1995, 129:225-241. ( 1) 1)
|
| [19] | 马爱军, 陈四清, 雷霁霖, 等.饲料中主要能量物质对大菱鲆幼鱼生长的影响[J]. 海洋与湖沼, 2001, 32(5):527-533. ( 1) 1)
|
| [20] | ALI M Z, JAUNCEY K.Optimal dietary carbohydrate to lipid ratio in African catfish Clarias gariepinus (Burchell 1822)[J]. Aquaculture International, 2004, 12(2):169-180. ( 1) 1)
|
| [21] | HU Y H, LIU Y J, TIAN L X, et al.Optimal dietary carbohydrate to lipid ratio for juvenile yellowfin seabream (Sparus latus)[J]. Aquaculture Nutrition, 2007, 13(4):291-297. ( 1) 1)
|
| [22] | MOHANTA K N, MOHANTY S N, JENA J K, et al.Optimal dietary lipid level of silver barb, Puntius gonionotus fingerlings in relation to growth, nutrient retention and digestibility, muscle nucleic acid content and digestive enzyme activity[J]. Aquaculture Nutrition, 2008, 14(4):350-359. ( 1) 1)
|
| [23] | 宋理平, 韩勃, 冒树泉, 等.脂肪水平对厚唇弱棘鯻生长及肠道脂肪酶活性的影响[J]. 广东海洋大学学报, 2010, 30(1):13-17. ( 1) 1)
|
| [24] | GANGADHARA B N, EESHA M C, VARGHESE T J, et al.Effect of varying protein and lipid levels on the growth of rohu, Labeo rohita[J]. Asian Fisheries Society, 1997, 10(2):139-147. ( 1) 1)
|



