维生素D3经肝脏、肾脏代谢后的主要活性形式为1,25-二羟维生素D3[1,25(OH)2D3],有重要生理活性[1]。研究表明,1,25(OH)2D3不仅参与钙、磷代谢和骨质钙化,还参与调节细胞的生长分化等过程,对机体的非钙调效应十分广泛,如调节免疫[2, 3, 4]。研究显示,抗原呈递细胞(APCs)和激活的淋巴细胞均能合成维生素D受体(vitamin D receptor,VDR),1,25(OH)2D3通过VDR的介导,作用于树突状细胞(dendritic cell,DC)和T细胞,抑制致病性效应T细胞,诱导调节性T细胞和细胞因子产生,从而调控机体的免疫反应[2, 5]。近年来,维生素D3调控免疫功能的作用已成为国外低分子药物研究的热点之一,但其研究多集中于体外试验,且国内对维生素D3的研究报道甚少[4, 6, 7]。为此,本试验旨在考察维生素D3对丝毛乌鸡组织细胞因子白细胞介素2(IL-2)和白细胞介素18(IL-18)基因相对表达量的影响,以期为生产应用积累资料。
试验选用120只丝毛乌鸡,随机分为5个处理,每个处理4个重复,每个重复6只鸡。对照处理饲喂基础饲粮,各试验处理分别饲喂在基础饲粮中添加0、800、1 600、3 200和6 400 IU/kg维生素D3的试验饲粮。常规笼养6周。每个处理选择接近该处理平均体重、健康的乌鸡4只,脱臼致死,剖腹,采集胸腺、十二指肠、空肠、回肠、盲肠和法氏囊各1~2 g,用剪刀剪成50~100 mg大小的组织块,用焦碳酸二乙酯(DEPC)水配制成的生理盐水洗去表面血液,放入2 mL冻存管,标记,液氮速冻,-70 ℃冰箱保存。从杀鸡到组织样品投入液氮速冻,整个过程在20 min内完成。
根据GenBank中鸡的β-肌动蛋白(内参基因)、IL-2和IL-18基因序列,利用Primer Premier 5.0软件设计引物,引物序列及参数见表1,通过NCBI中Blast功能,初步检测引物的特异性。引物由大连宝生物工程有限公司合成。
| 表1 引物序列及参数
Table 1 Primer sequences and parameters
|
采集的组织样品cDNA的获得、IL-2和IL-18基因的荧光定量PCR均采用文献[6]的方法进行。
数据处理亦采用文献[6]的方法进行。基因相对表达量用2-ΔΔCt法表示。
由图1可见,随着饲粮维生素D3添加水平的提高,IL-2基因的相对表达量先升高,在1 600 IU/kg时达峰值,随后有所下降,6 400 IU/kg再略有升高。随着饲粮维生素D3添加水平的提高,IL-18基因的相对表达量的变化幅度较大,在6 400 IU/kg时达峰值。
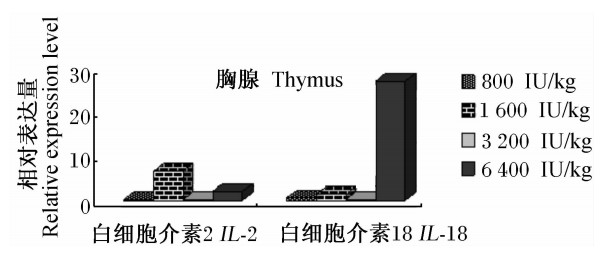 | 图1 维生素D3对丝毛乌鸡胸腺的组织IL-2和IL-18基因相对表达量的影响 Fig.1 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in thymic tissue of Silky fowls |
由图2可见,随着饲粮维生素D3添加水平的提高,IL-2和IL-18基因在丝毛乌鸡十二指肠组织中的相对表达量均呈现在800~3 200 IU/kg时逐渐下降,在6 400 IU/kg再次升高,但是达峰值的饲粮维生素D3添加水平不同,IL-2基因相对表达量出现在6 400 IU/kg,IL-18基因相对表达量出现在3 200 IU/kg。
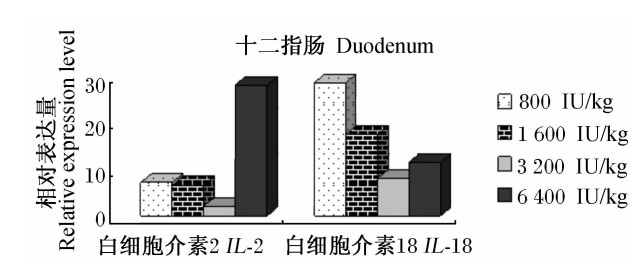 | 图2 维生素D3对丝毛乌鸡十二指肠的组织IL-2和IL-18基因相对表达量的影响 Fig.2 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in duodenal tissue of Silky fowls |
由图3可见,随着饲粮维生素D3添加水平的提高,IL-2基因在丝毛乌鸡空肠组织中的相对表达量先升高后降低,IL-18基因在丝毛乌鸡空肠组织中的相对表达量则呈现非添加量依赖性的波动。IL-2和IL-18基因在空肠组织的相对表达量较低,6 400 IU/kg的维生素D3对IL-2和IL-18基因在空肠中的相对表达量均不存在上调作用。
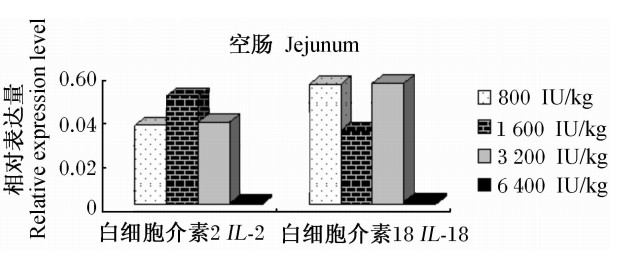 | 图3 维生素D3对丝毛乌鸡空肠的组织IL-2和IL-18基因相对表达量的影响 Fig.3 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in jejunal tissue of Silky fowls |
由图4可见,随着饲粮维生素D3添加水平的提高,IL-2基因在丝毛乌鸡回肠组织中的相对表达量逐渐降低,整体数值均较低。随着饲粮维生素D3添加水平的提高,IL-18基因相对表达量呈快速下降趋势,但6 400 IU/kg时呈高表达态势。
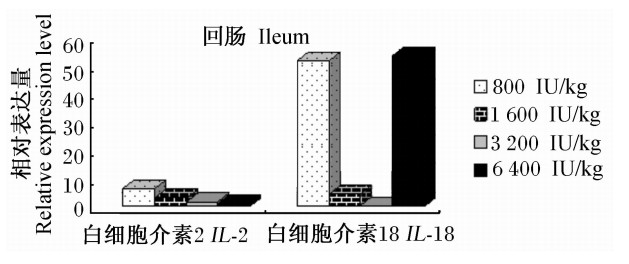 | 图4 维生素D3对丝毛乌鸡回肠的组织IL-2和IL-18基因相对表达量的影响 Fig.4 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in iliac tissue of Silky fowls |
由图5可见,IL-2和IL-18基因在丝毛乌鸡盲肠组织中的相对表达量随着饲粮维生素D3添加水平的提高呈逐渐上升态势。6 400 IU/kg维生素D3能够上调IL-2基因在盲肠组织中的相对表达量;3 200和6 400 IU/kg维生素D3均能使IL-18基因在盲肠组织中的相对表达量大幅度上调。
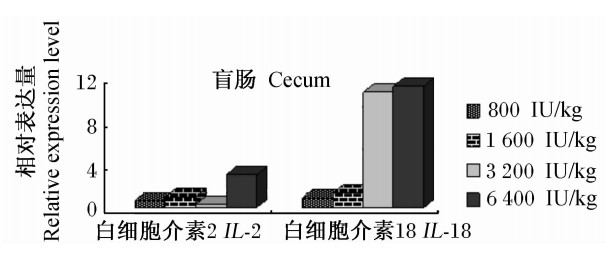 | 图5 维生素D3对丝毛乌鸡盲肠的组织IL-2和IL-18基因相对表达量的影响 Fig.5 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in cecaltissue of Silky fowls |
由图6可见,随着饲粮维生素D3添加水平的提高,IL-2基因在丝毛乌鸡法氏囊组织中的相对表达量在3 200 IU/kg时大幅上调,在6 400 IU/kg时略有降低;IL-18基因的相对表达量呈逐渐升高的趋势。3 200和6 400 IU/kg维生素D3能使IL-2基因在法氏囊组织中的相对表达量大幅度上调;6 400 IU/kg维生素D3能使IL-18基因在法氏囊组织中的相对表达量上调。
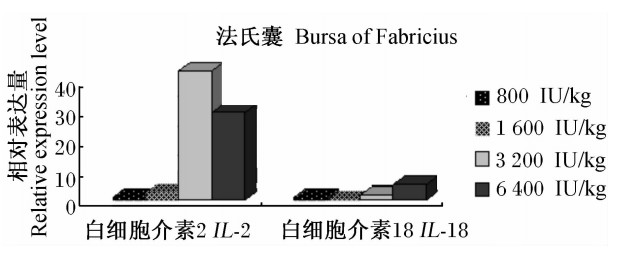 | 图6 维生素D3对丝毛乌鸡法氏囊的组织IL-2和IL-18基因相对表达量的影响 Fig.6 Effects of vitamin D3 on the relative expression levels of IL-2 and IL-18 genes in bursa of Fabricius tissue of Silky fowls |
IL-18主要由单核巨噬细胞系的细胞分泌,具有多种生物学功能[8],除能够诱导辅助性T细胞1(Th1)、自然杀伤细胞(NK)、自然杀伤T细胞(NKT)产生干扰素γ(IFN-γ)外,还可诱导诸如IL-2、肿瘤坏死因子a(TNF-α)等其他多种细胞因子的产生。另外,鸡IL-18可增强NK的活性,上调细胞毒作用,促进T细胞增殖,在诱导Th1的分化成熟过程和Th1为主的细胞免疫反应中具有促进和调节作用。本试验结果表明,维生素D3对丝毛乌鸡体内细胞因子IL-2和IL-18基因具有调节作用,但在不同组织中的作用不同;6 400 IU/kg维生素D3有助于IL-18基因在丝毛乌鸡胸腺、回肠、盲肠和法氏囊组织中的相对表达量的上调。
据报道,1,25(OH)2D3可抑制自身反应性T细胞的增殖和活化;减少T细胞分泌IL-18、IFN-γ等细胞因子;抑制巨噬细胞产生白细胞介素1(IL-1)、TNF-α、IFN-γ等[8, 9, 10]。CD4+ T细胞中Th1及其分泌的细胞因子IL-2、肿瘤坏死因子β(TNF-β)和IFN-γ参与细胞免疫为主的自身免疫性疾病,T辅助细胞2(Th2)和其分泌的细胞因子白细胞介素4(IL-4)、白细胞介素5(IL-5)、白细胞介素10(IL-10)和白细胞介素13(IL-13)在以抗体形成为主的体液免疫中起重要作用[10]。1,25(OH)2D3在体内和体外对Th1和Th2的细胞因子分泌的作用不同,能抑制单核细胞和B细胞分泌IL-12,而IL-12对Th1的活动和分化有重要作用。1,25(OH)2D3还能降低IL-2、IL-1和TNF-α的分泌,并诱导产生IL-10和IL-5。与影响其他免疫细胞和免疫产物一样,1,25(OH)2D3对细胞因子的影响有剂量依赖性。1,25(OH)2D3影响细胞因子分泌的最佳浓度为10-7~10-9 mol/L[11]。维生素D3能调节不同免疫细胞的细胞因子表达,且对不同细胞因子的调控不尽一致。本试验结果表明,维生素D3对IL-2基因的调控与IL-18基因不同;高剂量维生素D3有助于IL-2基因在十二指肠、法氏囊和盲肠的相对表达量的上调,但对其在胸腺、空肠和回肠中的表达无上调作用;维生素D3对IL-2和IL-18基因的调控与其添加水平相关,且对不同组织存在诱导差异。
研究证实,1,25(OH)2D3通过细胞因子基因下游的转录调控该细胞因子,活化T细胞核因子及核因子κB在其中具有重要作用[11]。IL-2、白细胞介素3(IL-3)、IL-4、TNF-α和IFN-γ等细胞因子基因下游的启动子都具有活化T细胞核因子(NFAT)元件,1,25(OH)2D3与VDR结合,影响启动子复合物的稳定性,从而抑制基因的转录[12]。本试验中维生素D3对细胞因子的诱导,可能也通过相似的调控途径,具体途径有待进一步验证。
据报道,1,25(OH)2D3及其类似物能抑制DC的成熟,使其处于未成熟状态,且对促使其成熟的刺激反应钝化,因此不能激活初始T细胞,使免疫反应不能继续[13]。在免疫应答和产生的免疫效应中,DC的成熟起关键作用。研究证实,将低浓度(10-12~10-8 mol/L)的1,25(OH)2D3和小鼠骨髓共同孵育,显著抑制了DC表达CD40等表面标志因子基因,并减少白细胞介素分泌,但不影响DC数量;较高浓度下,显著抑制DC产生[14, 15]。体内研究中,在VDR基因敲除的小鼠中,可见小鼠的皮下淋巴结明显增生,结内成熟DC显著增多,可以认为生理水平的1,25(OH)2D3抑制DC成熟;阻断1,25(OH)2D3和VDR的结合,可促进DC成熟。本试验中维生素D3对细胞因子基因相对表达量的影响可能也与DC细胞的成熟度相关。
① 6 400 IU/kg的维生素D3上调了IL-2基因在十二指肠、法氏囊和盲肠组织中的相对表达量,未见其在胸腺、空肠和回肠组织中的相对表达量上调。
② 6 400 IU/kg的维生素D3上调了IL-18基因在丝毛乌鸡胸腺、回肠、盲肠和法氏囊组织中的相对表达量。
③ 饲粮维生素D3添加水平与丝毛乌鸡体内IL-2和IL-18基因相对表达量相关,但作用存在组织差异。
| [1] | BONJOUR J P, CHEVALLEY T, FARDELLONE P.Calcium intake and vitamin D metabolism and action, in healthy conditions and in prostate cancer[J]. The British Journal of Nutrition, 2007, 97(4):611-616. ( 1) 1)
|
| [2] | BIKLE D.Nonclassic actions of vitamin D[J]. The Journal of Clinical Endocrinology and Metabolism, 2009, 94(1):26-34. ( 2) 2)
|
| [3] | 李思明, 欧阳玲花, 韦启鹏, 等.维生素D3的免疫功能及其对家禽免疫细胞和免疫因子的调节[J]. 动物营养学报, 2012, 24(7):1189-1192. ( 1) 1)
|
| [4] | 李思明, 周定刚.维生素D3对丝毛乌鸡的3个β-防御素基因在不同组织中表达的影响[J]. 营养学报, 2010, 22(1):93-94, 96. ( 2) 2)
|
| [5] | JONES G.Phosphorus metabolism and management in chronic kidney disease:expanding role for vitamin D in chronic kidney disease:importance of blood 25-OH-D levels and extra-renal 1α-hydroxylase in the classical and nonclassical actions of 1α, 25-dihydroxyvitamin D3[J]. Seminars in Dialysis, 2007, 20(4):316-324. ( 1) 1)
|
| [6] | 李思明, 周定刚.维生素D3对丝毛乌骨鸡组织中β-防御素基因的表达调控[J]. 动物营养学报, 2009, 21(4):573-579. ( 3) 3)
|
| [7] | LI S M, OUYANG L H, ZHOU D G.Effects of vitamin D3 on expression of defensins, Toll-like receptors, and vitamin D receptor in liver, kidney, and spleen of Silky fowl[J]. Czech Journal of Animal Science, 58(1):1-7. ( 1) 1)
|
| [8] | O'KELLY J, HISATAKE J, HISATAKE Y, et al.Normal myelopoiesis but abnormal T lymphocyte responses in vitamin D receptor knockout mice[J]. The Journal of Clinical Investigation, 2002, 109(8):1091-1099. ( 2) 2)
|
| [9] | FROICU M, CANTORNA M T.Vitamin D and the vitamin D receptor are critical for control of the innate immune response to colonic injury[J]. BMC Immunology, 2007, 8:5. ( 1) 1)
|
| [10] | KONG J, GRANDO S A, LI Y C.Regulation of IL-1 family cytokines IL-1alpha, IL-1 receptor antagonist, and IL-18 by 1, 25-dihydroxyvitamin D3 in primary keratinocytes[J]. Journal of Immunology, 2006, 176(6):3780-3787. ( 2) 2)
|
| [11] | TSE A K W, WAN C K, SHEN X L, et al.1, 25-dihydroxyvitamin D3 induces biphasic NF-κB responses during HL-60 leukemia cells differentiation through protein induction and PI3K/Akt-dependent phosphorylation/degradation of IκB[J]. Experimental Cell Research, 2007, 313(8):1722-1734. ( 2) 2)
|
| [12] | JAMES S Y, WILLIAMS M A, NEWLAND A C, et al.Leukemia cell differentiation:cellular and molecular interactions of retinoids and vitamin D[J]. General Pharmacology:The Vascular System, 1999, 32(1):143-154. ( 1) 1)
|
| [13] | SZELES L, KERESZTES G, TOROCSIK D, et al.1, 25-dihydroxyvitamin D3 is an autonomous regulator of the transcriptional changes leading to a tolerogenic dendritic cell phenotype[J]. Journal of Immunology, 2009, 182(4):2074-2083. ( 1) 1)
|
| [14] | GRIFFIN M D, DONG X Y, KUMAR R.Vitamin D receptor-mediated suppression of RelB in antigen presenting cells:a paradigm for ligand-augmented negative transcriptional regulation[J]. Archives of Biochemistry and Biophysics, 2007, 460(2):218-226. ( 1) 1)
|
| [15] | MATHIEU C, VAN ETTEN E, DECALLONNE B, et al.Vitamin D and 1, 25-dihydroxyvitamin D3 as modulators in the immune system[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2004, 89/90(1/2/3/4/5):449-452.( 1) 1)
|




