2. 动物抗病营养教育部重点实验室, 成都 611130
2. Key Laboratory of Animal Disease-Resistant Nutrition of Ministry of Education, Sichuan Agricultural University, Chengdu 611130, China
赭曲霉毒素(ochratoxin,OT)是一类主要由赭曲霉(Aspergillus ochraceus)、黑曲霉(Aspergillus niger)及青霉菌(Penicillium sp.)的某些菌株产生的真菌毒素,是目前受到普遍关注的五大类霉菌毒素之一。赭曲霉毒素包括7种结构类似物,其中毒性最大(仅次于黄曲霉毒素)、分布最广泛、对农作物的污染最严重、与人类和动物健康关系最密切的是赭曲霉毒素A(ochratoxin A,OTA)。OTA对人和动物均有多种毒理病理学效应:对肾脏和肝脏有强毒性,甚至诱导小鼠和大鼠肾脏、肝脏肿瘤;具有致畸、致癌、致突变性以及尿道毒性、免疫抑制毒性和胚胎毒性[1]。同时,OTA也被归为三大类肠致病性霉菌毒素之一。鉴于此,本文综述了为数不多的有关OTA肠毒性及其作用机制、营养干预研究的文献资料,围绕OTA诱导家畜肠道病理损伤进行阐述,探讨OTA的肠毒性效应及其严重的病理后果,以及可缓解OTA肠毒性的有效营养物质,为缓解OTA的肠毒性提供理论基础和实践依据。
OTA由甲基异香豆素的7-羧基以酰胺键与L-β-苯丙氨酸相连形成(图1),是一种稳定的无色结晶化合物,耐热,呈弱酸性;在酸性或中性pH条件下,易溶于极性有机溶剂(如醇类、酮类、氯仿),微溶于水,可溶于碱性溶液(如碳酸氢钠溶液),不溶于石油醚和饱和烃类;在有机溶剂和碱性溶液中,OTA对空气、光不稳定,尤其是在潮湿环境中,短暂的光照都能使之分解,但在乙醇溶液中低温可保存1年;紫外线(366 nm)照射下,OTA在酸性介质中呈绿色荧光,在碱性环境下呈蓝色荧光;不具有免疫原性,需与大分子结合后才具有抗原性,属于半抗原。OTA结构中的羟基基团以电离形式存在是OTA发挥毒性所必需的条件[2],氯原子则在其遗传毒性上发挥十分重要的作用[3]。OTA的苯丙氨酸基团可被其他氨基酸取代形成毒性不一的OTA类似物,如被酪氨酸、缬氨酸、丝氨酸取代形成的类似物,其毒性强于被蛋氨酸、色氨酸取代形成的类似物,而被谷氨酸、脯氨酸取代形成的类似物,其毒性要低于OTA[4]。
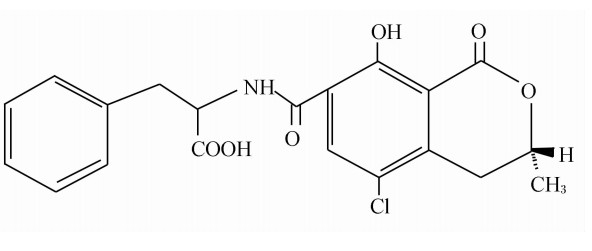 | 图1 OTA的化学结构
Fig.1 Chemical structure of OTA[2] |
OTA的吸收起始于胃,肠道吸收主要在近端空肠,以被动扩散方式进入肠细胞,主要以非离子态吸收[5, 6, 7]。不同动物对OTA的吸收效率有差 异。Galtier等[8]报道,猪口服OTA的吸收率为66%, 大鼠和家兔为56%,鸡为40%。一部分OTA可被消化道内羧肽酶A、胰蛋白酶、α-糜蛋白酶、组织蛋白C以及肠腔中的微生物水解成毒性更低的赭曲霉毒素α(ochratoxin α,OTα)[2];另一部分OTA从消化道吸收进入体循环后,大部分与血清蛋白(主要是白蛋白)结合(结合率达99.98%)[9],随后经血液循环到达机体各组织器官。
OTA在动物体内的半衰期存在种属[2, 8]和组织器官[10]差异,且与染毒途径有关,表现为:人最长,鲤鱼最短(表1);肌肉(97 h)>肝脏(60 h)>肾脏(54 h)>心脏(48 h)[10];静脉注射长于口服[2, 8]。
对于大多数动物,OTA主要通过肾脏随尿排泄;而对于啮齿动物,则主要通过胆汁分泌,随粪排泄[2]。此外,经肠道分泌的OTA量也较大,与通过胆汁分泌的量相当,其中后肠段是分泌OTA的主要位点,但这种分泌作用会随肠道内容物的存在而减弱[11]。另外,动物通过生产产品也可排出少量的OTA,如禽类产蛋、哺乳动物泌乳等[2]。
肠道通过高度复杂的交互作用参与营养物质、食物污染物和药物的选择性吸收、生物转化和外排入肠腔的过程,在调控物质的生物学利用率中担负重要作用。对饲粮来源的有害物质来说,肠黏膜是与其相互作用的第1位点,它的解剖学定位使其比其他器官接触到更高浓度的饲粮毒素,因此也是其可能的靶器官。
暴露OTA的试验动物其肠道不同肠段表现出程度不一的炎症损伤。Szczech等[12]报道,无特定病原体(SPF)小母猪(3~4周龄)饲喂含OTA的饲粮和纯OTA,导致采食量下降、精神不振、呕吐、多饮和多尿,进而出现腹泻和直肠温度升高,甚至死亡;死亡动物整个胃肠道有炎症反应,肠道呈局灶性坏死病变,空肠、回肠、螺旋结肠和直肠被胆汁染色的液体和气体充盈而肿胀,肠壁变薄而无活力。Szczech等[13]和Kitchen等[14]报道,青年雄性Beagle犬暴露OTA后,其盲肠、结肠和直肠出现中度至重度的黏膜出血性肠炎,肠黏膜固有层和上皮细胞坏死,而近端小肠受影响轻微。Kanisawa等[15]研究报道,Wistar大鼠单次口服5 mg/kg或更高浓度的纯OTA(羧甲基纤维素钠溶解)时,出现卡他性肠炎;解剖发现,大鼠暴露OTA(15、20、40 mg/kg)4 h,十二指肠和空肠均已出现明显病理变化,表现为严重的卡他性或糜烂性肠炎,肠黏膜固有层水肿,并伴有轻微出血,但胃和后肠未受影响;大鼠多次口服OTA[5 mg/(kg·d),3 d;10 mg/(kg·d),4 d]后也表现出类似的病理变化,即小肠轻微肿胀,黏液层中等程度充血。Kanisawa等[16]进一步研究了OTA在雄性Wistar大鼠上的作用模式及其与急性肠炎发展的关系,发现大鼠口服和肠外给予15 mg/kg OTA均能诱导肠炎;两端结扎的空肠盲囊腔直接暴露OTA后发生严重炎症,但结扎胆管可完全阻止炎症的发生,这些现象提示肠炎可能是由肠黏膜直接接触未经代谢的OTA所致,但仍怀疑OTα能增强炎症反应。Warren等[17]对1日龄雄性肉仔鸡的研究发现,OTA导致其肠道脆弱,并伴有大肠/体重比和脂肪含量增加,胶原蛋白含量显著降低。
OTA暴露将增加动物肠道对细菌和球虫感染的敏感性。Fukata等[18]对1日龄蛋仔鸡单次口服OTA(3 mg/kg BW)对鼠伤寒沙门菌(S. typhimurium)感染影响的研究发现,OTA处理7 h后十二指肠内容物中鼠伤寒沙门菌数量显著高于对照组,处理24 h后十二指肠和盲肠内容物中鼠伤寒沙门菌数量均显著高于对照组。同时,研究还考察了11 d后连续2 d接触鼠伤寒沙门菌,接着连续2 d口服OTA对蛋仔鸡的影响,发现24 h后其十二指肠和盲肠内容物中鼠伤寒沙门菌数量显著高于对照组,且OTA组发生急性肠炎[18]。Kumar等[19, 20]报道,肉仔鸡饲喂含2 mg/kg OTA饲粮后再接种大肠杆菌(E. coli),其死亡率从单独细菌感染的14.3%上升到35.7%,体重和采食量也进一步下降。此外,Manafi等[21]研究OTA对球虫攻击的1日龄肉仔鸡的影响时发现,OTA的存在加重了球虫的病理学效应,表现为仅饲喂OTA(1 mg/kg)组的死亡率(4%)是对照组的2倍,而OTA(1 mg/kg)和柔嫩艾美耳球虫(E. tenella)卵囊(50 000个/kg)联合饲喂组的死亡率(14%)为对照组的7倍;2个试验组均伴有严重的盲肠损伤和粪中卵囊增加,联合饲喂组还出现了肉眼可见的伴有黏膜组织碎片的出血性盲肠炎,特征是盲肠被微带血性的内容物充盈肿胀。
OTA暴露时间和浓度极显著影响体外培养肠细胞的增殖和存活,且两者间存在极显著的交互效应。人结肠癌细胞系(HT-29-D4和Caco-2-14细胞)经10 μmol/L(4 μg/mL)OTA处理,其生长就被显著抑制,100 μmol/L OTA甚至使细胞生长停止,50%抑制浓度分别为20和30 μmol/L[22]。Berger等[7]通过噻唑蓝(MTT)法和乳酸脱氢酶(LDH)释放试验以检测OTA对Caco-2细胞的毒性效应,研究表明OTA以浓度依赖方式抑制MTT的还原,但对培养液中LDH活性的影响不显著,甚至在100 μmol/L OTA浓度时对LDH活性的影响也不显著。陈平等[23]在仔猪空肠上皮细胞系(IPEC-J2细胞)上的研究表明,OTA使细胞活性降低,细胞正常增殖和存活受阻,暴露时间和浓度均极显著影响细胞存活率,且存在极显著的交互效应;考察OTA对IPEC-J2细胞结构功能完整性的影响时发现,OTA浓度越高,培养液中LDH活性越大,Na+-K+-ATP酶活性越低,表明细胞结构完整性和正常生理功能遭到破坏。不同细胞对OTA毒性的敏感性不一,其原因可能与细胞类型和细胞分化程度不同有关[22]。
肠道在营养物质吸收方面担任重要的生理功能,如果受到损害将产生严重的后果。研究表明,HT-29-D4细胞经100 μmol/L OTA暴露48 h后,Na+-依赖的葡萄糖吸收显著下降,果糖的转运活性有所升高,L-丝氨酸的转运活性显著升高。同样浓度和处理时间对Caco-2细胞的影响表现为:表征协同转运的脱氧葡萄糖(DOG)和果糖的吸收受到显著抑制;表征主动转运的α-甲基-吡喃葡萄糖苷(AMG)的吸收未受显著影响;L-丝氨酸的被动转运(Na+缺乏时)不受影响,但主动转运(Na+存在时)被抑制[22]。OTA能够影响线粒体功能,进而导致ATP生物合成障碍,这可能是其抑制主动转运的原因[24]。然而,OTA只抑制HT-29-D4细胞的葡萄糖转运载体——Na+-依赖性葡萄糖转运体1(SGLT1),而对其他主动转运载体没有影响,表明在ATP耗竭状态下,OTA诱导细胞特异性损伤,可能机制是OTA影响特定蛋白的合成。值得注意的是,OTA对HT-29-D4和Caco-2细胞吸收功能的影响不一致,表明OTA对肠上皮细胞的毒性可能存在特异性[22]。
大量研究表明,OTA是一类具有免疫抑制作用的真菌毒素,可导致动物重要免疫器官(如胸腺、脾脏、淋巴结)体积减小以及血液中抗体和免疫球蛋白反应破坏,还可影响免疫细胞细胞因子的合成和分泌[25]。肠上皮细胞是除主要免疫细胞(淋巴细胞、巨噬细胞等)外也可产生多种细胞因子的细胞。其中,促炎性细胞因子白细胞介素-8(interleukin 8,IL-8)是一种能特异趋化中性粒细胞进入炎性组织,并促使其脱颗粒,产生超氧阴离子,进而激活炎性细胞,促进急性期蛋白合成、炎性介质释放和炎性反应进程的细胞因子[26]。Maresca等[27]做了一项针对3种重要的肠致病性霉菌毒素,即呕吐毒素(deoxynivalenol,DON)、OTA和棒曲霉毒素(patulin,PAT),对Caco-2细胞促炎性细胞因子IL-8分泌影响的研究,其中针对OTA的研究表明,低浓度(1 μmol/L)OTA处理使白细胞介素-1β(interleukin-1β,IL-1β)诱导的促炎性细胞因子IL-8的分泌增加,指出OTA可间接加剧肠道炎症;但高浓度(100 μmol/L)OTA处理却抑制IL-8的分泌。鉴于OTA间接导致细菌易位,而IL-8的诱导分泌是细菌与细胞基底膜Toll样受体5(Toll-like receptor 5,TLR5)相互作用的结果,试验进一步考察了OTA在细菌诱导基底侧IL-8分泌上的影响,发现OTA事实上抑制了肠上皮细胞基底侧对细菌的敏感性,导致细菌对IL-8的诱导效应显著下降。这与烟曲霉毒素B1(fumonisin B1,FB1)诱导猪肠上皮细胞紧密连接打开而抑制IL-8分泌的结论相似[28]。OTA这种抑制IL-8分泌以及导致细菌易位效应的增加,将导致肠道对细菌感染高度敏感。
针对OTA的毒性效应已开展了较多的研究,目前普遍认为OTA可抑制蛋白质、RNA和DNA的合成,诱导细胞氧化应激(包括脂质过氧化、蛋白质氧化损伤以及DNA氧化损伤)、胞内钙平衡崩溃、线粒体机能障碍、细胞程序性死亡等[2]。上述研究结果主要基于肝脏和肾脏,而对OTA致肠毒性作用机制的研究较少,现有的研究结果主要有:1)OTA降低紧密连接复合体中关键蛋白的含量,诱导肠道屏障功能下降;2)OTA抑制抗氧化防御系统,诱导氧化应激。
紧密连接是肠道上皮细胞之间重要的连接方式之一,其主要功能是只允许离子及小分子可溶性物质通过,不允许毒性大分子及微生物通过,这种特殊的生理功能在肠道屏障的维护中起着举足轻重的作用,是阻止外源毒素和病原微生物等进入机体组织的重要物理屏障。跨上皮电阻(trans-epithelial electrical resistance,TEER)是反映紧密连接完整性的一个重要指标,TEER值的降低与紧密连接的改变直接相关,常用TEER值的变化来反映紧密连接的完整性。研究表明,OTA呈时间-剂量依赖方式诱导肠细胞单层TEER值下降,与此同时细胞单层通透性增加[22, 27, 29, 30]。Maresca等[27]以无钙培养基培养的Caco-2细胞作为紧密连接打开的正对照,阐明了OTA诱导TEER值下降与细胞单层通透性增加的关系,研究表明钙缺乏导致TEER值显著下降以及异硫氰酸荧光素-右旋糖酐(fluorescein isothiocyanate-dextran,FITC-dextran)和辣根过氧化物酶(horseradish peroxidase,HRP)流量显著增加,而FITC-dextran和HRP流量的增加也只在诱导TEER值显著下降的OTA浓度下发生。
进一步研究表明,细胞单层通透性的改变与OTA导致紧密连接结构中特定蛋白离域有关[22, 29, 30, 31]。Maresca等[22]报道,OTA影响Caco-2和HT-29细胞筏(rafts,与紧密连接相关的蛋白集中于此)中特定蛋白的定位,但未具体指出影响了哪些蛋白。McLaughlin等[29]进一步研究揭示了影响屏障功能的分子机制,认为OTA导致紧密连接复合体中闭合蛋白claudin-3和claudin-4离域是细胞屏障功能降低的原因。Lambert等[31]用洗涤剂(Lubrol WX)将与紧密连接相关的细胞筏分离为洗涤不溶微结构域(detergent resistant membrane microdomains,DRMs),研究了OTA对DRMs中蛋白的影响,证实OTA导致claudin-3和claudin-4从DRMs中离域。Ranaldi等[30]的研究也表明,OTA处理导致Caco-2/TC7细胞claudin-4的再分配。然而,目前尚不能确定OTA是影响成熟的紧密连接,使claudin-3和claudin-4与微结构域失去联系,而后被降解,还是影响DRMs中的claudin-3和claudin-4向紧密连接复合体的重新转运过程。OTA如何移除紧密连接中特定claudins的分子机制也还不清楚,可能是OTA直接与特定的claudins结合使其被降解[30],相关机制还有待进一步的研究。
肠上皮屏障的改变可能导致不良物质和病原体不受控制的进入机体内,如细菌、内毒素等直接或间接的导致肠道疾病。OTA诱导急性炎症、腹泻和细菌易位增加的效应均与上皮屏障功能下降有关。为此,从改善肠道屏障功能的角度寻求缓解OTA肠毒性的方法不失为一条好的途径。
霉菌毒素诱导氧化应激是近年研究其致毒机制的热点和重点。其中,有关OTA的很多试验表明,OTA不仅促使机体产生大量的活性氧(reactive oxygen species,ROS),并能通过氧化还原敏感机制,抑制核转录因子红细胞系-2相关因子2(NF-E2-related factor 2,Nrf2)活性,直接影响其调控的下游抗氧化酶和Ⅱ相解毒酶基因的表达,导致机体抗氧化能力下降[32, 33, 34, 35, 36]。Khor等[37]研究发现,Nrf2缺失[Nrf2(-/-)]使得小鼠对葡聚糖硫酸酯钠(dextran sulfate sodium,DSS)诱导的结肠炎的敏感性增加,表现为结肠炎和直肠出血更加严重;进一步的分析认为,Nrf2(-/-)小鼠结肠炎严重性增加与抗氧化酶和Ⅱ相脱毒酶基因表达下降有关,并指出Nrf2通过调节促炎性细胞因子的分泌和诱导Ⅱ相解毒酶基因的表达在保护肠道完整性上发挥重要作用。因此,可以推测,抑制Nrf2的活化以及Nrf2/抗氧化反应元件(antioxidant response element,ARE)信号途径下游相关基因的表达可能是OTA诱导氧化应激,进而发挥肠毒性的机制之一。
陈平[38]研究了OTA对IPEC-J2细胞Nrf2抗氧化系统的影响,发现OTA暴露情况下,IPEC-J2细胞的抗氧化能力降低,脂质过氧化产物丙二醛(malondialdehyde,MDA)含量增加。为了深入揭示OTA对抗氧化系统影响的机理,试验进一步检测了参与抗氧化系统构成的受Nrf2调控的抗氧化相关酶基因的表达水平。结果显示,谷胱甘肽过氧化物酶2(gastrointestinal glutathionperoxidase 2,GSH-Px2)、硫氧还蛋白还原酶1(thioredoxin reduetase l,TrxR1)、谷胱甘肽还原酶(glutathione reductase,GR)、谷胱苷肽硫转移酶(glutathione S-transfrase,GST)、谷氨酰胺半胱氨酸连接酶的催化亚基(glutathione cysteine ligase catalytic subunit,GCLC)和谷氨酰胺半胱氨酸连接酶的调节亚基(glutathione cysteine ligase modifier subunit,GCLM)mRNA的表达均被抑制,同时GST、GPx、GR活性也有不同程度的下降。试验进一步采用电泳迁移率变动分析(EMSA)法考察了OTA对IPEC-J2细胞Nrf2/ARE通路的影响,证实OTA抑制了细胞Nrf2的活化,表现为核转位减缓,最终造成了细胞抗氧化防御能力的降低,导致细胞出现氧化损伤。可见,氧化应激对肠细胞的损害是OTA毒性作用产生的重要途径,Nrf2介导的抗氧化防御能力的抑制是OTA发挥肠毒性的可能机制。
鉴于OTA对动物的巨大危害,迫切需要寻求一种安全高效的方法缓解其危害。目前,控制饲料霉菌毒素污染的主要措施是在饲料中添加防霉剂和吸附剂等,而通过营养措施来缓解霉菌毒素毒性效应的研究较少。目前,就营养干预OTA肠毒性而言,现有报道中涉及到的营养物质有苯丙氨酸(Phe)[22]、N-乙酰基半胱氨酸(N-acetyl cysteine,NAC)[30]、硒(Se)[38]、锌(Zn)[39](表2)。
| 表2 一些营养物质对OTA肠毒性的缓解效应
Table 2 Mitigative effects of some nutrients on intestinal toxicity of OTA
|
研究表明,添加L-Phe对OTA导致的Caco-2细胞吸收功能下降有一定的保护效应[22],添加巯基抗氧化剂NAC能显著缓解OTA的屏障毒性效应[30]。Ranaldi等[39]则研究了细胞内Zn储备在保护OTA刺激下肠黏膜完整性上的作用,表明Zn耗竭状态下,OTA处理可导致肠黏膜紧密连接通透性增加,并伴随凋亡率的增加,而添加Zn可改善OTA处理下Caco-2/TC7细胞的屏障功能,并可抑制细胞凋亡。陈平[38]系统研究了Se(亚硒酸钠)对OTA致氧化应激毒性效应的缓解作用及机制,表明亚硒酸钠显著提高了OTA暴露下的细胞存活率,有效降低了IPEC-J2细胞内LDH的外漏和脂质过氧化水平,细胞Na+-K+-ATP酶活性的抑制也得到有效缓解。并进一步研究证实Se是通过提高IPEC-J2细胞转录因子Nrf2的活化以及其下游抗氧化相关基因[如谷胱甘肽硫转移酶A2(glutathione S-transfrase A2,GSTA2)、谷胱甘肽硫转移酶O1(glutathione S-transfrase O1,GSTO1)、TrxR1、GR、GCLC和GCLM)的表达水平,提高了细胞的抗氧化能力,进而起到缓解OTA氧化应激损伤的作用。
综上所述,OTA具有较强的肠毒性,具体表现为:可损害肠上皮固有屏障功能,影响肠道对营养物质的吸收,抑制肠上皮细胞增殖,诱导肠细胞产生氧化应激,降低细胞抗氧化防御能力,其病理后果是机体对病原体感染的敏感性增加、肠道营养吸收不良、炎症、腹泻、肠黏膜坏死等,对动物肠道健康甚至整个机体构成了严重的威胁。因此,进一步阐明OTA诱导肠上皮细胞间紧密连接关键蛋白含量变化的作用机制,完善OTA在不同物种上诱导氧化应激的作用机制,以及寻求更多有效的营养途径和营养素以缓解OTA的肠毒性,对人类健康和动物生产具有重要的理论价值和实践意义。
| [1] | DUARTE S C, LINO C M, PENA A.Ochratoxin A in feed of food-producing animals:an undesirable mycotoxin with health and performance effects[J]. Veterinary Microbiology, 2011, 154(1/2):1-13. ( 1) 1)
|
| [2] | RINGOT D, CHANGO A, SCHNEIDER Y, et al.Toxicokinetics and toxicodynamics of ochratoxin A, an update[J]. Chemico-Biological Interactions, 2006, 159(1):18-46. ( 8) 8)
|
| [3] | HADJEBA-MEDJDOUB K, TOZLOVANU M, PFOHL-LESZKOWICZ A, et al.Structure-activity relationships imply different mechanisms of action for ochratoxin A-mediated cytotoxicity and genotoxicity[J]. Chemical Research in Toxicology, 2012, 25(1):181-190. ( 1) 1)
|
| [4] | HADIDANE R, BACHA H, CREPPY E E, et al.Isolation and structure determination of natural analogues of the mycotoxin ochratoxin A produced by Aspergillus ochraceus[J]. Toxicology, 1992, 76(3):233-243. ( 1) 1)
|
| [5] | KUMAGAI S, AIBARAI K.Intestinal absorption and secretion of ochratoxin A in the rat[J]. Toxicology and Applied Pharmacology, 1982, 64(1):94-102. ( 1) 1)
|
| [6] | KUMAGAI S.Effects of plasma ochratoxin A and luminal pH on the jejunal absorption of ochratoxin A in rats[J]. Food and Chemical Toxicology, 1988, 26(9):753-758. ( 1) 1)
|
| [7] | BERGER V, GABRIEL A F, SERGENT T, et al.Interaction of ochratoxin A with human intestinal Caco-2 cells:possible implication of a multidrug resistance-associated protein (MRP2)[J]. Toxicology Letters, 2003, 140/141:465-476. ( 2) 2)
|
| [8] | GALTIER P, ALVINERIE M, CHARPENTEAU J L.The pharmacokinetic profiles of ochratoxin A in pigs, rabbits and chickens[J]. Food and Cosmetics Toxicology, 1981, 19:735-738. ( 3) 3)
|
| [9] | HAGELBERG S, HULT K, FUCHS R.Toxicokinetics of ochratoxin A in several species and its plasma-binding properties[J]. Journal of Applied Toxicology, 1989, 9(2):91-96. ( 1) 1)
|
| [10] | 高翔, 李梅, 张立实.赭曲霉毒素A的毒性研究进展[J]. 国外医学:卫生学分册, 2005, 32(1):51-55. ( 2) 2)
|
| [11] | SUZUKI S, SATOH T, YAMAZAKI M.The pharmacokinetics of ochratoxin A in rats[J]. The Japanese Journal of Pharmacology, 1977, 27(5):735-744. ( 1) 1)
|
| [12] | SZCZECH G M, CARLTON W W, TUITE J, et al.Ochratoxin A toxicosis in swine[J]. Veterinary Pathology, 1973, 10(4):347-364. ( 1) 1)
|
| [13] | SZCZECH G M, CARLTON W W, TUITE J.Ochratoxicosis in beagle dogs.Ⅱ.Pathology[J]. Veterinary Pathology, 1973, 10(3):219-231. ( 1) 1)
|
| [14] | KITCHEN D N, CARLTON W W, TUITE J.Ochratoxin A and citrinin induced nephrosis in beagle dogs Ⅱ.Pathology[J]. Veterinary Pathology, 1977, 14(3):261-272. ( 1) 1)
|
| [15] | KANISAWA M, SUZUKI S, KOZUKA Y, et al.Histopathological studies on the toxicity of ochratoxin A in rats.Ⅰ.Acute oral toxicity[J]. Toxicology and Applied Pharmacology, 1977, 42(1):55-64. ( 1) 1)
|
| [16] | KANISAWA M, SUZUKI S, MOROI K.The mode of action of ochratoxin A in acute enteritis in rats[J]. Journal of Environmental Pathology Toxicology and Oncology, 1990, 10(1/2):56-63. ( 1) 1)
|
| [17] | WARREN M F, HAMILTON P B.Intestinl fragility during ochratoxicosis and aflatoxicosis in broiler chickens[J]. Applied and Environmental Microbiology, 1980, 40(3):641-645. ( 1) 1)
|
| [18] | FUKATA T, SASAI K, BABA E, et al.Effect of ochratoxin A on Salmonella typhimurium-challenged layer chickens[J]. Avian Diseases, 1996, 40(4):924-926. ( 2) 2)
|
| [19] | KUMAR A, JINDAL N, SHUKLA C L, et al.Effect of ochratoxin A on Escherichia coli-challenged broiler chicks[J]. Avian Diseases, 2003, 47(2):415-424. ( 1) 1)
|
| [20] | KUMAR A, JINDAL N, SHUKLA C L, et al.Pathological changes in broiler chickens fed ochratoxin A and inoculated with Escherichia coli[J]. Avian Pathology, 2004, 33(4):413-417. ( 1) 1)
|
| [21] | MANAFI M, MOHAN K, ALI M N.Effect of ochratoxin A on coccidiosis-challenged broiler chicks[J]. World Mycotoxin Journal, 2011, 4(2):177-181. ( 1) 1)
|
| [22] | MARESCA M, MAHFOUD R, PFOHL-LESZKOWICZ A, et al.The mycotoxin ochratoxin A alters intestinal barrier and absorption functions but has no effect on chloride secretion[J]. Toxicology and Applied Pharmacology, 2001, 176(1):54-63. ( 8) 8)
|
| [23] | 陈平, 田刚, 陈代文, 等.赭曲霉毒素A对IPEC-J2细胞生长和氧化还原平衡的影响[J]. 中国畜牧杂志, 2011, 47(3):22-26. ( 1) 1)
|
| [24] | ALEO M D, WYAT R D, SCHNELLMANN R G.Mitochondrial dysfunction is an early event in ochratoxin A but not oosporein toxicity to rat renal proximal tubules[J]. Toxicology and Applied Pharmacology, 1991, 107(1):73-80. ( 1) 1)
|
| [25] | AL-ANATI L, PETZINGER E.Immunotoxic activity of ochratoxin A[J]. Journal of Veterinary Pharmacology and Therapeutics, 2006, 29(2):79-90. ( 1) 1)
|
| [26] | 姚瑶, 王琳琳.白细胞介素-8研究进展[J]. 实用儿科临床杂志, 2009, 24(10):789-792. ( 1) 1)
|
| [27] | MARESCA M, YAHI N, YOUNS-SAKR L, et al.Both direct and indirect effects account for the pro-inflammatory activity of enteropathogenic mycotoxins on the human intestinal epithelium:stimulation of interleukin-8 secretion, potentiation of interleukin-1β effect and increase in the transepithelial passage of commensal bacteria[J]. Toxicology and Applied Pharmacology, 2008, 228(1):84-92. ( 2) 2)
|
| [28] | BOUHET S, LE DORZE E, PERES S, et al.Mycotoxin fumonisin B1 selectively down-regulates the basal IL-8 expression in pig intestine:in vivo and in vitro studies[J]. Food and Chemical Toxicology, 2006, 44(10):1768-1773. ( 1) 1)
|
| [29] | MCLAUGHLIN J, PADFIELD P J, BURT J P, et al.Ochratoxin A increases permeability through tight junctions by removal of specific claudin isoforms[J]. American Journal of Physiology:Cell Physiology, 2004, 287(5):C1412-C1417. ( 3) 3)
|
| [30] | RANALDI G, MANCINI E, FERRUZZA S, et al.Effects of red wine on ochratoxin A toxicity in intestinal Caco-2/TC7 cells[J]. Toxicology in Vitro, 2005, 21(2):204-210. ( 7) 7)
|
| [31] | LAMBERT D, PADFIELD P J, MCLAUGHLIN J, et al.Ochratoxin A displaces claudins from detergent resistant membrane microdomains[J]. Biochemical and Biophysical Research Communications, 2007, 358(2):632-636. ( 2) 2)
|
| [32] | MARIN-KUAN M, NESTLER S, VERGUET C, et al.A toxicogenomics approach to identify new plausible epigenetic mechanisms of ochratoxin a carcinogenicity in rat[J]. Toxicological Sciences, 2006, 89(1):120-134. ( 1) 1)
|
| [33] | CAVIN C, DELATOUR T, MARIN-KUAN M, et al.Reduction in antioxidant defenses may contribute to ochratoxin A toxicity and carcinogenicity[J]. Toxicological Sciences, 2007, 96(1):30-39. ( 1) 1)
|
| [34] | BOESCH-SAADATMANDI C, LOBODA A, JOZKOWICZ A, et al.Effect of ochratoxin A on redox-regulated transcription factors, antioxidant enzymes and glutathione-S-transferase in cultured kidney tubulus cells[J]. Food and Chemical Toxicology, 2008, 46(8):2665-2671. ( 1) 1)
|
| [35] | BOESCH-SAADATMANDI C, WAGNER A E, GRAESER A C, et al.Ochratoxin A impairs Nrf2-dependent gene expression in porcine kidney tubulus cells[J]. Journal of Animal Physiology and Animal Nutrition, 2009, 93(5):547-554. ( 1) 1)
|
| [36] | TAGUCHI K, MOTOHASHI H, YAMAMOTO M.Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution[J]. Genes to Cells, 2011, 16(2):123-140. ( 1) 1)
|
| [37] | KHOR T O, HUANG M T, KWON K H, et al.Nrf2-deficient mice have an increased susceptibility to dextran sulfate sodium-induced colitis[J]. Cancer Research, 2006, 66(24):11580-11584. ( 1) 1)
|
| [38] | 陈平.赭曲霉毒素A对IPEC-J2细胞Nrf2抗氧化系统的影响及硒的保护效应[D]. 硕士学位论文.雅安:四川农业大学, 2010. ( 4) 4)
|
| [39] | RANALDI G, CAPRINI V, SAMBUY Y, et al.Intracellular zinc stores protect the intestinal epithelium from ochratoxin A toxicity[J]. Toxicology in Vitro, 2009, 23(8):1516-1521. ( 3) 3)
|




