2. 兰州大学青藏高原生态系统管理国际中心, 兰州 730000;
3. 兰州大学生命科学学院, 兰州 730000
2. International Centre for Tibetan Plateau Ecosystem Management of Lanzhou University, Lanzhou 730000, China;
3. School of Life Science of Lanzhou University, Lanzhou 730000, China
藏羊(ovis aries)是我国三大原始绵羊品种之一,作为青藏高原地区的重要家畜品种,主要生活在海拔3 000 m以上高寒地区,现存栏量约5 000万头,在我国畜牧业中占有重要地位[1, 2]。目前,藏羊饲养仍以四季放牧、粗放管理的模式为主,较少补饲[3],因此采食草地天然牧草成为藏羊获得能量和蛋白质的主要途径。而青藏高原特殊的高海拔、低温、缺氧、强紫外线等自然条件,使得牧草生长期仅120 d左右,导致在漫长的枯草期饲草料供给严重不足,藏羊的营养摄入长期处于匮乏状态。面对恶劣环境,藏羊不仅要保证自身的生长、健康及繁衍后代,还要为人类提供肉、皮、毛等动物产品。研究表明,经过漫长的环境适应,牦牛进化出了特殊的营养物质消化代谢机制以应对营养匮乏的胁迫[4, 5, 6, 7],生活在同一环境下的藏羊也可能进化出了类似的适应机制。瘤胃是营养物质消化的重要场所,研究表明,藏羊瘤胃微生物区系会随着季节饲粮不同而发生适应性变化[8],且藏羊对高寒气候及粗料均有较好的耐受能力[1]。目前,对藏羊的研究主要还停留在品种资源描述、生产性能测定以及遗传特性等层面[9],对于营养物质消化代谢规律和氮维持需要的研究,鲜有报道。本试验模拟藏羊自然放牧条件下的季节采食量,设置不同限饲水平,在营养胁迫的情况下,研究其对营养物质消化代谢的规律以及氮维持需要,为科学指导藏羊的生产实际、提高生产性能提供理论依据。
选取5只体况相近[(45±2) kg]的20月龄健康去势公羊为试验动物,试验前做驱虫处理。采用自制的瘤胃管采集瘤胃液,将其探入藏羊瘤胃内辅以真空泵抽取采集。瘤胃管由带孔的不锈钢滤头(长8.0 cm,直径1.2 cm)、韧性较强的橡胶管(长2.5 m,直径1.2 cm)以及1 000 mL抽滤瓶组成。饲养试验于2012年12月至2013年3月,在甘肃省天祝藏族自治县境内的乌鞘岭试验基地(北纬37°12.479′,东经102°51.695′,海拔3 154 m)完成;样品试验室分析于2013年3月至2013年4月在兰州大学青藏高原生态系统管理国际中心实验室进行。
本试验选用单一的燕麦青干草作为饲粮,使用铡草机将其铡成长度约1~2 cm以便饲喂。其营养水平(风干基础)为:干物质(dry matter,DM)88.5%,有机物(organic matter,OM)82.9%,中性洗涤纤维(neutral detergent fiber,NDF)53.1%,酸性洗涤纤维(acid detergent fiber,ADF)39.8%,钙0.39%,磷0.18%。所有试验动物均在自制代谢笼中单笼饲养,预试期2个月,自由饮水,每期试验开始前及试验结束后的当天早上空腹称重。
采用4×4拉丁方试验设计(5号羊重复1号羊的处理,即每期试验1号羊与5号羊为组内重复)。试验选用5只藏羊,随机区分成4组[10],设置4个不同燕麦干草饲喂水平。每期试验21 d,包括预试期15 d以及正试期6 d。通过预试期自由采食确定了体重45 kg的藏羊自由采食量为DM 1 000 g/d。为保证采食完全,设置4个限饲水平,分别为燕麦干草饲粮自由采食量(VI)的90%(912.85 g,0.9VI组)、70%(707.64 g,0.7VI组)、50%(505.96 g,0.5VI组)和30%(304.28 g,0.3VI组)(DM基础),每天分2次(08:00和18:00)饲喂,自由饮水。拉丁方试验设计见表1。
| 表1 拉丁方试验设计 Table 1 Latin square experimental design |
绝食代谢试验在饲养试验结束后进行。预试期前以维持水平(maintenance level,ML),即DM 600 g/d饲喂10 d,正试期8 d,第1和2天分别饲喂ML的60%和30%,第3~6天完全绝食,第7和8天开始恢复饲喂,饲喂量分别为ML的30%和60%。
饲养试验正试期的第1~5天每天08:00(饲喂前)采用全收粪尿法收集粪尿样并定量。收集的尿样加入浓度为50%(体积比)硫酸进行酸化至pH<3.0。每天分别对尿液和粪样进行5%、10%取样,并置于-20 ℃冰箱保存,每期试验结束后,将收集的粪制成混合样。试验期第6天于饲喂前(0 h)和饲喂后的2、4、6、8 h用瘤胃管采集约100 mL瘤胃液,立即测定瘤胃液pH后,用4层纱布过滤,取滤液样分别于4只离心管(每管8 mL),每管加入1滴饱和氯化汞后,于-20 ℃冰箱保存,以备测定瘤胃液中的挥发性脂肪酸(volatile fatty acid,VFA)含量。
绝食代谢试验正试期的8 d内采用全收粪尿法收集粪尿样并定量,尿样同样酸化至pH<3.0,每天对粪样进行全部取样,尿样按5%取样,样品置于-20 ℃保存。饲料成分参照张丽英[11]的《饲料分析及饲料质量检测技术》(2版)进行测定;粪样、尿样中的氮含量按照凯氏定氮法测定[12];参照Erwin等[13]的方法测定瘤胃液中VFA含量[采用SP-3420A型气相色谱仪,FFAP柱,柱温为恒温120 ℃,火焰离子检测器(FID)为250 ℃,分流比1∶ 40]。
试验数据采用Excel进行整理和图表绘制;瘤胃发酵参数数据采用SPSS 17.0中的mixed model模块进行统计和显著性比较;营养物质消化率和氮代谢数据采用SPSS 17.0中one-way ANONA进行方差分析。
由表2可知,不同限饲水平下,晨饲后的瘤胃液pH均呈现先降低后升高的趋势,0.3VI组的在2 h时达到最低,其他各组均在4 h时达到最低,且4 h的pH在0.7VI组最低,但限饲和时间对瘤胃液pH的影响均不显著(P>0.050)。乙酸、丙酸、异丁酸、戊酸和异戊酸含量及乙酸/丙酸未受限饲水平影响(P>0.050),限饲水平对丁酸含量存在极显著影响(P<0.001),对总挥发性脂肪酸(TVFA)浓度存在显著影响(P<0.050)。0.9VI组丁酸含量及TVFA浓度均为最高,而0.5VI组均为最低,差异显著(P<0.050)。时间对丙酸含量和TVFA浓度存在显著或极显著影响(P<0.050或P<0.010)。限饲和时间对瘤胃液pH和VFA含量的影响均无显著交互作用(P>0.050)。
| 表2 燕麦干草饲粮限饲对藏羊瘤胃的发酵参数的影响
Table 2 Effects of dietary restriction of oat hay on ruminal fermentation parameters of Tibetan sheep
|
由表3可知,在不同限饲水平下,DM、OM、粗蛋白质(crude protein,CP)、NDF和ADF的消化率均差异不显著(P>0.050),但均呈现随限饲程度降低而升高的趋势。
| 表3 燕麦干草饲粮限饲对藏羊营养物质消化率的影响 Table 3 Effects of dietary restriction of oat hay on nutrient digestibility of Tibetan sheep % |
由表4可知,限饲水平与氮代谢各指标均存在极显著的线性关系(P<0.010)。随着限饲水平的降低,摄入氮、可消化氮、尿氮、粪氮、氮沉积和氮沉积率均增加;尿氮/摄入氮则降低,0.3VI组与其他3组差异显著(P<0.050),而0.7VI组与0.5VI和0.9VI组之间差异不显著(P>0.050),0.5VI组与0.9VI组之间差异显著(P<0.050)。
| 表4 燕麦干草饲粮限饲对藏羊氮代谢的影响
Table 4 Effects of dietary restriction of oat hay on N metabolism of Tibetan sheep
|
由图1可知,随着绝食时间的延长,粪氮呈现出先降低后稳定的趋势,第5天时最低;尿氮则呈现先降低后升高最后达到稳定的趋势,第3天时尿氮最少;总氮排出量也呈现先降后升最后达到稳定的趋势,其中第3天时最低。整个绝食期每天的尿氮均大于粪氮。
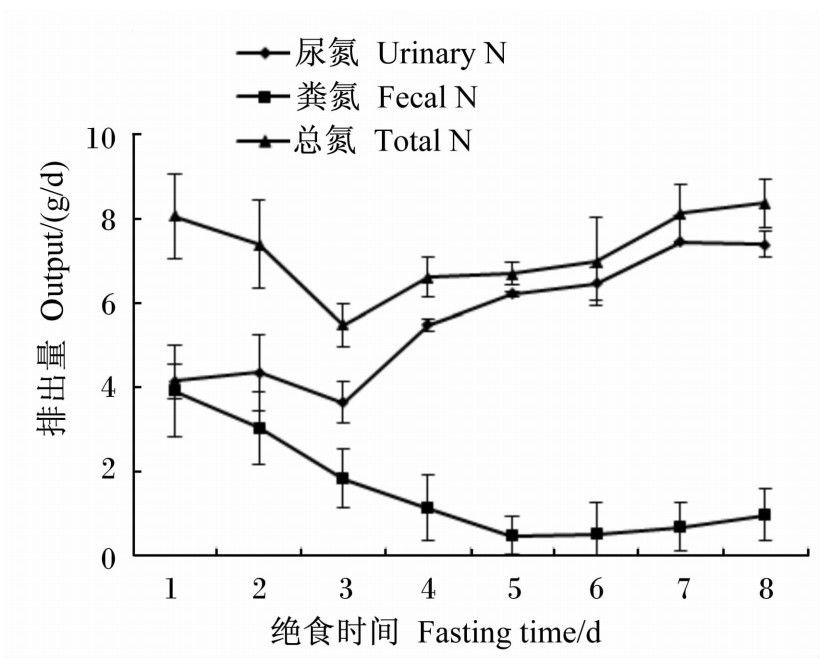 | 图1 藏羊绝食氮排放的动态变化 Fig.1 Dynamic changes of fasting N output of Tibetan sheep |
Allen[14]研究指出,瘤胃液pH受到瘤胃中发酵产生的酸、进入瘤胃的弱碱性唾液以及瘤胃的外排作用等多重影响,其变化范围一般在6.00~7.00。本试验中,不同限饲水平下的瘤胃液pH平均值在6.70左右,随着饲喂后时间延长呈现出先降低而后升高的“V”字形变化,饲喂后2~4 h时达到最低,这是饲粮中的碳水化合物被瘤胃微生物消化分解产生大量VFA所致。Towne等[15]报道,当饲粮中玉米或高粱比例在76%~83%时,pH变化范围是5.62~5.80;Slyter等[16]以高比例精料喂给奶牛后,发现瘤胃液pH可降至5.80左右。本试验瘤胃液pH比以上试验结果高,可能是由于采食含结构性碳水化合物较多的燕麦干草导致消化速率减慢所致,如Patra[17]报道,在给绵羊饲喂低质量饲料后,瘤胃液pH平均为6.77;米见对等[18]在给牦牛喂给精粗比4∶ 6饲粮时所得瘤胃液pH平均值也在7.00左右,与本试验结果相近。
本试验中,0.9VI组的瘤胃液TVFA浓度最高,显著高于0.3VI、0.5VI组,而与0.7VI组差异不显著,这是由于低水平限饲组有较多的可供微生物消化利用的营养物质(如碳水化合物、蛋白质、矿物质等)所致。瘤胃中产生的VFA以乙酸、丙酸、丁酸为主,大约占TVFA的95%[19],本试验的研究结果与此一致。乙酸是反刍动物主要的能量来源,本试验中乙酸含量呈现随限饲水平降低而降低的趋势,这可能是饲粮被转化成含更高比例丙酸用来供给能量。丙酸是体内葡萄糖的前体物质,而葡萄糖作为能量储备物质,利于家畜育肥。丙酸含量在0.9VI组中最高,显示有足够饲粮摄入时,更多的营养物质被机体储存。丁酸在机体吸收后能转变成β-羟丁酸而作为机体组织的能量来源,丁酸含量在4组之间差异显著,在0.9VI组丁酸含量最高,而0.3VI、0.5VI组均较低。饲粮不同精粗比会导致乙酸/丙酸变化,当精料比例提高时,会导致丙酸含量增加,由于本试验4组藏羊采食同种饲粮,故乙酸/丙酸无显著差异。
限饲水平对营养物质消化率的影响在不同研究报道中其结果也不尽一致。许贵善等[20]发现,在给肉用绵羊饲喂自由采食量100%、70%、40%时,DM、OM、CP、NDF和ADF的消化率差异不显著;齐景伟[21]在对妊娠后期母羊的研究中发现,不同限饲水平对DM、CP、NDF和ADF的表观消化率无显著影响,Teixeira等[22]以及霍小东等[23]对山羊的研究结果与上述一致。Long等[24]报道,给牦牛饲喂30%、60%、90%自由采食量3个水平的燕麦干草,DM消化率分别为66.1%、62.8%、59.1%,这可能是采食过多饲料导致在瘤胃内停留时间缩短而使消化率降低。钟伟等[25]在对梅花鹿的研究中,给3岁梅花鹿饲喂4个水平饲粮(2.5、2.0、1.5和1.0 kg/d),结果表明,饲粮水平降低会导致营养物质消化率显著降低;Singh等[26]研究发现,当杂交肉牛饲粮水平由95%降低到60%时,营养物质消化率差异不显著,而下降到40%时,消化率显著降低。本试验0.3VI、0.5VI、0.7VI和0.9VI组DM消化率分别为57.22%、57.73%、59.70%和61.61%,各组间差异不显著,但有随着限饲水平升高而降低的趋势,这可能是低水平饲粮下,瘤胃微生物的能量和蛋白质供给不足,进而影响了饲粮降解。Long等[24]给牦牛饲喂30%、60%和90%自由采食量3种水平燕麦干草的NDF消化率为54.3%~62.1%;许贵善等[20]给肉用绵羊饲喂40%、70%和100%自由采食量3个水平颗粒饲粮得到NDF和ADF的消化率分别是53.09%~57.22%和35.35%~39.66%;霍小东等[23]给辽宁绒山羊饲喂100%、90%、80%和70%自由采食量的精粗比为3∶ 7的饲粮,NDF和ADF的消化率分别为56.46%~59.32%和49.05%~51.97%。本试验藏羊对各组饲粮NDF和ADF的消化率分别是49.09%~53.82%和43.19%~47.50%,略低于上述研究结果,可能是由于使用含有较高结构性碳水化合物的饲粮所致。
氮平衡反映氮摄入与氮排出之间的平衡关系。George等[27]报道,当给肉牛饲喂120%、100%、80%和60%自由采食量4个水平饲粮时,排出氮及氮沉积均随着饲喂水平的降低而显著下降。本试验中,不同饲喂水平饲粮对尿氮和粪氮均有显著影响,且对粪氮影响较大(1.59~4.53 g/d),而对尿氮的影响不及粪氮,这与许贵善等[20]的研究一致。氮沉积能够较好地反映动物对饲粮蛋白质的利用情况[28],由于动物机体的新陈代谢需要一定量的蛋白质作为物质基础,摄入饲粮不足会导致能量和蛋白质同时缺乏,机体自身会提高氨基酸的氧化速率以应对能量的不足[29]。本试验中,0.3VI、0.5VI组为负的氮沉积,故0.3VI、0.5VI组饲粮不能满足藏羊对营养物质尤其是氮的需求。
由表3结果计算,摄入可消化氮与体内氮沉积之间存在显著线性相关,氮沉积[g/(kg BW0.75·d)]=-0.094 4+0.812 4×可消化氮(n=20,R2=0.960 7),当氮沉积为0时,可得藏羊可消化氮维持需要量为0.12 g/(kg BW0.75·d)。据冯仰廉等[30]报道,阉牛可消化氮维持需要量为0.40 g/(kg BW0.75·d),霍小东等[23]报道辽宁绒山羊为0.24 g/(kg BW0.75·d),钟铖等[31]报道青山羊为0.29 g/(kg BW0.75·d),本试验藏羊维持需要量低于上述研究结果,可能是藏羊体内存在更高效的氮利用机制,以适应青藏高原牧草长期匮乏环境。
绝食代谢是家畜代谢水平最低时的状态,此时体内的营养消耗最低,通过绝食试验可以研究动物能量和蛋白质等营养物质消化代谢规律[32]。由于绝食期没有饲粮摄入,机体依靠自身储备的营养物质维持体内代谢,随着绝食时间的延长,能量的来源也会随之发生变化,脂肪消耗比例降低,而体蛋白质消耗量增加[33]。本试验绝食期总氮排出量在5.49~8.37g/d,而粪氮在0.48~3.92 g/d,且随着绝食时间的推移持续降低,第5~7天时达到最低,这是由于采食的饲粮经消化后,大部分以粪便形式很快排出体外,绝食时间越长粪氮越少。尿氮作为内源氮体现了体内氮代谢水平[34, 35],本试验绝食期排出氮以尿氮为主,在3.65~7.45 g/d,呈现先降低后升高的趋势,第3天总氮排出量最低,第7天最高。一般认为绝食期氮维持需要量约等于粪氮与尿氮的总和,本试验排出氮在第4~6天基本达到平衡,排出氮分别为6.62、6.70和6.98 g,可视为稳定状态,计算可得绝食期藏羊的氮维持需要量为0.15 g/(kg BW0.75·d)。
① 限饲水平不影响藏羊对营养物质的消化。
② 藏羊常规饲养期可消化氮维持需要量为0.12 g/(kg BW0.75·d)。
③ 绝食期氮维持需要量为0.15 g/(kg BW0.75·d)。
| [1] | 祁玉香, 余忠祥.欧拉型藏羊[J]. 中国草食动物, 2006, 26(4):62-65. ( 2) 2)
|
| [2] | 王光明.海西州高原型藏羊种质资源调查[J]. 畜牧与兽医, 2012, 44(4):51-53. ( 1) 1)
|
| [3] | 阎明毅.青海省河南县欧拉型藏羊现状调查报告[J]. 青海畜牧兽医杂志, 2006, 36(3):25-26. ( 1) 1)
|
| [4] | 韩兴泰, 胡令浩, 谢敖云, 等.粗饲条件下生长牦牛能量代谢的估测[J]. 青海畜牧兽医杂志, 1992, 2(2):21-22. ( 1) 1)
|
| [5] | 胡令浩, 谢敖云, 韩兴泰.生长牦牛与生长黄牛体表面积的研究[J]. 中国畜牧杂志, 1994, 30(6):32-37. ( 1) 1)
|
| [6] | 张莹, 郭旭生, 龙瑞军, 等.饲粮氮水平对牦牛瘤胃发酵及营养物质消化代谢特征的影响[J]. 动物营养学报, 2011, 23(6):956-964. ( 1) 1)
|
| [7] | WANG H C, LONG R J, ZHOU W, et al.A comparative study on urinary purine derivative excretion for yak (Bos grunniens), indigenous cattle (Bos taurus) and crossbreed (Bos grunniens×Bos taurus) in Qing-hai Tibetan plateau[J]. China Journal of Animal Science, 2009, 87(7):2355-2362. ( 1) 1)
|
| [8] | 淡瑞芳, 龙瑞军, 张海涛, 等.藏系绵羊瘤胃细菌区系的季节动态分析[J]. 动物营养学报, 2009, 21(5):798-802. ( 1) 1)
|
| [9] | 郎侠.欧拉型藏羊消化系统发育和肌肉H-FABP基因表达规律的研究[D]. 博士学位论文.兰州:甘肃农业大学, 2011. ( 1) 1)
|
| [10] | SARRASECAL A, MILNE E, METCALF M J, et al.Urea recycling in sheep:effects of intake[J]. British Journal of Nutrition, 1998, 79(1):79-88. ( 1) 1)
|
| [11] | 张丽英.饲料分析及饲料质量检测技术[M]. 2版.北京:中国农业大学出版社, 2003. ( 1) 1)
|
| [12] | AOAC.Official methods of analysis of the association of official analytical chemists[S]. 15th ed.Washington, D.C.:Association of Official Analytical Chemists, 1990. ( 1) 1)
|
| [13] | ERWIN E S, MARCO G J, EMERY E M.Volatile fatty acid analyses of food and rumen fluid by gas chromatography[J]. Journal of Dairy Science, 1961, 44(9):1768-1771. ( 1) 1)
|
| [14] | ALLEN M S.Relationship between fermentation acid production in the rumen and the requirement for physically effective fiber[J]. Journal of Dairy Science, 1997, 80(7):1447-1462. ( 1) 1)
|
| [15] | TOWNE G, NAGARAJA T G, BRANDT R T, et al.Dynamics of ruminal ciliated protozoa in feedlot cattle[J]. Applied and Environmental Microbiology, 1990, 56(10):3174-3178. ( 1) 1)
|
| [16] | SLYTER L L, OLTJEN R R, KERN D L, et al.Influence of type and level of grain and diethylstilbestrol on the rumen microbial populations of steers fed all-concentrate diets[J]. Journal of Animal Science, 1970, 31(5):996-1002. ( 1) 1)
|
| [17] | PATRA A K.Effects of supplementing low-quality roughages with tree foliages on digestibility, nitrogen utilization and rumen characteristics in sheep:a meta-analysis[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(3):338-353. ( 1) 1)
|
| [18] | 米见对, 郭旭生, 周建伟, 等.日粮氮水平对牦牛瘤胃发酵参数和氮组分的影响[J]. 中国农业科学, 2011, 44(22):4678-4686. ( 1) 1)
|
| [19] | 罗佳捷, 张彬, 兰欣怡, 等.动物生产中挥发性脂肪酸的研究进展[J]. 饲料博览, 2012(3):10-12. ( 1) 1)
|
| [20] | 许贵善, 刁其玉, 纪守坤, 等.不同饲喂水平对肉用绵羊能量与蛋白质消化代谢的影响[J]. 中国畜牧杂志, 2012, 48(17):40-44. ( 3) 3)
|
| [21] | 齐景伟.营养限制和补偿生长对母羊和羔羊的生长轴激素及其受体基因表达水平的影响[D]. 博士学位论文.呼和浩特:内蒙古农业大学, 2006. ( 1) 1)
|
| [22] | TEIXEIRA I A M A, FILHO J M P, MURRAY P J, et al.Water balance in goats subjected to feed restriction[J]. Small Ruminant Research, 2006, 63(1/2):20-27. ( 1) 1)
|
| [23] | 霍小东, 贾志海, 张微, 等.限饲对辽宁绒山羊生产性能及消化代谢的影响[J]. 中国畜牧杂志, 2012, 48(23):39-43. ( 3) 3)
|
| [24] | LONG R J, DONG S K, HU Z Z, et al.Digestibility, nutrient balance and urinary purine derivative excretion in dry yak cows fed oat hay at different levels of intake[J]. Livestock Production Science, 2004, 88(1/2):27-32. ( 2) 2)
|
| [25] | 钟伟, 李光玉, 罗国良, 等.限饲对东北梅花鹿消化代谢及尿嘌呤衍生物排出量的影响[J]. 饲料工业, 2009(21):44-47. ( 1) 1)
|
| [26] | SINGH P, VERMA A K, SAHU D S, et al.Utilization of nutrients as influenced by different restriction levels of feed intake undersub-tropical conditions in crossbred calves[J]. Livestock Science, 2008, 117(2):308-314. ( 1) 1)
|
| [27] | GEORGE S K, DIPU M T, MEHRA U R, et al.Growth of crossbred bulls affected by level of feed intake[J]. Indian Journal of Animal Nutrition, 2005, 22(2):81-84. ( 1) 1)
|
| [28] | TYRRELL H, MOE R P W.Effect of intake on digestive efficiency[J]. Journal of Dairy Science, 1975, 58(8):1151-1163. ( 1) 1)
|
| [29] | 冯仰廉.反刍动物营养学[M]. 北京:科学出版社, 2004. ( 1) 1)
|
| [30] | 冯仰廉, 韩继福, 莫放, 等.生长肥育阉牛饲料蛋白质转化效率的研究[J]. 中国畜牧杂志, 1998, 34(5):3-4. ( 1) 1)
|
| [31] | 钟铖, 方国玺, 李凤双.青山羊生长期蛋白质需要量的研究[J]. 畜牧兽医学报, 1988(S1):32-38. ( 1) 1)
|
| [32] | 王莹, 魏炳栋, 邱玉朗, 等.舍饲绵羊生长阶段绝食代谢研究[J]. 畜牧与饲料科学, 2009, 30(4):46-47. ( 1) 1)
|
| [33] | 韩兴泰.影响反刍动物绝食代谢的因素[J]. 青海畜牧兽医杂志, 1990, 88(4):31-34. ( 1) 1)
|
| [34] | 魏炳栋, 邱玉朗, 万伶俐.舍饲肉羊生长期能量和蛋白质代谢特点及需要量的研究[J]. 饲料博览, 2010(7):5-8. ( 1) 1)
|
| [35] | 梁贤威, 杨炳壮, 文秋燕, 等.18月龄生长母水牛绝食代谢的研究[J]. 中国草食动物, 2005, 25(2):15-16. ( 1) 1)
|




