硬脂酰辅酶A去饱和酶1(SCD1)是Δ9脂肪酸去饱和酶家族成员之一,是催化单不饱和脂肪酸生物合成的限速酶,其首选底物是软脂酰辅酶A和硬脂酰辅酶A,分别转化生成棕榈酰辅酶A和油酰辅酶A,这些单不饱和脂肪酸是甘油三酯和膜磷脂的重要组分,对于维持细胞生理活动具有重要作用[1, 2, 3]。SCD1基因广泛分布于多种组织之中,尤其是在肝脏中高表达,并能够被高碳水化合物饲粮所诱导,因此,SCD1可能在肝脏能量和脂肪酸代谢方面发挥重要作用。SCD1基因的调控过程是非常复杂的,因为细胞内去饱和酶活性和营养、激素等多种因素有关,SCD1基因是这些刺激因素的主要靶点,主要通过基因的转录水平和蛋白质的快速降解而改变酶活[4]。SCD1 N端的30个氨基酸能够通过泛素依赖蛋白酶体机制快速被降解[5, 6];营养、激素、外部环境等诸多因素都能影响SCD1基因转录水平的表达[7, 8, 9, 10, 11, 12]。鹅肥肝的形成基础主要是通过强饲高能饲粮破坏鹅肝脏脂肪酸平衡,使得大量脂肪酸在肝脏内累积;而碳水化合物、脂肪酸代谢平衡对于维持肝细胞的正常代谢起到重要作用。SCD1基因在肝脏脂肪从头合成中起到重要作用,SCD1基因表达量及酶活性高低对鹅肥肝中脂肪酸的沉积和组成具有影响。多种碳水化合物能够刺激SCD1基因表达,研究发现,与常规饲粮相比,高果糖饲粮能够强烈诱导SCD1基因表达[13]。包括胰岛素在内的多种激素都是SCD1基因转录的强有力催化剂,它能够通过调控固醇调节元件结合蛋白1(SREBP-1)基因转录从而调节肝细胞中脂肪合成相关基因的表达[14]。因此,研究营养及激素对鹅肝细胞中脂肪代谢关键基因表达量的影响,对解释它们对肝脏脂肪酸代谢的影响具有重要意义。本研究以朗德鹅胚原代肝细胞为试验对象,通过添加不同浓度果糖和胰岛素处理,检测其对肝细胞SCD1基因表达量的影响,以探讨果糖和胰岛素在肝细胞脂肪代谢中可能发挥的作用,为进一步阐释鹅肥肝形成机理提供理论依据。
试验所用朗德鹅种蛋由扬州瑞农科技有限公司提供。种蛋孵化条件为37.5 ℃,湿度为75%~80%,转蛋周期为2 h/次。
无内毒素大提质粒试剂盒、微量总RNA提取试剂盒(带DNA酶)、DNA分子质量标准购自北京天根科技生化有限公司,DMEM、双抗、胶原酶Ⅳ、胎牛血清购自美国Gibco公司,反转录PCR试剂盒和实时定量PCR试剂盒购自大连宝生物工程有限公司;表皮生长因子、果糖和胰岛素购自美国Sigma公司;引物由上海生工生物工程有限公司合成;其余一般化学试剂均为国产分析级。
根据本实验室前期建立的鹅肝细胞分离及培养方法分离23胚龄朗德鹅胚肝细胞[13],铺板于24孔板内,6 h后用磷酸盐缓冲液冲洗后换为含10%胎牛血清的DMEM培养液,在38 ℃、5% CO2环境中孵育培养。待细胞长至培养孔70%左右改为无血清DMEM培养液,并按照试验要求向培养的鹅胚原代肝细胞中加入果糖和胰岛素。果糖单独添加试验中果糖终浓度分别为0、10、30、50 mmol/L;胰岛素单独添加试验中胰岛素终浓度0、50、100、200 nmol/L;果糖和胰岛素联合添加试验中按以下终浓度组合:10 mmol/L果糖+50 nmol/L胰岛素、10 mmol/L果糖+200 nmol/L胰岛素、50 mmol/L果糖+50 nmol/L胰岛素、50 mmol/L果糖+200 nmol/L胰岛素。继续培养48 h,每个处理设3个重复,每个孔为1个重复,所有试验均为同一批次分离的鹅胚原代肝细胞。
根据微量总RNA提取试剂盒操作说明提取试验处理48 h后的鹅胚原代肝细胞总RNA。反转录体系为10 μL:5×PrimeScript Buffer 2.0 μL,PrimeScript RT Enzyme Mix Ⅰ 0.5 μL,Oligo dT Rrimer(50 μmol/L)0.5 μL,Random 6 mers(100 μmol/L) 0.5 μL,总RNA 400 ng,用RNase Free H2O补足10 μL。反转录条件为37 ℃ 15 s,85 ℃ 5 s。反转录产物cDNA放于-20 ℃备用。
采用SYBR Green法检测SCD1基因表达量。SCD1基因引物设计参照本实验室前期扩增获得的序列(GenBank登录号HQ197924.1),上游引物5′-CACCTGGCTAGTGAACAG-3′,下游引物5′-AACTCACTGGTGGAGTAGTC-3′;内参基因甘油醛-3-磷酸脱氢酶(GAPDH)上游引物5′-GCCATCAATGATCCCTTCAT-3′,下游引物5′-CTGGGGTCACGCTCCTG-3′。实时定量PCR采用20 μL体系:10.0 μL SYBR Premix Ex Taq,0.8 μL上游引物(10 μmol/L),0.8 μL下游引物(10 μmol/L),0.4 μL ROX Reference Dye Ⅱ,1.0 μL cDNA模板,7.0 μL dH2O。实时定量PCR条件为:95 ℃ 30 s预变性;95 ℃ 5 s变性,60 ℃ 34 s退火,72 ℃ 15 s延伸反应,40个循环;每个cDNA模板设3个重复。采用2-△△Ct法相对定量目的基因的表达量[14]。
结果以平均值±标准差表示。使用SPSS 17.0统计分析软件ANOVE方法进行数据分析。
初分离肝细胞呈单个圆球形,胞质透亮,细胞膜清晰(图1-A)。培养24 h后细胞已经贴壁生长,且形态开始发生改变,变为多形态(图1-B)。培养36 h后细胞进一步生长并有部分连在一起(图1-C)。
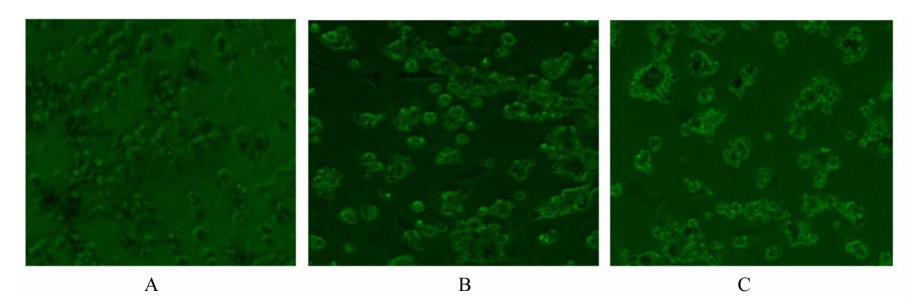 | 图1 鹅胚原代肝细胞形态
Fig.1 The morphous of primary germinal hepatocytes of geese (100×) |
所提取的细胞总RNA经核酸浓度测定仪测定,总RNA样品OD260 nm/OD280 nm均在1.8~2.0。琼脂糖凝胶快速电泳显示所提取的总RNA具有清晰的28S、18S条带(图2),这表明所提总RNA纯度高、无降解,质量能够满足实时定量PCR试验要求。
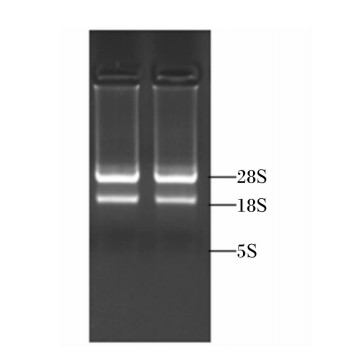 | 图2 总RNA琼脂糖电泳图
Fig.2 Agarose gel electrophoresis of total RNA |
由图3可以看出,当添加果糖浓度为10 mmol/L时,SCD1基因表达量极显著升高(P<0.01);但高浓度果糖(30和50 mmol/L)并没有使肝细胞SCD1基因表达量发生显著变化(P>0.05)。
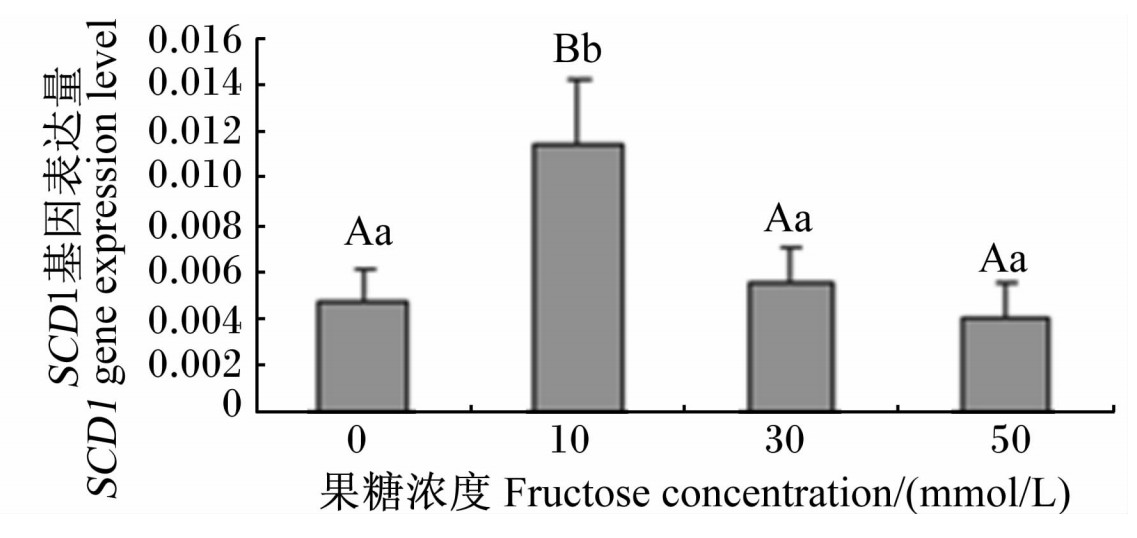 | 图3 不同浓度果糖对鹅胚原代肝细胞 SCD1基因表达量的影响 Fig.3 Effects of different concentrations of fructose on SCD1 gene expression level in primary germinal hepatocytes of geese |
由图4可以看出,当胰岛素浓度为200 nmol/L时,鹅胚原代肝细胞中SCD1基因表达量极显著升高(P<0.01);而低浓度胰岛素(50、100 nmol/L)对SCD1基因表达量的影响不显著(P>0.05)。
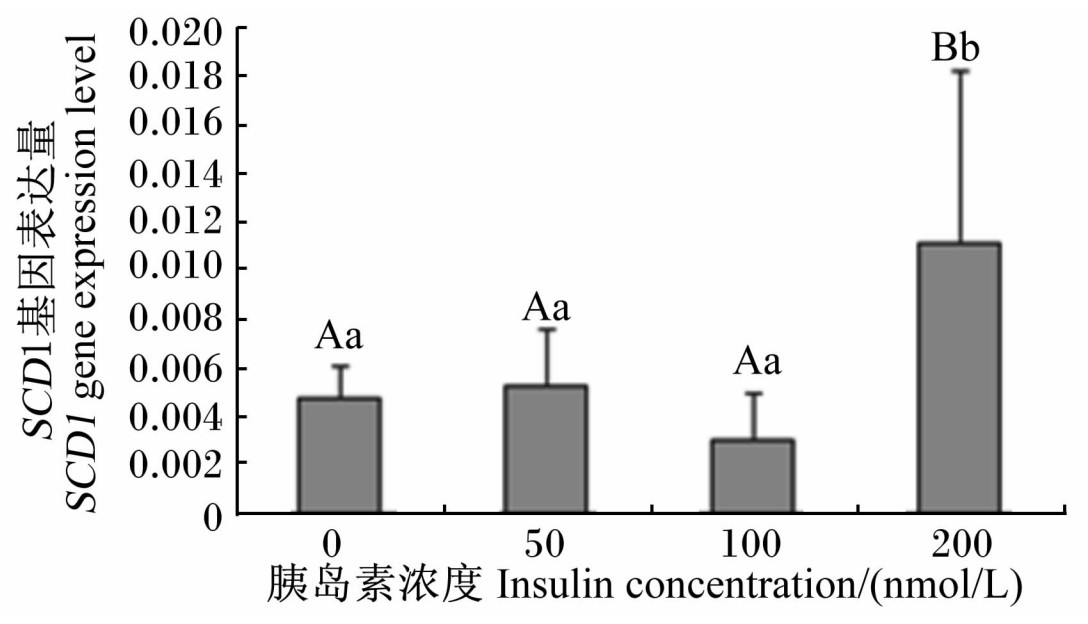 | 图4 不同浓度胰岛素处理对鹅胚原代肝细胞SCD1基因表达量的影响
Fig.4 Effects of different concentrations of insulin on SCD1 gene expression level in primary germinal |
由图5可以看出,添加不同浓度果糖和胰岛素协同处理均会造成鹅胚原代肝细胞SCD1基因表达量极显著升高(P<0.01),且以10 mmol/L果糖+50 nmol/L胰岛素协同处理时SCD1基因表达量增幅最大,但10 mmol/L果糖+50 nmol/L胰岛素、10 mmol/L果糖+200 nmol/L胰岛素、50 mmol/L果糖+50 nmol/L胰岛素、50 mmol/L果糖+200 nmol/L胰岛素处理之间SCD1基因表达量无显著差异(P>0.05)。
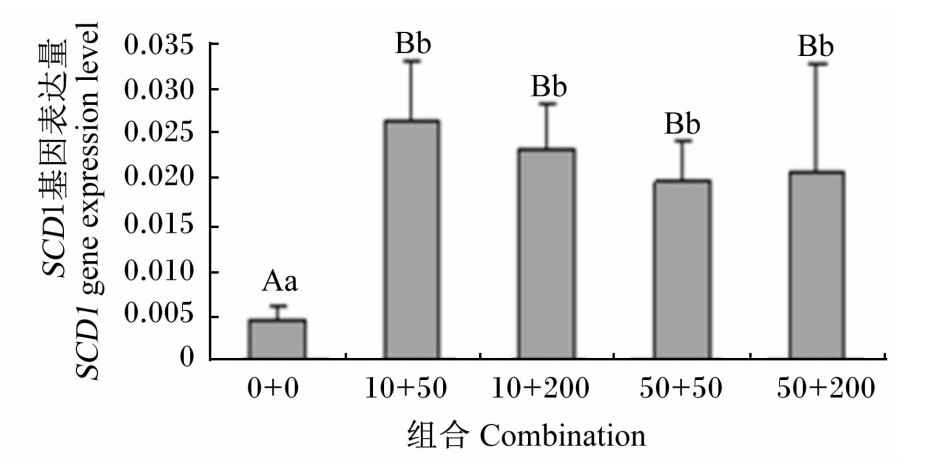 | 图5 不同浓度果糖和胰岛素协同对鹅胚原代肝细胞 SCD1基因表达量的影响 Fig.5 Effect of the combination of different concentrations of fructose and insulin on SCD1 gene expression level in primary germinal hepatocytes of geese |
肝脏是禽类脂肪代谢的主要场所,约90%的脂肪代谢发生在肝脏部位,因此研究禽类肝脏中脂肪代谢调控具有重要意义。肥肝生产过程中大多通过填饲高碳水化合物饲粮以破坏肝脏脂质代谢平衡,使脂肪在肝脏部位大量沉积。果糖属于单糖,能与肠黏膜上皮细胞载体蛋白结合被吸收,在肝内与果糖激酶发生作用生成1-磷酸果糖。在1-磷酸果糖醛缩酶的作用下生成磷酸二羟丙酮和甘油醛。甘油醛通过甘油醛激酶的磷酸化作用生成3-磷酸甘油醛。此产物与磷酸二羟丙酮经糖酵解途径氧化分解或经糖异生合成糖元。已有的试验数据表明,慢性高果糖饲喂大鼠会诱导其肝内脂肪沉积和肝内胰岛素抗性的发生,同时会增加脂肪的从头合成[15]。Waters等[16]试验发现饲喂果糖的小鼠在6 h内SCD1基因表达量上升2倍,而在24 h内SCD1基因表达量升高23倍。任路平等[17]研究发现,高果糖饲料能够增加肝脏脂质沉积并能刺激SCD1基因表达。Miyazaki等[13]研究表明,果糖通过SREBP-1c依赖和SREBP-1c非依赖方式刺激SCD1基因表达。本试验结果表明,低浓度果糖显著增加鹅胚原代肝细胞SCD1基因表达量,而高浓度果糖并没有使肝细胞SCD1基因表达量发生显著变化。本试验结果中低浓度果糖刺激SCD1基因表达量升高的原因可能是低浓度果糖通过基因转录、mRNA加工及稳定性及翻译等作用促进生脂基因的表达,进而促进脂肪的合成。而高浓度果糖引起肝细胞中SCD1基因表达量下降的原因可能是由于高果糖导致渗透压升高引起部分细胞凋亡。
长期以来胰岛素被认为是调节脂肪生成的主要因素,它能够增强脂肪组织中脂蛋白酯酶活性及促进脂肪酸在脂肪组织中的重酯化作用,从而促进脂肪的沉积和抑制脂肪酸动员[18]。胰岛素对SCD1基因转录的作用的特性主要集中在脂肪组织和肝细胞中研究,已经证明在多个物种上胰岛素是SCD1基因转录的强有力催化剂。胰岛素能够通过转录因子SREBP-1c基因激活SCD1基因转录,共转染和活体试验表明,SREBP-1c基因在肝脏组织中对SCD1基因转录激活起主要作用[19, 20]。在鸡胚胎肝细胞和HepG2细胞上的研究表明,胰岛素通过锚定在SCD1基因启动子区2个胰岛素效应元件上,从而激活磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)以及哺乳动物雷帕霉素靶蛋白(mTOR)依赖的信号通路,激活SCD1基因转录[21]。Han等[22]研究发现,100和150 nmol/L胰岛素能够增加鹅肝细胞甘油三酯累积,提高乙酰辅酶A羧化酶α(ACCα)、脂肪酸合成酶(FAS)活性,提高SREBP-1、FAS和ACCα基因表达量;而高胰岛素浓度能够抑制鹅肝细胞甘油三酯累积,降低ACCα、FAS活性,提高SREBP-1、FAS和ACCα基因表达量。本试验胰岛素浓度为200 nmol/L时,鹅胚原代肝细胞中SCD1基因表达量极显著升高;而低浓度胰岛素(50、100 nmol/L)对SCD1基因表达量的影响不显著。SREBP-1c在细胞内质网上被合成,接着转运到高尔基体,高尔基体裂开后释放出成熟形式,再转运到细胞核,它能够传导胰岛素信号发挥作用[23]。本试验发现低浓度胰岛素对鹅胚原代肝细胞SCD1基因表达量无显著影响,而高浓度胰岛素能够显著增加SCD1基因表达量。
在哺乳动物的研究中表明,胰岛素和葡萄糖对脂肪生成具有显著的协同作用[24, 25]。韩春春等[26]研究结果显示,胰岛素和葡萄糖共培养能够增强鹅肝细胞FAS活性和基因的表达量。但关于果糖和胰岛素协同处理对肝细胞SCD1基因表达量的影响还未见报道,本试验结果表明,添加不同浓度果糖和胰岛素协同处理都会造成鹅胚原代肝细胞SCD1基因表达量极显著升高,且以10 mmol/L果糖+50 nmol/L胰岛素协同处理肝细胞时SCD1基因表达量升高幅度最大,但10 mmol/L果糖+50 nmol/L胰岛素、10 mmol/L果糖+200 nmol/L胰岛素、50 mmol/L果糖+50 nmol/L胰岛素、50 mmol/L果糖+200 nmol/L胰岛素处理之间SCD1基因表达量无显著差异。胰岛素和果糖共同添加增加SCD1基因表达量可能的原因是胰岛素能够促进果糖的吸收,增加生脂基因SCD1基因的表达量。
① 10 mmol/L果糖能够极显著上调鹅胚原代肝细胞SCD1基因表达量,30、50、100 mmol/L果糖对SCD1基因表达量均无显著影响。
② 200 nmol/L胰岛素能够显著上调SCD1基因表达量。
③ 10 mmol/L果糖和200 nmol/L胰岛素协同作用能极显著上调SCD1基因表达量。
④ 适宜的果糖、胰岛素单独添加以及协同作用均能上调鹅胚原代肝细胞SCD1基因表达量。
| [1] | ENOCH H G, CATALÁ A, STRITTAMTTER P.Mechanism of rat liver microsomal stearyl-CoA desaturase.Studies of the substrate specificity, enzyme-substrate interactions, and the function of lipid[J]. Journal of Biological Chemistry, 1976, 251(16):5095-5103. ( 1) 1)
|
| [2] | DOBRZYN A, NTAMBI J M.The role of stearoyl-CoA desaturase in the control of metabolism[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2005, 73(1):35-41. ( 1) 1)
|
| [3] | FLOWERS M T, NTAMBI J M.Role of stearoyl-coenzyme A desaturase in regulating lipid metabolism[J]. Current Opinion in Lipidology, 2008, 19(3):248-256. ( 1) 1)
|
| [4] | NTAMBI J M.Regulation of stearoyl-CoA desaturase by polyunsaturated fatty acids and cholesterol[J]. Journal of Lipid Reseach, 1999, 40(9):1549-1558. ( 1) 1)
|
| [5] | MZIAUT H, KORZA G, OZOLS J.The N terminus of microsomal delta 9 stearoyl-CoA desaturase contains the sequence determinant for its rapid degradation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(16):8883-8888. ( 1) 1)
|
| [6] | KATO H, SAKAKI K, MIHARA K.Ubiquitin-proteasome-dependent degradation of mammalian ER stearoyl-CoA desaturase[J].Journal of Cell Science, 2006, 119:2342-2353.( 1) 1)
|
| [7] | 蒋越, 高运臻, 何侃, 等.遗传与营养因素对猪LDLR与SCD基因表达的影响[J]. 上海交通大学学报:农业科学版, 2010, 28(4):315-318. ( 1) 1)
|
| [8] | 陈才, 屈小丹, 富俊才.葵花籽对羊组织共轭亚油酸沉积及相关酶基因表达的影响[J]. 中国农业大学学报, 2012, 17(1):110-118. ( 1) 1)
|
| [9] | NTAMBI J M.Dietary regulation of stearoyl-CoA desaturase 1 gene expression in mouse liver[J]. Journal of Biological Chemistry, 1992, 267(15):10925-10930. ( 1) 1)
|
| [10] | BRYZGALOVA G, LUNDHOLM L, PORTWOOD N, et al.Mechanisms of antidiabetogenic and body weight-lowering effects of estrogen in high-fat diet-fed mice[J]. American Journal of Physiology-endocrinology and Metabolism, 2008, 295(4):E904-E912. ( 1) 1)
|
| [11] | COHEN P, MIYAZAKI M, SOCCI N D, et al.Role for stearoyl-CoA desturase-1 inleptin-mediated weight loss[J]. Science, 2002, 297:240-243. ( 1) 1)
|
| [12] | FLOWERS M T, KELLER M P, CHOI Y, et al.Liver gene expression analysis reveals endoplasmic reticulum stress and metabolic dysfunction in SCD1-deficient mice fed a very low-fat diet[J]. Physiological Genomics, 2008, 33(3):361-372. ( 1) 1)
|
| [13] | MIYAZAKI M, DOBRZYN A, MAN W C, et al.Stearoyl-CoA desaturase 1 gene expression is necessary for fructose-mediated induction of lipogenic gene expression by sterol regulatory element-binding protein-1c-dependent and-independent mechanisms[J]. Journal of Biological Chemistry, 2004, 279(24):25164-25171. ( 3) 3)
|
| [14] | KIM J B, SARRAF P, WRIGHT M, et al.Nutritional and insulin regulation of fatty acid synthetase and leptin gene expression through ADD1/SREBP1[J]. Journal of Clinical Investigation, 1998, 101(1):1-9. ( 2) 2)
|
| [15] | 洪胜辉, 张军, 邵丹, 等.鹅肝细胞的高纯分离及培养[J]. 中国兽医学报, 2012, 32(9):1378-1380, 1385. ( 1) 1)
|
| [16] | WATERS K M, NTAMBI J M.Insulin and dietary fructose induce stearoyl-CoA desaturase 1 gene expression of diabetic mice[J]. Journal of Biological Chemistry, 1994, 269(44):27773-2777. ( 1) 1)
|
| [17] | 任路平, 宋光耀, 章冬梅, 等.短期高果糖喂养对小鼠肝脏脂质沉积和胰岛素敏感性的影响[J]. 中国病理生理杂志, 2011, 27(12):2286-2290. ( 1) 1)
|
| [18] | EMERY R S.Biosynthesis of milk fat[J]. Journal of Dairy Science, 1973, 56(9):1187-1195. ( 1) 1)
|
| [19] | NTAMBI J M, SESSLER A M, TAKOVA T.A model cell line to study regulation of stearoyl-CoA desaturase gene 1 expression by insulin and polyunsaturated fatty acids[J]. Biochemical and Biophysical Research Communications, 1996, 220(3):990-995. ( 1) 1)
|
| [20] | LEFEVRE P, DIOT C, LEGRAND P, et al.Hormonal regulation of stearoyl coenzyme-A desaturase 1 activity and gene expression in primary cultures of chicken hepatocytes[J]. Archives of Biochemistry and Biophysics, 1999, 368(2):329-337. ( 1) 1)
|
| [21] | MAUVOISIN D, ROCQUE G, ARFA O, et al.Role of the PI3-kinase/mTOR pathway in the regulation of the stearoyl CoA desaturase (SCD1) gene expression by insulin in liver[J]. Journal of Cell Communication and Signaling, 2007, 1(2):113-125. ( 1) 1)
|
| [22] | HAN C, WANG J, ZHANG Z, et al.The role of insulin and glucose in goose primary hepatocyte triglyceride accumulation[J]. Journal of Experimental Biology, 2009, 212(10):15553-15558. ( 1) 1)
|
| [23] | FERR P, FOUFEELE F.SREBP-1c transcription factor and lipid homeostasis:clinical perspective[J]. Hormone Research, 2007, 68(2):72-82. ( 1) 1)
|
| [24] | DENTIN R, GIRARD J, POSTIC C.Carbohydrate responsive element binding protein (ChREBP) and sterol regulatory element binding protein-1c(SREBP-1c):two key regulators of glucose metabolism and lipid synthesis in liver[J]. Biochimie, 2005, 87(1):81-86. ( 1) 1)
|
| [25] | KOO S H, DUTCHER A K, TOWLE H C.Glucose and insulin function through two distinct transcription factors to stimulate expression of lipogenic enzyme genes in liver[J]. Journal of Biological Chemistry, 2001, 276(12):9437-9445. ( 1) 1)
|
| [26] | 韩春春, 王继文, 符自英, 等.葡萄糖和胰岛素对鹅肝细胞脂肪酸合成酶活性及转录表达的影响[J]. 农业生物技术学报, 2009, 17(4):634-637. ( 1) 1)
|




