铁(Fe)是生命有机体的必需营养素,在能量代谢、DNA复制、氧的运输、抗体生成、肝脏解毒及保护机体免受氧化应激等诸多生理过程中发挥着重要作用[ 1 ]。微生物也不例外,Fe参与微生物的电子传递、糖酵解、DNA合成及对抗自由基损伤等诸多生理代谢过程,对微生物的正常生长、增殖具有重要意义[ 2 ]。从宿主体内获取生长、繁殖所必需的Fe,是病原菌侵染宿主的前提。因此,控制病原菌的Fe摄取在机体抵抗病原菌侵染中发挥着关键作用。
1 哺乳动物的Fe代谢哺乳动物细胞摄取Fe的方式主要有3种[ 2 ](图1):1)细胞通过膜上的转铁蛋白受体(transferrin receptor,TFR)与血液中的转铁蛋白结合摄取Fe[ 3 ];2)肠腔中游离的Fe3+经十二脂肠细胞色素b还原酶(duodenal cytochrome b reductase,DCYTB)还原成Fe2+后,通过小肠黏膜细胞刷状缘上的二价金属转运载体1(divalent metal transporter 1,DMT1)转入胞内;3)血红素铁(血红蛋白或结合珠蛋白形式)可通过巨噬细胞膜上的血红蛋白清道夫受体——分化抗原簇163(cluster of differentiation 163,CD163)进入胞内。Fe进入胞内后,有的进入线粒体,用以合成血红素、铁硫簇(Fe-S cluster)等,进而参与机体氧的转运及电子传递等代谢过程;有的以铁蛋白的形式存在于胞内;还有部分Fe经转运进入血液循环系统,参与机体多种生理机能。肠上皮细胞内Fe的转出主要由肠绒毛上皮细胞膜上的铁转运蛋白(ferroportin,FPN)完成,转出的Fe2+在血浆铜蓝蛋白或小肠细胞膜铁转运辅助蛋白作用下成为Fe3+。此过程受肝脏分泌的铁调激素调控,当体内Fe浓度增高时,铁调激素表达量增加,诱导FPN降解,抑制胞内Fe转出,同时抑制Fe吸收;当体内Fe浓度低时,铁调激素表达量减少,FPN将胞内Fe转出进入循环系统,同时增加肠黏膜Fe的吸收率[ 4 ]。
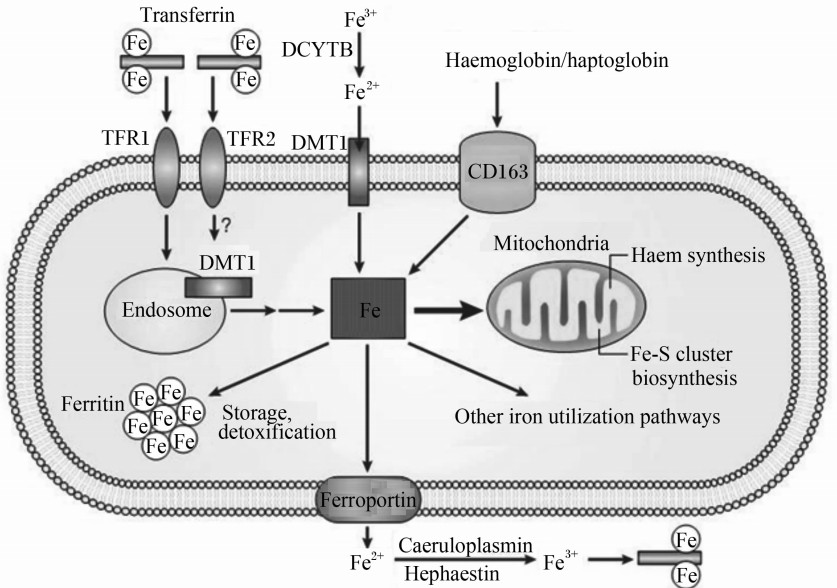 | 图1 宿主的Fe代谢 Fig.1 Iron metabolism in the host[ 2 ] |
Fe在微生物的生长、繁殖、代谢过程中具有很重要的作用。研究指出,病原菌在Fe浓度极低的环境中亦能正常生长,并感染宿主。这是由于这些病原菌具有高效的Fe摄取机制,能够从周围环境中摄取Fe,满足自身需要[ 5,6 ]。目前已知的3种病原菌Fe摄取机制为:嗜铁素系统、血红素获取系统和转铁蛋白/乳铁蛋白受体[ 1 ](图2)。嗜铁素与Fe的结合常数超过1050,使细菌能够高效获取环境中的Fe。负载Fe的嗜铁素能与细菌表面的受体共价结合,将Fe-嗜铁素复合物摄入细胞内,然后再释放出游离Fe作为细菌的营养物质。血红素获取系统主要通过细菌表面的血红素结合蛋白受体,从血红蛋白中获取血红素,转运进入细菌胞内,然后在血红素氧化酶或逆铁螯合酶的作用下,将Fe从血红素上解离下来。有些细菌具有转铁蛋白和乳铁蛋白受体,可以直接识别宿主转铁蛋白和乳铁蛋白,从宿主细胞中获取Fe[ 6,7 ]。
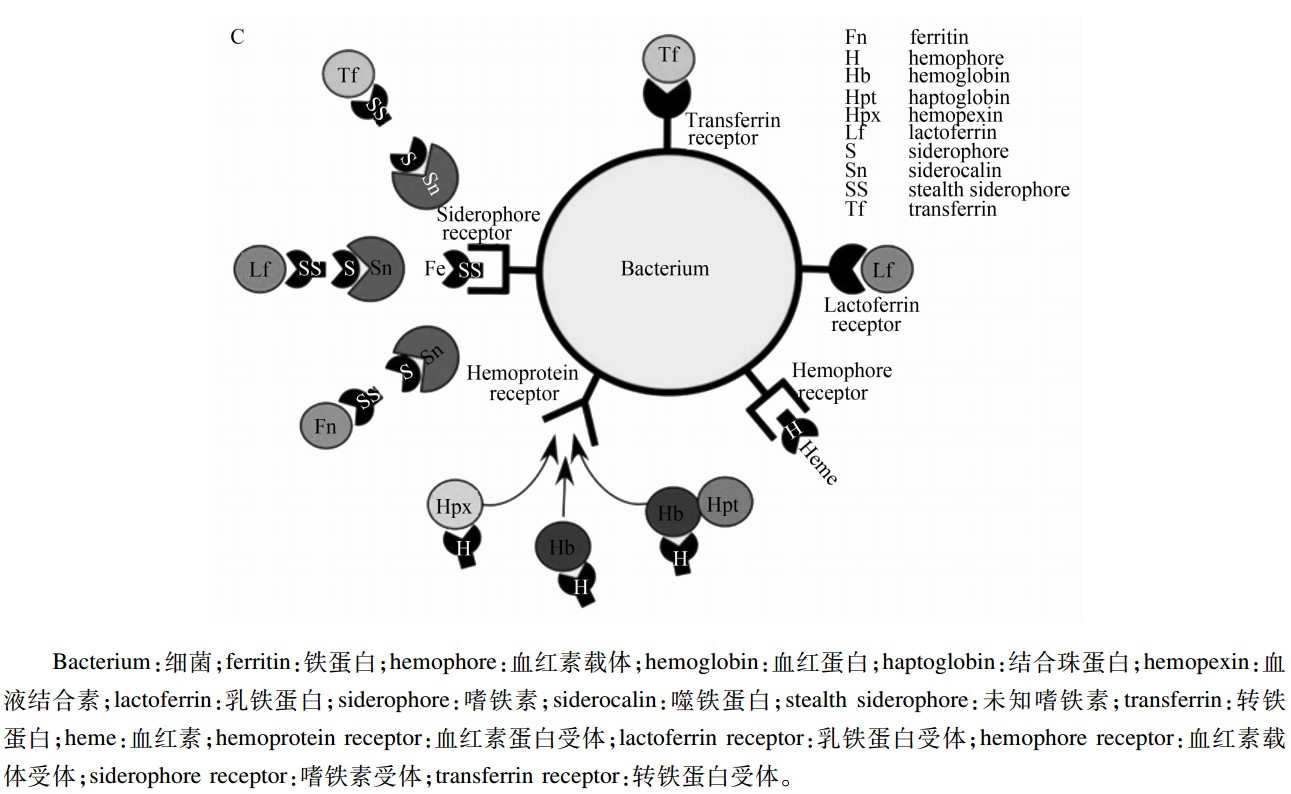 | 图2 病原菌的Fe摄取机制Fig.2 Iron uptake mechanism of bacterial pathogens[ 1 ] |
正常生理条件下,哺乳动物体内游离Fe的浓度很低,使体内细菌处于Fe饥饿状态,从而抑制其生长、繁殖,防止感染的发生,这是机体对抗病原菌侵染的第1道防线[ 8 ]。为了从宿主体内获取生长、繁殖、代谢所需要的Fe,细菌进化出了高效的Fe摄取系统。对此,动物机体也有一些竞争机制,限制细菌对Fe的摄取,从而抑制细菌(尤其是病原菌)的增殖。因此,宿主与病原菌之间Fe的竞争是机体对抗病原菌侵染的重要方式,对机体健康具有重要意义。
动物机体参与Fe竞争的蛋白因子有多种,二价金属转运载体、细胞色素b、遗传性血色病蛋白、铁调节蛋白、铁蛋白、FPN等参与机体Fe平衡代谢的蛋白因子均参与Fe竞争。感染发生时,机体会上调Fe摄入相关蛋白的表达,下调FPN等Fe转出相关蛋白的表达,将体内Fe大量转入胞内,与铁蛋白形成复合物贮存起来,降低细胞外液中Fe的浓度,抑制病原菌摄取Fe,从而抑制感染的发生。
脂质运载蛋白2(lipocalin-2,Lcn-2)是研究较为广泛的一种参与Fe竞争的蛋白因子,该蛋白因子又称噬铁蛋白、NGAL、24p3等。Flo等[ 9 ]运用基因芯片筛选技术首次发现小鼠Lcn-2可与负载Fe的大肠杆菌嗜铁素结合,抑制大肠杆菌对Fe的摄取,从而发挥抗菌作用。Saiga等[ 10 ]利用Lcn-2基因缺陷型小鼠研究发现,病原菌感染后,机体通过Toll样受体信号通路激活Lcn-2表达,抑制胞内Fe的释放,防止结核分枝杆菌对肺泡上皮细胞的感染。Bellmann-Weiler等[ 11 ]研究发现,Lcn-2能够显著抑制硫酸铁(FeSO4)刺激的小鼠胞内肺炎衣原体(Chlamydia pneumoniae)增殖,这也说明了Lcn-2可能通过抑制病原菌摄取Fe的方式来发挥抑菌作用;该研究还发现白细胞介素-10也可以促进胞内铁蛋白的合成,降低Fe的释放,进而发挥抑菌作用。Lcn-2亦在宿主对抗寄生虫感染过程中发挥重要作用。Garénaux等[ 12 ]对禽致病性大肠杆菌的研究证明,鸡Lcn-2同源蛋白Ex-FABP能显著抑制大肠杆菌Fe的摄取,提示Ex-FABP是鸡体内重要的Fe竞争蛋白,该蛋白通过与致病菌竞争Fe,抑制病原菌的生长与增殖。Sazawal等[ 13 ]和Zhao等[ 14 ]研究发现,Fe能刺激疟原虫的增殖,加快感染周期。在疟原虫感染初期,Lcn-2会抑制肠、肝、脾等的贮存Fe向血液中释放,从而抑制疟原虫的生长与增殖;同时,Lcn-2还会刺激单核细胞和巨噬细胞分裂,激活机体天然免疫系统,发挥抗寄生虫作用。Devireddy等[ 15 ]研究发现,小鼠Lcn-2自身并无Fe结合能力,只有与嗜铁素结合后才能与Fe结合;而哺乳动物细胞自身也能产生类似细菌嗜铁素的成分,帮助细胞结合环境中的Fe。
近年来的研究发现,铁调激素也在机体与病原菌的Fe竞争中发挥重要作用。绿脓杆菌、链球菌和伯氏疏螺旋体等病原菌均能刺激动物肝脏、脾脏产生分泌铁调激素,该激素进一步诱导肠黏膜细胞、肝细胞、脾细胞FPN降解,显著降低释放入血的Fe总量;铁调激素还会抑制肠黏膜Fe的吸收,从而抑制侵染进入血液、内脏器官的病原菌摄取Fe[ 16,17 ]。Wang等[ 18 ]和Portugal等[ 19 ]研究发现,在疟原虫感染过程中,肝脏铁调激素的表达量显著上升,血清Fe水平显著下降,从而抑制血液中疟原虫的生长繁殖,这对机体对抗疟疾发挥重要作用。机体Fe代谢因子在免疫应答反应中发挥重要的调节作用。研究发现,Hfe基因缺陷型小鼠的铁调激素水平显著下降,导致巨噬细胞FPN的表达量显著上升,这会引起肿瘤坏死因子-α、白细胞介素-6等因子的水平显著下降,从而导致胞内伤寒沙门氏菌的数量显著增加[ 20,21 ]。进一步研究发现,Fe代谢主要影响Toll 样受体4 (Toll-like receptor 4,TLR4)介导的细胞免疫反应[ 22 ]。
大多数微生物通过高效的Fe摄取系统,从Fe浓度极低的宿主体内获取足够的Fe,满足自身生长、繁殖、代谢等的需要。嗜铁素在细菌Fe竞争中的作用极其重要[ 7,8 ]。大肠杆菌嗜铁素与Fe的解离常数(Kd)为10-49,而转铁蛋白与Fe的Kd则为10-20,嗜铁素螯合Fe的能力远强于哺乳动物的转铁蛋白。宿主肝脏细胞产生的Lcn-2能够与嗜铁素竞争Fe,阻碍细菌摄取Fe[ 23 ]。为了逃避宿主Lcn-2的竞争,有些细菌的嗜铁素发生糖基化修饰或分子线性化,改变分子构象,避免被Lcn-2识别、结合,但其Fe螯合能力并未减弱[ 8 ]。此外,细菌还通过Fe2+转运蛋白AB(ferrous iron transport AB,FeoAB)、ATP结合盒(ATP-binding cassette,ABC)转运蛋白、乳铁蛋白/转铁蛋白/血红素铁转运系统等竞争性摄取内环境中的Fe,维持自身需要[ 7,24 ]。细菌具有极为精细的Fe感知系统,通过铁吸收调节因子(ferric uptake regulator,Fur)参与细菌Fe代谢相关基因的表达调控。当Fe含量丰富时,Fur会结合到铁调节相关基因的上游,抑制这些基因的表达;而当Fe缺乏时,Fur对铁调节相关基因的阻遏作用解除,铁调节相关基因开始表达,帮助细菌摄取Fe,这一机制在细菌Fe竞争中具有重要作用[ 1 ]。Fur还可通过ryhB RNA的反义作用,调节细菌利用Fe相关基因的表达[ 25 ]。
4 Fe对肠道微生物的影响动物肠道中生存的大量微生物多数是益生菌,在营养物质消化吸收、免疫机能调节以及防止病原微生物感染等过程中发挥着重要作用[ 26,27 ];同时,动物肠道中也存在少量的致病菌或条件性致病菌,在正常生理状况下,它们不会引起感染性疾病,但在肠道应激、机体免疫机能降低、饲粮改变等条件下会引起感染。许多研究表明,饲粮Fe水平对肠道微生物组成和肠道健康有显著影响,对幼龄动物的影响尤为明显[ 13 ]。Sazawal等[ 13 ]临床调查研究发现,口服Fe会导致肠道感染几率显著增加,这是由于高浓度未被吸收的Fe会引起结肠菌群结构发生变化,导致致病菌数量显著增加,从而诱发感染。Werner等[ 28 ]分别以不同Fe水平的饲粮饲喂小鼠,结果发现低Fe饲粮(或无Fe饲粮)使鼠肠道益生菌数量增加,而致病菌的数量显著下降。腹泻是全球范围内儿童最为重要的肠道疾病,世界卫生组织(World Health Organization,WHO )和美国国立卫生研究院(National Institutes of Health,NIH)均已就Fe对肠道感染的影响开展相关研究,为儿童合理补Fe提供科学依据[ 29 ]。Zimmermann等[ 30 ]研究指出,预防性补Fe会导致儿童肠道病原菌(如沙门氏菌)数量增加,诱发肠道疾病。Buhnik-Rosenblau等[ 31 ]利用Irp2和Hfe基因缺陷型小鼠进行研究,发现Fe吸收代谢相关基因缺陷会导致小鼠肠道微生物区系发生显著变化,进一步证明了宿主Fe吸收代谢与肠道菌群之间的关系。
饲粮Fe影响肠道微生物的机制尚不清楚。某些益生菌[如植物乳杆菌(L.plantarum)]的生长繁殖并不严格依赖Fe,在缺Fe或低Fe环境中仍能较好生长繁殖,而致病菌几乎都要依赖Fe才能大量繁殖[ 32 ]。多数益生菌与致病菌一样,需通过摄取环境中的Fe以满足自身需要。Valdebenito等[ 33 ]研究发现,与致病性大肠杆菌类似,益生菌Nissle 1917株也产生系列嗜铁素,获取宿主肠道中的Fe,但其不具有致病菌的毒力因子,不会致病。Fe摄取代谢系统与致病菌的毒力密切相关。沙门氏菌Fur与Fe结合后,能够激活HilD(hyperinvasive locus D)蛋白的表达,HilD进而激活其毒力相关蛋白沙门菌毒力岛1(Salmonella pathogenicity island 1,SPI1)的表达,通过Ⅲ型分泌系统增加细菌毒力,侵染宿主细胞[ 34,35 ]。
5 小 结贫血与腹泻是影响仔猪健康的两大重要疾病,而且这2种疾病经常同时发生,对养猪生产的危害极大。为预防仔猪贫血,生产中常通过注射Fe或饲粮添加Fe的方式给仔猪补Fe,然而,不合理地补Fe可能导致仔猪肠道菌群改变,弱化仔猪Fe竞争机制,从而导致病原菌感染发生。因此,本文针对Fe对仔猪肠道菌群组成的影响、宿主细胞与细菌的Fe竞争机制、益生菌与致病菌在Fe摄取过程中的异同点等问题进行研究,为仔猪生产中合理补Fe提供科学依据。
| [1] | SKAAR E P.The battle for iron between bacterial pathogens and their vertebrate hosts[J]. PLoS Pathogens,2010,6(8):e1000949. ( 4) 4)
|
| [2] | SCHAIBLE U E,KAUFMANN S H.Iron and microbial infection[J]. Nature Reviews Microbiology,2004,2(12):946-953. ( 3) 3)
|
| [3] | HENTZE M W,MUCKENTHALER M U,ANDREWS N C.Balancing acts:molecular control of mammalian iron metabolism[J]. Cell,2004,117(3):285-297. ( 1) 1)
|
| [4] | HENTZE M W,MUCKENTHALER M U,GALY B,et al.Two to tango:regulation of mammalian iron metabolism[J]. Cell,2010,142(1):24-38. ( 1) 1)
|
| [5] | WEINBERG E D.Iron availability and infection[J]. Biochimica et Biophysica Acta,2009,1790(7):600-605. ( 1) 1)
|
| [6] | JOHNSON E E,WESSLING-RESNICK M.Iron metabolism and the innate immune response to infection[J]. Microbes and Infection,2012,14(3):207-216. ( 2) 2)
|
| [7] | GARENAUX A,CAZA M,DOZOIS C M.The ins and outs of siderophore mediated iron uptake by extra-intestinal pathogenic Escherichia coli[J].Veterinary Microbiology,2011,153(1/2):89-98. ( 3) 3)
|
| [8] | FISCHBACH M A,LIN H,ZHOU L,et al.The pathogen-associated iroA gene cluster mediates bacterial evasion of lipocalin2[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(44):16502-16507. ( 3) 3)
|
| [9] | FLO T H,SMITH K D,SATO S,et al.Lipocalin2 mediates an innate immune response to bacterial infection by sequestrating iron[J]. Nature,2004,432(7019):917-921. ( 1) 1)
|
| [10] | SAIGA H,NISHIMURA J,KUWATA H,et al.Lipocalin 2-dependent inhibition of mycobacterial growth in alveolar epithelium[J]. The Journal of Immunology,2008,181(12):8521-8527. ( 1) 1)
|
| [11] | BELLMANN-WEILER R,SCHROLL A,ENGL S,et al.Neutrophil gelatinase-associated lipocalin and interleukin-10 regulate intramacrophage chlamydia pneumoniae replication by modulating intracellular iron homeostasis[J]. Immunobiology,2012,218(7):969-978. ( 1) 1)
|
| [12] | GARNAUX A,HOULE S,FOLCH B,et al.Avian lipocalin expression in chickens following Escherichia coli infection and inhibition of avian pathogenic Escherichia coli growth by Ex-FABP[J]. Veterinary Immunology and Immunopathology,2013,152(1/2):156-167. ( 1) 1)
|
| [13] | SAZAWAL S,BLACK R E,RAMSAN M,et al.Effects of routine prophylactic supplementation with iron and folic acid on admission to hospital and mortality in preschool children in a high malaria transmission setting:community-based,randomised,placebo-controlled trial[J]. The Lancet,2006,367(9507):133-143. ( 2) 2)
|
| [14] | ZHAO H,KONISHI A,FUJITA Y,et al.Lipocalin 2 bolsters innate and adaptive immune responses to blood-stage malaria infection by reinforcing host iron metabolism[J]. Cell Host Microbe,2012,12(5):705-716. ( 1) 1)
|
| [15] | DEVIREDDY L R,HART D O,GOETZ D H,et al.A mammalian siderophore synthesized by an enzyme with a bacterial homolog involved in enterobactin production[J]. Cell,2010,141(6):1006-1017. ( 1) 1)
|
| [16] | PEYSSONNAUX C,ZINKERNAGEL A S,DATTA V,et al.TLR4-dependent hepcidin expression by myeloid cells in response to bacterial pathogens[J]. Blood,2006,107(9):3727-3732. ( 1) 1)
|
| [17] | KOENING C L,MILLER J C,NELSON J M,et al.Toll-like receptors mediate induction of hepcidin in mice infected with Borrelia burgdorferi[J]. Blood,2009,114(9):1913-1918. ( 1) 1)
|
| [18] | WANG H Z,HE Y X,YANG C J,et al.Hepcidin is regulated during blood-stage malaria and plays a protective role in malaria infection[J]. The Journal of Immunology,2011,187(12):6410-6416. ( 1) 1)
|
| [19] | PORTUGAL S,CARRET C,RECKER M,et al.Host-mediated regulation of superinfection in malaria[J]. Nature Medicine,2011,17(6):732-737. ( 1) 1)
|
| [20] | CHERAYIL B J.The role of iron in the immune response to bacterial infection[J]. Immunological Research,2011,50(1):1-9. ( 1) 1)
|
| [21] | JOHNSON E E,SANDGREN A,CHERAYIL B J,et al.Role of ferroportin in macrophage-mediated immunity[J]. Infection and Immunity,2010,78(12):5099-5106. ( 1) 1)
|
| [22] | WANG L J,HARRINGTON L,TREBICKA E,et al.Selective modulation of TLR4-activated inflammatory responses by altered iron homeostasis in mice[J]. Journal of Clinical Investigation,2009,119(11):3322-3328. ( 1) 1)
|
| [23] | WILES T J,KULESUS R R,MULVEY M A.Origins and virulence mechanisms of uropathogenic Escherichia coli[J]. Experimental and Molecular Pathology,2008,85(1):11-19. ( 1) 1)
|
| [24] | ARYA G,NIVEN D F.Acquisition of haemoglobin-bound iron by strains of the Actinobacillus minor/‘porcitonsillarum'complex[J].Veterinary Microbiology,2011,148(2/3/4):283-291. ( 1) 1)
|
| [25] | MASSE E,SALVAIL H,DESNOYERS G,et al.Small RNAs controlling iron metabolism[J]. Current Opinion in Microbiology,2007,10(2):140-145. ( 1) 1)
|
| [26] | GAO Q X,QI L L,WU T X,et al.Ability of Clostridium butyricum to inhibit Escherichia coli-induced apoptosis in chicken enembryo intestinal cells[J].Veterinary Microbiology,2012,160(3/4):395-402. ( 1) 1)
|
| [27] | GAO Q X,QI L L,WU T X,et al.An important role of interleukin-10 in counteracting excessive immune response in HT-29 cells exposed to Clostridium butyricum[J].BMC Microbiology,2012,12:100. ( 1) 1)
|
| [28] | WERNER T,WAGNER S J,MARTINEZ I,et al.Depletion of luminal iron alters the gut microbiota and prevents Crohn's disease-like ileitis[J]. Gut,2011,60(3):325-333. ( 1) 1)
|
| [29] | KORTMAN G A,BOLEIJ A,SWINKELS D W,et al.Iron availability increases the pathogenic potential of Salmonella typhimurium and other enteric pathogens at the intestinal epithelial interface[J]. PLoS One,2012,7(1):e29968. ( 1) 1)
|
| [30] | ZIMMERMANN M B,CHASSARD C,ROHNER F,et al.The effects of iron fortification on the gut microbiota in African children:a randomized controlled trial in Coted'Ivoire[J]. American Journal of Clinical Nutrition,2010,92(6):1406-1415. ( 1) 1)
|
| [31] | BUHNIK-ROSENBLAU K,MOSHE-BELIZOWSKI S,DANIN-POLEG Y,et al.Genetic modification of iron metabolism in mice affects the gut microbiota[J]. Biometals,2012,25(5):883-892. ( 1) 1)
|
| [32] | DUHUTREL P,BORDAT C,WU T D,et al.Iron sources used by the nonpathogenic lactic acid bacterium Lactobacillus sakei as revealed by electron energy loss spectroscopy and secondary-ion mass spectrometry[J]. Applied and Environmental Microbiology,2010,76(2):560-565. ( 1) 1)
|
| [33] | VALDEBENITO M,CRUMBLISS A L,WINKELMANN G,et al.Environmental factors influence the production of enterobactin,salmochelin,aerobactin,and yersiniabactin in Escherichia coli strain Nissle 1917[J]. International Journal of Medical Microbiology,2006,296(8):513-520. ( 1) 1)
|
| [34] | ELLERMEIER J R,SLAUCH J M.Fur regulates expression of the Salmonella pathogenicity island 1 type Ⅲ secretion system through HilD[J]. Journal of Bacteriology,2008,190(2):476-486. ( 1) 1)
|
| [35] | TEIXIDO L,CARRASCO B,ALONSO J C,et al.Fur activates the expression of Salmonella enterica pathogenicity island 1 by directly interacting with the hilD operator in vivo and in vitro[J].PLoS One,2011,6(5):e19711. ( 1) 1)
|




