饲料成本是水产养殖成本中最主要的部分,至少会占到50%。鱼粉作为传统的肉食性鱼类饲料中的主要蛋白质源,成为水产饲料成本的重要构成部分。然而,随着海洋环境恶化、渔业资源的不断减少,以及受频繁的厄尔尼诺现象的影响,鱼粉价格不断攀升,2009和2012年价格均曾突破1 800美元/t。鱼粉短缺是全球性的问题,我国是水产养殖大国,鱼粉等优质蛋白质源缺乏的问题更为严峻[ 1,2 ]。某种程度上,鱼粉的质量和使用量决定着饲料的适口性和养殖质量,饲料企业纷纷寻求鱼粉替代蛋白质源以应对世界性鱼粉紧张的局势。其中,牛、羊源性动物蛋白质由于饲用安全性问题,在全球很多国家被禁止在饲料中使用。植物蛋白质由于其资源相对丰富,产量稳定,成为鱼粉替代蛋白质源的研究重点。大部分植物蛋白质都有氨基酸不平衡、适口性差、存在抗营养因子及消化吸收率较低等问题[ 3,4,5 ]。前期研究已经充分证明通过多种蛋白质源的配伍组合,补充外源性限制性氨基酸,可减少某些肉食性鱼类如虹鳟、硬头鲷、大菱鲆等品种饲料中鱼粉的使用量[ 5,6,7 ]。使饲料可消化必需氨基酸水平达到或接近理想蛋白质模式是有效解决蛋白质源紧张,降低氮、磷排放的途径之一。然而,对于大多数肉食性鱼类来说,受植物蛋白质饲料适口性较差的影响,仅通过营养素平衡仍然难以实现高水平替代鱼粉。本文在简述鱼类摄食生理机制的基础上,主要对中枢和外周信号系统调节摄食量的机制及其对鱼类利用植物蛋白质饲料的调控作用进行综述。
1 鱼类摄食生理机制 1.1 影响鱼类摄食的因素摄食是鱼类等水产养殖动物获取营养和能量的唯一途径,动物通过摄食为个体的存活、生长、发育及繁殖等提供物质和能量基础。鱼类的摄食包括摄食行为、摄食量、摄食频率、摄食节律等。集约化水产养殖中,饲料成本通常占养殖成本的60%以上,合理的投喂不仅使养殖动物可以获得充分、平衡的营养,降低饲料用量,提高生长效率,降低养殖成本,还可以减少废物排放,降低渔业污染[ 3,4 ]。然而,许多水产动物的摄食调控机制目前仍然十分模糊。这主要是因为水产动物的摄食调控非常复杂,不仅与其本身的遗传背景有关系,还随年龄、季节、食物类型、食物丰度、营养史等的变化发生变化[ 8,9,10 ]。鱼类的索饵和摄食行为同时受饵料的物理性状和饵料中溶出物引起的化学性刺激的感应。饲料的适口性包括物理性状和化学性状2方面的因素。物理性状包括饲料的粒径、形状、颜色、水中稳定性、硬度(硬颗粒或软颗粒)等,一般可以通过饲料加工工艺的调整与改进达到理想状态;化学性状主要是指饲料本身的气味和味道。鱼类寻找食物要通过视觉、机械感觉和化学感觉,其中的嗅觉已证明对许多鱼类确定食物的位置起重要作用[ 8 ]。但是摄入食物的适口性对一些抢食性较弱或某些肉食性的鱼类来说更为重要。饲料需要同时具有引诱性和适口性才能逐渐被鱼类接受。鱼类摄食行为及其对饲料(包括天然饵料)的嗜好性是一个相当复杂的问题,它与各种内、外因素有着相互密切的关联。因此,要探明鱼类的摄食机制并非易事。20世纪70年代以后,随着电生理与电化学、摄食行为学、营养学以及分子生物学研究的不断进步,鱼类摄食化学感觉和摄食调控有关的知识才得到迅速的积累[ 9,10,11,12,13,14,15 ]。
鱼类的味觉器官是味蕾,散布在身体表面,头部和口唇部最为密集[ 16 ]。除了对氨基酸反应敏感外,鱼类的味蕾还对多种有机酸、核苷和胆酸盐等的痕量溶液有明显反应[ 17 ,18,19 ]。因此,相对而言,鱼类比陆生哺乳动物的味觉更为敏感。
1.2 植物蛋白质饲料对鱼类适口性的影响在鱼粉替代蛋白质源的研究中,无论是动物性还是植物性的替代蛋白质源,它们都会因为本身所存在的一些缺陷,如氨基酸不平衡、必需脂肪酸不足、抗营养因子等因素降低饲料的适口性[ 6,20 ]。某些杂食性和草食性鱼类在摄食选择方面对鱼粉并没有依赖性,但肉食性鱼类普遍对植物蛋白质饲料表现出厌食现象,这也是肉食性鱼类对饲料中鱼粉依赖性较强的主要原因[ 6, 20, 21 ]。因此,对肉食性鱼类饲料中鱼粉替代蛋白质源的应用研究中,摄食是需要解决的首要问题。在饲料中添加适当的促摄食物质,改善替代蛋白质饲料的适口性,提高摄食率,促进生长,是解决这个问题的途径之一。但是,大部分非营养性促摄食物质所起到的作用持续时间较短,或者作用有限,不能从根本上解决肉食性鱼类对植物蛋白质饲料的厌食问题[ 4, 22, 23 ]。张志勇[ 24 ]在对鲈鱼的研究中发现,在饲喂全植物蛋白质饲料的3周内,花鲈持续处于饥饿状态,血浆中生长激素(GH)和神经肽Y(NPY)含量显著高于鱼粉对照组,生长激素受体(GHR)和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)mRNA的表达量显著降低。虽然此时花鲈体内的促摄食神经肽均已反馈到脑中,具有强烈的食欲,但在一定周期内(甚至长达4~8周),花鲈在摄食行为上对全植物蛋白质饲料的表现仍为抢食—吐食—厌食的循环。明显降低的摄食率导致鱼体摄入的营养物质不足,摄食率显著降低是导致摄食低鱼粉饲料的花鲈生长缓慢的最主要因素[ 24 ]。这说明,肉食性鱼类对于食物来源的选择性不完全受机体能量稳态和食欲的调控,长期的主动选择性摄食抑制(厌食症)是其存活率和生长率显著降低的主要原因。
2 鱼类摄食行为的中枢和外周调控机制 2.1 鱼类摄食适应性与哺乳动物类似,鱼类对植物蛋白质饲料存在摄食抑制到适应再到补偿性摄食的行为受中枢和外周脑肠肽(ghrelin)/瘦素(leptin)-NPY/豚鼠相关蛋白(AGRP)和mTOR(mammalian target of rapamycin,该因子不仅仅作用于哺乳动物,现称作mechanistic target of rapamycin,雷帕霉素靶蛋白)-NPY途径的调控[ 25 ]。然而,在一定程度上鱼类还具有独特的摄食适应性行为,如在虹鳟[ 26 ]和异育银鲫[ 4 ]上发现,前期摄食含较高鱼粉饲料再改喂豆粕或肉骨粉为主的饲料时,其摄食率均明显下降。但在摄食14~28 d之后,其摄食率会逐渐出现补偿性反弹,从而产生补偿生长效应。这种对植物蛋白质饲料的适应性也反映在花鲈的摄食行为上。在0~8周摄食明显受到抑制的花鲈,在8~16周逐渐表现出了对高植物蛋白质饲料的适应和摄食补偿现象,相应在这个阶段摄食植物蛋白质饲料组花鲈的特定生长率甚至显著高于鱼粉组[ 24 ]。这一点充分体现了在鱼类的生存竞争中其味觉敏感性和选择性摄食具有较强的可塑性。最适觅食理论(optimal foraging theory)假设:鱼类在觅食过程中的一系列形态、感觉、行为、生态和生理特性等,均为保证鱼类具有最大的摄食生态适应性,而这种适应总是倾向于使鱼类获得最大的净能收益(net energy gain)[ 27 ]。在对夏威夷金枪鱼摄食行为的研究中发现,这种鱼嗜好夏威夷鳀,如果改喂加利福尼亚鳀,最初其对加利福尼亚鳀的摄食量很低,但是,随着驯化时间的延长,其对加利福尼亚鳀的刺激表现的愈来愈兴奋,摄食量也逐渐恢复至正常水平[ 28 ]。由此可见,鱼类选择性摄食调节的高度适应性有利于鱼类的生存,使鱼类能够适应环境的变化。
2.2 鱼类摄食调控因子及分子机制机体能量稳态与摄食量的协调是一个非常复杂的过程,包括一些信号通路和营养感应因子。mTOR是生长因子和营养信号的整合器。哺乳动物中mTOR与其他不同的蛋白结合,形成2种复合体——mTOR复合体1(mTOR complex1,mTORC1)和mTOR复合体2(mTOR complex2,mTORC2)。mTORC1对雷帕霉素敏感,而mTORC2对雷帕霉素不敏感。在下丘脑中,mTORC1几乎参与动物机体所有营养素的代谢调控,其中最主要的功能是对蛋白质、脂肪合成和能量代谢的调控[ 29 ],而mTORC2参与细胞骨架的形成[ 30 ]。目前认为mTOR信号通路的上游调节因子主要有4种,即生长因子、营养要素、能量和环境压力。mTOR参与能量代谢调控过程中对摄食量的调控作用是最为关键的,一旦出现紊乱,则会出现一系列代谢性疾病,如糖尿病和肥胖症等。蛋白质合成最具特色的mTOR下游效应器包括2条信号通路,即真核细胞翻译启始因子4E结合蛋白1(eIF-4E-binding protein 1,4E-BP1)和核糖体蛋白S6激酶(ribosomal protein S6 kinase,S6K),形成2条平行的调节mRNA翻译的信号通路[ 31 ]。在动物摄食调控方面,胞外或胞内的影响因子通过不同的细胞表面受体或靶蛋白将信号传导至mTOR或直接作用于其下游效应器(可能为S6K1,但机制尚不明确),来调节下丘脑中食欲肽的表达[ 32 ]。哺乳动物中已经明确证实mTORC1通过降低下丘脑中促进食欲因子NPY和AGRP的表达抑制动物摄食[ 33,34 ](表1)。动物进化过程中,mTOR基因表现出了高度的保守性,鲤鱼、斑马鱼的mTOR基因与人类的同源性达到90%以上,鲤鱼与斑马鱼的mTOR基因同源性达到97%以上[ 35 ]。目前关于mTOR信号通路调控鱼类蛋白质和氨基酸代谢的研究[ 21, 35, 36 ]较多,但尚没有关于mTOR对其短期或长期摄食调控影响的研究报道。鉴于mTOR在其他动物体内代谢调节功能的重要性,可以推测mTOR同样是鱼类食欲中枢调控的最为重要的上游调控因子之一。与哺乳动物类似,鱼类的食欲同样受中枢和外周信号系统的调控,中枢调控主要在下丘脑区域,该区域整合来自各种物理、代谢或者内分泌的信号,再通过中枢神经系统发出刺激[促进食欲(orexigenci)]或者抑制摄食[抑制食欲(anorexigenic)]的信号[ 13 ](表1)。与哺乳动物相同,ghrelin、神经肽Y家族(NPYs)和leptin也是鱼类最受关注的摄食调控因子。不同因子在不同环境条件下调控功能的重要性不同。对于鱼类来说,不同食性品种、不同营养史都会导致中枢和外周摄食调控因子的显著变化。
| 表1 与摄食调控有关的主要神经肽 Table 1 Major neuropeptides involved in feed intake regulation[ 9 ] |
鱼类与其他动物类似,外周ghrelin和leptin分别是食欲增强和抑制的第一反应信号,而中枢NPY和前鸦片黑皮素原(POMC)信号通路分别在第一时间反馈启动或者停止摄食[ 9 ]。外周调控包括通过脑发出的或者消化道反馈的体液信号,如由胃、肠等合成的ghrelin具有促进生长激素释放、增加食欲等功能,是目前研究发现的唯一的外周分泌的能促进食欲的激素[ 9 ]。下丘脑ghrelin受体激活中枢NPY信号通道,释放NPY和AGRP,抑制POMC通道,引起食欲增强,摄食提高。leptin是外周重要的抑制摄食的因子之一,leptin可与下丘脑进食中枢的leptin受体相结合,抑制NPY/AGRP的表达,进而抑制食欲,也可与饱食中枢的leptin受体结合,促使POMC神经元分泌,释放α-促黑素细胞激素(α-MSH),引起食欲降低和机体能耗增加(图1)。人类的肥胖症和厌食症都是由中枢和外周食欲调控紊乱导致的。
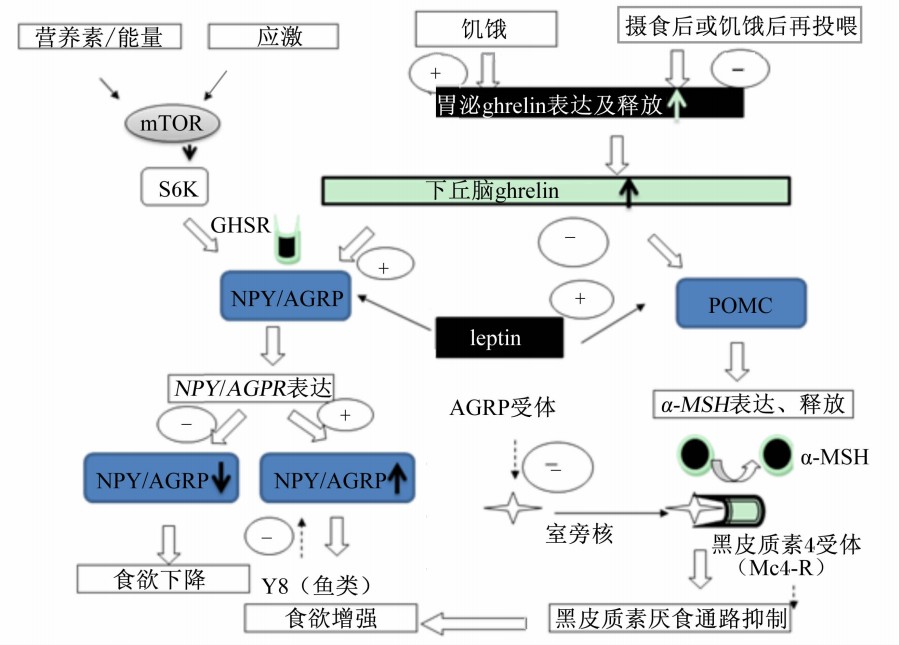 | 图1 中枢和外周mTOR-NYP/AGRP和leptin-NPY/POMC摄食调控途径
Fig.1 mTOR-NYP/AGRP and leptin-NPY/POMC pathways in central and peripheral of feed intake regulation |
NPYs包括NPY、YY肽(PYY)、胰多肽(PP)和Y肽(PY),这些缩氨酸连接的G-蛋白耦合受体组成Y家族,具有5个克隆支,分别命名为Y1、Y2、Y4、Y5和Y6[ 37 ]。NPY在哺乳动物中枢神经系统中有很高的丰度,尤其是在下丘脑核中[ 38 ],鱼类也同样如此[ 15,39 ]。NPY是在哺乳动物中已知的最有效的开胃药[ 38,40 ]。硬骨鱼类中NPY调控摄食的机理与哺乳动物类似。给金鱼、大西洋鲑、斑点叉尾 (Ictalurus punctatus)中枢注射哺乳动物或鱼类NPY会导致剂量依赖的摄食量增加[ 41,42,43,44 ]。给金鱼中枢注射低剂量的Y1或Y5受体激动剂可以诱导摄食量的增加,但注射Y2激动剂则没有显著影响[ 45 ]。这一结果证明NPY在金鱼中通过Y1或Y5受体单独的刺激摄食,这与哺乳动物完全一致。然而,Y1和Y5在草鱼中却可能并不存在,草鱼下丘脑中的主要NPY受体为2种Y8受体[ 15 ]。不同鱼类NPY在摄食调控网络中的重要性会有所区别,它们所拥有的NPY受体也不完全相同,这可能和鱼类食性分化有关[ 15,39 ]。
ghrelin,又称生长激素释放肽,是生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)的内源性配体。ghrelin在胃和脑中合成,在哺乳动物中控制能量平衡和增进食欲,被认为是餐前饥饿及启动摄食的第一信号。内源性ghrelin在空腹时升高,而在餐后迅速下降。肥胖症患者血浆通常有较高的leptin水平,较低的ghrelin水平,厌食症患者则与之相反[ 46 ]。同样,在淡水鳕(Lota lota)中,饥饿降低血浆中ghrelin免疫反应信号并伴随着leptin免疫反应信号的降低[ 47 ]。ghrelin mRNA在鱼类胃/肠中高度表达,并且在脑中检测到其中度表达[ 48,49,50 ]。ghrelin受体cDNA在河豚(Spheroides nephelus)[ 51 ]和黑鲷(Acanthopagrus schlegeli)中被发现并且在垂体和脑中高度表达,尤其是在下丘脑中[ 52 ]。无论中枢还是外周注射金鱼或人类的ghrelin均能促进金鱼摄食[ 48,53 ]。金鱼摄食前、后脑和肠中ghrelin mRNA表达和血清中ghrelin水平的变化进一步证明ghrelin具有促进食欲的作用。但是,给虹鳟中枢一次性注射或外周长期注射ghrelin均导致其摄食降低,该研究发现GHSR存在于虹鳟的中枢神经系统中,并且ghrelin在中枢神经系统中通过促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)介导途径扮演食欲减退激素的角色[ 54 ]。这说明某些鱼类摄食调控关键因子的功能和哺乳动物不同,有些甚至完全相反。
leptin主要由脂肪细胞产生和分泌,但同样也在其他组织中合成,如脑和胃上皮细胞[ 55 ]。leptin是一种多效性激素,对动物脂肪合成代谢、能量平衡及摄食调控等方面均起到重要调控作用[ 47, 56, 57 ]。leptin通过抑制下丘脑促食欲途径和刺激抑制食欲途径来影响摄食(图1)。对银大马哈鱼(Oncorhynchus kisutch)[ 58 ]、鲶鱼[ 44 ]和蓝鳃太阳鱼[ 59 ]的研究显示,leptin处理对摄食和增重没有影响。但在金鱼中,无论外周还是中枢注射鼠源的leptin均会降低摄食[ 60 ]。鱼类具有2个旁系同源的leptin基因——glep-a1和glep-a2。glep-a1广泛的在中枢和外周组织中表达,而glep-a2则优先在脑中表达,说明其可能在金鱼中存在不同的生理功能[ 57, 61, 62 ]。leptin受体——glepR mRNA在组织中广泛的表达,在端脑和下丘脑中表达量最高。
3 鱼类摄食调控的特殊性鱼类饱食后引起短暂摄食抑制与植物蛋白质引起的主动选择性长期的厌食可能存在不同的调控机制,某些调控因子在不同鱼类中的功能可能完全相反。对肉食性鱼类摄食调控网络进行系统研究是解决植物蛋白质高效利用的必要途径。由于人类食物链中的养殖陆生动物均为杂食性,目前关于肉食性陆生动物摄食调控的研究几乎为空白。野生猫科动物作为捕食者通常为肉食性,但是家猫由于生存环境的改变,虽然其食物中仍以动物性食物为止,但是猫粮中搭配较高比例的植物性原料已经十分普遍[ 63 ]。因此,肉食性鱼类,特别是亲本来自于野生群体的品种,其在摄食调控机理方面可能和其他食性动物在关键调控因子的功能上存在较大区别。这种由植物蛋白质引起的主动选择性长期的厌食机制可能与摄食节律饱食后引起短暂摄食抑制调控机制有一定差异。
大西洋鲑和草鱼中均发现中枢NPY对摄食节律引起的短期调控起关键作用,而对长期厌食调控并不是主导因子[ 15,50 ]。脑腔注射重组NPY后,与对照组相比,草鱼摄食量显著增加,但这种摄食促进作用仅在8 h内表现,而且高剂量组较低剂量组促摄食作用反而效果不明显[ 15 ]。对鱼类长期摄食调控机制的研究主要分为2种模式:一种是由环境应激引起的主动选择性摄食抑制[ 49,50 ],植物蛋白质替代鱼粉抑制肉食性鱼类摄食即属于这种模式;另外一种是人为限食模式,即将鱼饥饿一定时间后再恢复投喂所导致的摄食调控因子的变化规律,这种可以归类为被动性摄食抑制[ 64 ]。这2种饥饿模式所诱导的摄食调控机制可能不同,如Fox等[ 49 ]和Hervy等[ 50 ]均发现长期低温对罗非鱼或高温对大西洋鲑所导致的主动性摄食抑制主要受外周ghrelin表达降低的调控,NPY反应不敏感,而leptin表达受ghrelin的调控[ 49,50 ]。饥饿3周会降低杂交条纹鲈肝脏中leptin mRNA的水平,而在恢复摄食3周后又会增加,尽管其水平并没有完全恢复到对照组的水平。腹腔内注射人类leptin会抑制杂交条纹鲈的食欲。该结果证明leptin在鲈形目中会响应营养状况的变化,发挥摄食抑制作用,扮演调节体内能量平衡的作用[ 57 ]。但是Trombley等[ 64 ]却发现人为限食(正常摄食量的40%)7周内,1龄大西洋鲑血浆leptin水平和肝脏中glep-a1基因的表达均显著高于正常摄食组;而glep-a2基因表达下调,脑中leptin受体表达量上调,且随饥饿时间延长差异更为显著,说明大西洋鲑在长期食物不足的条件下,其leptin系统对摄食调控起主导作用。然而,在对金鱼的研究中却发现leptin系统的表达在对照组、2周过饱食组和1周饥饿组间没有显著的差异,肝脏中glep-a1基因在摄食后9 h显著的增加,而下丘脑中leptin系统的表达在摄食后并没有显著的变化。leptin在金鱼中能够导致短期的摄食变化,如餐后过饱,但似乎并不依赖于饥饿/过饱食状态,说明在金鱼中营养状况与leptin系统缺乏表观上的联系[ 61 ]。类似现象在点带石斑鱼上也有发现[ 62 ]。此外,leptin表达升高也是鱼类繁殖期摄食量骤减的主要调控因子[ 65,66 ]。以上均说明鱼类之间摄食调控模式具有较高的复杂性和多样性。
4 小 结植物蛋白质替代鱼粉不仅带来适口性的差异,而且由于一些条件性必需氨基酸的缺乏,甚至一些未知生长因子的影响均会导致高植物蛋白质饲料的营养缺乏。因此,饲喂高植物蛋白质饲料的鱼类摄食和生长性能降低也有可能是由替代蛋白质引起的mTOR上游刺激因子,如营养要素、能量、生长因子以及环境胁迫中的某种或全部因子发生改变而引起的下游信号通路受阻而导致的。鱼类的摄食行为受到复杂的因子调控,其中ghrelin/leptin-NPY/AGRP和mTOR-NPY是最直接的摄食调控信号通道,也是控制人类肥胖症、Ⅱ型糖尿病以及厌食症的重要调控中枢[ 67,68 ]。该系统通过中枢和外周的ghrelin/leptin以及上游因子mTOR对食欲进行调控。目前,对于肉食性鱼类摄食调控系统的研究尚属空白。鱼类和哺乳动物具有相似的摄食调控系统,但是主要摄食调控因子NYP、ghrelin和leptin与哺乳动物,甚至在不同鱼种之间同源性均较低[ 39,69 ],暗示着它们在不同鱼类摄食调控网络中的功能性可能具有一定差异,在不同生存条件下主导调控因子可能不同。但是,目前为止,尚没有任何关于鱼类主动和被动摄食抑制之间调控模式差异的研究,而且也没有关于替代蛋白质引起的摄食调控关键因素和调控机制的系统研究报道。对鱼类在应对植物蛋白质替代鱼粉饲料的摄食行为变化过程所对应的ghrelin/leptin-NPY/AGRP和mTOR-NPY系统的动态变化机制进行研究,明确其对植物蛋白质饲料的摄食抑制和适应能力背后的摄食调控机理,对以提高养殖鱼类利用植物蛋白质源摄食能力为目的的人工干预研究途径,有效提高鱼类,特别是肉食性鱼类利用植物蛋白质的能力具有关键性意义。
| [1] | NANG THU T T,PARKOUDA C,SAEGER S D,et al.Comparison of the lysine utilization efficiency in different plant protein sources supplemented with L-lysine-HCl in rainbow trout (Oncorhynchus mykiss) fry[J]. Aquaculture,2007,272(1/2/3/4):477-488. ( 1) 1)
|
| [2] | HU L,YUN B,XUE M,et al.Effects of fish meal quality and fish meal substitution by animal protein blend on growth performance,flesh quality and liver histology of Japanese seabass (Lateolabrax japonicus)[J]. Aquaculture,2013,372:52-61. ( 1) 1)
|
| [3] | SØRENSENA M,LJØKJELB K,STOREBAKKENA T,et al.Apparent digestibility of protein,amino acids and energy in rainbow trout (Oncorhynchus mykiss) fed a fish meal based diet extruded at different temperatures[J].Aquaculture,2002,211(1/2/3/4):215-225. ( 2) 2)
|
| [4] | XUE M,XIE S Q,CUI Y B.Effect of a feeding stimulant on feeding adaptation of gibel carp Carassius auratus gibelio (Bloch),fed diets with replacement of fish meal by meat and bone meal[J]. Aquaculture Research,2004,35(5):473-482. ( 4) 4)
|
| [5] | LUO L,XUE M,WU X F,et al.Partial or total replacement of fishmeal by solvent-extracted cottonseed meal in diets for juvenile rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Nutrition,2006,12(6):418-424. ( 2) 2)
|
| [6] | GMEZ-REQUENI P,MINGARRO M,CALDUCH-GINER J A,et al.Protein growth performance,amino acid utilization and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead seabream (Sparus aurata)[J]. Aquaculture,2004,232(1/2/3/4):493-510. ( 3) 3)
|
| [7] | FOURNIER V,HUELVAN C,DESBRUYERES E.Incorporation of a mixture of plant feedstuffas substitute for fish meal in diets of juvenile turbot (Psetta maxima)[J]. Aquaculture,2004,236(1/2/3/4):451-465. ( 1) 1)
|
| [8] | HARA T J.Role of olfaction in fish behavior[M]//PITCHER T J.The behaviour of teleost fishes.London:Groom Helm,1986:152-176. ( 2) 2)
|
| [9] | VOLKOFF H,CANOSA L F,UNNIAPPAN S,et al.Neuropeptides and the control of food intake in fish[J]. General and Comparative Endocrinology,2005,142(1/2):3-19. ( 5) 5)
|
| [10] | ZHOU Y,LIANG X F,YUAN X,et al.Neuropeptide Y stimulates food intake and regulates metabolism in grass carp Ctenopharyngodon idellus[J]. Aquaculture,2013,380/381/382/383:52-61. ( 2) 2)
|
| [11] | CARR W E S,BLUMENTHAL K M,NETHERTON J C Ⅲ.Chemoreception in the pigfish,Orthopristis chrysopterus:the contribution of amino acids and betaine to stimulation of feeding behavior by various extracts[J]. Comparative Biochemistry and Physiology,1977,58(1):69-73. ( 1) 1)
|
| [12] | JOHNSEN P B,ZHOU H,ADAMS M A.Gustatory sensitivity of the herbivore Tilapia zillii to amino acids[J]. Journal of Fish Biology,1990,36(4):587-593. ( 1) 1)
|
| [13] | HARA T J,KITADA Y,EVANS R E.Distribution patterns of palatal taste buds and their responses to amino acids in salmonids[J]. Journal of Fish Biology,1994,45(3):453-465. ( 2) 2)
|
| [14] | ALIRO B,VINICIUS R C.Feeding behavior in juvenile snook,Centropomus undecimalis Ⅰ.Individual effect of some chemical substances[J].Aquaculture,1998,169(1):25-35. ( 1) 1)
|
| [15] | VOLKOFF H,WYATT J L.Apelin in goldfish (Carassius auratus):cloning,distribution and role in appetite regulation[J]. Peptides,2009,30(8):1434-1440. ( 6) 6)
|
| [16] | MARUI T,CAPRIO J.Teleost gustation[M]//HARA T J.Fish chemoreception.London:Chapman & Hall,1992:171-198. ( 1) 1)
|
| [17] | CAPRIO J.Similarity of olfactory receptor responses (EOG) of freshwater and marine catfish to amino acids[J]. Canadian Journal of Zoology,1980,58:1778-1784. ( 1) 1)
|
| [18] | MARUI T,EVANS R E,ZIELINSKI B,et al.Gustatory responses of the rainbow trout (Salmo gairdneri) palate to amino acids and derivatives[J]. Journal of Comparative Physiology,1983,153(4):423-433. ( 1) 1)
|
| [19] | ZENG C,HIDAKA I.Single fiver responses in the palatine taste nerve of the yellowtail Seriola quinqueradiata[J]. Nippon Suisan Gakkaishi,1990,56(10):1611-1618. ( 1) 1)
|
| [20] | WANG J,YUN B,XUE M,et al.Apparent digestibility coefficients of several protein sources,and replacement of fishmeal by porcine meal at two digestible protein level in diets of Japanese seabass,Lateolabrax japonicus,are affected by dietary protein levels[J]. Aquaculture Research,2012,43(1):117-127. ( 2) 2)
|
| [21] | LANSARD M,PANSERAT S,SEILIEZ I,et al.Hepatic protein kinase B (Akt)-target of rapamycin (TOR)-signalling pathways and intermediary metabolism in rainbow trout (Oncorhynchus mykiss) are not significantly affected by feeding plant-based diets[J]. British Journal of Nutrition,2009,102(11):1564-1573. ( 2) 2)
|
| [22] | DIAS J,GOMES E F,KAUSHIK S J.Improvement of feed intake through supplementation with an attractant mix in European seabass fed plant-protein rich diets[J]. Aquatic Living Resources,1997,10(6):385-389. ( 1) 1)
|
| [23] | PAPATRYPHON E,SORARES J H,Jr.The effect of dietary feeding stimulants on growth performance of striped bass,Morone saxatilis,fed-a-plant feedstuff-based diet[J].Aquaculture,2000,185(3/4):329-338. ( 1) 1)
|
| [24] | 张志勇.花鲈和西伯利亚鲟利用植物蛋白源的差异及GH/IGF-Ⅰ轴调节机制的比较研究 [D].硕士学位论文.北京:中国农业科学院,2013. ( 3) 3)
|
| [25] | 郑溜丰,彭健.中枢神经系统整合外周信号调节采食量的分子机制[J]. 动物营养学报,2013,25(10):2212-2221. ( 1) 1)
|
| [26] | REFSTIE S,HELLAND S J,STOREBAKKEN T.Adaptation to soybean meal in diets for rainbow trout,Oncorhynchus mykiss[J]. Aquaculture,1997,153(3/4):263-272. ( 1) 1)
|
| [27] | KAMIL A C,KREBS J R,PULLIAM H R.Foraging behavior[M].New York:Plenum Press,1987. ( 1) 1)
|
| [28] | BARDACH J E,ATEMA J.The sense of taste in fishes[M]//BEIDLER L M.Handbook of sensory physiology.Berlin:Springer-Verlag,1971:293-336.( 1) 1)
|
| [29] | LAPLANTE M,SABATINI D M.mTOR signaling in growth control and disease[J]. Cell,2012,149(2):274-293. ( 1) 1)
|
| [30] | CYBULSKI N,HALL M N.TOR complex 2:a signaling pathway of its own[J]. Trends in Biochemical Sciences,2009,34(12):620-627. ( 1) 1)
|
| [31] | FINGAR D C,RICHARDSON C J,TEE A R,et al.mTOR controls cell cycle progression through its cell growth effectors S6K1 and 4E-BP/eukaryotic translation initiation factor 4E[J]. Molecular and Cellular Biology,2004,24(1):200-216. ( 1) 1)
|
| [32] | HOWELL J J,MANNING B D.mTOR couples cellular nutrient sensing to organismal metabolic homeostasis[J]. Trends in Biochemical Sciences,2011,22(3):94-102. ( 1) 1)
|
| [33] | BLOUET C,ONO H,SCHWARTZ G J.Mediobasal hypothalamic p70 S6 kinase 1 modulates the control of energy homeostasis[J]. Cell Metabolism,2008,8(6):459-467. ( 1) 1)
|
| [34] | COTA D,MATTER E K,WOODS S C,et al.The role of hypothalamic mammalian target of rapamycin complex 1 signaling in diet-induced obesity[J]. Journal of Neurosciences,2008,28(28):7202-7208. ( 1) 1)
|
| [35] | CHEN G,FENG L,KUANG S,et al.Effect of dietary arginine on growth,intestinal enzyme activities and gene expression in muscle,hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. British Journal of Nutrition,2012,108(2):195-207. ( 1) 1)
|
| [36] | SEILIEZ I,PANSERAT S,LANSARD M,et al.Dietary carbohydrate-to protein ratio affects TOR signaling and metabolism-related gene expression in the liver and muscle of rainbow trout after a single meal[J]. American Journal of Physiology:Regulatory Integrative and Comparative Physiology,2011,300:733-743. ( 1) 1)
|
| [37] | LARHAMMA R D,WRAITH A,BERGLUND M M,et al.Origins of the many NPY-family receptors in mammals[J]. Peptides,2001,22(3):295-307. ( 1) 1)
|
| [38] | HALFORD J C,COOPER G D,DOVEY T M.The pharmacology of human appetite expression[J]. Current Drug Targets,2004,5(3):221-240. ( 2) 2)
|
| [39] | LIANG X F,LI G Z,YAO W,et al.Molecular characterization of neuropeptide Y gene in Chinese perch,an acanthomorph fish[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,148(1):55-64. ( 3) 3)
|
| [40] | KALRA S P,DUBE M G,PU S,et al.Interacting appetite-regulating pathways in the hypothalamic regulation of body weight[J]. Endocrine Reviews,1999,20(1):68-100. ( 1) 1)
|
| [41] | DE PEDRO N,LÓPEZ-PATIÑO M A,GUIJARRO A I,et al.NPY receptors and opioidergic system are involved in NPY-induced feeding in goldfish[J]. Peptides,2000,21(10):1495-1502. ( 1) 1)
|
| [42] | LOPEZ-PATINO M A,GUIJARRO A I,ISORNA E,et al.Neuropeptide Y has a stimulatory action on feeding behavior in goldfish (Carassius auratus)[J]. European Journal of Pharmacology,1999,377:147-153. ( 1) 1)
|
| [43] | NARNAWARE Y K,PETER R E.Effects of food deprivation and refeeding on neuropeptide Y (NPY) mRNA levels in goldfish[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,129(2):633-637. ( 1) 1)
|
| [44] | SILVERSTEIN J T,PLISETSKAYA E M.The effects of NPY and insulin on food intake regulation in fish[J]. American Zoologist,2000,40(2):296-308. ( 2) 2)
|
| [45] | NARNAWARE Y K,PETER R E.Neuropeptide Y stimulates food consumption through multiple receptors in goldfish[J]. Physiology Behavior,2001,74(1/2):185-190. ( 1) 1)
|
| [46] | KOJIMA M,HOSODA H,DATE Y,et al.Ghrelin is a growth-hormone-releasing acylated peptide form stomach[J]. Nature,1999,402(6762):656-660. ( 1) 1)
|
| [47] | NIEMINEN P,MUSTONEN A M,HYVARINEN H.Fasting reduces plasma leptin-and ghrelin-immunoreactive peptide concentrations of the burbot (Lota lota) at 2 ℃ but not at 10 ℃[J]. Zoological Science,2003,20(9):1109-1115. ( 2) 2)
|
| [48] | UNNIAPPAN S,LIN X,CERVINI L,et al.Goldfish ghrelin:molecular characterization of the complementary deoxyribonucleic acid,partial gene structure and evidence for its stimulatory role in food intake[J]. Endocrinology,2002,143:4143-4146. ( 2) 2)
|
| [49] | FOX B K,BREVES J P,HIRANO T,et al.Effects of short and long-term fasting on plasma and stomach ghrelin,and the growth hormone/insulin-like growth factor Ⅰ axis in the tilapia,Oreochromis mossambicus[J]. Domestic Animal Endocrinology,2009,37(1):1-11. ( 4) 4)
|
| [50] | HEVRØY E M,WAAGBØ R,TORSTENSEN B E,et al.Ghrelin is involved in voluntary anorexia in Atlantic salmon raised at elevated sea temperatures[J]. General and Comparative Endocrinology,2012,175(1):118-134. ( 5) 5)
|
| [51] | PALYHA O C,FEIGHNER S D,TAN C P,et al.Ligand activation domain of human orphan growth hormone (GH) secretagogue receptor (GHS-R) conserved from pufferfish to humans[J]. Molecular Endocrinology,2000,14(1):160-169. ( 1) 1)
|
| [52] | CHAN C B,CHENG C H.Identification and functional characterization of two alternatively spliced growth hormone secretagogue receptor transcripts from the pituitary of black seabream,Acanthopagrus schlegeli[J]. Molecular and Cellular Endocrinology,2004,214(1/2):81-95. ( 1) 1)
|
| [53] | UNNIAPPAN S,CANOSA L F,PETER R E.Orexigenic actions of ghrelin in goldfish:feeding-induced changes in brain and gut mRNA expression and serum levels,and responses to central and peripheral injections[J]. Neuroendocrinology,2004,79(2):100-108. ( 1) 1)
|
| [54] | JÖNSSON E,KAIYA H,BJÖRNSSON B T.Ghrelin decreased food intake in junvenile rainbow trout (Oncorhynchus mykiss) through the central anorexigenic corticotrophin-releasing factor system[J]. General and Ccomparative Endocrinology,2010,166:39-46. ( 1) 1)
|
| [55] | HARVEY J,ASHFORD M L.Leptin in the CNS:much more than a satiety signal[J]. Neuropharmacology,2003,44(7):845-854. ( 1) 1)
|
| [56] | LI G G,LIANG X F,XIE Q,et al.Gene structure,recombinant expression and functional characterization of grass carp leptin[J]. General and Comparative Endocrinology,2010,166(1):117-127. ( 1) 1)
|
| [57] | WON E T,BALTZEGAR D A,PICHA M E,et al.Cloning and characterization of leptin in a perciform fish,the striped bass (Morone saxatilis):control of feeding and regulation by nutritional state[J]. General and Comparative Endocrinology,2012,178(1):98-107. ( 3) 3)
|
| [58] | BAKER D M,LARSEN D A,SWANSON P,et al.Longterm peripheral treatment of immature coho salmon (Oncorhynchus kisutch) with human leptin has no clear physiologic effect[J]. General and Comparative Endocrinology,2000,118:134-138. ( 1) 1)
|
| [59] | LONDRAVILLE R L,DUVALL C S.Murine leptin injections increase intracellular fatty acid-binding protein in green sunfish (Lepomis cyanellus)[J]. General and Comparative Endocrinology,2002,129(1):56-62. ( 1) 1)
|
| [60] | VOLKOFF H,EYKELBOSH A J,PETER R E.Role of leptin in the control of feeding of goldfish Carassius auratus:interactions with cholecystokinin,neuropeptide Y and orexin A,and modulation by fasting[J]. Brain Research,2003,972(1/2):90-109. ( 1) 1)
|
| [61] | TINOCO A B,NISEMBAUM L G,ISORNA E,et al.Leptins and leptin receptor expression in the goldfish (Carassius auratus).Regulation by food intake and fasting/overfeeding conditions[J]. Peptides,2012,34(2):329-335. ( 2) 2)
|
| [62] | ZHANG H,CHEN H,ZHANG Y,et al.Molecular cloning,characterization and expression profiles of multiple leptin genes and a leptin receptor gene in orange-spotted grouper (Epinephelus coioides)[J]. General and Comparative Endocrinology,2013,181:295-305. ( 2) 2)
|
| [63] | WILLARD T.Choosing and sourcing the best ingredients[M]//KVAMME J L,PHILLIPS T D.Petfood technology.Mt Morris:Watt Pub.,2003:76-81.( 1) 1)
|
| [64] | TROMBLEY S,MAUGARS G,KLING P,et al.Effect of long-term restricted feeding on plasma leptin,hepatic leptin expression and leptin receptor expression in juvenile Atlantic samlmon (Salmo salar L.)[J]. General and Comparative Endocrinology,2012,175(1):92-99. ( 2) 2)
|
| [65] | TROMBLEY S,SCHMITZ M.Leptin in fish:possible role in sexual maturation in male Atlantic salmon[J]. Fish Physiology and Biochemistry,2013,39(1):103-106. ( 1) 1)
|
| [66] | BARASH I A,CHEUNG C C,REN H P,et al.Leptin is a metabolic signal to the reproductive system[J]. Endocrinology,1996,137(7):3144-3147. ( 1) 1)
|
| [67] | TSCHÖP M,SMILEY D,HELMAN M.Ghrelin induces adiposity in rodents[J]. Nature,2000,407(6806):908-913. ( 1) 1)
|
| [68] | MORTON G J,CUMMINGS D E,BASKIN D G,et al.Central nervous system control of food intake and body weight[J]. Nature,2006,443(7109):289-295. ( 1) 1)
|
| [69] | CHEN C Y,ASAKAWA A,FUJIMIYA M,et al.Ghrelin gene products and the regulation of food intake and gut motility[J]. Pharmacological Reviews,2009,61(4):430-481. ( 1) 1)
|




