动物的胃肠道是一个复杂的生态系统,包含丰富的宿主微生物及多种不同表型肠上皮细胞,共同参与复杂的代谢活动。肠道微生物对正常的肠道功能及宿主健康发挥着重要作用。越来越多的研究证据表明,乳酸杆菌、双歧杆菌等有益微生物可通过其代谢产物及分泌抗菌活性物质,参与到动物体内抵抗病原菌侵袭的防御系统中[ 1 ]。近10年来,一些研究结果表明,饲粮中添加5 000 mg/kg苯甲酸能改善仔猪生长性能[ 2,3,4,5 ],在研究苯甲酸对猪肠道微生物菌群结构的影响时,对乳酸杆菌的报道差异较大[ 4, 6, 7, 8, 9 ],对双歧杆菌的影响未见报道。Knarreborg等[ 10 ]通过模拟胃和肠道pH环境体外培养大肠杆菌及乳酸杆菌,在pH为4.5(胃的环境)和5.5(小肠环境)时,分别添加0、12.5、25.0、50.0、100.0、200.0 mmol/L的苯甲酸,研究发现添加苯甲酸对这2种细菌均具有明显的抑菌效果。但该学者对苯甲酸浓度的设定缺乏体内研究基础。本研究通过体内、体外试验,系统研究饲粮添加苯甲酸后其在仔猪消化道中的浓度、对消化道食糜pH、微生物菌群结构及代谢产物的影响;同时以体内试验的肠道食糜中苯甲酸浓度及消化道食糜pH为依据,通过体外试验,探讨不同浓度苯甲酸及pH对约氏乳杆菌、大肠杆菌生长的影响,进一步证实苯甲酸对肠道微生物的直接作用,旨在揭示苯甲酸是否对肠道有益微生物存在益菌作用,为深入认识苯甲酸的营养生理作用和实践中科学使用苯甲酸提供更多科学依据。 1 材料与方法 1.1 体内试验 1.1.1 试验材料
苯甲酸:VevoVitall ,由帝斯曼中国有限公司 生产并提供,纯度99.5%。
1.1.2 试验设计与试验动物试验选取20头初始体重为(18.75±0.20) kg的健康“杜×长×大”去势公猪,随机分为2组,分别饲喂基础饲粮(对照组)和在基础饲粮中添加5 000 mg/kg苯甲酸的试验饲粮(苯甲酸组),每组10个重复,每个重复1头猪,试验期14 d。
1.1.3 试验饲粮基础饲粮为玉米-豆粕型饲粮,参考NRC(1998)10~20 kg仔猪营养需要量配制,所有饲粮均为颗粒料。基础饲粮组成及营养水平见表1。苯甲酸组用苯甲酸替代等量玉米构成试验饲粮。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) % |
试验在四川农业大学动物营养研究所教学科研试验基地代谢室进行,试验猪只单笼饲养。试验期间,试猪自由饮水,每日饲喂4次(08:30、12:30、16:30和20:30),少喂勤添,喂量以料槽内略有剩余为度。猪舍舍温控制在25~27 ℃,相对湿度控制在70%左右。定期冲洗圈舍,保持圈舍通风、清洁、干燥、卫生。
1.1.5 样品采集与处理于试验第14天早晨少喂多次,连续饲喂2 h,使仔猪在屠宰时保持胃肠道充盈,每组随机选择6头接近平均体重的试猪用盐酸氯丙嗪按照每千克体重3 mg的剂量耳缘静脉注射,麻醉处死。打开腹腔,迅速分离胃和肠段,取胃、十二指肠、空肠、回肠、盲肠、结肠和直肠食糜于纸杯中,测定食糜pH;并取十二指肠、回肠和盲肠食糜各4份,分装于灭菌的EP管中,均用锡箔纸包裹好,液氮速冻,-70 ℃保存,用于回肠、盲肠食糜中的微生物菌群数量、盲肠食糜中微生物代谢产物浓度以及十二指肠、回肠、盲肠食糜中苯甲酸浓度的测定。
1.1.6 测定指标与方法 1.1.6.1 消化道食糜pH用pH仪(PHS-3C pH计,上海精密科学仪器有限公司)直接测定。
1.1.6.2 回肠、盲肠食糜中微生物菌群数量采用实时荧光定量PCR技术测定回肠、盲肠食糜中双歧杆菌、乳酸杆菌、芽孢杆菌、大肠杆菌及总细菌的数量。采用Omega公司的DNA提取试剂盒提取食糜中总DNA,-20 ℃保存备用。采用Bio-Rad公司CFX96实时定量PCR仪,根据细菌的16S rRNA基因序列设计特异性引物,应用Taqman探针进行实时荧光定量PCR反应,使用天根公司的RealMaterMix进行检测。乳酸杆菌、大肠杆菌和芽孢杆菌采用20 μL反应体系,包括Probe Ehance Solution 1 μL、RealMaterMix 8 μL、上下游引物各1 μL、DNA模板1 μL、探针0.3 μL和ddH2O 7.7 μL;双歧杆菌采用20 μL反应体系,包括Probe Ehance Solution 1 μL、RealMaterMix 8 μL、上下游引物各1 μL、DNA模板1 μL、探针0.8 μL和ddH2O 7.2 μL。采用三步法PCR扩增标准程序:95 ℃预变性10 s,95 ℃ 5 s,50~60 ℃ 25 s,95 ℃ 10 s,共40个循环。总细菌采用25 μL反应体系,包括SYBR Premix Ex Taq(2×)12.5 μL、上下游引物各1 μL、ddH2O 9.5 μL和DNA 1 μL。采用三步法PCR扩增标准程序:95 ℃预变性10 s,95 ℃ 5 s,50~60 ℃ 25 s,95 ℃ 10 s,熔解曲线条件为95 ℃ 39 s,55 ℃ 1 min,95 ℃ 1 min,共40个循环。以每克内容物为检测单位,通过Ct值与标准曲线计算得出每份样品所含拷贝数,结果用每克内容物中细菌拷贝数的常用对数表示[lg(copies/g)]。PCR引物及探针序列见表2。
1.1.6.3 盲肠食糜中微生物代谢产物浓度取盲肠食糜3 g,用蒸馏水进行稀释(质量体积比1∶ 1),振荡混匀至无明显结块的悬浮状。500×g离心10 min,取上清液2 mL至新EP管中,12 000×g离心10 min,取上清液1 mL,加入25%的偏磷酸0.2 mL,充分混匀,静置30 min后12 000×g离心10 min,取上清液100 μL,加入甲醇100 μL,充分混匀并12 000×g离心10 min,收集上清液于EP管中,-20 ℃冰箱保存待测。乙酸、丙酸、丁酸浓度采用气相色谱仪(VARIAN CP-3800,美国)进行测定。
1.1.6.4 十二指肠、回肠、盲肠食糜中苯甲酸浓度对照品苯甲酸(纯度≥99%)购于阿拉丁试剂公司,乙腈为色谱纯,其余试剂为分析纯,水为超纯水。
取食糜样品0.5 g,精密称定,用3倍量乙酸乙酯超声提取,然后将乙酸乙酯层取出水浴挥干,加1 mL水超声溶解,滤过,用HITACHI L-2000液相色谱仪[色谱柱:ZORBAX SB-C18 (5 μm,3 mm×25 cm),柱温:30 ℃,流动相:0.1%甲酸水-乙腈(20∶ 80),紫外检测波长:254 nm,进样50 μL]对滤液进行检测,记录色谱图,采用外标法与苯甲酸标准品溶液进行对比,计算出食糜中苯甲酸浓度。
1.2 体外试验 1.2.1 试验材料 1.2.1.1 菌种及苯甲酸来源大肠杆菌ATCC25922,即编号为25922的国际质量控制标准菌株;约氏乳杆菌JJB3,分离自健康仔猪降结肠肠壁,耐酸耐胆盐,拮抗致病性大肠杆菌和沙门氏菌。2种菌株均由四川农业大学动物微生态研究中心保存、提供。
苯甲酸:VevoVitall ,由帝斯曼中国有限公司生产并提供,纯度99.5%。
1.2.1.2 MRS培养基牛肉膏5.0 g、酵母浸出粉4.0 g、蛋白胨10.0 g、磷酸氢二钾2.0 g、吐温80 1.0 mL、硫酸镁0.2 g、葡糖糖20.0 g、乙酸钠5.0 g、柠檬酸三铵0.2 g、硫酸锰0.05 g、蒸馏水1 000 mL,调节pH至6.1,121 ℃灭菌15 min。
1.2.1.3 NB培养基牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g、蒸馏水1 000 mL,调节pH至7.4,121 ℃灭菌15 min。
1.2.2 试验方法 1.2.2.1 菌株活化在无菌条件下将100 μL甘油保存的菌种液加入5 mL培养基中,大肠杆菌ATCC25922接种于NB培养基中,约氏乳杆菌JJB3接种于MRS培养基中,分别在37 ℃下有氧、厌氧环境中培养24 h,取出并重复上述操作,每接种1次为1代,连续传代3次恢复其活性。
1.2.2.2 试验设计取一定量的苯甲酸溶于制备好的培养基中并倍比稀释为1 000、200、30、15、5、0 mg/L 6个浓度,每个浓度均通过调节pH分别为5.0、5.5、6.0、6.5、7.0的5个处理,每个处理3个重复,121 ℃灭菌15 min。将活化好的试验菌株在无菌条件下按5%的比例分别接种到各处理中,混合均匀后,大肠杆菌ATCC25922、约氏乳杆菌JJB3分别置于37 ℃培养箱有氧、厌氧培养24 h。
1.2.3 测定指标与方法样品吸光度(OD)值测定:将培养后的等量液体置于600 nm波长下测其OD值。
1.3 数据处理所有数据均采用Microsoft Excel 2007进行整理,采用SPSS 18.0软件对数据进行统计分析。其中体内试验用t检验对2个组试验数据进行分析,P<0.05时为差异显著,P<0.01时为差异极显著,0.05<P<0.10时为有趋势。试验结果以“平均值±标准差”表示。
2 结 果 2.1 苯甲酸对仔猪肠道食糜中苯甲酸浓度的影响由表3可知,与对照组相比,饲粮添加苯甲酸可显著提高十二指肠和回肠食糜中苯甲酸浓度(P<0.05),对盲肠食糜中苯甲酸浓度影响不显著(P>0.05)。
| 表3 苯甲酸对仔猪肠道食糜中苯甲酸浓度的影响 Table 3 Effects of benzoic acid on its concentration in intestinal digesta of piglets μg/g |
由表4可知,与对照组相比,饲粮添加苯甲酸极显著降低直肠食糜pH(P<0.01),显著降低胃、回肠、结肠食糜pH(P<0.05),对空肠、盲肠食糜pH有降低的趋势(P<0.10)。
| 表4 苯甲酸对仔猪消化道食糜pH的影响 Table 4 Effects of benzoic acid on pH in digestive tract digesta of piglets |
2.3 苯甲酸对仔猪肠道食糜中微生物菌群数量的 影响
由表5可知,与对照组相比,饲粮添加苯甲酸显著提高回肠食糜中乳酸杆菌数量(P<0.05),有提高回肠食糜中双歧杆菌数量和降低总细菌数量的趋势(P<0.10)。同时,饲粮添加苯甲酸有提高盲肠食糜中乳酸杆菌和双歧杆菌数量的趋势(P<0.10);但对回肠及盲肠食糜中大肠杆菌和芽孢杆菌数量无显著影响(P>0.05)。
| 表5 苯甲酸对仔猪肠道食糜中微生物菌群数量的影响 Table 5 Effects of benzoic acid on the number of microflora in intestinal digesta of piglets lg(copies/g) |
2.4 苯甲酸对仔猪盲肠食糜中微生物代谢产物的 影响
由表6可知,与对照组相比,饲粮添加苯甲酸有提高盲肠食糜中丙酸、丁酸、总挥发性脂肪酸浓度的趋势(P<0.10),但对乙酸浓度影响不显著(P>0.05)。
| 表6 苯甲酸对仔猪盲肠食糜中微生物代谢产物的影响 Table 6 Effects of benzoic acid on microbial metabolites in cecal digesta of piglets μmol/g |
由图1可知,在5种pH条件下,5、15、30、200、1 000 mg/L苯甲酸均具有一定抑制大肠杆菌生长的能力,其中1 000 mg/L苯甲酸的抑菌能力优于其他浓度;5、15、30 mg/L苯甲酸在不同pH条件下的抑菌能力较接近。当pH为5.0、5.5时,200、1 000 mg/L苯甲酸具有更强的抑菌能力。而当pH达到6.0及以上时,所有苯甲酸浓度间的抑菌能力趋于一致。
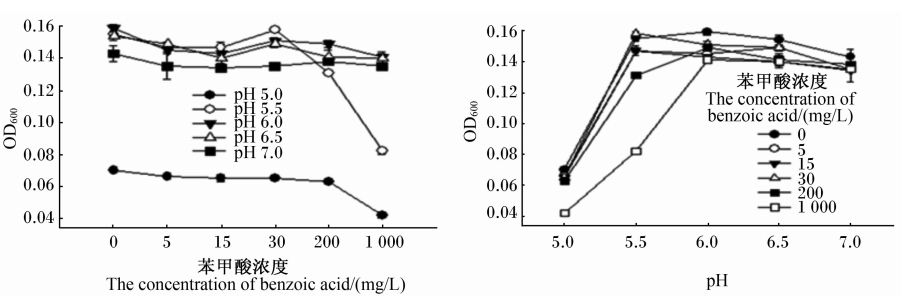 | 图1 苯甲酸及pH对大肠杆菌ATCC25922 OD600值的影响 Fig.1 Effects of benzoic acid and pH on OD600 value of Escherichia coli ATCC25922 (n=3) |
2.6 苯甲酸及pH对约氏乳杆菌JJB3 OD600值的影响
由图2可知,当pH为5.5、6.0、6.5时,5、15、30、200、1 000 mg/L苯甲酸均具有一定的益菌能力,但1 000 mg/L苯甲酸益菌能力弱;且益菌能力有随着pH提高而增强的趋势。在同一pH条件下,200 mg/L苯甲酸具有最强的益菌能力,30 mg/L苯甲酸其次;5和15 mg/L苯甲酸弱于前2种浓度,两者间的益菌能力也较为一致。
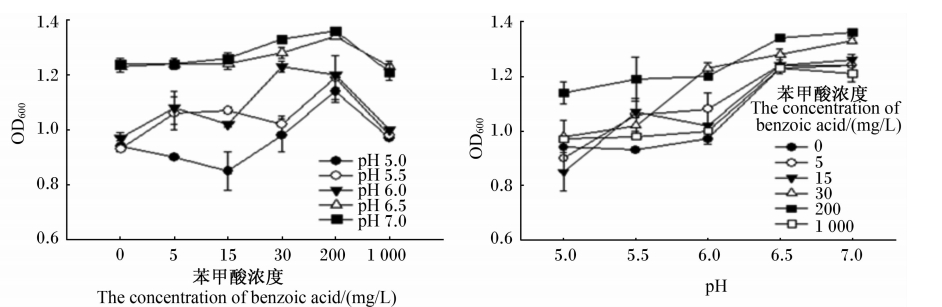 | 图2 苯甲酸及pH对约氏乳杆菌JJB3 OD600值的影响 Fig.2 Effects of benzoic acid and pH on OD600 value of Lactobacillus JJB3 (n=3) |
苯甲酸在食品工业中被广泛用于防腐,它具有广谱的抗菌效果[ 13 ]。为研究苯甲酸在人体内是否沉积及可能存在的毒副作用,20世纪40年代许多学者开始研究其在不同动物体内的代谢途径[ 14,15 ]。研究发现,不同动物苯甲酸的代谢方式不同。其中,人类在食入苯甲酸后,24 h内几乎完全以马尿酸的形式从尿中排出,在体内无残留[ 14 ]。但由于其可能存在叠加毒性,一些国家已禁止在儿童食品中使用;我国规定苯甲酸在食品中的使用量为0.2~1.0 g/kg,按此规定量使用不会有安全问题[ 16 ]。对猪的研究表明,采食含苯甲酸的饲粮后,苯甲酸在肠道快速吸收进入血液,85%左右以马尿酸形式排出,15%左右通过苯甲酸方式排泄,在体内基本无残留[ 14,17 ]。基于苯甲酸的抗菌力及其在人、猪体内基本无残留,2003年,欧盟正式允许在猪料中添加0.5%~1.0%的苯甲酸作为酸化剂。
在众多研究文章中,苯甲酸在动物消化道食糜中的浓度尚未见报道。本研究表明,仔猪连续采食添加5 000 mg/kg苯甲酸的饲粮2 h后,十二指肠、回肠食糜中苯甲酸浓度显著高于对照组,而在盲肠中则差异不显著。这说明采食2 h后,仍有少量苯甲酸在小肠段存在,但当食糜进入盲肠前,苯甲酸已基本被小肠吸收。
猪只适宜、稳定的消化道pH环境是维持消化道健康、保证正常发挥消化吸收功能至关重要的因素之一。许多研究报道,单一酸化剂、复合酸化剂可降低仔猪消化道食糜pH[ 18,19,20,21,22 ]。有关苯甲酸对仔猪消化道食糜pH影响的报道很少,Halas等[ 23 ]和Murphy等[ 24 ]分别以断奶仔猪及肥育猪为试验对象,研究表明,苯甲酸可显著降低粪便pH。本试验中,5 000 mg/kg苯甲酸显著降低仔猪全段消化道食糜pH,其中直肠食糜pH的研究结果与前人一致。酸化剂降低消化道内容物pH的原因,一般认为与其降低饲料缓冲力、提高胃酸酸化能力及调节肠道微生物结构、导致微生物代谢产物(挥发性脂肪酸)浓度增加有关。而苯甲酸酸性弱,电离常数(pKa)为4.2,且微溶于水,其降低饲料缓冲力的能力有限,但在胃pH为3.47时(本试验测定数据),大部分苯甲酸可以游离分子形式进入肠道。本试验的数据证实苯甲酸进入肠道并延续到大肠。由此可以推测,苯甲酸促进消化道食糜pH降低一方面是苯甲酸释放H+的原因,另一方面与其调节肠道微生物结构,增加酸性代谢产物有关。
3.2 苯甲酸对体内外微生物数量的影响本研究表明,苯甲酸提高回肠和盲肠食糜中乳酸杆菌的数量。这一结果可能与本研究中苯甲酸降低仔猪消化道食糜pH有关,乳酸杆菌具有较强的抗酸能力,在pH 3.0~4.5的酸性条件下仍能生存[ 25 ],而大肠杆菌的抗酸能力弱,因而肠道环境的改变更有利于乳酸杆菌成为优势菌群。但许多学者的研究表明,苯甲酸对消化道乳酸杆菌数量无影响,甚至降低[ 4, 6, 7, 8, 9 ]。研究结果的差异可能与苯甲酸添加量、饲粮结构、研究目的与试验动物日龄、饲养管理环境等有关。本研究结果还表明,苯甲酸不影响回肠及盲肠食糜中大肠杆菌数量,与苯甲酸降低猪只消化道食糜中大肠杆菌数量的研究结果[ 4, 6, 9 ]存在差异。这种差异可能与苯甲酸的添加量及饲养管理方式有关,本试验添加量为5 000 mg/kg,而对大肠杆菌抑菌效果明显时,添加量为8 500或10 000 mg/kg;本试验采用单笼饲养,群体小、密度低、卫生状况好,很少与污染源接触,因而,对大肠杆菌的抑菌效果不明显。关于苯甲酸减少回肠的总细菌数量的研究结果,与其他学者的报道一致[ 4, 19, 22 ]。这可能是因为苯甲酸提高回肠和盲肠食糜中乳酸杆菌及双歧杆菌数量,它们的代谢产物及产生的抗菌物质如抗菌肽对大肠杆菌等有害微生物有抑制效应,从而降低了总细菌数量[ 1, 26, 27 ]。
为进一步探讨2种微生物生长与苯甲酸浓度及pH的关系,验证体内试验的结果,体外试验研究了乳酸杆菌及大肠杆菌在5个pH、6个苯甲酸浓度条件下的菌液浓度。结果表明,在同一pH条件下,乳酸杆菌生长不受200 mg/L以内的苯甲酸抑制,反而促进了其生长;而大肠杆菌受到抑制,但200 mg/L以内的苯甲酸浓度对其生长影响较小。在同一苯甲酸浓度条件下,乳酸杆菌的生长具有随pH升高而增加的明显趋势,说明乳酸杆菌对酸性至中性环境具有较强的适应性。大肠杆菌在pH为5.0、5.5条件下,高浓度的苯甲酸对其具有明显的抑制能力;pH在6.0~7.0之间变化时,不同浓度的苯甲酸对大肠杆菌的抑制能力差异小。其原因主要在于:苯甲酸以分子形式抑制微生物的生长,其pKa为4.2,pH越低,分子形式的苯甲酸越多,反之,苯甲酸分子越少。因而,pH为5.0、5.5时,高浓度的苯甲酸含有更多分子形式,故抑菌能力强;当pH提高时,无论苯甲酸浓度的高低,基本都以酸根形式存在,因而抑菌能力趋于一致。
由此可见,微生物的生长受到苯甲酸浓度及pH环境的共同影响。当苯甲酸浓度与食糜中苯甲酸浓度接近时,有利于乳酸杆菌的生长繁殖,对大肠杆菌生长无影响;当pH与食糜pH相近时,对大肠杆菌生长繁殖无太大影响。此结果在一定程度上印证了体内试验中苯甲酸提高回肠、盲肠食糜中乳酸杆菌数量,而对大肠杆菌数量无显著影响的结论。并进一步说明乳酸杆菌对pH环境具有较强的适应性,且其数量的增加与肠道食糜中的苯甲酸存在联系。
3.3 苯甲酸对盲肠食糜中微生物代谢产物的影响猪消化道的严格厌氧菌能发酵碳水化合物及未消化的蛋白质,尤其在大肠段,产生许多挥发性脂肪酸,如乙酸、丙酸、丁酸等,它们能抑制兼性厌氧菌的生长。此外,这些挥发性脂肪酸还能为动物提供能量、抵御病原微生物及维持动物肠道健康[ 28 ]。苯甲酸可调节回肠和盲肠微生物的结构,因而对其代谢产物必将产生影响。但有关此内容的报道并不多,结果也不尽一致。本研究表明,饲粮中添加5 000 mg/kg苯甲酸有提高仔猪盲肠食糜丙酸、丁酸和总挥发性脂肪酸浓度的趋势。Buhler等[ 29 ]研究也发现,饲粮中添加5 000 mg/kg苯甲酸可显著提高生长期猪只盲肠和直肠内容物中丁酸的浓度。而Kasprowicz-Potocka等[ 30 ]在28日龄断奶仔猪饲粮中添加10 000 mg/kg苯甲酸时,十二指肠食糜中乳酸浓度显著上升,回肠食糜中丁酸浓度和盲肠内容物中甲酸浓度显著下降。Halas等[ 8 ]研究表明,5 000 mg/kg苯甲酸有显著降低断奶仔猪盲肠和直肠内容物乳酸浓度及支链脂肪酸比例的趋势。verland等[ 31 ]在生长公猪饲粮中添加8 500 mg/kg苯甲酸,对直肠内容物中挥发性脂肪酸(乙酸、丙酸、丁酸)的浓度无显著影响。研究结果的差异可能与苯甲酸的添加量、饲粮结构、猪只所处的生长阶段、饲养环境等有关。在本研究中,苯甲酸提高肠道食糜中乳酸杆菌和双歧杆菌数量,而乳酸杆菌的主要代谢产物为乳酸[ 25, 26, 32 ],双歧杆菌的主要代谢产物为乙酸,也会产生一定量的乳酸[ 26 ]。双歧杆菌虽然不直接产生丁酸,但其与乳酸杆菌的代谢产物乳酸可转化为丁酸[ 33 ]。丁酸是小肠上皮的重要能量源,调节肠上皮细胞的生长和分化[ 34,35 ]。因此,乳酸杆菌及双歧杆菌的代谢产物乳酸、乙酸及转化的丁酸不仅可降低消化道的pH,而且为小肠上皮的生长提供更多的能量物质,促进了小肠黏膜结构的改善,提高了养分的吸收效率。
4 结 论本试验条件下,饲粮中添加5 000 mg/kg苯甲酸提高了十二指肠、回肠、盲肠食糜中苯甲酸浓度,降低消化道食糜pH,促进了有益菌的生长,改善了肠道微生物菌群结构,提高微生物代谢产物丙酸、丁酸及总挥发性脂肪酸的浓度。
| [1] | SERVIN A L.Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens[J]. FEMS Microbiology Reviews,2004,28(4):405-440. ( 2) 2)
|
| [2] | GRBER T,KLUGE H,HIRCHE F,et al.Effects of dietary benzoic acid and sodium-benzoate on performance,nitrogen and mineral balance and hippuric acid excretion of piglets[J]. Archives of Animal Nutrition,2012,66(3):227-236. ( 1) 1)
|
| [3] | DIERICK N,MICHIELS J,VAN NEVEL C.Effect of medium chain fatty acids and benzoic acid,as alternatives for antibiotics,on growth and some gut parameters in piglets[J]. Communications in Agricultural and Applied Biological Sciences,2004,69(2):187-190. ( 1) 1)
|
| [4] | KLUGE H,BROZ J,EDER K.Effect of benzoic acid on growth performance,nutrient digestibility,nitrogen balance,gastrointestinal microflora and parameters of microbial metabolism in piglets[J]. Journal of Animal Physiology and Animal Nutrition,2006,90(7/8):316-324. ( 5) 5)
|
| [5] | PAPATSIROS V,TASSIS P,TZIKA E,et al.Effect of benzoic acid and combination of benzoic acid with a probiotic containing Bacillus Cereus var.toyoi in weaned pig nutrition[J]. Polish Journal of Veterinary Sciences,2011,14(1):117-125. ( 1) 1)
|
| [6] | GUGGENBUHL P,SON A,QUINTANA A P,et al.Effects of dietary supplementation with benzoic acid (vevovitall®) on the zootechnical performance,the gastrointestinal microflora and the ileal digestibility of the young pig[J]. Livestock Science,2007,108(1):218-221. ( 3) 3)
|
| [7] | TORRALLARDONA D,BADIOLA I,BROZ J.Effects of benzoic acid on performance and ecology of gastrointestinal microbiota in weanling piglets[J]. Livestock Science,2007,108(1):210-213. ( 2) 2)
|
| [8] | HALAS D,HANSEN C F,HAMPSON D,et al.Dietary supplementation with benzoic acid improves apparent ileal digestibility of total nitrogen and increases villous height and caecal microbial diversity in weaner pigs[J]. Animal Feed Science and Technology,2010,160(3/4):137-147. ( 3) 3)
|
| [9] | ØVERLAND M,KJOS N P,BORG M,et al.Organic acids in diets for entire male pigs:effect on skatole level,microbiota in digesta,and growth performance[J]. Livestock Science,2008,115(2):169-178. ( 3) 3)
|
| [10] | KNARREBORG A,MIQUEL N,GRANLI T,et al.Establishment and application of an in vitro methodology to study the effects of organic acids on coliform and lactic acid bacteria in the proximal part of the gastrointestinal tract of piglets[J]. Animal Feed Science and Technology,2002,99(1):131-140. ( 1) 1)
|
| [11] | QI H,XIANG Z,HAN G,et al.Effects of different dietary protein sources on cecal microflora in rats[J]. African Journal of Biotechnology,2011,10(19):3704-3708. ( 1) 1)
|
| [12] | FIERER N,JACKSON J A,VILGALYS R,et al.Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Applied and Environmental Microbiology,2005,71(7):4117-4120. ( 1) 1)
|
| [13] | NING D,WANG H,ZHUANG Y.Induction of functional cytochrome P450 and its involvement in degradation of benzoic acid by Phanerochaete chrysosporium[J]. Biodegradation,2010,21(2):297-308. ( 1) 1)
|
| [14] | BRIDGES J,FRENCH M,SMITH R,et al.The fate of benzoic acid in various species[J]. Biochem Journal,1970,118:47-51. ( 3) 3)
|
| [15] | BRAY H,NEALE F,THORPE W.The fate of certain organic acids and amides in the rabbit:1.Benzoic and phenylacetic acids and their amides[J]. Biochemical Journal,1946,40(1):134-139. ( 1) 1)
|
| [16] | 曾正渝.苯甲酸及其钠盐在食品和药品中的应用[J]. 中国药业,2007,16(6):64. ( 1) 1)
|
| [17] | KRISTENSEN N B,RGAARD J V,WAMBERG S,et al.Absorption and metabolism of benzoic acid in growing pigs[J]. Journal of Animal Science,2009,87(9):2815-2822. ( 1) 1)
|
| [18] | 冷向军,王康宁,杨凤,等.酸化剂对早期断奶仔猪胃酸分泌、消化酶活性和肠道微生物的影响[J]. 动物营养学报,2002,14(4):44-48. ( 1) 1)
|
| [19] | 李鹏,武书庚,张海军,等.复合酸化剂对断奶仔猪生长性能、胃肠道酸度及消化酶活性的影响[J]. 养猪,2009(1):5-8. ( 2) 2)
|
| [20] | 晏家友.缓释复合酸化剂对断奶仔猪消化道酸度及肠道形态和功能的影响[D]. 硕士学位论文.雅安:四川农业大学,2009. ( 1) 1)
|
| [21] | BURNELL T,CROMWELL G,STAHLY T S.Effects of dried whey and copper sulfate on the growth responses to organic acid in diets for weanling pigs[J]. Journal of Animal Science,1988,66(5):1100-1108. ( 1) 1)
|
| [22] | RISLEY C R,KORNEGAY E T,LINDEMANN M D,et al.Effect of feeding organic acids on selected intestinal content measurements at varying times postweaning in pigs[J]. Journal of Animal Science,1992,70(1):196-206. ( 2) 2)
|
| [23] | HALAS D,HANSEN C F,HAMPSON D J,et al.Effects of benzoic acid and inulin on ammonia-nitrogen excretion,plasma urea levels,and the pH in faeces and urine of weaner pigs[J]. Livestock Science,2010,134(1/2/3):243-245. ( 1) 1)
|
| [24] | MURPHY D P,O'DOHERTY J V,BOLAND T M,et al.The effect of benzoic acid concentration on nitrogen metabolism,manure ammonia and odour emissions in finishing pigs[J]. Animal Feed Science and Technology,2011,163:194-199. ( 1) 1)
|
| [25] | 吴忠良,张瑞峰,王金义.乳酸杆菌对早期断乳仔猪生长性能的影响[J]. 畜牧兽医杂志,2005,24(1):27-29. ( 2) 2)
|
| [26] | PICARD C,FIORAMONTI J,FRANCOIS A,et al.Review article:bifidobacteria as probiotic agents-physiological effects and clinical benefits[J]. Alimentary Pharmacology & Therapeutics,2005,22(6):495-512. ( 3) 3)
|
| [27] | GIBSON G R,WANG X.Regulatory effects of bifidobacteria on the growth of other colonic bacteria[J]. Journal of Applied Microbiology,1994,77(4):412-420. ( 1) 1)
|
| [28] | LEAVITT J,BARRETT J C,CRAWFORD B D,et al.Butyric acid suppression of the in vitro neoplastic state of Syrian hamster cells[J]. Nature,1978,271(5642):262-265. ( 1) 1)
|
| [29] | BUHLER K,BUCHER B,WENK C,et al.Influence of benzoic acid in high fibre diets on nutrient digestibility and VFA production in growing/finishing pigs[J]. Archives of Animal Nutrition,2009,63(2):127-136. ( 1) 1)
|
| [30] | KASPROWICZ-POTOCKA M,FRANKIEWICZ A,SELWET M,et al.Effect of salts and organic acids on metabolite production and microbial parameters of piglets' digestive tract[J]. Livestock Science,2009,126(1):310-313. ( 1) 1)
|
| [31] | ØVERLAND M,KJOS N P,BORG M,et al.Organic acids in diets for entire male pigs[J]. Livestock Science,2007,109(1):170-173. ( 1) 1)
|
| [32] | 黄沧海,谯仕彦,李德发,等.益生乳酸杆菌抑制大肠杆菌的研究[J]. 中国畜牧杂志,2003,39(6):27-28. ( 1) 1)
|
| [33] | CRITTENDEN R,MARTINEZ N,PLAYNE M.Synthesis and utilisation of folate by yoghurt starter cultures and probiotic bacteria[J]. International Journal of Food Microbiology,2003,80(3):217-222. ( 1) 1)
|
| [34] | BUGAUT M,BENTJAC M.Biological effects of short-chain fatty acids in nonruminant mammals[J]. Annual Review of Nutrition,1993,13(1):217-241. ( 1) 1)
|
| [35] | BOFFA L C,LUPTON J R,MARIANI M R,et al.Modulation of colonic epithelial cell proliferation,histone acetylation,and luminal short chain fatty acids by variation of dietary fiber (wheat bran) in rats[J]. Cancer Research,1992,52(21):5906-5912. ( 1) 1)
|




