蜜蜂是一种变态发育的社会性昆虫,需经历卵、幼虫、蛹和成蜂4个阶段[ 1 ]。在正常条件下,由3~12日龄的哺育蜂为蜜蜂幼虫提供蜂王浆或蜂粮等食物,满足其对各种营养物质的需求[ 2 ]。成年蜜蜂在不同环境、日龄及劳动分工中,所需的营养差异很大。然而,充足均衡的营养对蜜蜂正常的生长发育和代谢有着重要意义。维生素C是一种水溶性的抗氧化剂,在生物体的有氧代谢过程中能够保护机体免于氧化剂的威胁,在机体的抗氧化过程中发挥着重要的作用[ 3 ]。维生素C作为自由基清除剂,能与超氧阴离子自由基(O2-·)、过氧化氢(H2O2)、羟自由基(·OH)结合,生成抗坏血酸自由基,同时它也可以清除单线态氧,从而保护机体免受内源性氧自由基的损伤[ 4 ]。维生素C也是蜜蜂生长发育、繁殖以及维持正常的生命活动不可或缺的营养物质[ 5 ]。研究表明,维生素C是蜜蜂机体内重要的抗氧化因子,具有极强的抗氧化能力,是蜜蜂维持正常生命特征的重要保障。早在1990年,刘富海[ 6 ]的研究就表明,在蜜蜂饲粮中添加适量的维生素C可延长蜜蜂的寿命。维生素C也能有效刺激蜜蜂取食并对幼虫及成蜂腺体发育有促进作用[ 7 ]。
超氧化物歧化酶(SOD)是一类广泛存在于动物、植物、微生物中的金属酶,根据活性中心结合的金属离子不同,可以分为铜锌超氧化物歧化酶(Cu/Zn-SOD)、铁超氧化物歧化酶(Fe-SOD)和锰超氧化物歧化酶(Mn-SOD)3类[ 8 ],它们通过催化超氧阴离子自由基发生歧化反应,进而减轻或消除机体代谢过程中产生的过多的超氧阴离子自由基,在预防疾病、提高机体免疫力以及抗衰老、抗炎症等方面发挥重要的作用[ 9 ]。研究表明,中华蜜蜂Cu/Zn-SOD基因在不同发育时期和不同部位均有表达特异性,而且在6日龄幼虫中的表达量达到峰值,而在4日龄蛹中的表达量最低;头部与腹部的表达量显著高于胸部[ 10 ]。2013年,刘俊峰等[ 11 ]通过给刚出房的中华蜜蜂(Apis cerana cerana)工蜂饲喂不同浓度的维生素C,发现随着维生素C浓度的升高,10日龄中华蜜蜂的死亡率显著下降,Cu/Zn-SOD基因相对表达量也呈下降趋势,但差异不显著。然而,其试验组只设计了2种浓度的维生素C,饲喂高浓度维生素C对蜜蜂生存能力的影响未见报道。鉴于此,本试验拟在总结前人试验的基础上,进一步开展维生素C对中华蜜蜂幼虫发育及工蜂生存能力的影响。 1 材料与方法 1.1 试验动物
试验动物为江西农业大学蜜蜂研究所饲养的中华蜜蜂。 1.2 主要试剂
Trizol总RNA提取试剂盒、RNA酶抑制剂购自全式金公司,M-MLV反转录酶及SYBR Green Ⅱ荧光定量试剂购自TaKaRa公司,维生素C(25 g,浓度在99.0%以上)购自Sigma公司。 1.3 主要仪器
主要仪器有24孔细胞培养板(赛业生物科技公司)、生化培养箱(GZ-250-GSI型,韶关市广智科技设备发展有限公司)、普通离心机(飞鸽KA-1000型,上海安亭科学仪器厂公司)、台式冷冻离心机(5810R型,Eppendorf公司)、PCR仪(iQ TM2型,Bio-Rad公司)。 1.4 试验设计 1.4.1 蜜蜂幼虫饲养试验
将800只1日龄中华蜜蜂幼虫随机分为5组,每组8个重复,每个重复20只。其中,对照组(Ⅰ组)饲喂基础饲粮(表1),基础饲粮中维生素C含量为1.6 mg/kg;4个试验组分别饲喂在基础饲粮中添加10(Ⅱ组)、20(Ⅲ组)、30(Ⅳ组)、40 mg/kg(Ⅴ组)维生素C的试验饲粮,对应的试验饲粮中维生素C含量分别为11.6、21.6、31.6、41.6 mg/kg。由于维生素C性质不稳定,容易被氧化分解,每天的饲粮现配现用。
| 表1 中华蜜蜂幼虫基础饲粮组成 Table 1 Basal diet composition of larvae for Apis cerana cerana |
选取4群群势相同的中华蜜蜂蜂群,隔王产卵,将即将出房的封盖子放入恒温恒湿(34 ℃,相对湿度为75%)的培养箱中羽化。将羽化出的1日龄中华蜜蜂工蜂分成4组,每组6个重复,每个重复24 g(约300只)。其中,对照组(Ⅵ组)饲喂1 ∶ 1(蔗糖与水的质量比)的糖水,3个试验组分别在1 ∶ 1的糖水中添加50(Ⅶ组)、500(Ⅷ组)、2 500 mg/kg(Ⅸ组)的维生素C。各组糖水现用现配。 1.4.3 蜜蜂幼虫饲养方法
用蒸馏水反复冲洗24孔细胞培养板,然后用70%乙醇溶液消毒,再将培养板放于超净工作台中,打开紫外照射灯,通风干燥5 h。将200 μL幼虫饲粮加入到培养板的每个孔中,并置于34 ℃培养箱中预热5 min。再用移虫针将1日龄幼虫从巢脾中移出,放入盛有营养液的培养板的孔内,每孔2~4只,使幼虫漂浮在营养液表面。移虫完成后,将培养板放入恒温恒湿(34 ℃,相对湿度为95%)的培养箱中,避光培养。每12 h更换1次食物。每次饲喂300 mg幼虫饲粮。第2天之后,饲养密度降低至1只幼虫/孔。7~8日龄时能在培养板的孔底部看到尿素晶体和纤维状物质,说明幼虫开始排便,准备化蛹,此时,将大幼虫转移至化蛹培养板,并放入恒温恒湿(34 ℃,相对湿度为75%)的培养箱中,避光培养,直至蜜蜂出房。此期间是蜜蜂发育的敏感时期,避免移动化蛹培养板。 1.4.4 工蜂饲养方法
将1日龄工蜂以重复为单位随机放入小木箱(11 cm×13 cm×15 cm)中,将小木箱放入恒温恒湿(34 ℃,相对湿度为65%)的培养箱中继续饲养。为避免应激干扰带来的影响,首次饲喂24 h后取出已死亡的蜜蜂,开始正式试验。在前3天试验中给予充足花粉,补充发育所需的营养。另外,每24 h更换1次食物,并记录和清除已死亡的蜜蜂,直到蜜蜂全部死亡。 1.5 样品采集 1.5.1 蜜蜂幼虫饲养试验
从每组的8个重复中各任意选出4个重复,每重复随机选取发育正常的6日龄幼虫、3日龄蛹以及刚羽化蜜蜂(1日龄成蜂)各5只,准确称重,计算其均值(幼虫需用蒸馏水冲洗掉体表蜂王浆并用吸水纸擦干)。另外,从剩余的4个重复中,每重复随机选取6日龄幼虫、3日龄蛹以及刚羽化蜜蜂各3只,立即放入液氮速冻,-80 ℃保存,用于Cu/Zn-SOD基因相对表达量的测定。 1.5.2 工蜂笼养试验
在各重复中选择3个重复进行采样,不参与 生存率的记录和分析。每重复随机采集3、9、15日龄工蜂各4只,以4只工蜂头部作为1个样品,取样后立即放入液氮速冻,-80 ℃保存,用于Cu/Zn-SOD基因相对表达量的测定。 1.6 Cu/Zn-SOD基因相对表达量的测定
用Trizol总RNA提取试剂盒进行样品总RNA的提取。所有操作均按照试剂盒说明书进行。将提取的总RNA溶于30 μL RNA-free的焦磷酸二乙酯(DEPC)水中,经琼脂糖凝胶电泳和紫外分光光度计检测后,放入-80 ℃保存。
用反转录试剂盒对总RNA进行反转录,反应体系为50 μL:8 μL总RNA,10 μL Buffer,8 μL dNTP,1.5 μL M-MLV反转录酶,3 μL Oligo dT,1 μL RNA酶抑制剂,18.5 μL DEPC水。反转录反应条件如下:体系混匀后,42 ℃反应60 min,75 ℃反应5 min。反转录产物稀释10倍后保存于-80 ℃。
采用DNAMAN 5.0设计引物,引物序列见表2。实时定量PCR(RT-qPCR)反应体系为10 μL:1 μL反转录产物,目的基因的上游和下游引物各0.4 μL,5 μL 2×SYBR Premix Ex TaqTM Ⅱ,3.2 μL ddH2O。PCR扩增程序为95 ℃预变性30 s,95 ℃ 10 s,58.9 ℃ 1 min,40个循环;最后以每5 s上升0.5 ℃的速度从61 ℃升到95 ℃,记录熔解曲线,每个反转录样品重复测定3次。反应结束后收集目的基因与内参基因的循环数(Ct)值,用qPCR package的R软件计算扩增效率,参考文献[ 12 ]的方法计算目的基因的相对表达量。
| 表2 引物序列
Table 2 Primer sequence
|
采用SPSS 17.0软件对试验数据进行Kaplan-Meier法的生存分析,采用StatView软件“ANOVA and t-test”中的“ANOVA or ANCOVA”进行统计分析。 2 结果与分析 2.1 维生素C对中华蜜蜂幼虫发育的影响 2.1.1 维生素C对中华蜜蜂幼虫体重的影响 2.1.1.1 6日龄幼虫体重
由图1可知,6日龄幼虫的体重随着饲粮中维生素C含量的增加先增加后降低,具体表现为Ⅱ和Ⅲ组显著高于对照组(P<0.05),且Ⅱ和Ⅲ组还显著高于Ⅴ组(P<0.05),但Ⅱ和Ⅲ组之间差异不显著(P>0.05)。
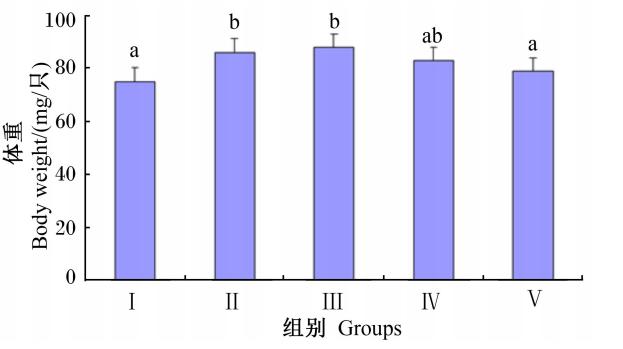 | 图1 维生素C对6日龄幼虫体重的影响
Fig.1 Effects of vitamin C on body weight of 6-day-old larvae数据柱标注相同字母表示差异不显著( P> 0. 05) ,不同字母表示差异显著( P< 0. 01) 。 下图同。 Date columns with the same letters mean no significant difference ( P> 0. 05) , while with different letters mean signif.icant difference ( P< 0. 05) . The same as below. |
由图2可知,3日龄蛹的体重随着饲粮中维生素C含量的增加先增加后降低,具体表现为Ⅱ和Ⅲ组均显著高于对照组(P<0.05),且Ⅱ和Ⅲ组还显著高于Ⅳ和Ⅴ组(P<0.05),但Ⅱ和Ⅲ组之间差异不显著(P>0.05)。
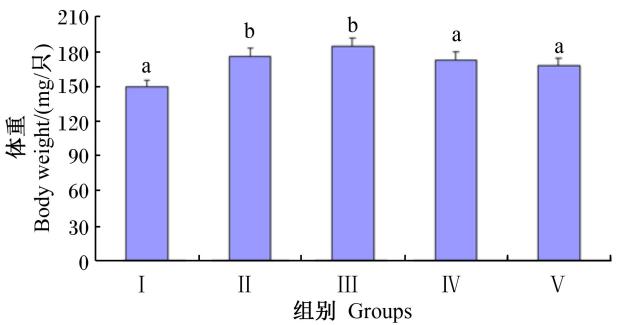 | 图2 维生素C对3日龄蛹体重的影响 Fig.2 Effects of vitamin C on body weight of 3-day-old pupae |
由图3可知,刚羽化蜜蜂体重随着饲粮中维生素C含量的增加先增加后降低,具体表现为Ⅱ和Ⅲ组显著高于对照组及Ⅳ和Ⅴ组(P<0.05),但Ⅱ和Ⅲ组之间差异不显著(P>0.05)。
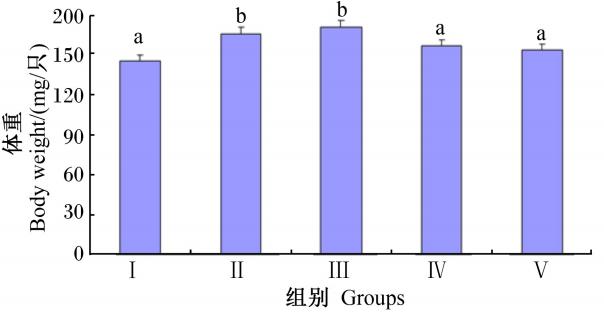 | 图3 维生素C对刚羽化蜜蜂体重的影响 Fig.3 Effects of vitamin C on body weight of new emerged bees |
由图4可知,中华蜜蜂幼虫化蛹率及羽化率随着饲粮中维生素C含量的增加均先上升后下降。在化蛹率方面,Ⅱ和Ⅲ组显著高于对照组及Ⅳ和Ⅴ组(P<0.05),而Ⅱ和Ⅲ组之间差异不显著(P>0.05)。在羽化率方面,Ⅱ、Ⅲ和Ⅳ组显著高于对照组和Ⅴ组(P<0.05),但Ⅱ、Ⅲ和Ⅳ组之间差异不显著(P>0.05)。
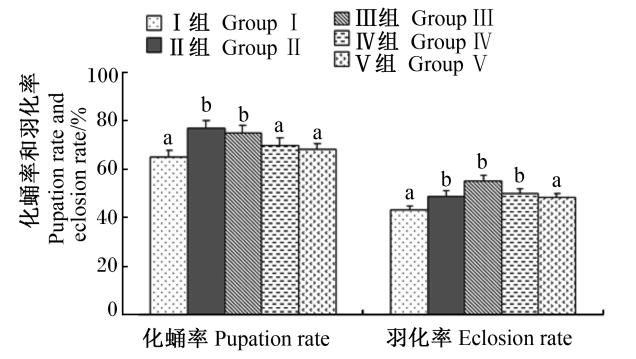 | 图4 维生素C对中华蜜蜂幼虫化蛹率和羽化率的影响 Fig.4 Effects of vitamin C on pupation rate and eclosion rate of larvae for Apis cerana cerana |
由图5可知,中华蜜蜂幼虫不同发育时期Cu/Zn-SOD基因的相对表达量均随着饲粮中维生素C含量的增加先升高后降低。其中,各试验组6日龄幼虫和3日龄蛹Cu/Zn-SOD基因的相对表达量均显著高于对照组(P<0.05),且以Ⅲ组的相对表达量最高。对于刚出房的1日龄成蜂的Cu/Zn-SOD基因的相对表达量,各组之间差异均不显著(P>0.05)。
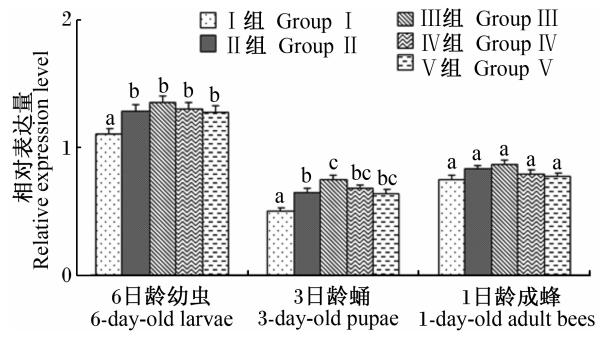 | 图5 维生素C对不同阶段中华蜜蜂幼虫 Cu/Zn-SOD基因相对表达量的影响 Fig.5 Effects of vitamin C on the relative expression level of Cu/Zn-SOD gene of larvae for Apis cerana cerana in different stages |
由表3可知,工蜂的平均寿命随着饲粮中维生素C含量的增加先增加后减少,具体表现为各试验组均显著高于对照组(P<0.05),其中Ⅷ组的平均寿命最长,为24.204 d。分析工蜂的存活曲线(图6)发现,添加维生素C的各试验组工蜂的生存时间明显长于对照组,而且Ⅷ组工蜂的存活率高于其他试验组,存活的时间最长。
| 表3 维生素C对工蜂平均寿命的影响 Table 3 Effects of vitamin C on average lifespan of worker bees d |
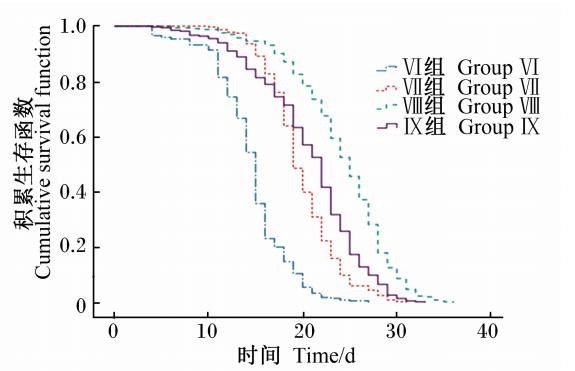 | 图6 维生素C对工蜂存活率的影响 Fig.6 Effects of vitamin C on survival rate of worker bees |
由图7可知,各日龄工蜂Cu/Zn-SOD基因的相对表达量均随着饲粮维生素C含量的增加而减少,其中Ⅸ组3、9、15日龄工蜂以及Ⅷ组9、15日龄工蜂Cu/Zn-SOD基因的相对表达量均显著低于对照组(P<0.05)。
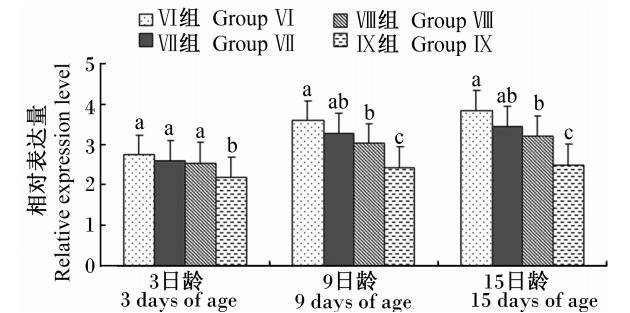 | 图7 维生素C对不同阶段工蜂 Cu/Zn-SOD基因相对表达量的影响 Fig.7 Effects of vitamin C on the relative expression level of Cu/Zn-SOD gene of worker bees in different stages |
蜜蜂营养对蜜蜂正常生长与繁衍的重要作用,一直受到世界各国蜜蜂科研工作者的广泛关注,特别是蜜蜂对维生素的需求,现已成为人们关注的焦点之一。维生素C作为具有抗氧化活性的水溶性维生素,对大部分植食性昆虫是必不可少的,这也是这类昆虫的特点[ 13 ]。在生物体的有氧代谢过程中,维生素C能够保护机体免于氧化剂的威胁,在机体的抗氧化过程中发挥着重要的作用[ 3 ]。本试验在饲粮中人工添加不同浓度的维生素C,分别饲喂中华蜜蜂幼虫和刚出房的工蜂后发现:添加适量维生素C可以提高幼虫的体重、抗氧化能力和工蜂的生存能力,适量的维生素C能够增加工蜂的寿命,饲粮中维生素C的含量过量反而降低工蜂的寿命,甚至有害健康。这与前人研究的结果[ 6,11 ]相符。这表明维生素C不仅是成年工蜂所必需的营养成分,同时也是幼虫发育过程中必不可少的功能性营养物质,对幼虫正常的生长发育起着重要的作用。试验结果还发现,向幼虫基础饲粮中添加10和20 mg/kg维生素C的试验组在6日龄幼虫、3日龄蛹、刚羽化蜜蜂的体重以及化蛹率、羽化率方面均显著高于对照组,表明蜜蜂幼虫饲粮中维生素C的适宜含量为11.6~21.6 mg/kg。另外,饲喂中等浓度(500 mg/kg)维生素C后工蜂的平均寿命最长。然而,蜜蜂是典型的社会性昆虫,以群体为单位,在对蜂群进行人工饲养时,不可能对幼虫和工蜂进行单独饲养。对蜂群饲喂不同含量的维生素C饲粮后,其工蜂分泌的蜂王浆和饲喂给幼虫食物中维生素C含量有待于进一步研究,从而最终确定蜂群对维生素C的营养需要量。
SOD是一种主要的抗氧化酶,它能催化超氧阴离子自由基发生歧化反应而生成分子氧和过氧化氢,为清除氧自由基的第1道防线[ 9 ]。本研究发现,饲喂添加维生素C饲粮后6日龄幼虫和3日龄蛹Cu/Zn-SOD基因的相对表达量均显著高于对照组,说明维生素C可以提高幼虫的抗氧化能力。然而,在刚出房的工蜂中,Cu/Zn-SOD基因的相对表达量在各试验组与对照组之间均差异不显著,而且对刚出房的工蜂采用不同浓度维生素C饲粮进行饲养后,其Cu/Zn-SOD基因的相对表达量随着维生素C含量的增加而降低,饲喂添加高剂量(2 500 mg/kg)维生素C饲粮的工蜂Cu/Zn-SOD基因的相对表达量在3、9、15日龄均显著低于对照组,可能是工蜂与幼虫的抗氧化性能机制不同,也可能是长时间饲喂维生素C导致的。维生素C本身作为一种抗氧剂,在一定程度上可能替代了Cu/Zn-SOD基因的表达产物发挥抗氧化作用,导致机体抗氧化基因的表达量下降,其具体的作用机理仍需进一步研究。 4 结 论
① 中华蜜蜂幼虫人工饲粮中维生素C的适宜含量为11.6~21.6 mg/kg。
② 饲粮中维生素C含量对中华蜜蜂工蜂的生存能力有影响。
致谢: 试验中得到了江西农业大学蜜蜂研究所何旭江、王文祥等同学的支持和帮助,在此表示衷心的感谢。
| [1] | 曾志将.蜜蜂生物学[M]. 北京:中国农业出版社,2007. ( 1) 1)
|
| [2] | 曾志将.养蜂学[M]. 2版.北京:中国农业出版社,2009. ( 1) 1)
|
| [3] | 熊正英,张全江.维生素C抗氧化作用及其在运动中的应用[J]. 陕西师范大学学报:自然科学版,1998,26(4):109-112. ( 2) 2)
|
| [4] | BOTTJE W G,ERF G F,BERSI T K,et al.Effect of dietary DL-alpha-tocopherol on tissue alpha- and gamma-tocopherol and pulmonary hypertension syndrome (ascites) in broilers[J]. Poultry Science,1997,76(11):1506-1512. ( 1) 1)
|
| [5] | 冯倩倩,胥保华,刘锋,等.维生素对蜜蜂生长发育的影响[J]. 中国蜂业,2011,62(1):14-15. ( 1) 1)
|
| [6] | 刘富海.矿物质、维生素C、鞣酸对蜜蜂寿命的影响[J]. 中国蜂业,1990(2):8-9. ( 2) 2)
|
| [7] | 汪礼国.蜜蜂营养对王浆增产效果的研究[J]. 蜜蜂杂志,1992(3):10-11. ( 1) 1)
|
| [8] | 林庆斌,廖升荣,熊亚红,等.超氧化物歧化酶(SOD)的研究和应用进展[J]. 化学世界,2006,47(6):378-381. ( 1) 1)
|
| [9] | 朱秀敏.超氧化物歧化酶的生理活性[J]. 当代医学,2011,17(15):26-27. ( 2) 2)
|
| [10] | 刘俊峰,刘亭亭,王欢,等.中华蜜蜂铜锌超氧化物歧化酶基因的克隆、序列分析及表达特征[J]. 动物营养学报,2012,24(8):1512-1519. ( 1) 1)
|
| [11] | 刘俊峰,吴小波,王子龙,等.维生素C对中华蜜蜂死亡率及其铜锌超氧化物歧化酶基因表达的影响[J]. 中国畜牧兽医,2013,40(8):39-41. ( 2) 2)
|
| [12] | HUANG Q,KRYGER P,LE CONTE Y,et al.Survival and immune response of drones of a Nosemosis tolerant honey bee strain towards N.ceranae infections[J]. Journal of Invertebrate Pathology,2012,109(3):297-302. ( 1) 1)
|
| [13] | 方杰,朱麟,杨振德,等.昆虫人工饲料配方研究概况及问题探讨[J]. 四川林业科技,2003,24(4):18-26. ( 1) 1)
|




