2. 日本鹿儿岛大学农学部, 日本鹿儿岛 890-0065
2. Department of Biochemical Science and Technology, Faculty of Agricultural, Kagoshima University, Kagoshima 890-0065, Japan
在动物机体中存在2类抗氧化防御体系,包括酶类反应系统和非酶类反应系统。非酶类反应系统主要为具有还原性的小分子物质,如维生素C、一些巯基化合物、还原型谷胱甘肽(reduced glutathione,GSH)等物质在体内与过氧化物、活性氧自由基(reactive oxygen species,ROS)等发生氧化还原反应来起到抗氧化的效应。但通过过量补充此类小分子还原性物质的抗氧化试验并未取得很好的预期效果[1]。动物机体抗氧化的最主要且根本的措施则是另一类——酶类反应系统,它包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和转化活性物质的Ⅱ相解毒酶系统(phase Ⅱ enzymes),如醌氧化还原酶-1(NQO1)、谷胱甘肽-S-转移酶(GST)等,而在动物机体中它们被证实普遍都受到Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)-核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)途径的控制,而该途径为实现适度、可控的畜禽抗氧化过程的调节开辟了新途径。
1 ARE、Nrf2和Keap1的分子生物学特性及 三者的关系 1.1 ARE的分子生物学特性ARE位于频谱细胞保护基因的上游启动子区域,是一个特异的DNA-启动子结合序列[2],它调控下游多种基因的表达,包括有:Ⅱ相解毒酶基因(如NQO1、GST等)、抗氧化蛋白类基因(如SOD、CAT、GSH等)、蛋白酶体/分子伴侣类基因(如26S蛋白酶体的20S核心颗粒中的关键催化亚单位psmb5[3]、含热休克蛋白在内的某些分子伴侣家族[4,5]等)、抗炎因子类基因(如白细胞介素-1、肿瘤坏死因子-α、血红素加氧酶-1等)和其他特殊基因(如多向性耐药蛋白1-2[6]等)。这些基因多数与机体的抗氧化、抗炎症有关,对维护机体的氧化与抗氧化平衡,维持机体氧化还原的稳态有着关键的作用。
1.2 Nrf2的分子生物学特性
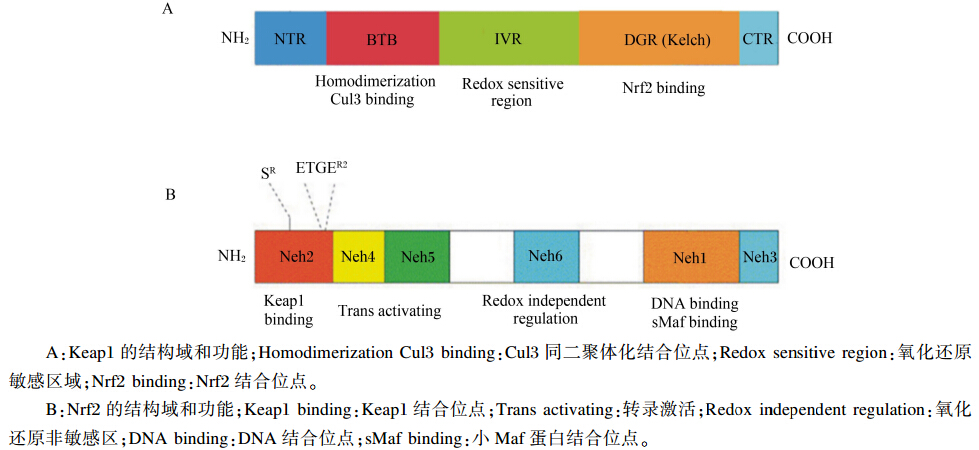
Nrf2是CNC(cap‘n’collar)转录因子家族成员,且是其中活力最强的转录调节因子,在生物体多脏器中均高度表达,具有一个高度保守的碱性亮氨酸拉链结构(leucime zipper,bZIP)[7,8]。Nrf2蛋白分子含有6个不同的功能区域,分别被命名为Neh1~Neh6,如图1所示[2,9]。Neh1区含有一个C端bZIP结构,能够与细胞核内的小Maf蛋白(small Maf proteins,sMaf)结合,从而识别ARE上的特定基序而结合到ARE上,启动目标基因表达[10];Neh2区是Nrf2与Keap1的结合位点,其上的ETGE基序对这一过程起着至关重要的作用[11];Neh3、Neh4、Neh5区可与一些转录激活剂,如cAMP反应元件结合蛋白(cAMP responsive element binding protein,CBP)、组蛋白乙酰基转移酶等作用,启动靶基因转录及上调靶基因表达[1, 2, 12];Neh6区是氧化还原非敏感区,有大量丝 氨酸残基,对Nrf2有不依赖于Keap1的负调控作用[13,14]。
1.3 Keap1的分子生物学特征Keap1是一个与胞浆肌动蛋白结合的多肽,同时也是Nrf2在细胞质中的结合蛋白,主要通过结合Nrf2使之无法进入细胞核,从而抑制Nrf2的活性,对Nrf2起负调控作用,被认为是机体氧化应激的感受器[1, 2, 15]。Keap1包含5个区域(如图1所示[2,9]),分别为:N端结构域(NTR)、C端区域(CTR)、插入结构域(IVR)、BTB/POZ结构域和Kelch/DGR(double glycine repeat)结构域。Kelch/DGR区含有6个双链甘氨酸重复片段,既是Keap1与胞浆肌动蛋白的结合位点,也是其与Nrf2的结合位点[16];BTB/POZ结构域介导Keap1二聚体化并与其跟Nrf2的结合力有关,并且参与Nrf2的泛素化降解过程[2,17];IVR区富含半胱氨酸残基,对氧化信号敏感,因此Keap1与亲电化合物及氧化剂的反应就发生在该区[2, 17, 18],IVR区亦参与泛素连接酶形成,与Nrf2稳定性有关[15,17]。
1.4 Nrf2的活化及其与ARE、Keap1的关系
在正常的生理状态下,Nrf2的Neh2区通过ETGE基序在胞浆中与含有6个双链甘氨酸重复片段的固定在胞浆肌动蛋白上Keap1的Kelch/DGR区相结合,并且依靠26S蛋白酶体的降解作用维持低含量非活性的稳定状态,此状态下Nrf2无法由细胞质进入细胞核激活下游基因表达[9, 16, 19];目前认为的Nrf2激活方式有竞争性抑制激活(如前胸腺素α等物质与Keap1的结合能力超过Nrf2从而使Nrf2活化)、降低Nrf2的降解激活(如通过蛋白酶体抑制剂抑制其对Nrf2的降解)等方式[1],不过并未获得共识,而有研究还认为Nrf2本身可能也含有氧化应激感受器,但缺乏有力证明[20]。而现今公认的Nrf2活化的2种主要方式如图2所示[21],即当氧化性分子和亲电物质等与Keap1的IVR区反应(IVR区的半胱氨酸残基担负着对应激信号主要的传感作用,其机制是Cys273和Cys288的2处半胱氨酸残基突变为丙氨酸和丝氨酸,导致Nrf2泛素化降低,稳定性升高[22])使Nrf2活化或是Nrf2在多种蛋白激酶途径中其自身被磷酸化而激活,且目前多认为不同的细胞类型和刺激方式使得Nrf2磷酸化激活的途径不同,如有促分裂原活化蛋白激酶(MAPKs)、蛋白激酶C(PKC)、磷脂酰肌醇-3-激酶(PI3K)、胰腺内质网激酶(PERK)等几条蛋白激酶途径参与了Nrf2的激活[23,24,25]。活化的Nrf2不会被蛋白酶体降解并进入细胞核内与小Maf蛋白等其他的bZIP蛋白质结合成异二聚体,之后识别到ARE元件上,并在CBP等转录激活剂、分子伴侣的帮助下,启动ARE下游一系列抗氧化解毒酶类基因的转录表达,提高机体抗氧化能力[2]。
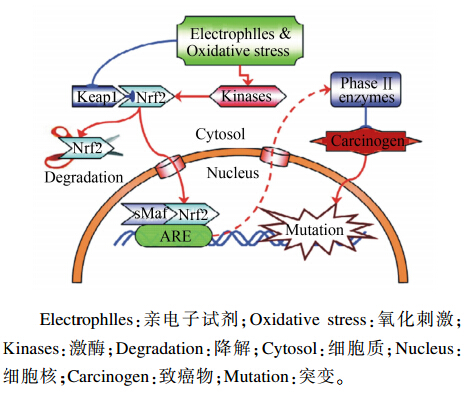 | 图2 亲电试剂或氧化刺激激动Keap1/Nrf2/ARE示意图Fig.2 Schematic overview of Keap1/Nrf2/ARE activation by electrophiles or oxidative stress[21] |
自由基介导的氧化应激广泛参与众多病理生理变化,对畜禽生产、肉品质及健康有着极大的负面影响。Nrf2介导的生物机体内源抗氧化途径作为机体最重要的抗氧化、抗炎症措施与动物体的产品品质及健康保护息息相关。
2.1 肉品质目前,蛋白酶体与肉嫩度等品质的关系已逐渐开始被认识到[26],蛋白酶体不仅能够破坏肌原纤维结构,水解肌原纤维蛋白,而且在尸僵后肉的成熟过程中(死后7 d,pH<6.0),蛋白酶体依然保持很高的多种酶或酶样活性[27],而蛋白酶体的亚单位蛋白合成能力随衰老和氧化应激而下降,而且26S蛋白酶体20S核心颗粒中14个亚单位蛋白中12个的表达随着Nrf2激活诱导剂的加入而升高[3,4],表明Nrf2可能通过对蛋白酶体产生作用而影响畜禽肉品质。
王成等[28]研究肉仔鸡卫星细胞氧化应激时发现在地塞米松诱导的肉仔鸡胸肌骨骼肌卫星细胞产生的氧化应激过程中,p38 MAPK通路起着关键作用。不过目前将畜禽的肉品质与Nrf2直接相关联的研究报道还十分少见,仅见胥蕾[29]从SOD、GST和调控它们表达的MAPK-Nrf2/ECH(chicken erythroid-derived CNC-homology factor,鸡中的Nrf2同源蛋白)-ARE信号通路的角度着手,研究了不同致晕方法(电致晕和气致晕)对肉仔鸡肌肉在储存期间肉色和脂质氧化的影响及脂质过氧化物清除的机制,其结果显示在致晕处理中,G40%(40%二氧化碳致晕)和E65 V(65 V电致晕)都有维护储存期肉色稳定的效果。但其中E65 V通过升高血清尿酸水平,激活MAPK-Nrf2信号通路及该通路下游的SOD和GST的基因表达,增强了抗氧化能力,缓解了肉品在储存期间的脂质过氧化,而G40%由于屠宰初期对上述基因的表达发生抑制,显示适应性较低,肉品在储存期间受到更强的氧化损伤,这不仅说明E65 V电致晕对保存期肉品质有更优的效果,更充分说明Nrf2/ECH介导的机体抗氧化途径抑制脂质过氧化,对提升畜禽肉质有重要作用。
2.2 抗应激应激根据应激原不同分为冷应激、热应激、断奶应激、噪声应激等[30],机体的应激反应可能造成机体的氧化还原状态失衡,如宋小珍等[31]和王妍琪[32]分别报道了热应激均导致了肉牛和肉仔鸡机体产生了明显的氧化损伤,且机体中多种抗氧化酶活性呈先降低后缓慢升高的态势;又如Shustanova等[33]研究发现,冷应激通过改变生物体的促氧化和抗氧化间的平衡,降低髓过氧化酶活性等,使机体产生过多的自由基,脂质过氧化作用增强,诱发氧化损伤,王金涛等[34,35]进一步研究发现急性冷应激时雏鸡的总抗氧化能力(T-AOC)在下丘脑、腓肠肌及血清中均呈下降趋势,且下丘脑GSH-Px活性随应激时间的延长逐渐降低,但血清中GSH-Px活性变化规律则反之。急、慢性冷应激条件下,雏鸡下丘脑与血清SOD、CAT活性降低,但随应激时间的延长又代偿性渐缓升高,黄芳芳[36]在间歇低温刺激对肉鸡抗氧化功能等的研究中也得到了类似结论。而动物机体中各种抗氧化酶的表达及活性均受到Keap1-Nrf2-ARE通路的精密调控,上述各不同应激条件下动物机体中多种抗氧化酶活性的变化都说明Nrf2参与了动物机 体的抗应激及抗由应激造成的氧化损伤的过程。同时刘晓丹[37]在对肉鸡冷应激相关基因的mRNA表达谱分析及差异表达基因的研究中,通过Pathway分析表明差异表达的基因主要富集在MAPK信号通路、磷脂酰肌醇信号系统、氧化磷酸化、过氧化物酶、糖酵解/异生等过程中,提示肉鸡在冷应激条件下可能通过激活的MAPK、磷脂酰肌醇等通路中的激酶使Nrf2磷酸化而激活,进而由Nrf2启动ARE下游的一系列抗氧化、解毒酶类表达从而使机体抵抗因冷应激而产生的氧化损伤。
2.3 保健品、新型绿色饲料添加剂等的开发目前,在医学上利用无毒或毒性较低的天然化合物通过调控Keap1-Nrf2-ARE途径来保护多脏器,实现抗氧化、抗炎症以及抑癌等的研究方兴未艾。在现代畜禽生产中,通过开发动物体的新型绿色保健药物或是天然饲料添加剂来激活机体内源的抗氧化、抗炎症机制,调节畜禽机体的氧化还原平衡,提高畜禽生产性能,保持畜禽健康和肉品质的研究亦极具潜力。如表1所示,总结介绍了近年来研究的多种对机体抗氧化及对Nrf2-ARE途径具有激动诱导作用的天然产物。
| 表1 具有激活Nrf2抗氧化途径作用的天然产物
Table 1 Natural products activate of the Nrf2 antioxidant response pathway
|
表1中列举的多种天然产物实际上有一些已开始在畜牧业中作为饲料添加剂或畜禽保健产品来使用,或是正在尝试着进行相关的开发研究,如姜黄素、茶多酚等,而另外的也极具开发潜力。除此之外,还有诸如大豆异黄酮、花青素等亦具有类似功能。利用天然产物激动机体Nrf2抗氧化途径的特性来研究、开发相应的畜禽保健品或饲料添加剂的前景十分广阔。
2.4 生长发育Nrf2介导的抗氧化途径广泛存在于畜禽机体中,并被证明与动物的生长发育极度相关。而在动物营养领域目前相关的研究主要集中在猪上。Wang等[57]研究发现出生重低的仔猪的空肠重量极显著低于正常出生重仔猪,其空肠组织中氧化型谷胱甘肽/还原型谷胱甘肽(GSSG/GSH)亦极显著高于正常出生重的仔猪,表明低出生重仔猪肠道发育受到抑制,同时肠道氧化应激损伤严重。Yin等[58]研究新生仔猪受到的氧化应激及其与机体抗氧化系统的发育时发现,新生仔猪在出生时(1日龄)其血浆丙二醛、蛋白羰基化及8-羟基-(脱氧)鸟嘌呤水平均很高,表明新生仔猪在出生时受到全面且严重的氧化应激损伤,而血浆和肠道中SOD等抗氧化酶及Nrf2的基因表达及含量升高,使机体不断对抗氧化应激损伤,同时不断完善自身的内源抗氧化系统,保障机体的正常生长发育,特别是肠道等营养器官的生长发育。这些都说明Nrf2调控的抗氧化途径与畜禽的生长发育及营养代谢息息相关。
3 小 结机体氧化还原水平失衡是多种疾病的病理生理基础,亦会对动物的营养代谢、抗应激能力及发育机能造成影响,进而降低畜禽生长、繁殖性能,同时氧化还原水平的失衡对畜禽的肉品质亦有危害,降低畜禽产品质量。不同于以往其他的抗氧化剂,Nrf2-ARE通路由于是细胞调控多种抗氧化酶转录表达的关键通路,能使细胞免受氧化损伤,此通路为实现有效、适度的抗氧化调控提供了新方法。而目前发现多种天然产物对Nrf2-ARE通路有激动作用,通过对这些以及对Nrf2和其调控的抗氧化通路全面、精确的了解,将为开发新型畜禽抗氧化保健品或饲料添加剂以及实现对机体内源抗氧化进行适度、有效的调控开辟新的途径。
| [1] | 蔡维霞,张军,胡大海.氧化和化学应激的防御性转导通路——Nrf2/ARE[J]. 中国生物化学与分子生物学报,2009,25(4):297-303. ( 4) 4)
|
| [2] | 童海达,王佳茗,宋英.Keap1-Nrf2-ARE在机体氧化应激损伤中的防御作用[J]. 癌变·畸变·突变,2013,25(1):71-75. ( 8) 8)
|
| [3] | KWAK M K,WAKABAYASHI N,ITOH K,et al.Modulation of gene expression by cancer chemopreventive dithiolethiones through the Keap1-Nrf2 pathway.Identification of novel gene clusters for cell survival[J]. The Journal of Biological Chemistry,2003,278(10):8135-8145. ( 2) 2)
|
| [4] | BULTEAU A L,SZWEDA L I,FRIGUET B.Age-dependent declines in proteasome activity in the heart[J]. Archives of Biochemistry and Biophysics,2002,397(2):298-304. ( 2) 2)
|
| [5] | CULLINAN S B,ZHANG D,HANNINK M,et al.Nrf2 is a direct PERK substrat e and effector of PERK-dependent cell survival[J]. Molecular and Cell Biology,2003,23(20):7198-7209. ( 1) 1)
|
| [6] | LAU A,VILLENEUVE N F,SUN Z,et al.Dual roles of Nrf2 in cancer[J]. Pharmacological Research,2008,58(5/6):262-270. ( 1) 1)
|
| [7] | YU X,KENSLER T.Nrf2 as a target for cancer chemoprevention[J]. Mutation Research,2005,591(1/2):93-102. ( 1) 1)
|
| [8] | 李航,段惠军.Nrf2/ARE信号通路及其调控的抗氧化蛋白[J]. 中国药理学通报,2011,27(3):300-303. ( 1) 1)
|
| [9] | NIOI P,HAYES J D.Contribution of NAD(P)H:quinone oxidoreductase 1 to protection against carcinogenesis,and regulationof its gene by the Nrf2 basic-region leucine zipper and the arylhydrocarbon receptor basic helix-loop-helix transcription factors[J]. Mutation Research,2004,555(1/2):149-171. ( 4) 4)
|
| [10] | JAIN A K,BLOOM D A,JAISWAL A K.Nuclear import and export signals in control of Nrf2[J]. Journal of Biological Chemistry,2005,280(32):29158-29168. ( 1) 1)
|
| [11] | NIOI P,MCMAHON M,ITOH K,et al.Identification of a novel Nrf2-regulated antioxidant response element (ARE) in the mouse NAD(P)H:quinone oxidoreductase 1 gene:reassessment of the ARE consensus sequence[J]. The Biochemical Journal,2003,374(Pt 2):337-348. ( 1) 1)
|
| [12] | KATOH Y,ITOH K,YOSHIDA E,et al.Two domains of Nrf2 cooperatively bind CBP,a CREB binding protein,and synergistically activate transcription[J]. Genes Cells,2001,6(10):857-868. ( 1) 1)
|
| [13] | MAGESH S,CHEN Y,HU L Q.Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J]. Medicinal Research Review,2012,32(4):687-726. ( 1) 1)
|
| [14] | MCMAHON M,THOMAS N,ITOH K,et al.Redox-regulated turnover of Nrf2 is determined by at least two separate protein domains,the redoxsensitive Neh2 degron and the redox-insensitive Neh6 degron[J]. The Journal of Biological Chemistry,2004,279(30):31556-31567. ( 1) 1)
|
| [15] | 刘芳,杜志银,王应雄.Keap1在氧化应激方面的研究进展[J]. 中国临床药理学与治疗学,2010,15(5):596-600. ( 2) 2)
|
| [16] | KANG M I,KOBAYASHI A,WAKABAYASHI N,et al.Scaffolding of Keap1 to the actin cytoskeleton controls the function of Nrf2 as key regulator of cytoprotective phase 2 genes[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(7):2046-2051. ( 2) 2)
|
| [17] | 钟敏.Nrf2-Keap1抗氧化系统研究进展[J]. 中国公共卫生,2006,22(3):360-362. ( 3) 3)
|
| [18] | DINKOVA-KOSTOVA A T,HOLTZCLAW W D,COLE R N,et al.Direct evidence that sulfhydryl groups of Keap1 are the sensors regulating induction of phase 2 enzymes that protect against carcinogens and oxidants[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(18):11908-11913. ( 1) 1)
|
| [19] | 朱宇旌,李艳,张勇,等.转录因子E2相关因子2-抗氧化反应元件信号通路与机体抗氧化的关系[J]. 动物营养学报,2013,25(3):458-463. ( 1) 1)
|
| [20] | BAIRD L,DINKOVA-KOSTOVA A T.The cytoprotective role of the Keap1-Nrf2 pathway[J]. Archives of Toxicology,2011,85(4):241-272. ( 1) 1)
|
| [21] | KWON K H,BARVE A,YU S,et al.Cancer chemoprevention by phytochemicals:potential molecular targets,biomarkers and animal models[J]. Acta Pharmacological Sinica,2007,28(9):1409-1421. ( 2) 2)
|
| [22] | 齐晓龙.共轭亚油酸对产蛋鸡抗氧化机能的影响 . 博士学位论文.北京:中国农业科学院,2013. ( 1) 1)
|
| [23] | JAIN A K,JAISWAL A K.GSK-3 beta acts upstream of Fyn kinase in regulation of nuclear export and degradation of NF-E2 related factor 2[J]. The Journal of Biological Chemistry,2007,282(22):16502-16510. ( 1) 1)
|
| [24] | CULLINAN S B,DIEHL J A.PERK-dependent activation of Nrf2 contributes to redox homeostasis and cell survival following endoplasmic reticulum stress[J]. The Journal of Biological Chemistry,2004,279(19):20108-20117. ( 1) 1)
|
| [25] | 李煌元,石年.Keap-Nrf2/ARE通路在分子毒理学中的研究进展[J]. 国外医学:卫生学分册,2006,33(3):129-135. ( 1) 1)
|
| [26] | 陈旭东,唐茂妍,计成,等.蛋白酶体及其与肉品质的关系[J]. 中国饲料,2006(16):29-32. ( 1) 1)
|
| [27] | LAMARE M,TAYLOR R G,FAROUT L.Changes in proteasome activity during postmortem aging of bovine muscle[J]. Meat Science,2002,61(2):199-204. ( 1) 1)
|
| [28] | 王成,武书庚,张海军,等.肉仔鸡卫星细胞氧化应激时MAPK信号通路[J]. 中国农业科学,2010,43(20):4286-4294. ( 1) 1)
|
| [29] | 胥蕾.致晕方法影响肉仔鸡肉品质的机理及脂质过氧化调控[D]. 博士学位论文.北京:中国农业科学院,2011. ( 2) 2)
|
| [30] | 李洁.益生菌、葡聚糖对不同冷应激状态下贵妃雏鸡生理生化指标、免疫及HSP70表达的影响研究[D]. 硕士学位论文.泰安:山东农业大学,2012. ( 1) 1)
|
| [31] | 宋小珍,付戴波,瞿明仁,等.热应激对肉牛血清内分泌激素含量、抗氧化酶活性及生理生化指标的影响[J]. 动物营养学报,2012,24(12):2485-2490. ( 1) 1)
|
| [32] | 王妍琪.茶多酚、维生素E对肉仔鸡热应激时生产性能和抗氧化性能的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2004. ( 1) 1)
|
| [33] | SHUSTANOVA T A,BONDARENKO T I,MILIUTIAN N P.Free radical mechanism of the cold stress development in rats[J]. Rossiîskii Fiziologicheskiî Zhurnal Imeni I M Sechenova,2004,90(1):73-82. ( 1) 1)
|
| [34] | 王金涛.冷应激对雏鸡神经内分泌及抗氧化功能的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2006. ( 1) 1)
|
| [35] | 王金涛,李宁,徐世文.急、慢性冷应激对雏鸡腓肠肌及血清抗氧化功能的影响[J]. 中国农学通报,2007,23(3):28-32. ( 1) 1)
|
| [36] | 黄芳芳.间歇性低温刺激对肉鸡生产性能、抗氧化功能和组织结构的影响[D]. 硕士学位论文.哈尔滨:东北农业大学,2012. ( 1) 1)
|
| [37] | 刘晓丹.肉鸡冷应激相关基因的mRNA表达谱分析及差异表达基因的研究[D]. 硕士学位论文.哈尔滨:东北农业大学,2012. ( 1) 1)
|
| [38] | MUNDAY R,MUNDAY C M.Induction of phase Ⅱ detoxification enzymes in rats by plant-derived isothiocyanates:comparison of allylisothiocyanate with sulforaphane and related compounds[J]. Journal of Agricultural and Food Chemistry,2004,52(7):1867-1871. ( 1) 1)
|
| [39] | 刘善新.羟基红花黄素A对缺氧\复氧诱导的H9c2心肌细胞凋亡的影响及机制研究[D]. 博士学位论文.杭州:浙江大学,2011. ( 1) 1)
|
| [40] | 黎荣,徐灵源,梁韬,等.葛根素对6-羟多巴胺所致帕金森病大鼠黑质组织Nrf2/ARE通路的影响[J]. 中国实验方剂学杂志,2013,19(6):230-233. ( 1) 1)
|
| [41] | 李兵兵,王龙,陈维雄,等.姜黄素对大鼠非酒精性脂肪性肝炎的作用及其机制初探[J]. 肝脏,2013,18(1):18-22. ( 1) 1)
|
| [42] | CHEN C,YU R,OWUOR E D,et al.Activation of antioxidant response element (ARE),mitogen-activated protein kinases (MAPKs) and caspases by major green tea poly phenol components during cell survival and death[J]. Archives of Pharmacal Research,2000,23(6):605-612. ( 2) 2)
|
| [43] | TANIGAWA S,FUJII M,HOU D X.Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin[J]. Free Radical Biology and Medicine,2007,42(11):1690-1703. ( 1) 1)
|
| [44] | CHEN C Y,JANG J H,LI M H,et al.Resveratrol upregulates heme oxygenase-1 expression via activation of NF-E2-related factor 2 in PC12 cells[J]. Biochemical and Biophysical Research Communications,2005,331(4):993-1000. ( 1) 1)
|
| [45] | CHEN C,PUNG D,LEONG V,et al.Induction of detoxifying enzymes by garlic organ osulfur compounds through transcription factor Nrf2:effect of chemical structure and stress signals[J]. Free Radical Biology and Medicine,2004,37(10):1578-1590. ( 1) 1)
|
| [46] | GONG P F,HU B,CEDERBAUM A I.Diallyl sulfide induces heme oxygenase-1 through MAPK pathway[J]. Archives of Biochemistry and Biophysics,2004,432(2):252-260. ( 1) 1)
|
| [47] | BEN-DOR A,STEINER M,GHEBER L,et al.Carotenoids activate the antioxidant response element transcription system[J]. Molecular Cancer Therapeutics,2005,4(1):177-186. ( 1) 1)
|
| [48] | MCMAHON M,ITOH K,YAMAMOTO M,et al.The Cap'n’collar basic leucine zipper transcription factor Nrf2 (NF-E2 p45-related factor 2) controls both constitutive and inducible expression of intestinal detoxification and glutathione biosynthetic enzymes[J]. Cancer Research,2001,61(8):3299-3307. ( 1) 1)
|
| [49] | JOUNG E J,LI M H,LEE H G,et al.Capsaicin induces heme oxygenase-1 expression in HepG2 cells via activation of PI3K-Nrf2 signaling:NAD(P)H:quinone oxidoreductase as a potential target[J]. Antioxidants & Redox Signaling,2007,9(12):2087-2098. ( 1) 1)
|
| [50] | CHOI B M,KIM B R.Upregulation of heme oxygenase-1 by brazilin via the phosphatidylinositol 3-kinase/Akt and ERK pathways and its protective effect against oxidative injury[J]. European Journal of Pharmacology,2008,580(1/2):12-18. ( 1) 1)
|
| [51] | CHOI B M,KIM S M,PARK T K,et al.Piperine protects cisplatin-induced apoptosis via heme oxygenase-1 induction in auditory cells[J]. The Journal of Nutritional Biochemistry,2007,18(9):615-622. ( 1) 1)
|
| [52] | NA H K,KIM E H,JUNG J H,et al.(-)-Epigallocatechin gallate induces Nrf2-mediated-antioxidant enzyme expression via activation of PI3K and ERK in human mammary epithelial cells[J]. Archives of Biochemistry and Biophysics,2008,476(2):171-177. ( 1) 1)
|
| [53] | ANDREADI C K,HOWELLS L M,ATHERFOLD P A,et al.Involvement of Nrf2,p38,B-Raf,and nuclear factor-kappaB,but not phosphatidylinositol 3-kinase,in induction of hemeoxygenase-1 by dietary polyphenols[J]. Molecular Pharmacology,2006,69(3):1033-1040. ( 1) 1)
|
| [54] | WU C C,HSU M C,HSIEH C W,et al.Upregulation of heme oxygenase-1 by Epigallocatechin-3-gallate via the phosphatidylinositol 3-kinase/Akt and ERK pathways[J]. Life Sciences,2006,78(25):2889-2897. ( 1) 1)
|
| [55] | LIAO B C,HSIEH C W,LIU Y C,et al.Cinnamaldehyde inhibits the tumor necrosis factor-alpha-induced expression of cell adhesion molecules in endothelial cells by suppressing NF-kappaB activation:effects upon IkappaB and Nrf2[J]. Toxicology and Applied Pharmacology,2008,229(2):161-171. ( 1) 1)
|
| [56] | ZHANG Y,GUAN L,WANG X,et al.Protection of chlorophyllin against oxidative damage by inducing HO-1 and NQO1 expression mediated by PI3K/Akt and Nrf2[J]. Free Radical Research,2008,42(4):362-371. ( 1) 1)
|
| [57] | WANG J J,CHEN L X,LI P,et al.Gene expression is altered in piglet small intestine by weaning and dietary glutamine supplementation[J]. The Journal of Nutrition,2008,138(6):1025-1032. ( 1) 1)
|
| [58] | YIN J,REN W,LIU G,et al.Birth oxidative stress and the development of an antioxidant system in newborn piglets[J]. Free Radical Research,2013,47(12):1027-1035. ( 1) 1)
|