淀粉被认为是奶牛体内最重要的葡萄糖前体物,它进入奶牛体内后经历非常复杂的代谢过程。大多数的可消化碳水化合物在瘤胃微生物的发酵下变为短链脂肪酸,如乙酸、丙酸和丁酸[1,2]。因此,大部分采食的淀粉在瘤胃内被分解,到达小肠以能量的形式被吸收的就很少了[3,4,5]。淀粉在瘤胃和小肠分布的比例影响蛋白质转化效率和能量代谢[6],因此产生了许多的饲喂方式来提高过瘤胃可消化淀粉以增加动物体内葡萄糖含量,例如加工处理或饲料组合[7]。一般来说,小肠内淀粉消化所吸收能量的利用效率高于瘤胃[6, 8, 9]。小肠消化的淀粉由肠道吸收后转化为葡萄糖供反刍动物利用,而瘤胃或小肠后肠段消化的淀粉则主要转化为VFA,其中只有丙酸在肝脏葡萄糖合成过程中发挥作用[8, 10, 11]。有研究表明,增加小肠淀粉的消化可以增加乳蛋白产量[12],这可能是由于节约了肠道和肝脏中氨基酸的利用。Nocek等[12]指出,没有确切的证据说明过瘤胃淀粉的消化能够增加产奶量或乳成分含量。然而,近期一些研究表明,瘤胃的发酵功能对于产奶量的贡献更大,淀粉的消化从瘤胃转移到小肠和大肠对产奶量和乳成分有害而不是有益[13]。本研究旨在探讨真胃灌注不同水平淀粉(0、800、1 600、2 400 g/d)对泌乳奶牛采食量、泌乳性能、胃肠道发酵和血液代谢的影响,探究增加小肠内淀粉水平是否有利于生产性能的提高以及最适的水平,为营养调控提供理论依据。
1 材料与方法 1.1 试验动物选取4头安装有瘤胃瘘管的荷斯坦2胎奶牛,平均泌乳天数为(267±17) d,平均产奶量为(19.0±2.3) kg/d,平均体重为(621±35) kg。试验在中国农业大学延庆试验基地进行。由于试验结果可能会受到妊娠情况的影响,本试验所用试验牛在试验期间均未参与配种。试验牛采用全混合日粮饲喂,其组成及营养水平见表1。
| 表1 全混合日粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the total mixed ration (DM basis) % |
试验采用4×4拉丁方设计将4头牛分为4组,分别向真胃内灌注0(对照组)、800、1 600、2 400 g/d淀粉,以20%淀粉溶液的形式灌注。共进行4期试验,每期7 d(5 d的预试期和2 d的正试期)。正试期内进行采样。本试验的试验期较短,主要是考虑到能量吸收效应能在短期内调控采食[14]。
真胃灌注方法:通过将1个直径为6 mm的塑料管经过瘤胃插入真胃,用1个直径18 cm的橡胶垫固定,将淀粉溶液灌入真胃[15,16]。
1.3 饲养管理试验动物在铺有橡胶垫的牛舍内栓系式饲养,每天07:30和19:30饲喂,07:00和19:00挤奶,1 h自由活动,自由饮水。
1.4 测定指标 1.4.1 采食量和营养物质表观消化率记录正试期的采食量,每头牛取800 g左右全混合日粮样以及剩料样,并用直肠取粪法每天分5次共采集1 200 g左右的鲜粪。采集的样品放入烘箱内65 ℃烘48 h,称重,粉碎过1 mm筛,保存待测。体重和体况评分在正试期第2天早上挤奶后4~6 h[14]由3位实验员进行测定,体重用胸围估测法,体况评分采用5分法[17]。
干物质(dry matter,DM)、有机物(organic matter,OM)、粗蛋白质(crude protein,CP)、中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)和淀粉含量的测定根据AOAC(1997)[18]中的方法进行。
全肠道营养物质表观消化率用酸不溶灰分(acid insoluble ash,AIA)作为内源指示剂进行测定[19],饲料、剩料和粪中AIA含量用4N-盐酸法测定,计算公式如下:
营养物质表观消化率(%)=[1-(Ain×Nf)/(Af ×Nin)]×100[20]。式中:Ain为消化的AIA含量(%,干物质基础,后同);Nin为消化的某营养物质(干物质、有机物、粗蛋白质、中性洗涤纤维、酸性洗涤纤维和淀粉)含量(%);Af为粪中AIA含量(%);Nf为粪中的该营养物质含量(%)。
1.4.2 泌乳性能正试期内记录产奶量。分别在早晨和晚上进行奶样的采集。奶样滴加重铬酸钾并置于4 ℃保存,送往北京奶牛中心用近红外分析仪(Milk Scan 605,丹麦Foss公司)测定乳脂、乳蛋白和乳糖含量,计算产量和比率。按以下公式计算4%乳脂校正乳产量、能量校正乳产量、乳能量输出量。
4%乳脂校正乳产量(kg/d)=(0.4×产奶量)+(15×乳脂产量); 能量校正乳产量(kg/d)=(0.324 6×产奶量)+12.86×乳脂产量)+(7.04×乳蛋白产量); 乳能量输出量(MJ/d)=4.184×产奶量×[(0.092 9×乳脂率)+(0.056 3×真蛋白质率)+(0.039 5×乳糖率)]。 1.4.3 瘤胃发酵特性正试期的第1天07:30~19:30每隔3.0 h采集1次瘤胃液,第2天往后推1.5 h,样品为12.0 h内每1.5 h采集得到。采集后的瘤胃液用8层乳酪纱布过滤,立即用pH计(pHB-4型,上海雷磁仪器厂)测定pH。取2 mL滤液于冻存管中,-80 ℃保存,用于测定淀粉酶活性。5 mL滤液在3 000×g离心15 min,上清液-20 ℃保存,用于测定挥发性脂肪酸浓度和氨态氮含量。淀粉酶活性用淀粉酶试剂盒(南京建成生物工程研究所)测定,方法参考文献[21]。5 mL滤液加入1 mL 25%的偏磷酸用气相色谱仪(Model 7980,美国Agilent公司)测定挥发性脂肪酸浓度,方法参考文献[22]。氨态氮含量用苯酚-次氯酸钠法[23]测定。
1.4.4 粪尿特征正试期第2天07:30~19:30每隔3.0 h采集1次牛的粪尿样品,粪样采集用直肠取粪法,尿样用按摩取尿法。粪样用50 mL离心管采集,采集的粪样加入等量的蒸馏水[24],密封混匀[25],立即测定pH。粪液-20 ℃保存,用于测定挥发性脂肪酸浓度和氨态氮含量。尿样立即测定pH,剩余的-20 ℃保存,用于测定氨态氮含量。
1.4.5 血液代谢血液样品采集的时间与瘤胃液时间一致,用尾根静脉采集法。采集的血液3 000×g离心15 min,取血浆用北京九强生物技术有限公司试剂盒在日立7020自动生化分析仪测定葡萄糖(glucose)含量以及胰岛素(insulin)、胆固醇(cholesterol,CHO)、甘油三酯(triglyceride,TG)、尿素氮(urinary nitrogen,UN)、β-羟丁酸(β-hydroxybutyric acid,BHBA)和非酯化脂肪酸(non-esterified fatty acid,NEFA)浓度。
1.5 数据统计分析按照4×4拉丁方设计,数据采用SAS 8.0软件的PROC MIXED过程进行分析,模型如下:
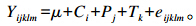
式中:μ为平均值,Ci为试验牛效应(i=1~4),Pj为试验期效应(j=1~4),Tk为处理效应(k=1~4),eijklm为误差项。
采用线性和二次回归来分析淀粉灌注量增加的影响,P<0.05为差异显著,0.05<P<0.12定义为有变化的趋势。
2 结果与分析 2.1 采食量、体况和营养物质表观消化率真胃灌注不同水平淀粉对泌乳奶牛采食量、体况和营养物质表观消化率的影响见表2。与对照组相比,真胃灌注不同水平的淀粉对奶牛干物质采食量无显著影响(P>0.05),但将额外真胃灌注的淀粉计算入消化能采食量和泌乳净能采食量后,奶牛的消化能(P=0.022)和泌乳净能采食量(P=0.014)均随着淀粉灌注量的增加而呈线性增加。真胃灌注不同水平淀粉的4组奶牛体重和体况无显著差异(P>0.05),但从数值来看,真胃灌注2 400 g/d的淀粉的体况评分最高。真胃灌注淀粉没有显著影响奶牛的干物质、有机物质、粗蛋白质、中性洗涤纤维和酸性洗涤纤维的表观消化率(P>0.05)。然而,随着真胃淀粉灌注量的增加,奶牛淀粉的表观消化率线性降低(P=0.029),与对照组相比,真胃灌注800 g/d的淀粉使奶牛的淀粉表观消化率提高了1.91%(P>0.05),当真胃淀粉灌注量达到2 400 g/d时,淀粉的表观消化率降低了4.88%(P>0.05)。以上结果说明,泌乳后期奶牛真胃灌注不同水平淀粉线性提高了消化能和泌乳净能采食量,线性降低了淀粉表观消化率。
2.2 瘤胃发酵特性真胃灌注不同水平淀粉对泌乳奶牛瘤胃发酵特性的影响见表3。真胃灌注不同水平淀粉对瘤胃液pH、氨态氮含量、挥发性脂肪酸浓度、瘤胃食糜淀粉酶活性均未产生显著影响(P>0.05)。
2.3 粪尿特征真胃灌注不同水平淀粉对泌乳奶牛粪尿特征的影响见表4。真胃淀粉灌注没有显著影响泌乳后期奶牛的粪便评分,4组奶牛粪便评分相同。粪中干物质含量呈二次曲线增加的趋势(P=0.072),以1 600 g/d组最高(18.74%),但粪干物质中的淀粉含量没有显著变化(P>0.05)。真胃灌注4个不同水平淀粉,对奶牛粪液pH、氨态氮含量、乙酸和丙酸浓度没有显著影响(P>0.05)。然而,粪液丁酸和总挥发性脂肪酸浓度受到淀粉灌注量的影响而差异显著(P<0.05),特别是800 g/d组的粪液丁酸浓度(4.27 mmol/L)显著低于1 600和2 400 g/d组(P<0.05),粪液总挥发性脂肪酸浓度(91.31 mmol/L)显著低于对照组 (123.44 mmol/L)和1 600 g/d组(119.70 mmol/L) (P<0.05),与2 400 g/d组(98.98 mmol/L)无显著差异(P>0.05),但随淀粉灌注量的增加未呈现出线性或二次的变化(P>0.05)。泌乳后期奶牛真胃灌注淀粉没有显著影响尿pH和氨态氮含量(P>0.05)。
| 表2 真胃灌注不同水平淀粉对泌乳奶牛采食量、体况和营养物质表观消化率的影响 Table 2 Effects of different starch infusion levels in abomasum on feed intake,body condition and nutrient apparent digestibility of lactating cows |
| 表3 真胃灌注不同水平淀粉对泌乳奶牛瘤胃发酵特性影响 Table 3 Effects of different starch infusion levels in abomasum on ruminal fermentation characteristics of lactating cows |
| 表4 真胃灌注不同水平淀粉对泌乳奶牛粪尿特征的影响 Table 4 Effects of different starch infusion levels in abomasum on fecal and urinary characteristics of lactating cows |
真胃灌注不同水平淀粉对泌乳奶牛血液代谢的影响见表5。真胃灌注不同水平淀粉没有显著影响奶牛血液葡萄糖含量以及胰岛素、胆固醇、甘 油三酯、尿素氮、β-羟丁酸和非酯化脂肪酸浓度 (P>0.05)。从数值上看,随着淀粉灌注量的增加,血液葡萄糖含量有一定程度的增加,但未达到显著水平(P>0.05);同时,与对照组相比,淀粉的灌注降低了血液中胰岛素的浓度(P>0.05)。
| 表5 真胃灌注不同水平淀粉对泌乳奶牛血液代谢的影响 Table 5 Effects of different starch infusion levels in abomasum on blood metabolism of lactating cows |
真胃灌注不同水平淀粉对泌乳奶牛泌乳性能的影响见表6。淀粉真胃灌注量达到2 400 g/d时,对泌乳后期奶牛的产奶量、4%乳脂校正乳产量、能量校正乳产量和乳能量输出量均无显著影响(P>0.05),同时乳蛋白和乳糖产量也没有受到淀粉灌注量的影响(P>0.05)。与对照组相比,800和1 600 g/d组的乳脂率显著提高(P<0.05),2 400 g/d组无显著变化(P>0.05)。随着真胃淀粉灌注量的增加,乳脂率呈二次曲线增加(P=0.024),同样地,乳脂产量也受到了真胃淀粉灌注量的影响,随着真胃淀粉灌注量的增加呈二次曲线增加(P=0.022);1 600 g/d灌注量时乳脂产量和乳脂率最大。这说明泌乳后期奶牛真胃灌注淀 粉能够增加泌乳奶牛的乳脂率及乳脂产量。
| 表6 真胃灌注不同水平淀粉对泌乳奶牛泌乳性能影响 Table 6 Effects of different starch infusion levels in abomasum on milk performance of lactating cows |
关于泌乳奶牛小肠淀粉消化的报道很少,可查到的大多数文献是关于过瘤胃淀粉全消化道消化率的研究报道[12,26]。研究表明,泌乳牛小肠可消化淀粉的量低于2 400 g/d[26],本试验灌注淀粉的最高量在此范围内。
本研究中淀粉的真胃灌注量没有影响泌乳后期奶牛的干物质采食量、产奶量等指标,但由于灌注量的增加,消化能和泌乳净能采食量均随着灌注淀粉量的增加而线性增加。结合粪中的干物质和淀粉含量以及淀粉表观消化率的变化,可以看出灌注到真胃的淀粉在后肠段消化吸收的情况,当淀粉灌注量为800 g/d时,泌乳后期奶牛的消化率最高,而当灌注量再增加时,消化率反而下降,虽然粪中淀粉含量没有显著变化,但干物质含量呈二次曲线增加的趋势,说明供应过多的能量奶牛无法利用。Hurtaud等[27]研究结果也表明,当给奶牛十二指肠灌注1 500 g/d葡萄糖时,奶牛表现出吸收不完全。根据本试验结果,1 600 g/d为真胃淀粉最高灌注量。Reynolds等[28]的结果也表明,灌注到十二指肠高达1 600 g/d的粗玉米淀粉能够被奶牛消化。
3.2 真胃灌注不同水平淀粉对泌乳后期奶牛胃肠道发酵的影响瘤胃液pH和挥发性脂肪酸浓度能够反映动物胃肠道的健康状况。可消化碳水化合物在瘤胃微生物的发酵作用下转化为短链脂肪酸,如乙酸、丙酸、丁酸[28]。其中,丁酸是大肠肠壁细胞的主要能量来源,它的增加能够减少毒性基因的表达[29],增强体质。关于灌注碳水化合物对奶牛胃肠道发酵参数影响的结果表明,无论灌注位点或灌注水平均对瘤胃参数无显著影响[14,16]。本试验中真胃灌注不同水平淀粉对瘤胃液各指标均无影响,表明灌注的淀粉全部进入后肠段消化利用,淀粉未回流至瘤胃发酵成为挥发性脂肪酸,本试验所采用的真胃灌注技术在测定营养物质过瘤胃作用方面是可行的。真胃灌注不同水平淀粉后瘤胃挥发性脂肪酸浓度没有变化,但粪中总挥发性脂肪酸和丁酸浓度受灌注量的影响变化显著,表明有一部分淀粉在后肠段发酵[28]。
3.3 真胃灌注不同水平淀粉对泌乳后期奶牛血液代谢的影响血浆中葡萄糖可能通过增加3-磷酸-葡萄糖的产量而加快了脂肪组织游离脂肪酸的再酯化速率[30],同时胰岛素含量的增加,减少了脂肪组织脂肪酸的释放[31],随着血浆中β-羟丁酸和非酯化脂肪酸浓度的下降,长链脂肪酸如C18含量也下降[32],脂质分解与合成的平衡下降[33],这些都能够表明体脂合成的增加[34,35]。然而本试验中真胃灌注淀粉7 d后,血液中各代谢指标都没有受到淀粉灌注的影响。
3.4 真胃灌注不同水平淀粉对泌乳后期奶牛泌乳性能的影响本研究中真胃灌注不同水平的淀粉没有影响泌乳后期奶牛的产奶量,关于饲喂淀粉增加过瘤胃淀粉的泌乳效应众说纷纭。Nocek等[12]综述中也指出“生产试验数据不能够明确证明过瘤胃淀粉的消化能够增加产奶量或乳成分”。本试验中淀粉灌注7 d,乳脂率呈二次曲线上升(P=0.024),Knowlton等[15]的研究结果表明,当过瘤胃淀粉消化提供更多的能量时,乳脂率下降。同时许多研究都表明了葡萄糖灌注能够显著降低乳脂产量[32, 36, 37, 38, 39]。然而,Reynolds等[28]提出高速率灌注可能引起淀粉后肠段发酵的挥发性脂肪酸吸收的增加,供应给额外的乳脂合成。给产后2个月的奶牛增加十二指肠葡萄糖灌注,乳脂率呈二次曲线变化,最低值出现在750 g/d葡萄糖灌注量[27]。Hurtaud等[27]的研究也表明,大量的葡萄糖供应给奶牛可能以能量形式直接作用于乳腺,包括短链和中链脂肪酸的延长。
影响泌乳性能的因素包含与泌乳阶段、能量需要量和平衡相关的干物质和代谢能采食量。如乳中乳脂的产生主要受到瘤胃发酵过程中产生的乙酸的影响,瘤胃内乙酸浓度越高,乳中的乳脂率越高。本试验采用真胃灌注的方法,这样就避开瘤胃发酵,可以更直接地看到后肠段补充能量对泌乳性能的影响。从试验结果看,除了乳脂率,其他泌乳性能相关指标都没有受到灌注的影响,这就进一步印证了瘤胃发酵对于乳成分影响的重要性,同时这一结果也可能是受到试验动物处于泌乳后期且产奶量较低的影响。一般来说,奶牛在泌乳前期和高峰期存在着严重的能量负平衡,而泌乳后期对于能量的需求不大,瘤胃发酵的能量足以供给动物的泌乳需求,那么在后肠段额外添加的能量就会出现吸收不完全、从粪便中排出的现象,而吸收的那部分能量则更趋于进入脂肪沉积通路。因此,本研究数据没有支持增加葡萄糖的吸收可能增加供应到乳腺的氨基酸的假设,奶牛对淀粉增加消化的反应能力受到基础代谢蛋白质供应的限制[27]。
泌乳后期奶牛的能量利用主要以体沉积为主,奶牛的能量负平衡一般发生泌乳高峰期,因此,有必要进一步研究泌乳高峰期灌注相同比例的淀粉对奶牛消化代谢、生产性能的影响,以便揭示不同泌乳阶段的奶牛是否需要过瘤胃淀粉,其能量分配走向以及对代谢的影响。
4 结 论① 泌乳后期奶牛真胃灌注不同水平淀粉,对主要营养物质的全消化道消化率没有显著影响,但随着淀粉灌注量的增加,消化能、泌乳净能采食量线性增加,淀粉表观消化率线性下降。
② 泌乳后期奶牛真胃灌注不同水平淀粉,对奶牛生产性能没有显著影响,但对乳脂率有一定的提高作用。
③ 泌乳后期奶牛能够利用的过瘤胃淀粉的最大量为1 600 g/d。
| [1] | YOUNG J W.Gluconeogenesis in cattle:significance and methodology[J]. Journal of Dairy Science,1977,60(1):1-15. ( 1) 1)
|
| [2] | REYNOLDS C K,HARMON D L,CECAVA M J.Absorption and delivery of nutrients for milk protein synthesis by portal-drained viscera[J]. Journal of Dairy Science,1994,77(9):2787-2808. ( 1) 1)
|
| [3] | HUNTINGTON G B,REYNOLDS P J.Net absorption of glucose,L-lactate,volatile fatty acids,and nitrogenous compounds by bovine given abomasal infusions of starch or glucose[J]. Journal of Dairy Science,1986,69(9):2428-2436. ( 1) 1)
|
| [4] | KREIKEMEIER K K,HARMON D L,BRANDT,R T,et al.Small intestinal starch digestion in steers:effect of various levels of abomasal glucose, corn starch and corn dextrin infusion on small intestinal disappearance and net glucose absorption[J]. Journal of Animal Science,1991,69(1):328-338. ( 1) 1)
|
| [5] | REYNOLDS C K,HUMPHRIES D J,CAMMELL S B,et al.Effects of abomasal wheat-starch infusion on splanchnic metabolism and energy-balance of lactating dairy-cows[M]//MCCRACKEN K,UNSWORTH E F,WYLIE A R G.Energy metabolism of farm animals.New York:CAB International,1998:39-42. ( 1) 1)
|
| [6] | OWENS F N,ZINN R A,KIM Y K.Limits to starch digestion in the ruminant small intestine[J]. Journal of Animal Science,1986,63(5):1634-1648. ( 2) 2)
|
| [7] | HUNTINGTON G B.Starch utilization by ruminants:from basics to the bunk[J]. Journal of Animal Science,1997,75(3):852-867. ( 1) 1)
|
| [8] | ARMSTRONG D A,BLAXTER K L,GRAHAM N M.Fat synthesis from glucose by sheep [C]//Proceedings of the nutrition society.Oxon:CAB International,1960,19(2):R31-R32. ( 2) 2)
|
| [9] | MCDONALD P,EDWARDS R A,GREENHALGH J F D,et al.Animal nutrition[M]. 5th ed.Harlow:Longman Scientific & Technical,1995. ( 1) 1)
|
| [10] | ØRSKOV E R,FRASER C,KAY R N B.Dietary factors influencing the digestion of starch in the rumen and small and large intestine of early weaned lambs[J]. British Journal of Nutrition,1969,23(2):217-226. ( 1) 1)
|
| [11] | TYRRELL H F,MOE P W.Net energy value of a corn and a barley ration for lactation[J]. Journal of Dairy Science,1974,57(4):451-458. ( 1) 1)
|
| [12] | NOCEK J E,TAMMINGA S.Site of digestion of starch in the gastrointestinal tract of dairy cows and its effect on milk yield and composition[J]. Journal of Dairy Science,1991,74(10):3598-3629. ( 4) 4)
|
| [13] | THEURER C B,HUBER J T,DELGADO-ELORDUY A,et al.Invited review:summary of steam-flaking corn or sorghum grain for lactating dairy cows[J]. Journal of Dairy Science,1999,82(9):1950-1959. ( 1) 1)
|
| [14] | BOUDON A,FAVERDIN P,DELAGARDE R,et al.Effects of rumen or duodenal glucose infusions on intake in dairy cows fed fresh perennial ryegrass indoors[J]. Journal of Dairy Science,2007,90(9):4397-4410. ( 3) 3)
|
| [15] | KNOWLTON K F,DAWSON T E,GLENN B P,et al.Glucose metabolism and milk yield of cows infused abomasally or ruminally with starch[J]. Journal of Dairy Science,1980,81(12):3248-3258. ( 2) 2)
|
| [16] | LARSEN M,KRISTENSEN N B.Effect of abomasal glucose infusion on splanchnic and whole-body glucose metabolism in periparturient dairy cows[J]. Journal of Dairy Science,2009,92(3):1071-1083. ( 2) 2)
|
| [17] | WILDMAN E E,JONES G M,WAGNER P E,et al.A dairy cow body condition scoring system and its relationship to selected production characteristics[J]. Journal of Dairy Science,1982,65(3):495-501. ( 1) 1)
|
| [18] | MCCLEARY B V,GIBSON T S,MUGFORD D C.Measurement of total starch in cereal products by amyloglucosidase-alpha-amylase method:collaborative study[J]. Journal of AOAC International,1997,80(3):571-579. ( 1) 1)
|
| [19] | VAN KEULEN J,YOUNG B A.Evaluation of acid-insoluble ash as a natural marker in ruminant digestibility studies[J]. Journal of Animal Science,1977,44(2):282-287. ( 1) 1)
|
| [20] | 曹锦萍,张晓雷,翟英丽,等.全收粪法和AIA指示剂法测定奶牛日粮有机物消化率差异比较[J]. 中国草食动物,2008,28(6):18-20. ( 1) 1)
|
| [21] | DAHLQVIST A.A method for the determination of amylase in intestinal content[J]. Scandinavian Journal of Clinical and Laboratory Investigation,1962,14(2):145-151. ( 1) 1)
|
| [22] | HAMADA T,OMORI S,KAMEOKA K,et al.Direct determination of rumen volatile fatty acids by gas chromatography[J]. Journal of Dairy Science,1968,51(2):228-229. ( 1) 1)
|
| [23] | BRODERICK G A,KANG J H.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science,1980,63(1):64-75. ( 1) 1)
|
| [24] | BERG E L,FU C J,PORTER J H,et al.Fructooligosaccharide supplementation in the yearling horse:effects on fecal pH,microbial content,and volatile fatty acid concentrations[J]. Journal of Animal Science,2005,83(7):1549-1553. ( 1) 1)
|
| [25] | OSBORNE J K,MUTSVANGWA T,ALZAHAL O,et al.Effects of monensin on ruminal forage degradability and total tract diet digestibility in lactating dairy cows during grain-induced subacute ruminal acidosis[J]. Journal of Dairy Science,2004,87(6):1840-1847. ( 1) 1)
|
| [26] | REYNOLDS C K,SUTTON J D,BEEVER D E.Effects of feeding starch to dairy-cattle on nutrient availability and production [C]//Recent advances in animal nutrition.Nottingham:Nottingham University Press,1997:103-134. ( 2) 2)
|
| [27] | HURTAUD C,RULQUIN H,VÉRITÉ R.Effects of graded duodenal infusions of glucose on yield and composition of milk from dairy cows.1.Diets based on corn silage[J]. Journal of Dairy Science,1998,81(12):3239-3247. ( 3) 3)
|
| [28] | REYNOLDS C K,CAMMELL S B,HUMPHRIES D J,et al.Effects of postrumen starch infusion on milk production and energy metabolism in dairy cows[J]. Journal of Dairy Science,2001,84(10):2250-2259. ( 4) 4)
|
| [29] | LAWHON S D,MAURER R,ALTIER C,et al.Intestinal short-chain fatty acids alter salmonella typhmurium invasion gene expression and virulence through BarA/SirA[J]. Molecular Microbiology,2002,46(5):1451-1464. ( 1) 1)
|
| [30] | VERNON R G.Lipid metabolism in the adipose tissue of ruminant animals[J]. Progress in Lipid Research,1980,19(1/2):23-106. ( 1) 1)
|
| [31] | MCCLYMONT G L,VALLANCE S.Depression of blood glycerides and milk-fat synthesis by glucose infusion [C]//Proceedings of the nutrition society.Oxon:CAB International,1962,21(2):R41. ( 1) 1)
|
| [32] | HURTAUD C,LEMOSQUET S,RULQUIN H.Effect of graded duodenal infusions of glucose on yield and composition of milk from dairy cows.2.Diets based on grass silage[J]. Journal of Dairy Science,2000,83(12):2952-2962. ( 2) 2)
|
| [33] | GRIINARI J M,MCGUIRE M A,DWYER D A,et al.Role of insulin in the regulation of milk fat synthesis in dairy cows[J]. Journal of Dairy Science,1997,80(6):1076-1084. ( 1) 1)
|
| [34] | LEMOSQUET S,RIDEAU N,RULQUIN H,et al.Effects of a duodenal glucose infusion on the relationship between plasma concentration of glucose and insulin in dairy cows[J]. Journal of Dairy Science,1997,80(11):2854-2865. ( 1) 1)
|
| [35] | GRUMMER R R.Impact of changes in organic nutrient metabolism on feeding the transition dairy cow[J]. Journal of Animal Science,1995,73(9):2820-2833. ( 1) 1)
|
| [36] | PEEL C J,FRONK T J,BAUMAN D E,et al.Lactational response to exogenous growth hormone and abomasal infusion of a glucose-sodium caseinate mixture in high-yielding dairy cows[J]. The Journal of Nutrition,1982,112(9):1770-1778. ( 1) 1)
|
| [37] | VIK-MO L,EMERY R S,HUBER J T.Milk protein production in cows abomasally infused with casein or glucose[J]. Journal of Dairy Science,1974,57(8):869-877. ( 1) 1)
|
| [38] | HURTAUD C,VRIT R,RULQUIN H.Effects on milk yield and composition of infusions of different levels and natures of energy into the digestive tract of dairy cows[J]. Annales de Zootechnie(Paris),1992,41(1):105. ( 1) 1)
|
| [39] | HURTAUD C,VRIT R,RULQUIN H.Effects on milk yield and composition of infusions of graded levels of glucose into the duodenum of dairy cows[J]. Annales de Zootechnie(Paris),1994,43(3):309. ( 1) 1)
|




