2. 广东恒兴集团有限公司, 湛江 524094;
3. 中国海洋大学, 水产动物营养与饲料研究室, 青岛 266003
2. Aqua-Feed Research and Development Center, Guangdong Evergreen Feed Industry Co. , Ltd., Zhanjiang 524094, China;
3. Laboratory of Aquatic Animal Nutrition and Feed, Ocean University of China, Qingdao 266003, China
生物素是动物机体内维持正常生理机能所必需的维生素之一,是乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、丙酮酸羧化酶、丙酰辅酶A羧化酶和3-甲基巴豆酰辅酶A羧化酶4种羧化酶辅酶的成分,在动物体内的葡萄糖、氨基酸和脂肪酸代谢过程中起着重要作用[1,2,3]。在畜禽集约化生产实践中,多种养殖动物出现生物素缺乏症,人们开始广泛的开展生物素及其营养研究,发现饲粮中添加生物素能提高动物的生产性能[4]。国内外有关水生动物生物素的研究多集中在鱼类需求量及缺乏症上,如斑马鱼(Danio rerio)[5]、日本鲈鱼(Lateolabrax japonicus)[2]、罗非鱼(Oreochromis niloticus×O.laureus)[6]、虹鳟(Salmo gairdneri)[7]、印度鲶(Heteropneustes fossilis)[8]、鲤鱼(Cyprinus carpio)[9]、草鱼(Ctenopharyngodon idllus)[10]、斑点叉尾 (Ictalurus punctatus)[11]等,而甲壳类动物生物素需求量的研究仅见关于斑节对虾(Penaeus monodon)幼虾[12]的报道,对凡纳滨对虾(Litopenaeus vannamei)生物素需求量的研究尚未见报道。
凡纳滨对虾分布于秘鲁、厄瓜多尔和墨西哥一带,因其具有适应能力强、耐盐性广、生长迅速、繁殖期长、抗病力强、肉味鲜美、加工出肉率高、适应于人工高密度养殖等优点,一直是世界重要的水产养殖品种之一。1988年引入我国后迅速遍及全国,目前是我国对虾养殖产量最高、出口量最大的虾类品种,具有巨大的市场需求[13]。由于对虾养殖业的迅速发展,相关饲料产业的发展对其养殖的意义重大,而营养全面的高质量饲料对凡纳滨对虾的健康养殖非常重要。目前国内外已对凡纳滨对虾的蛋白质、氨基酸、脂肪和糖类等营养需求量[1, 14, 15, 16]进行了研究,但关于凡纳滨对虾维生素营养需求量的研究只是集中于维生素C、维生素E等少数几种[1],对于生物素的需求量及其在机体内的代谢过程和免疫效果的研究尚缺乏,因此研究凡纳滨对虾对生物素的需求量有很重要的意义。本试验拟以凡纳滨对虾幼虾作为研究对象,在基础饲料中添加不同水平的生物素,观察生物素对其生长性能、体成分及生理生化指标的影响,确定凡纳滨对虾幼虾对饲料中生物素的需求量,为凡纳滨对虾商业饲料的配制提供依据。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕、面粉等为主要原料配制基础饲料(表1)。生物素(购自帝斯曼公司)设6个添加量,分别为0、0.50、1.00、2.00、4.00和8.00 mg/kg DM,将其用微晶纤维素预混后添加到基础饲料中,配制成6种试验饲料。经中国广州分析测试中心采用高效液相色谱法测得试验饲料中生物素的实际含量分别为0.068、0.410、0.910、1.960、4.620和9.380 mg/kg DM。各饲料原料粉碎过60目筛,微量成分采取逐级扩大法添加,与大宗原料混合均匀后,用双螺杆制粒机挤压成1.0和1.5 mm 2种粒径的颗粒饲料,风干后放入冰箱中冷冻保存备用。
1.2 试验虾及饲养管理试验用凡纳滨对虾幼苗为广东省湛江市恒兴863基地种苗场繁育,试验前先暂养3周,投喂商业饲料,使其达到试验要求规格(平均体重1.03 g)。试验分为6组,每组3个重复,每重复随机分40尾虾苗于500 L玻璃缸里,同组对虾投喂同种试验饲料。每天投喂4次,投喂时间分别为07:00、12:00、17:00和21:00,投喂量为对虾体重的6%~10%,且早、晚投喂量约为日投喂量的60%,根据对虾的摄食情况调节投喂量,及时清理粪便,更换养殖海水。试验期间水体温度为(28.7±2.3) ℃,pH为7.7±0.1,盐度为(17.4±2.7)‰,溶解氧浓度不低于6.0 mg/L,氨氮浓度不高于0.05 mg/L。
| 表1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) % |
养殖试验结束时,对虾空腹24 h,称重并计数。每重复随机取5尾对虾,用于分析对虾体成分。每重复另随机取10尾对虾,用1 mL无菌注射器从对虾头胸甲后缘围心窦入针取血,注入Eppendorf管中置于4 ℃冰箱静置24 h后10 000 r/min离心10 min,取上清液于-80 ℃冰箱中保存备用。采血后剥取肝胰腺,将取出的肝胰腺放入Eppendorf管中置于-80 ℃冰箱中保存备用。
1.4 指标测定 1.4.1 生长性能指标计算公式增重率(weight gain rate,WGR,%)=100×(终末体重-初始体重)/初始体重;
特定生长率(specific growth rate,SGR,%/d)=100×(ln终末体重-ln初始体重)/试验天数;
存活率(survival rate,SR,%)=100×终末虾尾数/初始虾尾数;
饲料效率(feed efficiency,FE)=(终末体重-初始体重)/饲料摄食量;
蛋白质效率(protein efficiency ratio,PER)=(终末体重-初始体重)/(饲料摄食量×饲料蛋白质含量);
蛋白质沉积率(protein retention rate,PRR,%)=100×(终末体重×终末虾体蛋白质含量-初始体重×初始虾体蛋白质含量)/(饲料摄食量×饲料蛋白质含量)。
1.4.2 营养成分分析饲料及虾体水分含量采用105 ℃恒温干燥失重法测定,测出水分含量后采用差值法计算干物质含量,粗蛋白质含量采用凯氏定氮法测定,粗脂肪含量采用索氏抽提法测定,粗灰分含量采用马福炉灰化法测定。
1.4.3 生化指标测定血清葡萄糖(glucose,GLU)、总蛋白(total protein,TP)、总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)含量均在OLYMPUSAU600型全自动生化分析仪(日本)上测定。血清总抗氧化能力(total antioxidant capacity,T-AOC),超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、ACC活性及丙二醛(malondialdehyde,MDA)含量均采用南京建成生物工程研究所生产的试剂盒测定,操作步骤参照试剂盒所附说明书进行。肝胰腺生物素含量由中国广州分析测试中心采用高效液相色谱法测定。
1.5 数据分析试验结果用平均值±标准差(mean±SD)表示。数据分析采用SPSS 17.0统计软件,经单因素方差分析有显著差异后,再用Duncan氏法进行组间的多重比较,显著水平为P<0.05。通过折线模型确定凡纳滨对虾幼虾对饲料中生物素的需求量。
2 结 果 2.1 饲料中生物素含量对凡纳滨对虾幼虾生长性能的影响由表2可知,对虾的终末体重、增重率、特定生长率、饲料效率和蛋白质效率均以0.068 mg/kg DM组为最低,显著低于其他各组(P<0.05),其他各组间差异不显著(P>0.05)。各组的存活率和蛋白质沉积率差异不显著(P>0.05)。以饲料效率为评价指标,采用折线模型分析得出凡纳滨对虾幼虾饲料中生物素的需求量为0.72 mg/kg DM(图1)。
| 表2 饲料中生物素含量对凡纳滨对虾幼虾生长性能的影响
Table 2 Effects of dietary biotin content on growth performance of juvenile Pacific white shrimp (Litopenaeus vannamei) (n=3)
|
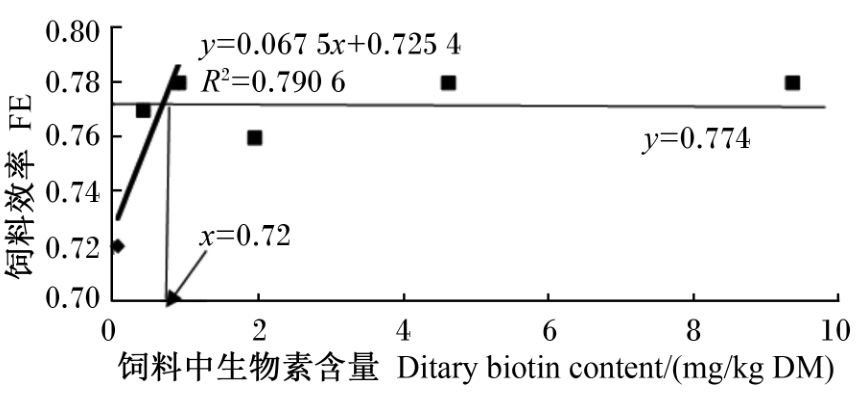 | 图1 饲料中生物素含量与凡纳滨对虾 幼虾饲料效率的关系 Fig.1 Relationship between dietary biotin content and FE of juvenile Pacific white shrimp (Litopenaeus vannamei) |
饲养56 d后,凡纳滨对虾幼虾的体成分见表3。以0.068 mg/kg DM组干物质含量最高,同时其粗蛋白质含量也最高,但与其他组的差异均未达到显著水平(P>0.05)。此外,各组粗脂肪和粗灰分含量无显著差异(P>0.05)。
| 表3 饲料中生物素含量对凡纳滨对虾幼虾体成分的影响 Table 3 Effects of dietary biotin content on body composition of juvenile Pacific white shrimp (Litopenaeus vannamei) (n=3) |
由表4可知,饲料中生物素含量对血清TP、GLU、TC和TG含量无显著影响(P>0.05),但以0.068 mg/kg DM组的TG含量最高,GLU含量最低。以0.910 mg/kg DM组的血清T-AOC最高,显著高于0.068 mg/kg DM组(P<0.05),与其他组差异不显著(P>0.05)。以0.068 mg/kg DM组血清CAT活性最低,与0.410 mg/kg DM组差异不显著(P>0.05),但显著低于其他各组(P<0.05)。各组血清SOD活性和MDA含量差异不显著(P>0.05),但以0.068 mg/kg DM组SOD活性最低,MDA含量最高。肝胰腺生物素含量随着饲料中生物素含量的升高而显著上升(P<0.05)。当饲料中生物素含量从0.068 mg/kg DM增加至1.960 mg/kg DM时,血清ACC活性显著升高(P<0.05),在4.620 mg/kg DM组达到最高,之后有所降低。以血清ACC活性为评价指标,采用折线模型分析得出凡纳滨对虾幼虾对饲料中生物素的需求量为2.25 mg/kg DM(图2)。
| 表4 饲料中生物素含量对凡纳滨对虾幼虾生化指标的影响
Table 4 Effects of dietary biotin content on biochemical indices of juvenile Pacific white shrimp (Litopenaeus vannamei) (n=3)
|
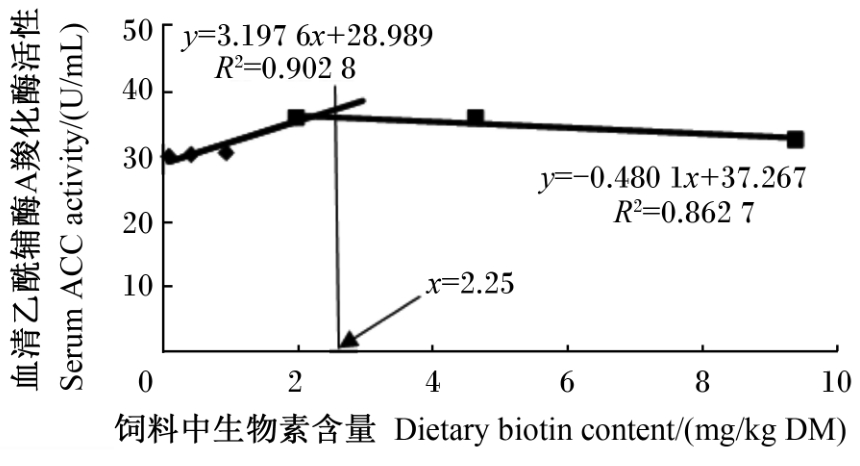 | 图2 饲料中生物素含量与凡纳滨对虾幼虾血清乙酰辅酶A羧化酶活性的关系 Fig.2 Relationship between dietary biotin content and serum ACC activity of juvenile Pacific white shrimp (Litopenaeus vannamei) |
本试验结果表明,饲料中适宜含量的生物素可以提高凡纳滨对虾幼虾的生长性能,改善饲料 效率。以饲料效率为评价指标,通过折线模型分 析得出凡纳滨对虾幼虾对饲料中生物素的需求量为0.72 mg/kg DM,与Shiau等[12]以增重率和蛋白质效率为评价指标得出的斑节对虾幼虾的生物素需求量分别为2.0和2.4 mg/kg DM存在一定差异。这可能与所用评价指标以及虾种不同有关。此外,本试验为了提高饲料的适口性,以获取适宜的生长性能和饲料利用率,以鱼粉、豆粕、面粉等商业饲料原料配制成实用饲料,而斑节对虾幼虾试验中配制的是纯化饲料,导致斑节对虾幼虾的饲料效率(0.22~0.45)较低,蛋白质效率(0.24~1.11)也较低[12]。同时,本试验中,在饲料中生物素含量为0.910 mg/kg DM时,凡纳滨对虾幼虾的饲料效率最高,而斑节对虾幼虾获得最高饲料效率时的饲料中生物素含量为3.0 mg/kg DM[12]。故本试验以饲料效率为评价指标得到的凡纳滨对虾幼虾的生物素需求量低于斑节对虾幼虾。
生物素提高凡纳滨对虾幼虾的生长性能与饲 料效率的提高有关。由本试验结果可知,当饲料中生物素含量从0.068 mg/kg DM增加至0.410 mg/kg DM时,凡纳滨对虾幼虾的饲料效率显著提高,相应地,其增重率和特定生长率也显著提高。相关研究也表明,饲料中适宜含量的生物素可提高斑节对虾幼虾[12]、罗非鱼幼鱼[6]和幼建鲤[17]的饲料效率和生长性能。同时,水生动物体内净营养物质的沉积与饲料效率密切相关。当饲料中生物素含量从0.068 mg/kg DM增加至0.410 mg/kg DM时,凡纳滨对虾幼虾的蛋白质效率显著提高。综上表明,生物素可以通过提高凡纳滨对虾幼虾的饲料效率以及饲料蛋白质的利用率,来促进生长。
ACC是催化脂肪酸合成代谢第1步反应的限速酶,在ATP供能、镁离子(Mg2+)存在下,其以碳酸氢根(HCO-3)为羧基供体,生成丙二酰单酰辅酶A,是生物素依赖性酶[18]。本试验中,饲料中生物素含量显著影响了凡纳滨对虾幼虾血清ACC活性,当饲料中生物素含量从0.068 mg/kg DM增加至1.960 mg/kg DM时,ACC活性显著升高,且最低值出现在0.068 mg/kg DM组。以血清ACC活性为评价指标,通过折线模型分析得出凡纳滨对虾幼虾对饲料中生物素的需求量为2.52 mg/kg DM。
赵姝等[17]观察到饲料中生物素含量显著影响幼建鲤的鱼体粗脂肪含量,以未添加组的含量最低。但在本试验中,凡纳滨对虾幼虾的虾体粗脂肪含量不受饲料中生物素含量的影响,这与Shaiu等[12]在斑节对虾幼虾上的研究结果一致,可能是由于本试验中各试验饲料中粗脂肪含量(占饲料干重的8%)为凡纳滨对虾幼虾的适宜需求量,抑制了体内脂肪酸的从头合成,饲料中生物素调控凡纳滨对虾脂肪代谢机制仍需要进一步研究。此外,本试验中肝胰腺生物素含量随饲料中生物素含量的增加而升高,但未达到饱和状态,在Shiau等[12]对斑节对虾幼虾的研究中也观察到类似现象。
动物机体的抗氧化水平在一定程度上反映了机体的健康状况。T-AOC是近年研究发现的用于衡量机体抗氧化系统功能状况的综合性指标,代表和反映了机体抗氧化酶系统和非酶促系统对外来刺激的代偿能力以及机体自由基代谢的状态[19]。本试验中,饲料中生物素含量显著影响了凡滨对虾幼虾血清中T-AOC,当饲料中生物素含量从0.068 mg/kg DM增加至0.910 mg/kg DM时,T-AOC显著提高。SOD和CAT是水生动物体内抗氧化酶系统的重要成员,SOD主要负责将超氧阴离子(O-2)转化为过氧化氢(H2O2),清除体内的O-2[2];CAT催化分解H2O2为水(H2O)和氧气(O2)[20]。本试验中,饲料中生物素含量显著影响了凡纳滨对虾幼虾血清CAT活性,当饲料中生物素含量从0.068 mg/kg DM增加至0.910 mg/kg DM时,CAT活性显著提高,而血清SOD活性则不受饲料中生物素含量的影响。
机体通过酶系统或非酶系统产生活性氧自由基,活性氧自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化反应,并以此形成脂质过氧化物。MDA作为脂质过氧化产物,可以作为反映机体内脂质过氧化程度的指标,间接地反映出细胞损伤的程度[21,22];而T-AOC及SOD和CAT活性作为衡量机体清除自由基能力的指标,可以显示机体的抗氧化水平[23,24,25]。本试验中,0.068 mg/kg DM组血清T-AOC及SOD和CAT活性最低,MDA含量最高。这可能是因为生物素缺乏导致机体脂肪酸代谢异常,产生大量氧自由基,不同程度地消耗机体抗氧化酶,从而降低机体的抗氧化水平。因此,饲料中添加适量生物素可以提高凡纳滨对虾机体的抗氧化水平。
4 结 论本试验条件下,以凡纳滨对虾饲料效率和血清ACC活性为评价指标,通过折线模型分析得出凡纳滨对虾幼虾对饲料中生物素的需求量分别为0.72和2.25 mg/kg DM。
致谢: 感谢宁波大学海洋学院鱼类营养实验室全体成员对本试验提供的帮助,感谢恒兴集团863海水养殖种子基地提供试验场所和养殖系统,支持试验可以顺利进行。
| [1] | NRC.Nutrient requirements of fish and shrimp[S]. Washington,D.C.:National Academies Press,2011. ( 2) 2)
|
| [2] | LI J,ZHANG L,MAI K,et al.Estimation of dietary biotin requirement of Japanese seabass,Lateolabrax japonicus C[J]. Aquaculture Nutrition,2010,16(3):231-236. ( 3) 3)
|
| [3] | 潘林,孙建义.生物素的生理功能及其分子作用机制[J]. 中国饲料,2005,6(6):21-24. ( 1) 1)
|
| [4] | 黄兴国,戚咸理,贺建华,等.生物素及其营养应用[J]. 饲料博览,2003,7(7):17-19. ( 1) 1)
|
| [5] | YOSSA R,SARKER P K,MOCK D M,et al.Dietary biotin requirement for growth of juvenile zebrafish Danio rerio (Hamilton-Buchanan)[J]. Aquaculture Research,2013.doi:10.1111/are.12124. ( 1) 1)
|
| [6] | SHIAU S Y,CHIN Y H.Estimation of the dietary biotin requirement of juvenile hybrid tilapia,Oreochromis niloticus×O.laureus[J]. Aquaculture,1999,170:71-78. ( 2) 2)
|
| [7] | WOODWORD B,FRIGG M.Dietary biotin requirements of young rainbow trout (Salmo gairdneri) determined by weight gain,hepatic biotin concentration and maximal biotin-dependent enzyme activities in liver and white muscle[J]. The Journal of Nutrition,1989,119(1):54-60. ( 1) 1)
|
| [8] | MOHAMED J S.Dietary biotin requirement determined for Indian catfish,Heteropneustes fossilis (Bloch),fingerlings[J]. Aquaculture Research,2001,32(9):709-716. ( 1) 1)
|
| [9] | OGINO C,WATANABE T,KAKINO J,et al.B vitamin requirements of carp:Ⅲ.Requirement of biotin[J]. Bulletin of Japanese Society Science Fish,1970,36(7):734-740. ( 1) 1)
|
| [10] | 吴凡,刘安龙,文华,等.饲料中添加生物素对草鱼幼鱼生长、体成分和血清生化指标的影响[J]. 淡水渔业,2009,39(3):52-56. ( 1) 1)
|
| [11] | ROBINSON E H,LOVELL R T.Essentiality of biotin for channel catfish (Ictalurus punctatus) fed lipid and lipid-free diets[J]. The Journal of Nutrition,1978,108(10):1600-1605. ( 1) 1)
|
| [12] | SHIAU S Y,CHIN Y H.Dietary biotin requirement for maximum growth of juvenile grass shrimp,Penaeus monodon[J]. The Journal of Nutrition,1998,128(12):2494-2497. ( 7) 7)
|
| [13] | 孙燕军,龙勇.南美白对虾营养需求的研究进展[J]. 齐鲁渔业,2007,24(5):39-41. ( 1) 1)
|
| [14] | ZHANG S P,LI J,WU X C,et al.Effects of different dietary lipid level on the growth,survival and Immune-relating genes expression in Pacific white shrimp,Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2013,34(5):1131-1138. ( 1) 1)
|
| [15] | ZHOU Q C,WANG Y L,WANG H L,et al.Dietary threonine requirements of juvenile Pacific white shrimp,Litopenaeus vannamei[J]. Aquaculture,2013,392/393/394/395:142-147. ( 1) 1)
|
| [16] | KURESHY N,DAVIS D A.Protein requirement for maintenance and maximum weight gain for the Pacific white shrimp,Litopenaeus vannamei[J]. Aquaculture,2002,204(1):125-143. ( 1) 1)
|
| [17] | 赵姝.生物素对幼建鲤消化吸收能力、抗氧化能力和免疫功能的影响[D]. 硕士学位论文.雅安:四川农业大学,2011. ( 2) 2)
|
| [18] | 李洁琼,郑世学,喻子牛,等.乙酰辅酶A羧化酶:脂肪酸代谢的关键酶及其基因克隆研究进展[J]. 应用与环境生物学报,2011,12(5):753-758. ( 1) 1)
|
| [19] | 谭树华,何典翼,严芳,等.亚硝酸钠对鲫鱼肝脏丙二醛含量和总抗氧化能力的影响[J]. 农业环境科学学报,2005,24(增刊1):21-24. ( 1) 1)
|
| [20] | 张璐.鲈鱼和大黄鱼几种维生素的营养生理研究和蛋白源开发[D]. 博士学位论文.青岛:中国海洋大学,2006. ( 1) 1)
|
| [21] | YANG S P,WU Z H,JIAN J C,et al.Effect of marine red yeast Rhodosporidium paludigenum on growth and antioxidant competence of Litopenaeus vannamei[J]. Aquaculture,2010,309(1):62-65. ( 1) 1)
|
| [22] | MA X Y,LIN Y C,JIANG Z Y,et al.Dietary arginine supplementation enhances antioxidative capacity and improves meat quality of finishing pigs[J]. Amino Acids,2010,38(1):95-102. ( 1) 1)
|
| [23] | JIANG Z Y,JIANG S Q,LIN Y C,et al.Effects of soybean isoflavone on growth performance,meat quality,and antioxidation in male broilers[J]. Poultry Science,2007,86(7):1356-1362. ( 1) 1)
|
| [24] | BAKAN N,TAYSI S,YILMAZ O,et al.Glutathione peroxidase,glutathione reductase,Cu-Zn superoxide dismutase activities,glutathione,nitric oxide,and malondialdehyde concentrations in serum of patients with chronic lymphocytic leukemia[J]. Clinica Chimica Acta,2003,338(1/2):143-149. ( 1) 1)
|
| [25] | LI Y,LI M,SHI J Q,et al.Hepatic antioxidative responses to PCDPSs and estimated short-term biotoxicity in freshwater fish[J]. Aquatic Toxicology,2012,120/121:90-98. ( 1) 1)
|




