在畜禽养殖生产中,给饲养动物提供一个舒适的环境温度条件是其最大生产和繁殖性能得到充分发挥的必要条件,因此热舒适评价的研究对动物生产实践中的环境管理有重要的指导意义。在人类研究中,热舒适指的是人对周围热环境所做的主观满意度评价(ISO 7730),Bedford在1936年提出人的热舒适的7个评价等级,分别为:冷、凉、舒适的凉爽、舒适并不冷不热、舒适的温暖、暖、热。由于动物不能主观表达其自身的温热感受,而应激对动物的生理和行为活动等会产生很大的影响,因此,对动物热舒适与否的评价只能通过一些客观的生理或行为等指标进行反映。在对动物热舒适性评价过程中,存在的关键问题是哪些指标能够客观反映动物的温热感受和应激与否,同时这些指标数据的采集或获取过程对动物又不会造成侵犯和干扰,因为侵犯和干扰本身也是应激,会影响这些指标的数值。
当动物受到应激时,刺激下丘脑-垂体-肾上腺(HPA)轴分泌糖皮质激素,动员体内的储备能量,使动物作好战斗或逃跑的准备,是应激的非特异性反应。鸟类分泌的糖皮质激素主要为皮质酮。以往关于环境应激的研究也多采用血液皮质酮作为指标,如Bize等[1]报道突然的环境恶化能引起幼年高山雨燕血液皮质酮含量升高,Breuner等[2]在白冠麻雀的研究中发现大气压降低对血液皮质酮含量没有影响。然而,由于抓鸡采血会造成应激,并在短时间内引起血浆皮质酮含量的升高[3],以血液皮质酮含量为指标的相关研究结果逐渐受到质疑。有学者认为先前测定血浆皮质酮基础含量的研究只有在抓鸡后3 min内完成采血才是可靠的[4,5],Beuving等[6]研究表明将鸡绑定45 s后血浆皮质酮含量便会升高。因此,血液皮质酮含量作为评价肉鸡热舒适的指标在实际应用中具有一定的局限性,需要一项非侵入指标用于反映HPA轴的活性,进而用于热舒适评价。
在哺乳动物和禽类中,粪便中肾上腺皮质激素代谢产物含量的测定技术已经得到研究证实[7,8,9,10,11],而以此作为应激指标在很多物种的研究中也有很广泛的应用,如干旱或社交对非洲大象的应激[12],争斗对斑点鬣狗的应激[13],蛋鸡的抓捕应激[14],汞暴露对燕鸥的应激[15]等。但目前尚无关于环境温度应激对肉鸡粪便皮质酮代谢产物影响的研究报道。本文以肉鸡为研究对象,旨在探索和研究粪便皮质酮代谢产物作为一项非侵入指标用于肉鸡热舒适评价的可行性。
1 材料与方法 1.1 试验1肉鸡粪便皮质酮代谢产物含量的昼夜节律研究。
1.1.1 试验设计选取42日龄体重相近的爱拔益加(AA)肉仔鸡16只(公母各占1/2),按体重和性别随机分为4笼,每笼为1个重复,每个重复4只鸡,放于人工环境控制仓中饲养,温度22 ℃,湿度60%,自由采食和饮水,24 h光照。预试期3 d,正试期1 d。试验动物所用饲粮为参照NRC(1994)营养需要配制,基础饲粮组成及营养水平见表1。试验2、试验3采用饲粮均同试验1。
| 表1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) % |
正试期08:00开始,每2 h收集各重复排出的所有粪便,收集12次共24 h。粪便立刻放于-80 ℃保存,用于粪便皮质酮代谢产物含量的测定。
取10 g左右冷冻粪样于真空冷冻干燥机中充分冷冻干燥。取冻干粪便0.5 g左右溶于5 mL 60%(V/V)甲醇水溶液中,手动涡流振荡2 min,离心15 min(4 000 r/min),取上清液,用Corticosterone 酶联免疫吸附测定(ELISA)试剂盒(Enzo)测量皮质酮及皮质酮代谢产物含量。该试剂盒是采用多克隆抗体,以皮质酮为标准品,检测与皮质酮标准品具有共有稳定结构、相同免疫活性的一类物质的量。
1.2 试验2急性热应激对肉鸡粪便皮质酮代谢产物含量的影响。 1.2.1 试验设计
同试验1。
1.2.2 试验方法正试期08:00开始,在10 min内将人工环境控制仓内温度升到35 ℃,湿度60%保持不变。温度35 ℃保持2 h,然后将温度在10 min内降回到22 ℃。收集升温前2 h内的粪便,同时升温后2、4、6、22 h各收集2 h内的粪便,立刻放于-80 ℃保存,用于粪便皮质酮代谢产物含量的测定。测定方法同试验1。
1.3 试验3环境温度对肉鸡粪便皮质酮代谢产物含量的影响。
1.3.1 试验设计选取21日龄体重相近的AA肉仔鸡288只(公母各占1/2)平均分配到6个人工环境控制仓内饲养,每个仓48只鸡,按体重和性别分为6笼,每笼作为1个重复,每个重复8只鸡。温度22 ℃,湿度60%,自由采食和饮水,24 h光照。预试期7 d,正试期14 d。正试期第1天08:00将各人工环境控制仓温度分别在1 h内逐渐调到10、14、18、22、26、30 ℃,温度均保持恒定直至试验结束。试验期内所有肉仔鸡自由采食和饮水,湿度60%,24 h光照。
1.3.2 试验方法调整温度的前1天(-1 d)及调整温度后1、3、7、14 d收集06:00~08:00内各笼排出的粪便,立刻放于-80 ℃保存,用于粪便皮质酮代谢产物含量测定。测定方法同试验1。
1.4 数据统计分析试验数据用“平均值±标准差”表示,采用SAS 9.1.3统计软件中的ANOVA过程进行单因素方差分析和Duncan氏法多重比较,P<0.05为差异显著。
2 结果与分析试验1结果见图1,粪便皮质酮代谢产物含量在06:00~16:00和18:00~04:00期间均没有明显的波动(P>0.05),仅在16:00时显著高于18:00和04:00时(P<0.05)。另外,统计分析表明,粪便皮质酮代谢产物含量整体上白天(08:00~18:00)显著高于夜间(20:00~06:00)(P<0.05)。
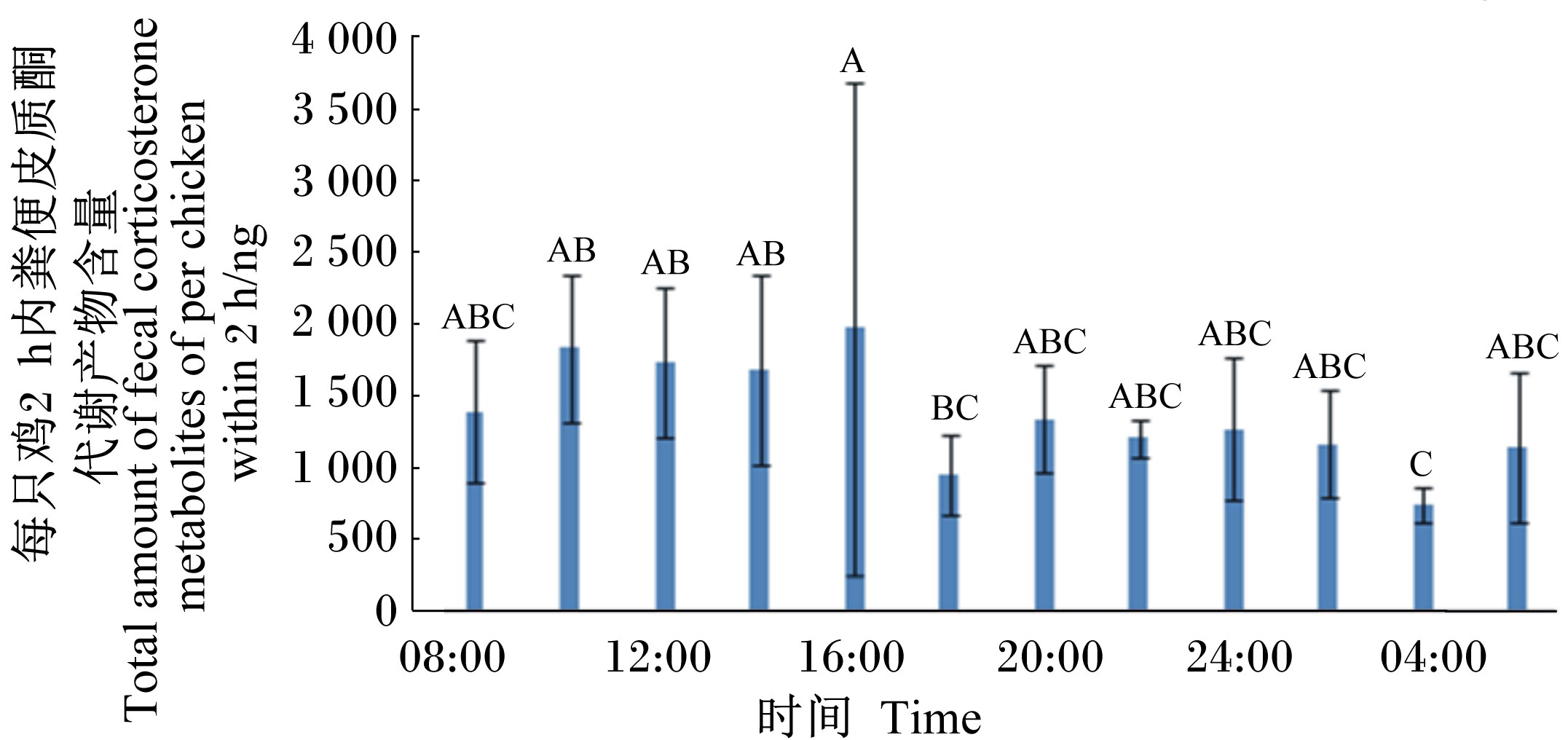 |
数据柱上标不同字母表示差异显著(P<0.05)。下图同。 Value columns with different letters differ significantly (P<0.05). The same as below. 图1 肉鸡粪便皮质酮代谢产物含量的昼夜节律 Fig.1 Diurnal rhythm of fecal corticosterone metabolites content of broiler chickens |
试验2结果见图2,与升温前相比,急性热应激后2 h(10:00)内肉鸡粪便皮质酮代谢产物含量显著升高(P<0.05),4 h(12:00)后恢复到正常水平,6 h(14:00)后比升温前有所降低(P<0.05),而在22 h(06:00)后与升温前没有显著差别(P>0.05)。
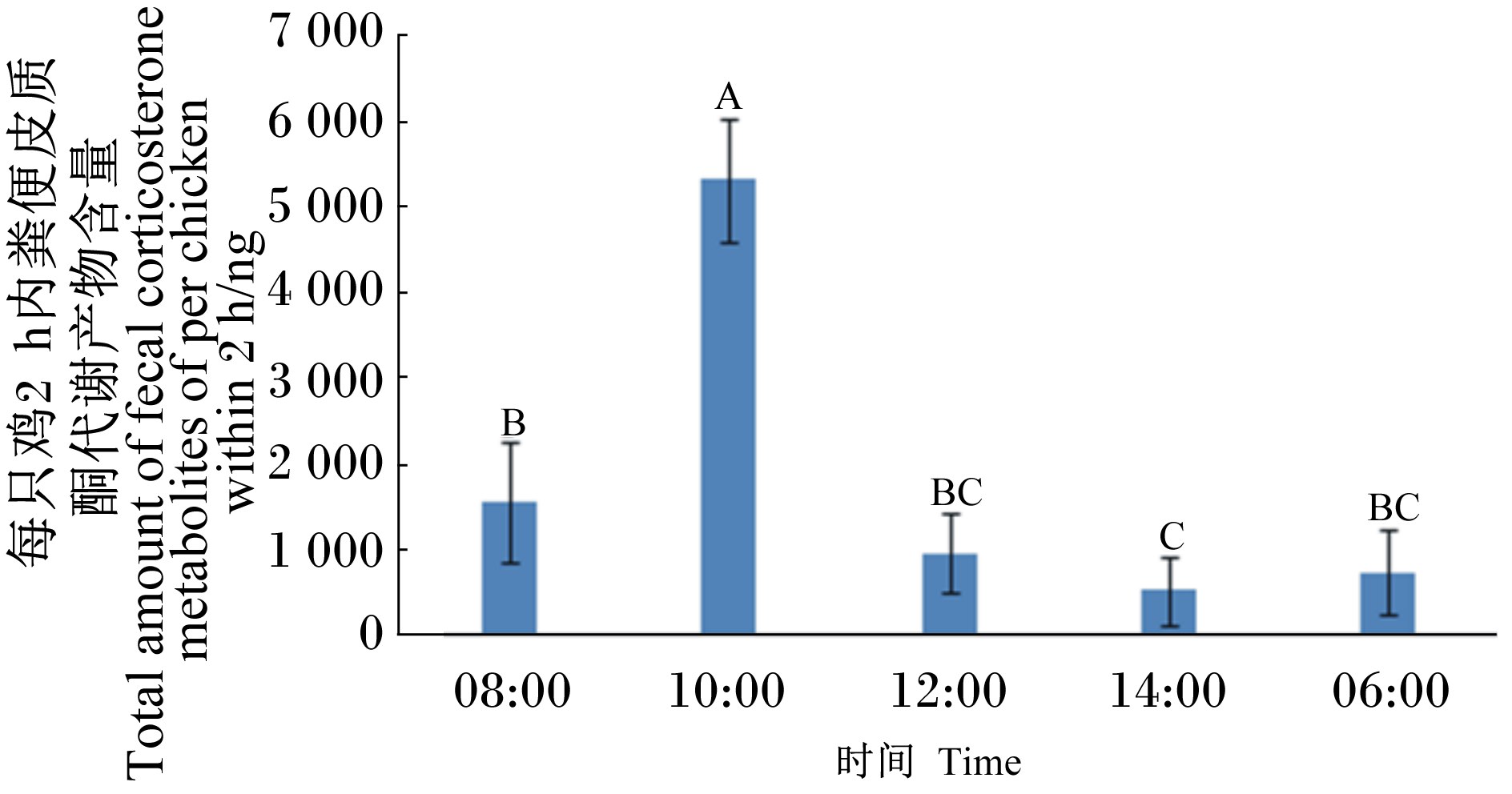 | 图2 急性热应激对肉鸡粪便皮质酮代谢产物含量的影响 Fig.2 Effects of acute heat stress on fecal corticosterone metabolites content of broiler chickens |
试验3结果见表2,在调整温度之前(-1 d),各处理肉鸡粪便皮质酮代谢产物含量没有显著差异(P>0.05)。而在调整温度之后,温度显著影响了粪便皮质酮代谢物含量(P<0.05),其中温度相对较高的22、26、30 ℃处理显著高于10 ℃处理(P<0.05),26 ℃处理显著高于18 ℃处理(P<0.05)。而肉鸡在调整温度3、7、14 d后,各温度处理粪便皮质酮代谢物含量均没有显著差异(P>0.05)。
| 表2 环境温度对肉鸡粪便皮质酮代谢产物含量的影响 Table 2 Effects of environmental temperature on fecal corticosterone metabolites content of broiler chickens ng |
采用以2 h时间段内粪便皮质酮代谢产物含量作为指标,不但采样方便,不会干扰动物的行为,而且排泄物中代谢产物含量代表了过去一段时间内皮质酮分泌量的综合水平。而血液采样是确定时间点的采样,代表的只是这一时刻血液中的皮质酮水平,受采样时间的影响较大。在昼夜节律方面的研究中,需要1 d中多次采样,以血液皮质酮作为指标,采血次数受到很大限制,获得的结果也有很大差异。如Romero等[4]研究皮质酮分泌的昼夜节律中1 d选取4个采样时间点,为了使皮质酮基础水平在采血后得到恢复,2次采血的时间间隔36 h,造成1 d中4个不同的时间点的数据并不是来自同一天的采样。从结果来看,Dufty等[16]在西美角鸮,Breuner等[17]在白冠麻雀,Romero等[4]在欧洲紫翅椋鸟的研究表明血液皮质酮在白天活动期的分泌水平高于夜晚,而Marra等[18]在白冠麻雀中的研究表明没有明显的昼夜节律,这除了由于所用动物种类不同外,很可能也与血液指标采集的方式和时间点选取不同有关。而本研究试验1结果表明白天粪便皮质酮代谢产物含量高于夜间,由于采取24 h光照制度,所以这是肉鸡本身的生物节律,与光照无关。同时,试验1结果表明粪便皮质酮代谢产物的排泄量在非干扰状态下在06:00~16:00和18:00~04:00期间均没有明显的波动,证实了其作为应激指标的可行 性,也为应激试验处理和采样时间的选取提供了依据。
试验2结果中显示粪便皮质酮代谢产物含量在急性热暴露2 h内的急剧升高,而温度恢复后又降低到之前的水平,反映了肉鸡在2 h高温条件下经受了热应激,热舒适性受到了影响,引起HPA轴兴奋程度增强,皮质酮分泌增多。这与Frigerio等[19]在公灰鹅中研究表明的环境温度与其粪便皮质酮代谢产物含量呈现良好的线性关系的结果一致。而Goymann等[20]在欧洲野翁鸟中的研究也表明粪便皮质酮代谢产物对外界环境温度的变化反应敏感。Lobato等[21]研究表明,粪便皮质酮代谢产物在成年蓝山雀和斑鹟中不受外界环境温度的影响,而对于生长阶段的幼雏却呈现出于环境温度负相关关系。结合以上前人的相关研究结果,试验2结果可表明粪便皮质酮代谢产物作为一项非侵入指标可以反映肉鸡遭受的急性热应激。
试验3结果显示肉鸡在不同的环境温度下饲养持续1 d后,粪便皮质酮代谢产物含量整体表现为高温处理较高,而低温处理的较低。除了22 ℃处理的温度与之前维持相同外,其他各处理均遭受了环境温度的变化,来自温度升高和降低的环境应激导致的1 d后粪便皮质酮代谢产物含量的变化趋势并不相同,其作用机制有待进一步研究。动物在应激情况下通常会激活HPA轴,肾上腺皮质激素的分泌水平增加;但随着应激状况的持续,肾上腺皮质激素的分泌水平也会发生进一步的变化。刘胜军等[22]研究表明,受高温的猪血浆皮质醇水平在第1天降低,第7天升高,第14天恢复到正常水平;Daniels-Severs等[23]研究表明,小鼠在冷暴露7 d后血浆和肾上腺皮质酮水平均升高,而在8周龄后却显著降低。试验3结果中第3天、第7天、第14天后粪便皮质酮代谢产物含量没有差别,说明HPA轴已经适应了之前变化的温度。还有研究表明热应激时血浆中皮质酮水平显著增加[24,25],但长期的温度处理对血液中皮质酮含量无显著影响[26,27];Jaferi等[28]研究表明持续的热应激能降低小鼠HPA轴对热环境本身的敏感性和反应性,破坏了HPA轴的负反馈调节通路。这些与本研究用粪便中皮质酮代谢产物得出的结果是一致的,表明皮质酮对长期持续温度处理反应不敏感。
4 结 论粪便皮质酮代谢产物含量白天和夜间均没有显著的波动,对急性高温应激反应敏感,可作为一项非侵入指标对肉鸡热应激做出及时评价。
| [1] | BIZE P,STOCKER A,JENNI-EIERMANN S,et al.Sudden weather deterioration but not brood size affects baseline corticosterone levels in nestling Alpine swifts[J]. Hormones and Behavior,2010,58(4):591-598. ( 1) 1)
|
| [2] | BREUNER C W,SPRAGUE R S,PATTERSON S H,et al.Environment,behavior and physiology:do birds use barometric pressure to predict storms[J]. The Journal of Experimental Biology,2013,216(11):1982-1990. ( 1) 1)
|
| [3] | PLACE N J,KENAGY G J.Seasonal changes in plasma testosterone and glucocorticosteroids in free-living male yellow-pine chipmunks and the response to capture and handling[J]. Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2000,170(3):245-251. ( 1) 1)
|
| [4] | ROMERO L M,REMAGE-HEALEY L.Daily and seasonal variation in response to stress in captive starlings (Sturnus vulgaris):corticosterone[J]. General and Comparative Endocrinology,2000,119(1):52-59. ( 3) 3)
|
| [5] | ROMERO L M,REED J M,WINGFIELD J C.Effects of weather on corticosterone responses in wild free-living passerine birds[J]. General and Comparative Endocrinology,2000,118(1):113-122. ( 1) 1)
|
| [6] | BEUVING G,VONDER G M A.Effect of stressing factors on corticosterone levels in the plasma of laying hens[J]. General and Comparative Endocrinology,1978,35(2):153-159. ( 1) 1)
|
| [7] | TESKEY-GERSTL A,BAMBERG E,STEINECK T,et al.Excretion of corticosteroids in urine and faeces of hares (Lepus europaeus)[J]. Journal of Comparative Physiology B,2000,170(2):163-168. ( 1) 1)
|
| [8] | SCHATZ S,PALME R.Measurement of faecal cortisol metabolites in cats and dogs:a non-invasive method for evaluating adrenocortical function[J]. Veterinary Research Communications,2001,25(4):271-287. ( 1) 1)
|
| [9] | RETTENBACHER S,MOSTL E,HACKL R,et al.Measurement of corticosterone metabolites in chicken droppings[J]. British Poultry Science,2004,45(5):704-711. ( 1) 1)
|
| [10] | MÖSTL E,RETTENBACHER S,PALME R.Measurement of corticosterone metabolites in birds' droppings:an analytical approach[J]. Annals of the New York Academy of Sciences,2005,1046(1):17-34. ( 1) 1)
|
| [11] | YOUNG A M,HALLFORD D M.Validation of a fecal glucocorticoid metabolite assay to assess stress in the budgerigar (Melopsittacus undulatus)[J]. Zoo Biology,2013,32(1):112-116. ( 1) 1)
|
| [12] | FOLEY C A H,PAPAGEORGE S,WASSER S K.Noninvasive stress and reproductive measures of social and ecological pressures in free-ranging african elephants[J]. Conservation Biology,2002,15(4):1134-1142. ( 1) 1)
|
| [13] | GOYMANN W,MSTL E,VAN’T HOF T,et al.Noninvasive fecal monitoring of glucocorticoids in spotted hyenas,Crocuta crocuta[J]. General and Comparative Endocrinology,1999,114(3):340-348. ( 1) 1)
|
| [14] | FRAISSE F,COCKREM DR J F.Corticosterone and fear behaviour in white and brown caged laying hens[J]. British Poultry Science,2006,47(2):110-119. ( 1) 1)
|
| [15] | HERRING G,ACKERMAN J T,HERZOG M P.Mercury exposure may suppress baseline corticosterone levels in juvenile birds[J]. Environmental Science and Technology,2012,46(11):6339-6346. ( 1) 1)
|
| [16] | DUFTY Jr, A M,BELTHOFF J R.Corticosterone and the stress response in young western screech-owls:effects of captivity,gender,and activity period[J]. Physiological Zoology,1997,70(2):143-149. ( 1) 1)
|
| [17] | BREUNER C W,WINGFIELD J C,ROMERO L M.Diel rhythms of basal and stress-induced corticosterone in a wild,seasonal vertebrate,Gambel’s white-crowned sparrow[J]. The Journal of Experimental Zoology,1999,284(3):334-342. ( 1) 1)
|
| [18] | MARRA P P,LAMPE K T,TEDFORD B L.Plasma corticosterone levels in two species of Zonotrichia sparrows under captive and free-living conditions[J]. The Wilson Bulletin,1995,107(2):296-305. ( 1) 1)
|
| [19] | FRIGERIO D,DITTAMI J,MÖSTL E,et al.Excreted corticosterone metabolites co-vary with ambient temperature and air pressure in male Greylag geese (Anser anser)[J]. General and Comparative Endocrinology,2004,137(1):29-36. ( 1) 1)
|
| [20] | GOYMANN W,TRAPPSCHUH M,JENSEN W,et al.Low ambient temperature increases food intake and dropping production,leading to incorrect estimates of hormone metabolite concentrations in European stonechats[J]. Hormones and Behavior,2006,49(5):644-653. ( 1) 1)
|
| [21] | LOBATO E,MERINO S,MORENO J,et al.Corticosterone metabolites in blue tit and pied flycatcher droppings:effects of brood size,ectoparasites and temperature[J]. Hormones and Behavior,2008,53(1):295-305. ( 1) 1)
|
| [22] | 刘胜军,卢庆萍,张宏福,等.高温高湿环境对生长猪生长性能、血浆皮质醇浓度和免疫功能的影响[J]. 动物营养学报,2010,22(5):1214-1219. ( 1) 1)
|
| [23] | DANIELS-SEVERS A,GOODWIN A,KEILAND L C,et al.Effect of chronic crowding and cold on the pituitary-adrenal system:responsiveness to an acute stimulus during chronic stress[J]. Pharmacology,1973,9(6):348-356. ( 1) 1)
|
| [24] | GOULD N R,SIEGEL H S.Effects of corticotropin and heat on corticosteroid-binding capacity and serum corticosteroid in White rock chickens[J]. Poultry Science,1985,64(1):144-148. ( 1) 1)
|
| [25] | DEYHIM F,TEETER R G.Research note:sodium and potassium chloride drinking water supplementation effects on acid-base balance and plasma corticosterone in broilers reared in thermoneutral and heat-distressed environments[J]. Poultry Science,1991,70(12):2551-2553. ( 1) 1)
|
| [26] | HESTER P Y,SMITH S G,WILSON E K,et al.The effect of prolonged heat stress on adrenal weight,cholesterol,and corticosterone in White Pekin ducks[J]. Poultry Science,1981,60(7):1583-1586. ( 1) 1)
|
| [27] | WILLIAMSON R A,MISSON B H,DAVISON T F.The effect of exposure to 40 degrees on the heat production and the serum concentrations of triiodothyronine,thyroxine,and corticosterone in immature domestic fowl[J]. Genenal and Comprative Endocrinology,1985,60(2):178-186. ( 1) 1)
|
| [28] | JAFERI A,NOWAK N,BHATNAGAR S.Negative feedback functions in chronically stressed rats:role of the posterior paraventricular thalamus[J]. Physiology & Behavior,2003,78(3):365-373. ( 1) 1)
|




