2. 四川农业大学动物抗病营养教育部重点实验室, 成都 611130;
3. 四川省草原科学研究院, 成都 611743
2. Key Laboratory of Animal Disease-Resistant Nutrition of Ministry of Education, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Academy of Grassland Sciences, Chengdu 611743, China
肠道既是营养物质消化吸收的主要部位,又是大多数有毒有害物质侵入机体的主要门户,因此,肠道结构和功能的完整性与整个动物机体的健康状况密切相关。肠道由若干层组成,其中黏膜上皮、黏膜固有层、糖萼和分泌的黏液共同构成了肠道屏障[1,2]。而肠上皮细胞作为黏膜上皮的主要功能性细胞和肠道屏障的主要结构基础,其结构功能的完整性对肠道生理功能的正常发挥至关重要。
肠上皮结构功能的研究常以体外培养的肠上皮细胞为模型。然而,这些研究多采用细胞系进行,如大鼠隐窝细胞系(IEC-6/-18),人结肠腺癌细胞系(Caco-2和HT-29),人正常小肠细胞系(HIEC-6、H4、H4-1),新生仔猪小肠上皮细胞系(IPEC-J2、IPEC-1、PSI-1/CLAB)等[2]。这些细胞系或来源于肿瘤组织,或经过永生化处理(正常细胞),或已传代数十次,其生物性状已与体内正常细胞相差甚远。癌细胞系甚至在细胞基本结构、代谢和功能特性等方面均与正常上皮细胞存在一定的差异,而原代培养的肠上皮细胞其生物性状尚未发生改变,与体内正常细胞接近[3]。因此,建立可靠且稳定的肠上皮细胞分离培养方法,获得纯化的上皮细胞,在一定细胞周期内作为细胞模型,在肠生理学、肠营养学、肠病理学等研究中具有重要意义。
目前,已在体外成功分离培养了人[4,5]、家禽[6,7,8,9]、鼠[3, 10, 11, 12]、猪[13,14,15]、牛[16,17]和羊[18]等物种的小肠上皮细胞。然而,国内外有关家兔肠细胞分离培养的研究较少,且主要集中于结肠上皮细胞[19,20,21,22],有关小肠上皮细胞的报道很少[23,24]。鉴于小肠在组织学上可分为十二指肠、空肠(占小肠长度的近90%)和回肠[1],且各肠段的生理功能不尽相同,因此,分离培养特定肠段的黏膜上皮细胞对研究肠上皮的结构功能似乎更为合理,且更有说服力。Brow等[24]报道了用透明质酸酶消化家兔空肠而分离出有活性的肠细胞,从蔗糖酶和γ-谷氨酰转移酶的活性分析指出分离的细胞来源于上端绒毛,但未对细胞进行传代、纯化。因此,本试验拟以新生新西兰白兔(1~3日龄)空肠为研究对象,采用链霉蛋白酶E、胶原酶Ⅳ和二硫苏糖醇混合消化法消化家兔空肠组织,以建立较稳定的、可重复的空肠上皮细胞分离培养方法,并从形态学观察、碱性磷酸酶染色、细胞角蛋白8免疫荧光染色和肠上皮细胞标志物基因表达分析4方面来鉴定分离培养的细胞,为进一步研究外源物质对家兔小肠上皮结构功能的影响及其作用机制提供体外模型。 1 材料与方法 1.1 试验材料 1.1.1 试验动物
健康的新生新西兰白兔(1~3日龄),购于四川省实验动物专委会养殖场。 1.1.2 主要试剂与仪器
链霉蛋白酶E(Sigma)、胶原酶Ⅳ(Sigma)、二硫苏糖醇(Merck)、DMEM/F12培养基(Hycone)、胎牛血清(Hycone)、表皮生长因子(Peprotech)、胰岛素-转铁因子-硒补充剂-A(ITS-A,Gibco)、谷氨酰胺(Amresco)、胰蛋白酶(Gibco)、青链霉素混合液(100×,Solarbio)、肝素钠(Amresco)、山梨醇(科龙)、细胞角蛋白8抗体(Bio-Rad)、链霉亲和素-生物素复合物(SABC)免疫组化试剂盒(Bio-Rad)、BCIP/NBT碱性磷酸酯酶显色试剂盒(BestBio)、RNAiso Plus(TaKaRa)、SYBR PrimeScriptTM RT-PCR试剂盒(TaKaRa)、细胞培养瓶/板/皿(Costar)。
Revco Ultima Ⅱ二氧化碳培养箱(Thermo Scientific)、荧光倒置显微镜(Nikon)、高速冷冻离心机(Beckman Coulter)、T100 Thermal Cycler PCR仪(Bio-Rad)、170-8170型凝胶成像系统(Bio-Rad)等。 1.2 试验方法 1.2.1 试剂配制
DMEM/F12完全培养基:由DMEM/F12培养基中添加5%胎牛血清、20 ng/mL表皮生长因子、1% ITS-A、100 μg/mL肝素钠、1%青链霉素混合液组成;肠组织清洗液:含1.25 μg/mL两性霉素B、25 μg/mL氨苄西林和2%青链霉素混合液的磷酸盐缓冲液(PBS,pH=7.2~7.4),一次性针头滤器过滤除菌;混合酶消化液:由0.5 mg/mL链霉蛋白酶E、0.2 mg/mL胶原酶Ⅳ和0.25 mg/mL二硫苏糖醇以及2%青链霉素混合液组成,4 ℃保存;细胞分散液:由DMEM/F12培养基中添加2%山梨醇和2.5%胎牛血清组成,一次性针头滤器过滤除菌;培养用具:用鼠尾胶原包被所需培养瓶/皿;细胞冻存液:在6 mL新配制的DMEM/F12完全培养基中加入3 mL胎牛血清,再加入1 mL甘油,即配成10%甘油冻存液,现用现配。 1.2.2 细胞分离与培养
试兔过量吸入乙醚死亡后,无菌剪取空肠,置培养皿中,尽量去除肠系膜,纵向剖开,去除内容物,肠组织清洗液漂洗2~3次;将洗净的空肠转移至青霉素小瓶中,用手术剪充分剪碎成1 mm3左右的碎片,加肠组织清洗液充分清洗,至洗液澄清为止;吸弃洗液,加入5 mL混合酶消化液(预热至37 ℃),置37 ℃水浴恒温振荡器消化60 min(175 r/min);消化结束后,反复吹打细胞悬液5 min,加入适量细胞分散液,静置1 min,然后仔细转移上层悬液至15 mL无菌离心管,重复上述步骤3次或以上(充分沉淀未消化完全的组织块);收集最后1次的上层清液,300 r/min室温离心3 min,仔细移除上层悬液,沉淀,再用细胞分散液重悬离心,重复该步骤至少5次(充分去除单细胞);最后沉淀用DMEM/F12完全培养基重悬,接种于培养瓶/皿中,置培养箱于37 ℃、5% CO2、饱和湿度条件下培养,24 h后换液。 1.2.3 细胞形态学观察
用相差显微镜观察细胞生长状态和形态特征,并拍照记录。 1.2.4 细胞生长曲线
细胞接种于24孔板,每天计数3孔,求其平均值,绘制生长曲线。 1.2.5 细胞纯化
采用相差消化法、差速贴壁法进行纯化:胰酶消化过程中,在倒置显微镜下观察,大部分成纤维细胞会先于肠上皮细胞变小并漂浮上来,此时吸去胰酶消化液,用PBS清洗后再次用胰酶消化,此时消化下来的细胞大部分是肠上皮细胞;第2次消化下来的细胞用DMEM/F12完全培养基重悬后于培养箱培养30 min,随后取上清液至另一培养瓶/皿再次培养30 min,重复3次。 1.2.6 细胞冻存与复苏
细胞冻存:第2代细胞加入细胞冻存液进行冻存保存,4 ℃ 2 h→-20 ℃ 2 h→-80 ℃过夜,最后移入液氮容器内;细胞复苏:取出冻存的细胞置37 ℃水浴箱,快速摇晃至全部融化,加入适当DMEM/F12完全培养基于离心管中离心,DMEM/F12完全培养基重悬后接种至培养瓶,24 h后换液。 1.2.7 碱性磷酸酶染色
按试剂盒说明书配制BCIP/NBT染色工作液,现配现用。第2代细胞经4%甲醛固定2 h后,PBS清洗5 min,重复3次,最后1次洗涤完毕后,加入适量BCIP/NBT染色工作液,充分覆盖样品;室温孵育5~30 min或更长时间(可长达24 h),直到显色至预期深浅;显微镜下观察并拍照。 1.2.8 细胞角蛋白8免疫荧光染色
取第2代细胞进行试验:1)细胞接种至96孔板,24 h后吸去培养液,用PBS清洗2~3遍;2)加入4%甲醛(PBS溶解)室温固定2 h;3)细胞用PBS清洗5 min,重复3次,加入0.2% Triton X-100 (溶解于含5%山羊血清的PBS)孵育15 min,以阻断非特异结合;4)PBS清洗5 min,重复3次,于室温下与细胞角蛋白8抗体(封闭液1 ∶ 200稀释)孵育60 min;5)PBS清洗5 min,重复3次,滴加和一抗相对应的生物素化二抗[免疫球蛋白G(IgG),PBS 1 ∶ 100稀释]100 μL,室温孵育30 min;6)PBS清洗5 min,重复3次,滴加链霉亲和素生物素复合物-异硫氰酸荧光素(SABC-FITC,PBS 1 ∶ 100稀释)100 μL,室温避光孵育30 min;7)PBS清洗5 min,重复3次,用Hoechst(10 μg/mL)对细胞核染色30 min;8)PBS清洗5 min,重复3次,缓冲甘油封片,进行免疫荧光镜检并拍照。 1.2.9 细胞基因表达分析
总RNA的提取和cDNA的合成:细胞生长于6孔细胞培养板,基本融合后,用PBS轻轻清洗2次,随后加入Trizol裂解液(1 mL/孔)仔细吹打,按试剂盒说明书提取细胞总RNA,随即测定总RNA浓度并经1%琼脂糖凝胶电泳鉴定其完整性后反转录为cDNA;反转录-聚合酶链式反应(RT-PCR)扩增:以cDNA为模板进行RT-PCR,扩增产物经1.5%琼脂糖凝胶电泳检测。用于特异扩增cDNA片段的引物见表1,委托上海生工生物工程有限公司合成引物。PCR反应程序:95 ℃预变性3 min;然后95 ℃变性60 s,复性60 s(复性温度为60 ℃),72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。
| 表1 RT-PCR引物序列及参数 Table 1 Primer sequences and parameters for RT-PCR |
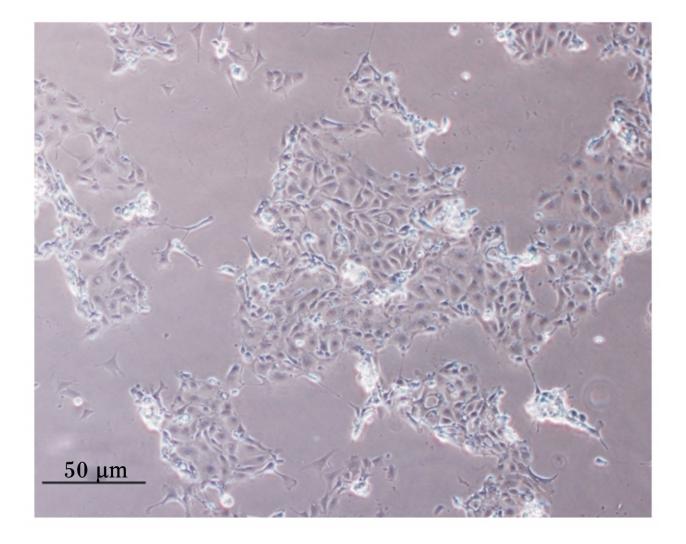
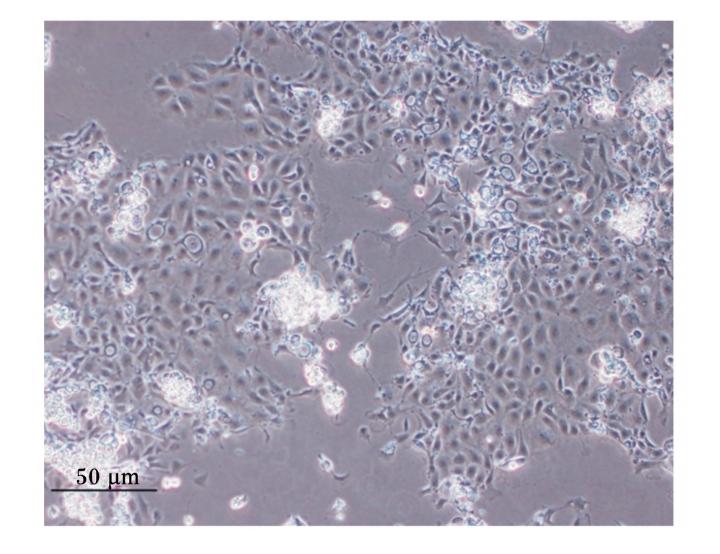
本试验运用混合酶消化法分离家兔空肠上皮细胞,消化液经2%山梨醇密度梯度离心获得了大量细胞团(图1)。在倒置显微镜下观察,细胞团12 h贴壁,并有细胞迁出,向四周蔓延生长,细胞呈扁平多角状或卵石状或椭圆状,胞质丰富(图2);24 h后,细胞进一步向外辐射生长,形成一群一群的细胞集落(图3);5~7 d细胞融合成片,呈铺路石样,单层生长,互不重叠,边界清晰(图4)。在培养过程中将传至第2代的细胞进行冻存处理,以观察细胞复苏后的生长状态及活力。结果表明:细胞复苏后第2天即贴壁,且生长状态较佳;细胞生长6 d后融合成片(图5)。细胞冻存、复苏的成功为后续的相关试验研究提供良好的基础。
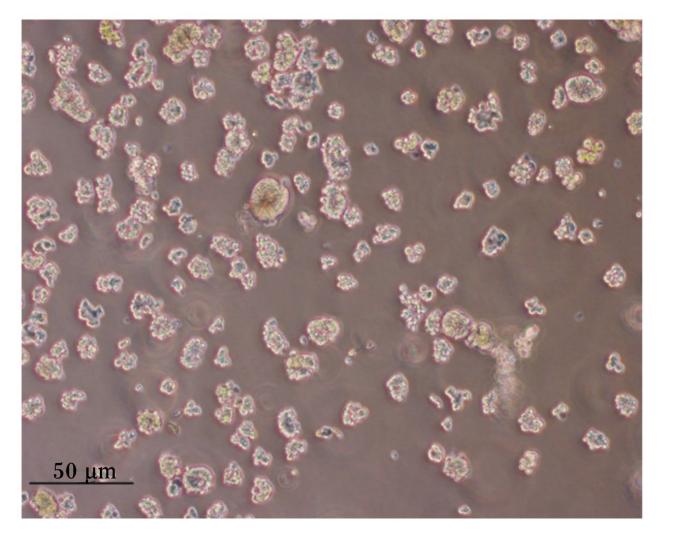 | 图1 分离获得的家兔空肠组织细胞团 Fig.1 Cell aggregates isolated from rabbit jejunum (100×) |
 | 图2 12 h后细胞团增殖 Fig.2 Cell aggregates proliferation after 12 h (100×) |
 | 图3 24 h后细胞团增殖 Fig.3 Cell aggregates proliferation after 24 h (100×) |
 | 图4 细胞生长7 d后形成细胞单层 Fig.4 Cells grow to form monolayers after 7 days (100×) |
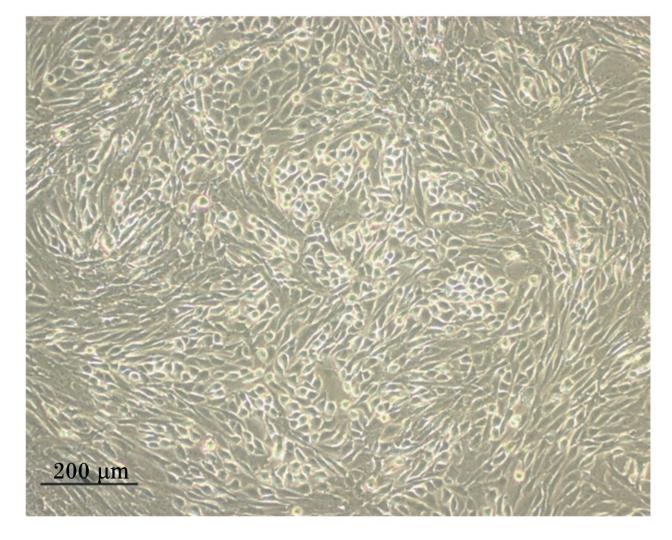 | 图5 复苏后6 d细胞融合成片 Fig.5 Cells grow to form monolayers after 6 days of recovery (100×) |
细胞接种3 d后进入对数生长期(3~6 d),从第7天开始细胞增殖基本处于停滞状态,符合肠上皮细胞的特性。这也提示细胞接种后3~6 d是1代细胞活性最好的阶段(图6)。
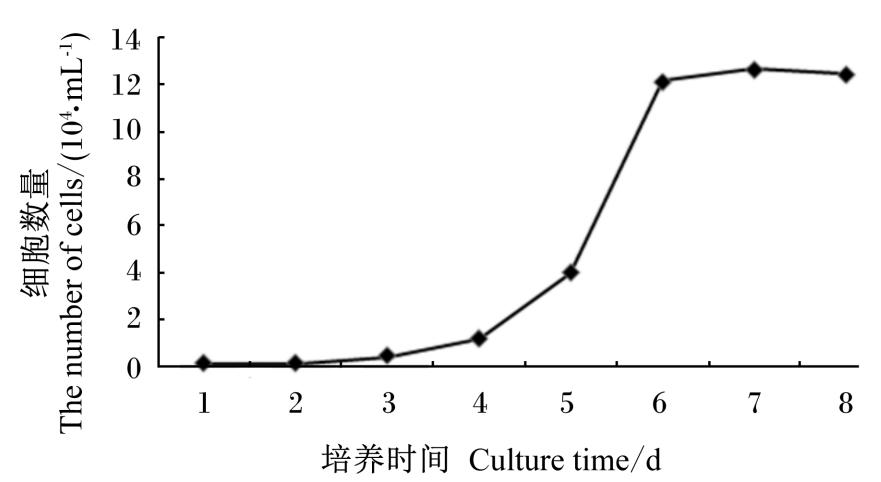 | 图6 家兔空肠上皮细胞的生长曲线 Fig.6 Growth curve of rabbit jejunal epithelial cells |
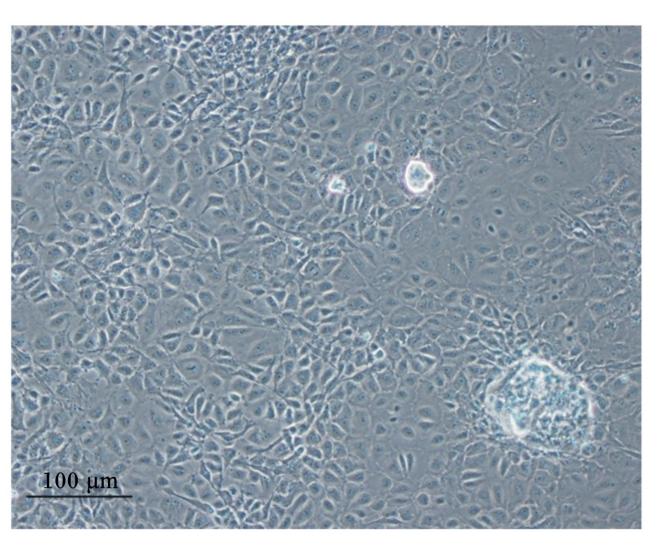
经2次纯化的第2代细胞,接种后24 h即贴 壁,可见细胞呈多角形或卵圆形(图7-A);5 d后融合成片,细胞连接紧密,呈典型的铺路石样(图7-B)。原代培养的肠上皮细胞会随着传代次数的增加而出现间隙增大且发生变形,因此,本研究采用经2次纯化的第2代细胞进行相关鉴定试验。
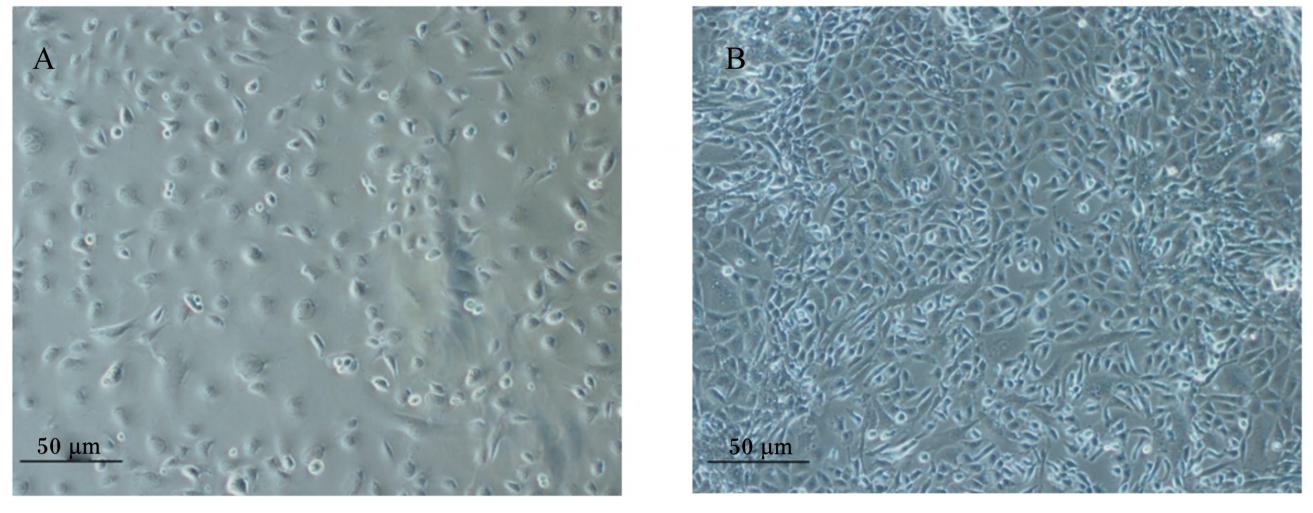 | 图7 家兔空肠上皮细胞的纯化
Fig.7 Purification of rabbit jejunal epithelial cells (100×) A:第 2 代细胞接种 24 h 后贴壁;B:第 2 代细胞接种 5 d 后融合成片。 A: the second-generation cells adherence after seeding 24 h; B: the second-generation cells grow to form monolayers after seeding 5 days. |
碱性磷酸酶是肠上皮细胞微绒毛上的标志性酶,常被认为是鉴定小肠上皮细胞的一个标志,本试验将24 h贴壁后的第2代细胞用碱性磷酸酶染色,可见细胞表面及细胞质中出现蓝紫色颗粒(图8B),阴性对照不显色(图8A)。
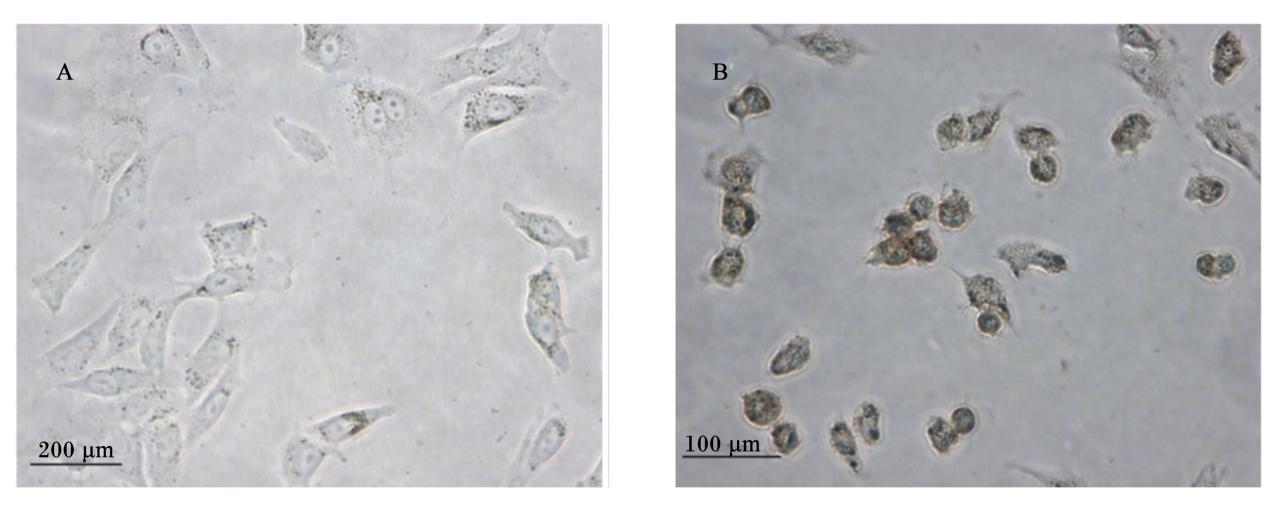 | 图8 家兔空肠上皮细胞的碱性磷酸酶染色
Fig.8 Alkaline phosphatase staining of rabbit jejunal epithelial cells (400×) A:未染色细胞( 阴性对照) ;B:碱性磷酸酶染色的细胞。 A: unstaining cells ( negative control) ; B: cells stained by alkaline phosphatase. |
细胞角蛋白是上皮组织中特异性的抗原,常用于鉴定分离细胞的上皮源性。本试验选用细胞角蛋白8抗体对第2代的家兔空肠上皮细胞进行免疫荧光检测,结果表明细胞表达细胞角蛋白8(图9)。
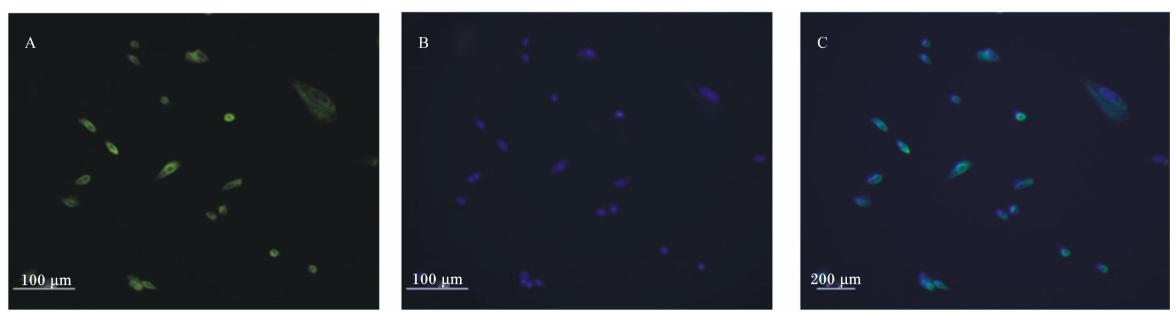 | 图9 家兔空肠上皮细胞的细胞角蛋白8免疫荧光染色
Fig.9 Cytokerain-8 immunofluorescence staining of rabbit jejunal epithelial cells (200×) A:细胞的细胞角蛋白 8 染色;B:细胞核 Hoechst 染色;C:A、B 的合成图。 A: cells stained by cytokerain-8; B: nucleus stained by Hoechst; C: merged figure of A and B. |
除了E-钙黏蛋白和紧密连接蛋白-4是所有上皮细胞的结构组成部分外,我们还研究了肠上皮细胞的功能性标志蛋白脂肪酸结合蛋白2,结果显示家兔空肠上皮细胞表达脂肪酸结合蛋白2。对另一个肠组织特异标志物,编码肠肽酶的基因的表达分析表明,肠肽酶在家兔空肠上皮细胞内表达,而肠肽酶的表达可以认为是空肠上皮细胞的标志[14](图10)。
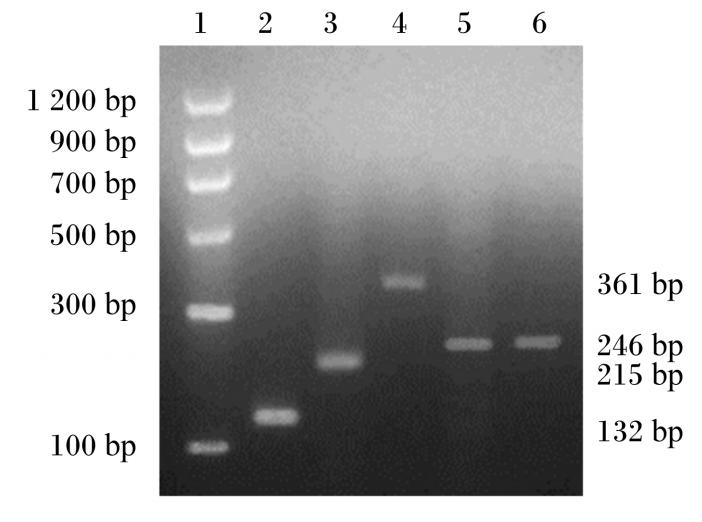 | 图10 家兔空肠上皮细胞的基因表达分析
Fig.10 Gene expression analysis of rabbit jejunal epithelial cells 1:DNA 分子标记;2:β - 肌动蛋白;3:E - 钙黏蛋白;4:
紧密连接蛋白-4;5:肠肽酶;6:脂肪酸结合蛋白 2。 1: DNA maker; 2: β-actin; 3: E-cadherin; 4: claudin-4; 5: enterokinase; 6: FABP2. |
选用合适的消化酶和确定适宜的消化时间以消化分离出肠隐窝细胞团是小肠上皮细胞体外培养成功的关键。为达到分离肠隐窝细胞团的目的,相关研究多采用多种酶联合进行消化,涉及的有胶原酶和中性蛋白酶[6, 11, 12, 14, 16]、胶原酶Ⅰ和嗜热菌蛋白酶[6,7]、链霉蛋白酶和胶原酶Ⅳ[22]、胶原酶和透明质酸酶[25]联合应用。由于胶原酶作用温和且能抑制成纤维细胞的生长,常与不同的酶联合运用。直至目前,在对家兔肠道上皮细胞的分离培养研究中,多集中在结肠上皮细胞的培养[19,20,21,22],对小肠上皮细胞的分离报道较少[23,24]。Brown等[24]以成年新西兰白兔空肠为研究对象,报道了运用1.5 mg/mL浓度的透明质酸酶于37 ℃水浴振摇(75 r/min)消化20 min分离出有活性的空肠细胞的方法,从蔗糖酶和γ-谷氨酰转移酶活性分析指出这种方法分离的细胞来源于上端绒毛,具有积累糖类和氨基酸的能力,同时保持正常生理状态的离子吸收特性,但未对细胞进行纯化。刘飞飞等[23]以新生未哺乳仔兔小肠为研究对象,运用胶原酶Ⅳ消化过夜以分离小肠上皮细胞,在第3代细胞传代时,用相差消化法和差速贴壁法进行纯化,从形态学、细胞生长曲线和细胞角蛋白8单克隆抗体染色来鉴定分离培养的细胞。本试验以新生家兔(1~3日龄)空肠组织为研究对象,尽管试兔已经哺乳,但经肠组织液彻底清洗,有效防止了细菌污染,另外参考Reddy等[22]的研究运用0.5 mg/mL链霉蛋白酶E、0.2 mg/mL胶原酶Ⅳ和0.25 mg/mL二硫苏糖醇混合消化液,振摇(175 r/min)消化60 min,较刘飞飞等[23]时间缩短,结合2%山梨醇密度梯度离心[3],去除了大量单细胞,成功分离获得了大量细胞团(图1),细胞团贴壁和增殖能力强(图2)。 3.2 肠上皮细胞的纯化
在肠上皮细胞原代培养试验中存在的最大问题是成纤维细胞、平滑肌细胞等非目标细胞过度生长的问题,尽管少量的异源细胞存在对上皮细胞生长繁殖是必要的,但异源细胞的过度增长会影响生长的优势状态[26]。因此,肠上皮细胞必须进行纯化。目前纯化方法主要有机械刮除法、相差消化法和差速贴壁法等。本试验在酶消化后通过山梨醇密度梯度低速离心(300 r/min)去除了大量单个细胞,再结合后续的胰酶消化传代时运用相差消化法和差速贴壁法进行纯化,成功获得了纯化的上皮细胞(图7)。 3.3 培养基及生长基质对肠上皮细胞培养的影响
培养基的质量及成分是关系上皮细胞生长的关键因素,本试验培养基由DMEM/F12基础培养基添加5%胎牛血清以及表皮生长因子、ITS-A、肝素钠、谷氨酰胺、青链霉素混合液组成,培养的上皮细胞生长和增殖良好。值的注意的是,培养基中血清的浓度要适宜:浓度过高,上皮细胞大量增殖的同时存在的成纤维细胞及平滑肌细胞等非目标细胞也会大量增殖,且后者增殖速度将大于前者;过低,成纤维细胞和上皮细胞的生长都将受到抑制。因此,血清浓度一般控制在5%左右[7, 10, 13, 14, 15, 18]。ITS-A的添加对细胞的生长具有关键的作用,Schierack等[27]甚至推测表皮生长因子和ITS-A的添加很有可能取代血清。小肠黏膜细胞主要以氧化谷氨酰胺获能,因此尽管DMEM/F12基础培养基含有2.5 mmol/L谷氨酰胺,本试验再额外添加了2 mmol/L谷氨酰胺,使培养基中谷氨酰胺浓度为4.5 mmol/L。培养基中添加肝素钠(100 μg/mL)则是基于其可抑制平滑肌细胞的生长,同时还可作为原代培养肠上皮细胞的一种营养剂[28]。另外,适当的细胞黏附基质有助于上皮细胞贴壁,并可促进其体外增殖和保持其分化特性,多聚赖氨酸、Ⅰ型鼠尾胶原等常用来包被细胞培养瓶/皿。本试验中我们采用自制的鼠尾胶原蛋白包被所用细胞培养瓶/皿,隐窝细胞团接种后12 h即贴壁,且生长状态良好。 3.4 分离肠上皮细胞的鉴定
在对小肠上皮细胞的鉴定中,目前常用的方法有碱性磷酸酶染色、免疫荧光染色和电镜观察。此外,也有研究进行肠上皮细胞特异基因和蛋白的表达分析[16]。细胞角蛋白作为上皮组织中特异性的抗原被广泛用于原代培养肠上皮细胞的鉴定,本试验选用细胞角蛋白8抗体对第2代细胞进行免疫荧光染色,结果表明细胞呈阳性反应。碱性磷酸酶作为肠上皮细胞微绒毛上的标志性酶,与上皮细胞的分化、物质吸收和转运等功能活动密切相关,也常用于原代肠上皮细胞的鉴定。但是,有关原代培养小肠上皮细胞是否表达碱性磷酸酶的研究结果存在不一致:一些研究报道原代培养的细胞不具有碱性磷酸酶活性[15, 29, 30],另有一些研究表明原代培养的细胞碱性磷酸酶染色呈阳性。如杨文平等[31]报道,培养至11 d的鸡肠上皮细胞碱性磷酸酶染色结果呈强阳性;古少鹏等[6]报道铺路石样细胞和散在的上皮细胞碱性磷酸酶染色呈阳性;李莉等[32]报道分离获得的仔猪小肠上皮细胞在培养11 d后,90%以上的细胞碱性磷酸酶染色呈阳性;贾国东等[33]报道原代分离培养的鸡小肠上皮细胞,其表面及细胞质的碱性磷酸酶染色呈阳性。本试验对第2代细胞进行碱性磷酸酶染色试验,结果显示细胞呈阳性反应。Rusu等[16]介绍了几种互补的方法(免疫细胞化学、蛋白印迹、基因表达分析、酶活性分析和电子显微观察)来表征原代培养的牛肠上皮细胞,其中对肠上皮细胞特异基因的表达分析结果表明,肠肽酶仅在空肠细胞内表达,指出肠肽酶的表达可认为是空肠上皮细胞的标志。本试验同样进行了肠上皮细胞特异基因表达的分析,结果表明,编码脂肪酸结合蛋白2、肠肽酶、E-钙黏蛋白的肠上皮细胞标志蛋白的基因在家兔空肠上皮细胞内表达。 4 结 论
本研究通过混合酶消化法得到了符合肠上皮细胞形态特征、活性强、能够传代的家兔空肠上皮细胞,第2代细胞碱性磷酸酶染色和细胞角蛋白8免疫荧光染色鉴定结果均呈阳性,并且选择的多个肠上皮标志基因均在细胞内表达。由此可以初步确定获得的细胞为空肠上皮细胞。此外,肠上皮细胞冻存、复苏的成功为后续的相关试验研究提供较好的基础。
| [1] | PATSOS G,CORFIELD A.Management of the human mucosal defensive barrier:evidence for glycan legislation[J]. Biological Chemistry,2009,390(7):581-590. ( 2) 2)
|
| [2] | CENCIC A,LANGERHOLC T.Functional cell models of the gut and their applications in food microbiology-a review[J]. International Journal of Food Microbiology,2010,141(31):4-14. ( 2) 2)
|
| [3] | EVANS G S,FLINT N,SOMERS A S,et al.The development of a method for the preparation of rat intestinal epithelial cell primary cultures[J]. Journal of Cell Science,1992,101:219-231. ( 3) 3)
|
| [4] | PERREAULT N,BEAULIEU J F.Primary cultures of fully differentiated and pure human intestinal epithelial cells[J]. Experimental Cell Research,1998,245(1):34-42. ( 1) 1)
|
| [5] | CHOUGULE P,HERLENIUS G,HERNANDEZ N M,et al.Isolation and characterization of human primary enterocytes from small intestine using a novel method[J]. Scandinavian Journal of Gastroenterology,2012,47(11):1334-1343. ( 1) 1)
|
| [6] | 古少鹏,王敏霞,赵素芬,等.鸡胚盲肠上皮细胞原代培养与鉴定[J]. 畜牧兽医学报,2009,40(11):1699-1704. ( 3) 3)
|
| [7] | 洪智敏,贾永杰,瞿明仁,等.鸡胚小肠上皮细胞的分离及原代培养研究[J]. 江西农业大学学报,2011,33(6):1164-1170. ( 3) 3)
|
| [8] | VELGE P,BOTTREAU E,QUR P,et al.Establishment and characterization of partially differentiated chicken enterocyte cell clones[J]. European Journal of Cell Biology,2002,81(4):203-212. ( 1) 1)
|
| [9] | MAC DONAL O,CHEDIACK J G,CAVIEDES-VIDAL E.Isolation of epithelial cells,villi and crypts from small intestine of pigeons (Columba livia)[J].Biocell,2008,32(3):219-227. ( 1) 1)
|
| [10] | YAMADA K,SATO K,MORISHITA S,et al.Establishment of a primary culture method for mouse intestinal epithelial cells by organ culture of fetal small intestine[J]. Bioscience Biotechnology and Biochemistry,2009,73(8):1849-1855. ( 2) 2)
|
| [11] | 纪华英,陈其奎,曾晖.小鼠小肠上皮细胞的体外原代培养[J]. 医学综述,2010,16(9):1417-1419. ( 2) 2)
|
| [12] | 周莹,胡学庆,周广东,等.大鼠小肠上皮类器官单位的分离培养鉴定[J]. 组织工程与重建外科杂志,2005,1(4):214-216. ( 2) 2)
|
| [13] | 王静,张彦明,仝钢,等.新生仔猪小肠上皮细胞的分离培养和鉴定[J]. 畜牧兽医学报,2010,41(1):92-98. ( 2) 2)
|
| [14] | 周传丽,刘铮铸,俞英,等.仔猪小肠黏膜上皮细胞体外分离培养及鉴定[J]. 中国农业科学,2011,44(21):4516-4524. ( 4) 4)
|
| [15] | 李慧,格日乐其木格,王健宇,等.肠绒毛消化法所得仔猪小肠上皮细胞的培养与鉴定[J]. 中国细胞生物学学报,2011,33(10):1094-1101. ( 3) 3)
|
| [16] | RUSU D,LORET S,PEULEN O,et al.Immunochemical,biomolecular and biochemical characterization of bovine epithelial intestinal primocultures[J]. BMC Cell Biology,2005,6(42):1471-2121. ( 4) 4)
|
| [17] | LORET S,RUSU D,MOUALIJ B E,et al.Preliminary characterization of jejunocyte and colonocyte cell lines isolated by enzymatic digestion from adult and young cattle[J]. Research in Veterinary Science,2009,87(1):123-132. ( 1) 1)
|
| [18] | 孙志洪,张庆丽,贺志雄,等.山羊瘤胃上皮细胞和空肠黏膜上皮细胞原代培养技术研究[J]. 动物营养学报,2010,22(3):602-610. ( 2) 2)
|
| [19] | HATE Y,OTA S,NAGATA T,et al.Primary colonic epithelial cell culture of the rabbit producing prostaglandins[J]. Prostaglandins,1993,45(2):129-l41. ( 2) 2)
|
| [20] | BENYA R V,SCHMIDT L N,SAHI J,et al.Isolation,characterization,and attachment of rabbit distal colon epithelial cells[J]. Gastroenterology,1991,101(3):692-702. ( 2) 2)
|
| [21] | HOMAIDAN F R,ZHAO L,DONOVAN V,et al.Eparation of pure populations of epithelial cells from rabbit distal colon[J]. Analytical Biochemistry,1995,224(1):134-139. ( 2) 2)
|
| [22] | REDDY P M,SAHI J,DESAI G,et al.Altered growth and attachment of rabbit crypt colonocytes isolated from different developmental stages[J]. Pediatric Research,1996,39(2):287-294. ( 4) 4)
|
| [23] | 刘飞飞,车东升,穆成龙,等.兔小肠上皮细胞体外分离培养[J]. 吉林农业大学学报,2011,33(4):429-432. ( 4) 4)
|
| [24] | BROWN P D,SEPÙLVEDA F V.A rabbit jejunal isolated enterocyte preparation suitable for transport studies[J]. The Journal of Physiology,1985,363:257-270. ( 3) 3)
|
| [25] | PEDERSEN G,SAERMARK T,GIESE B,et al.A simple method to establish short-term cultures of normal human colonic epithelial cells from endoscopic biopsy specimens.Comparison of isolation methods,assessment of viability and metabolic activity[J]. Scandinavian Journal of Gastroenterology,2000,35(7):772-780. ( 1) 1)
|
| [26] | KÉDINGER M,SIMON-ASSMANN P,ALEXANDRE E,et al.Importance of a fibroblastic support for in vitro differentiation of intestinal endodermal cells and for their response to glucocorticoids[J]. Cell Death and Differentiation,1987,20(2/3):171-182. ( 1) 1)
|
| [27] | SCHIERACK P,NORDHOFF M,POLLMANN M,et al.Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochemistry and Cell Biology,2006,125(3):293-305. ( 1) 1)
|
| [28] | FLINT N,COVE F L,EVANS G S.Heparin stimulates the proliferation of intestinal epithelial cells in primary culture[J]. Journal of Cell Science,1994,107(2):401-411. ( 1) 1)
|
| [29] | LANDSVERK T.The epithelium covering Peyer’s patches in young milk-fed calves.An ultrastructural and enzyme histochemical investigation[J]. Acta Veterinaria Scandinavica,1981,22(2):198-210. ( 1) 1)
|
| [30] | MIYAZAWA K,HONDO T,KANAYA T,et al.Characterization of newly established bovine intestinal epithelial cell line[J]. Histochemistry and Cell Biology,2010,133(1):125-134. ( 1) 1)
|
| [31] | 杨文平,高峰,许辉堂,等.鸡肠上皮细胞体外原代培养研究[J]. 江西农业学报,2007,19(5):113-115. ( 1) 1)
|
| [32] | 李莉,高淑静,张守全,等.新生仔猪小肠上皮细胞体外培养的研究[J]. 仲恺农业工程学院学报,2010,23(1):30-33. ( 1) 1)
|
| [33] | 贾国东,赵毅博,刘冠群,等.鸡肠上皮细胞原代培养方法的改进研究[J]. 中国家禽,2012,34(19):25-32. ( 1) 1)
|




