2. 上海交通大学农业与生物学院, 上海 200240
2. School of Agriculture and Biology, Shanghai Jiaotong University, Shanghai 200240, China
益生菌是指一类活的微生物,当摄入充足量时对宿主起到一定的益生作用。益生菌在代谢过程中产生一些抑菌物质,可以维持动物肠道菌群平衡,提高动物免疫,促进生长。研究报道,乳杆菌、双歧杆菌等益生菌能改善肠道生物屏障功能,减少致病菌引起的肠道疾病[ 1,2,3 ]。致泄性大肠杆菌(Escherichia coli)是引起人和动物肠道疾病的重要致病菌,该菌也是多种猪肉制品的污染源。而抗生素的使用使动物机体产生药物依懒性、免疫力下降、胃肠道内菌群失调等问题,益生菌在一定程度上能防治致病菌引起的肠道疾病[ 4 ]。
益生菌进入肠道后,黏附于肠上皮细胞,通过与致病菌竞争黏附位点和营养物质而抑制致病菌在肠道中的黏附,维持肠道菌群平衡,缓解致病菌引起的肠道混乱。但是,益生菌在通过胃肠道时,由于胃酸胆盐的作用,到达肠道的活菌数量极少[ 5 ]。如果采用包埋、冷冻干燥等方法来维持益生菌的活性,成本将大大提高,限制了益生菌产品作为饲料添加剂在畜禽饲养中的应用。最近的一些研究表明,灭活菌体也具有益生作用,从粪便中分离得到的乳杆菌可以抑制沙门氏菌和大肠杆菌在Caco-2细胞上的黏附[ 6 ]。Lin等[ 7 ]研究发现,混合乳杆菌的热灭活菌体可以通过激活巨噬细胞进行免疫调节,从而抑制沙门氏菌的入侵。乳酸菌的细胞表面结构,如肽聚糖、磷壁酸、胞外多糖、表面蛋白等物质,在益生菌发挥益生作用过程中起着重要的作用[ 8 ]。Sun等[ 9 ]研究发现,乳杆菌属细菌的肽聚糖可以通过激活巨噬细胞来提高宿主的免疫功能。Smelt等[ 10 ]研究发现,植物乳杆菌(Lactobacillus plantarum)WCFS1的磷壁酸可以使健康小鼠产生调节性T细胞,从而增强小鼠的免疫功能。
本试验拟研究嗜酸乳杆菌活菌体和热灭活菌体对IPEC-J2细胞的黏附性,对大肠杆菌黏附IPEC-J2细胞的拮抗效应,以及对大肠杆菌生长的抑制作用,为灭活益生菌在微生态制剂开发中的应用提供依据。
1 材料与方法 1.1 试验材料大肠杆菌,具体菌种名为大肠杆菌C83907,购自国家兽医微生物菌种保藏中心,保藏号:CVCC 200;IPEC-J2细胞,由河南农业大学魏占勇博士转赠;嗜酸乳杆菌,从小猪粪便中分离得到,具体菌种名为嗜酸乳杆菌yy13002,购自中国微生物菌种保藏中心,保藏号:CGMCC 8043。
1.2 试验方法 1.2.1 嗜酸乳杆菌活菌体和热灭活菌体对IPEC-J2细胞的黏附性IPEC-J2细胞的培养:IPEC-J2细胞采用DMEM/F12培养基培养,并添加10%(体积分数)的热灭活(30 min,56 ℃)胎牛血清、1%(体积分数)的青-链霉素。IPEC-J2细胞于CO2培养箱(5% CO2和95%空气)中37 ℃培养,1~2 d换液1次[ 11 ]。
活菌体的准备:嗜酸乳杆菌在MRS培养液中活化3代,10 000×g离心5 min,收集菌体,用无菌磷酸盐缓冲液(PBS,pH 7.2)洗涤2次后用无菌PBS重悬菌体。
热灭活菌体的准备:嗜酸乳杆菌在MRS培养液中活化3代,10 000×g离心5 min,收集菌体,用无菌PBS洗涤2次,重悬在无菌PBS中,重悬菌体在80 ℃下加热20 min,制备热灭活菌体。梯度稀释热灭活菌体和活菌体悬液,倾注于MRS固体平板中计数。活菌体悬液样品菌落数为1.1×109 CFU/mL,热灭活菌体悬液样品则没有菌落。
黏附试验:IPEC-J2细胞长成单层细胞后,胰酶消化,将细胞以每毫升2×105个细胞的量加入到6孔组织细胞培养板中,37 ℃条件下于CO2培养箱中恒温培养至长成单层细胞后进行黏附试验。将IPEC-J2细胞培养板用无菌PBS清洗2次,加入1 mL上述制备好的菌体悬液(108 CFU/mL),每个样品重复3孔,在CO2培养箱中37 ℃培养2 h。之后移去菌体悬液,用无菌PBS洗涤4次,以除去未黏附的嗜酸乳杆菌,然后每孔用无水乙醇固定30 min,清洗后,进行革兰氏染色,干燥后计数。显微镜随机观察20个400×视野,记录100个细胞上黏附的嗜酸乳杆菌数。
1.2.2 嗜酸乳杆菌活菌体和热灭活菌体抑制大肠杆菌对IPEC-J2细胞的黏附 1.2.2.1 嗜酸乳杆菌活菌体和热灭活菌体竞争性抑制大肠杆菌对细胞的黏附细胞和菌体的制备如上所述。将IPEC-J2细胞用无菌的PBS洗涤2次,将等量的大肠杆菌和嗜酸乳杆菌活菌体或热灭活菌体加入到IPEC-J2细胞中,在CO2培养箱中37 ℃培养2 h,用无菌PBS清洗4次,移去未黏附的细菌,加入1 mL 1%(体积分数)的Triton 100,吹打混匀,将从细胞上解析下来的菌体梯度稀释后,用伊红美蓝琼脂培养基平板计数对照组和试验组中大肠杆菌的菌落数。对照组只加大肠杆菌[ 12 ]。
竞争抑制率(%)=100×(Ae-A)/Ae。
式中:Ae表示对照组中大肠杆菌在IPEC-J2细胞上的黏附数;A表示试验组中大肠杆菌在IPEC-J2细胞上的黏附数。
1.2.2.2 嗜酸乳杆菌活菌体和热灭活菌体排阻抑制大肠杆菌对IPEC-J2细胞的黏附将1 mL嗜酸乳杆菌活菌体或热灭活菌体悬液(108 CFU/mL)加入到IPEC-J2细胞中,在CO2培养箱中37 ℃培养2 h。然后用无菌PBS洗涤3次,移去未黏附的菌体,加入1 mL大肠杆菌悬液(108 CFU/mL),CO2培养箱中37 ℃培养2 h。用无菌PBS清洗细胞4次,除去未黏附的菌体,加入1 mL 1%(体积分数)的Triton 100,吹打混匀,将从细胞上解析下来的菌体梯度稀释后,用伊红美蓝琼脂培养基平板计数对照组和试验组中大肠杆菌的菌落数。对照组不经嗜酸乳杆菌预先处理,只加大肠杆菌[ 12 ]。
排阻抑制率(%)=100×(Ae-A)/Ae。
式中:Ae表示对照组中大肠杆菌在IPEC-J2细胞上的黏附数;A表示试验组中大肠杆菌在IPEC-J2细胞上的黏附数。
1.2.2.3 嗜酸乳杆菌活菌体和热灭活菌体替换抑制大肠杆菌对IPEC-J2细胞的黏附将1 mL大肠杆菌悬液(108 CFU/mL)加入到IPEC-J2细胞中,在CO2培养箱中37 ℃培养2 h,然后用无菌PBS洗涤3次,除去未黏附的大肠杆菌,然后加入1 mL嗜酸乳杆菌活菌体或热灭活菌体悬液(108 CFU/mL),在CO2培养箱中37 ℃培养2 h,然后用无菌PBS洗涤4次,除去未黏附的菌体,加入1 mL 1%(体积分数)的Triton 100,吹打混匀,将从细胞上解析下来的菌体梯度稀释后,用伊红美蓝琼脂培养基平板计数对照组和试验组中大肠杆菌的菌落数。对照组只加大肠杆菌[ 12 ]。
替换抑制率(%)=100×(Ae-A)/Ae。
式中:Ae表示对照组中大肠杆菌在IPEC-J2细胞上的黏附数;A表示试验组中大肠杆菌在IPEC-J2细胞上的黏附数。
1.2.3 嗜酸乳杆菌发酵上清的抑菌能力采用琼脂扩散法进行嗜酸乳杆菌对大肠杆菌的抑制生长试验。嗜酸乳杆菌发酵上清的制备:将嗜酸乳杆菌活化2代,培养20 h,10 000×g离心5 min收集上清。指示菌的制备:将大肠杆菌活化2代,培养20 h,并将菌液浓度调整至107 CFU/mL。取1 mL大肠杆菌菌液加入培养皿中,用LB培养基倾注平板,待完全凝固后,每个平板打5个直径5 mm的小孔,在每孔中加入100 μL的发酵上清,培养24 h后,观察抑菌圈大小,测量直径。将发酵上清pH调整至7.0后,采用上述方法测其抑菌圈直径。以MRS培养基(pH 3.94)为对照。
1.2.4 嗜酸乳杆菌发酵上清与大肠杆菌的共培养将嗜酸乳杆菌活化2代,以3%的接种量接种至MRS培养液中培养20 h,离心收集上清,测定上清pH为3.94,将上清过滤除菌后调整pH至7.0,过滤除菌备用。嗜酸乳杆菌发酵上清和LB培养液1 ∶ 1混合,将活化2代的大肠杆菌以3%的接种量接种至混合培养液中,分别在2、4、6、8、10和12 h后取样,测定混合培养液在600 nm处的吸光度值。以MRS培养液(pH 3.94)为阴性对照,以LB培养液为空白对照。
1.3 数据统计与分析所有试验均设3个重复。数据分析采用SPSS 16.0中的单因素方差分析(one-way ANOVA)进行统计分析和差异显著性比较。结果用平均值±标准差(mean±SD)表示。
2 结 果 2.1 嗜酸乳杆菌活菌体和热灭活菌体对IPEC-J2细胞的黏附性本试验采用IPEC-J2细胞模型,测定嗜酸乳杆菌活菌体和热灭活菌体的体外黏附性。通过显微镜随机观察20个视野,共100个细胞上黏附的嗜酸乳杆菌,计算平均每个细胞上黏附的嗜酸乳杆菌的个数。图1-a为嗜酸乳杆菌活菌体对IPEC-J2细胞的黏附性,每个细胞上黏附的活菌数为(20±2) CFU,图1-b为嗜酸乳杆菌热灭活菌体对IPEC-J2细胞的黏附性,每个细胞上黏附的热灭活菌数为(40±2) CFU,这说明热灭活菌体对IPEC-J2细胞的黏附能力高于活菌体。
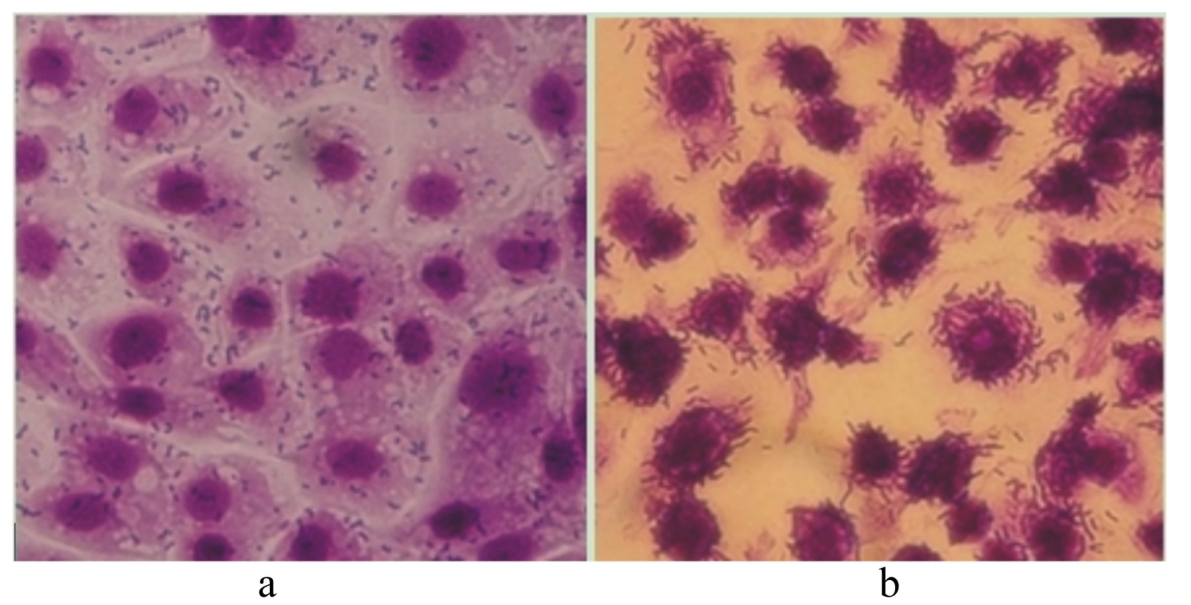 | 图1 嗜酸乳杆菌活菌体(a)和热灭活菌体对 IPEC-J2细胞的黏附性(b) Fig.1 Adhesion of live (a) and heat-killed Lactobacillus acidophilus on IPEC-J2 cells (b) |
嗜酸乳杆菌对大肠杆菌在IPEC-J2细胞上黏附的抑制结果见表1。
| 表1 嗜酸乳杆菌对大肠杆菌在IPEC-J2细胞上黏附的抑制 Table 1 Inhibition of Escherichia coli adhere to IPEC-J2 cells by live and heat-killed Lactobacillus acidophilus % |
竞争性抑制试验:嗜酸乳杆菌活菌体和热灭活菌体与大肠杆菌同时处理IPEC-J2细胞时,与对照组相比,2个试验组中大肠杆菌对细胞的黏附数明显减少,表明活菌体和热灭活菌体都可以抑制大肠杆菌对IPEC-J2细胞的黏附,其中活菌体对大肠杆菌黏附的竞争抑制率[(49.12±1.50)%]显著高于热灭活菌体对大肠杆菌黏附的竞争抑制率[(42.33±1.02)%](P<0.05)。
排阻抑制试验:IPEC-J2细胞经嗜酸乳杆菌活菌体和热灭活菌体预先处理后,大肠杆菌在细胞上的黏附数与对照组相比明显减少,其中热灭活菌体对大肠杆菌黏附的排阻抑制率为(49.27± 0.94)%,活菌体对大肠杆菌黏附的排阻抑制率为 (39.5±1.29)%,两者差异显著(P<0.05)。
替换抑制试验:嗜酸乳杆菌活菌体和热灭活菌体都可以替换下已黏附到细胞上的大肠杆菌,其中活菌体对大肠杆菌的替换抑制率为(46.53±1.43)%,显著高于热灭活菌体对大肠杆菌的替换抑制率(39.50±1.61)%(P<0.05)。
2.3 嗜酸乳杆菌发酵上清的抑菌能力本试验通过琼脂扩散法,观察嗜酸乳杆菌发酵上清对大肠杆菌的抑菌圈的大小,将pH为3.94 的MRS培养基作为对照,同时将发酵上清pH调 整至7.0,观察抑菌圈的大小,结果见表2。结果发现,嗜酸乳杆菌的发酵上清能很好地抑制大肠杆菌的生长,发酵上清调整至中性(pH 7.0)后,其抑菌圈直径显著减小(P<0.05),基本不能抑制大肠杆菌的生长,而将MRS培养基调整至pH 3.94后也能抑制大肠杆菌的生长,但其抑菌圈直径显著小于嗜酸乳杆菌发酵上清的抑菌圈直径(P<0.05)。
| 表2 嗜酸乳杆菌发酵上清的抑制能力 Table 2 Antimicrobial ability of culture supernatant of Lactobacillus acidophilus mm |
由图2可知,嗜酸乳杆菌的发酵上清与大肠杆菌共培养时,嗜酸乳杆菌发酵上清能很好地抑制大肠杆菌的生长繁殖,pH 3.94的MRS培养液也可以抑制大肠杆菌的生长,但嗜酸乳杆菌发酵上清调整至pH 7.0后,抑制作用不明显,大肠杆菌能在其中正常生长。
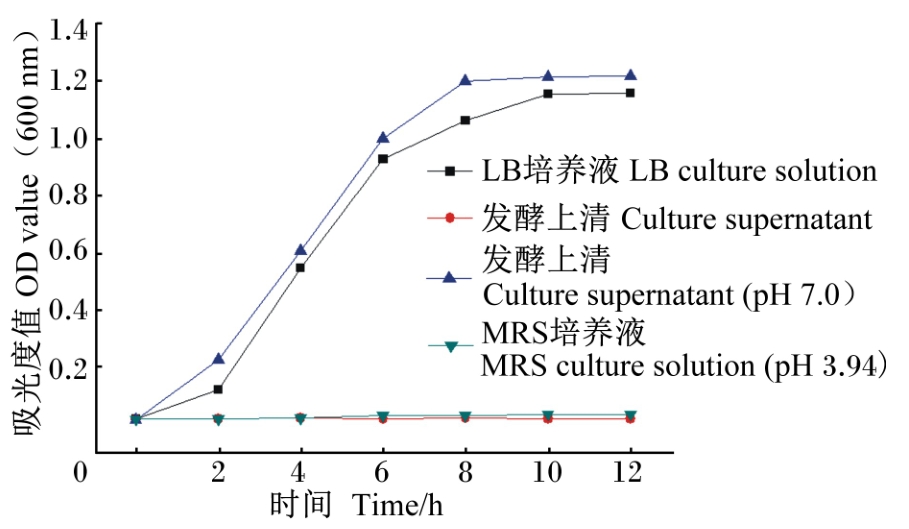 | 图2 嗜酸乳杆菌发酵上清与大肠杆菌共培养情况下大肠杆菌的生长情况 Fig.2 Growth condition of Escherichia coli in co-culture with culture supernatant of Lactobacillus acidophilus |
益生菌保护肠道免受致病菌入侵的机制不仅仅是通过产生一些有机酸和细菌素杀死致病菌,更重要的是干扰致病菌在肠上皮细胞上的黏附和入侵[ 13 ]。另外,最新研究表明,益生菌可以诱导肠黏膜表层上皮细胞分泌分泌型免疫球蛋白A(sIgA),从而清除致病菌,维持肠道菌群平衡[ 14 ]。Ishikawa等[ 15 ]研究表明,热灭活的植物乳杆菌b240可以通过抑制致病菌黏附和入侵,以及诱导肠道黏膜细胞分泌sIgA,从而减少鼠伤寒沙门氏菌(Salmonella enteric serovar Typhimurium)对小鼠肠道的损伤。
黏附是细菌和宿主相互作用的第1步,益生菌黏附在肠黏膜上后形成一层保护层,阻止致病菌和宿主细胞间的接触和入侵,同时益生菌还可以通过空间位阻以及与致病菌竞争黏附位点和营养物质抑制致病菌在肠上皮细胞上的黏附,从而维持肠道菌群平衡[ 16 ],对维护肠黏膜屏障功能及免受侵害具有重要意义。Schierack等[ 17 ]研究表明,IPEC-J2细胞能很好地反映猪消化道的感染和反应过程,是目前模拟猪体内试验的最佳体外模型之一。本文采用IPEC-J2细胞模型,研究嗜酸乳杆菌活菌体以及热灭活菌体对IPEC-J2细胞的黏附性,结果表明热灭活菌体对细胞的黏附能力要高于活菌体。这一结果与一些文献报道类似,如孙建芝等[ 18 ]研究发现,乳杆菌在热灭活状态下对Hela细胞的黏附能力高于活菌体,邢咏梅等[ 19 ]研究发现,德氏乳杆菌和肠球菌的灭活状态较活菌状态黏附性显著增高,这一结果为深入研究灭活状态益生菌对细胞的免疫调节作用奠定了基础。目前,对于热灭活菌体的黏附能力高于活菌体的机制还不明确,推测可能是益生菌在加热过程中经热胁迫作用激活了相关黏附素和黏附物质的高表达,从而使更多的热灭活菌体黏附到细胞上[ 18 ]。
致病菌黏附到肠上皮细胞后引起进一步的感染和侵袭。据报道,致病菌和宿主细胞的直接接触是致病菌表达毒力因子和入侵宿主细胞的必要条件[ 20 ]。致病菌在肠上皮细胞上的黏附和入侵会使致病菌大量繁殖,破坏肠道菌群平衡,同时引起细胞死亡,破坏肠黏膜屏障功能[ 21,22 ]。抑制致病菌在肠上皮细胞上的黏附可以有效缓解致病菌引起的肠道疾病。益生菌可以通过竞争、排阻以及替换机制,与致病菌竞争黏附位点和营养物质,阻止致病菌对肠上皮细胞的黏附和入侵,增强宿主屏障功能,预防肠道损伤。
益生菌可以通过竞争黏附位点和营养物质抑制致病菌在肠上皮细胞上的黏附,同时在代谢过程中产生一些有机酸或抑菌物质杀死致病菌[ 23 ]。本研究发现,活菌体和热灭活菌体都可以通过竞争、排阻以及替换方式抑制致病菌在肠上皮细胞上的黏附,这一结果与Ostad等[ 6 ]的研究类似,即从粪便中分离的乳杆菌的活菌体和热灭活菌体都可以抑制大肠杆菌和沙门氏菌对Caco-2细胞的黏附。其中,在排阻抑制情况下,细胞预先经嗜酸乳杆菌处理,形成一层微生物屏障,阻断了致病菌与细胞的进一步接触,因此具有一定的预防作用,排阻抑制率越高说明菌体的预防作用越好。热灭活菌体对大肠杆菌的排阻抑制效果高于活菌体,推测可能是因为热灭活菌体能更好地黏附到IPEC-J2细胞上,与大肠杆菌竞争黏附位点,从而减少大肠杆菌在细胞上的黏附,在这一过程中主要是通过竞争黏附位点来抑制大肠杆菌对细胞的黏附。研究发现,在竞争和替换过程中,活菌体的抑制效果好于热灭活菌体,这提示嗜酸乳杆菌活菌体在抑制大肠杆菌黏附的过程中不只是通过竞争黏附位点这一作用,还有可能会产生一些抑菌物质来抑制致病菌的黏附和入侵。研究报道,植物乳杆菌WS4174和LB279与大肠杆菌和产单核细胞李斯特菌(L. monocytogenes)共同培养时,代谢产生短链脂肪酸和细菌素,使病原菌的生长受到显著抑制[ 24 ]。
益生菌在代谢过程中会产生一些有机酸,如乙酸、丙酸和丁酸,它们可以降低动物肠道pH,有效抑制致病菌的生长。同时,益生菌还能产生一些抗菌肽、细菌素,对致病菌起杀菌作用。在研究嗜酸乳杆菌发酵上清抑制大肠杆菌生长的试验中发现,嗜酸乳杆菌发酵上清能抑制大肠杆菌的生长,而将发酵上清的pH调整到7.0时,其抑菌能力消失,同时将MRS培养基的pH调整到3.94时同样能抑制大肠杆菌的生长,但是其抑菌圈直径显著小于发酵上清的抑菌圈直径,因此初步推测嗜酸乳杆菌在发酵过程中产生的有机酸抑制了大肠杆菌的生长,同时可能还有细菌素类抑菌物质在起作用。
4 结 论① 嗜酸乳杆菌的活菌体和热灭活菌体都能很好地黏附在IPEC-J2细胞上,且热灭活菌体对细胞的黏附性高于活菌体。
② 嗜酸乳杆菌的活菌体和热灭活菌体都能很好地抑制大肠杆菌在IPEC-J2细胞上的黏附,且对细胞的处理方式不同,其抑制效果不同,其中热灭活菌体在预防过程中效果较好,而活菌体在竞争和替换过程中能更好地抑制大肠杆菌在细胞上的黏附。
③ 嗜酸乳杆菌发酵上清能抑制大肠杆菌的生长繁殖。
| [1] | NANDA KUMAR N S,BALAMURUGAN R,JAYAKANTHAN K,et al.Probiotic administration alters the gut flora and attenuates colitis in mice administered dextran sodium sulfate[J]. Journal of Gastroenterology and Hepatology,2008,23(12):1834-1839. ( 1) 1)
|
| [2] | FUKUDA S,TOH H,HASE K,et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature,2011,469(7331):543-547. ( 1) 1)
|
| [3] | JONES S E,VERSALOVIC J.Probiotic Lactobacillus reuteri biofilms produce antimicrobial and anti-inflammatory factors[J]. BMC Microbiology,2009,9(1):35. ( 1) 1)
|
| [4] | GIONCHETTI P,RIZZELLO F,HELWIG U,et al.Prophylaxis of pouchitis onset with probiotic therapy:a double-blind,placebo-controlled trial[J]. Gastroenterology,2003,124(5):1202-1209. ( 1) 1)
|
| [5] | 李孝辉,皮雄娥,许尧兴.热灭活嗜酸乳杆菌培养物在饲料工业中的应用[J]. 饲料与畜牧,2009(12):14-18. ( 1) 1)
|
| [6] | OSTAD S N,SALARIAN A A,GHAHRAMANI M H,et al.Live and heat-inactivated Lactobacilli from feces inhibit Salmonella typhi and Escherichia coli adherence to Caco-2 cells[J]. Folia Microbiologica,2009,54(2):157-160. ( 2) 2)
|
| [7] | LIN W H,YU B,LIN C K,et al.Immune effect of heat-killed multistrain of Lactobacillus acidophilus against Salmonella typhimurium invasion to mice[J]. Journal of Applied Microbiology,2007,102(1):22-31. ( 1) 1)
|
| [8] | LEBEER S,VANDERLEYDEN J,DE KEERSMAECKER S C.Genes and molecules of lactobacilli supporting probiotic action[J]. Microbiology and Molecular Biology Reviews,2008,72(4):728-764. ( 1) 1)
|
| [9] | SUN J,SHI Y H,LE G W,et al.Distinct immune response induced by peptidoglycan derived from Lactobacillus sp[J]. World Journal of Gastroenterology,2005,11(40):6330-6337. ( 1) 1)
|
| [10] | SMELT M J,DE HAAN B J,BRON P A,et al.The impact of Lactobacillus plantarum WCFS1 teichoic acid D-alanylation on the generation of effector and regulatory T-cells in healthy mice[J]. PLoS One,2013,8(4):e63099. ( 1) 1)
|
| [11] | LIU Y Y,FATHEREE N Y,MANGALAT N,et al.Human-derived probiotic Lactobacillus reuteri strains differentially reduce intestinal inflammation[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology,2010,299(5):G1087-G1096. ( 1) 1)
|
| [12] | CAMPANA R,FEDERICI S,CIANDRINI E,et al.Antagonistic activity of Lactobacillus acidophilus ATCC 4356 on the growth and adhesion/invasion characteristics of human Campylobacter jejuni[J]. Current microbiology,2012,64(4):371-378. ( 3) 3)
|
| [13] | BERNET M F,BRASSART D,NEESER J R,et al.Lactobacillus acidophilus LA 1 binds to cultured human intestinal cell lines and inhibits cell attachment and cell invasion by enterovirulent bacteria[J]. Gut,1994,35(4):483-489. ( 1) 1)
|
| [14] | MEDICI M,VINDEROLA C G,WEILL R,et al.Effect of fermented milk containing probiotic bacteria in the prevention of an enteroinvasive Escherichia coli infection in mice[J]. Journal of Dairy Research,2005,72(2):243-249. ( 1) 1)
|
| [15] | ISHIKAWA H,KUTSUKAKE E,FUKUI T,et al.Oral administration of heat-killed Lactobacillus plantarum strain b240 protected mice against Salmonella enterica serovar Typhimurium[J]. Bioscience, Biotechnology, and Biochemistry,2010,74(7):1338-1342. ( 1) 1)
|
| [16] | LIU C,ZHANG Z Y,DONG K,et al.Adhesion and immunomodulatory effects of Bifidobacterium lactis HN019 on intestinal epithelial cells INT-407[J]. World Journal of Gastroenterology,2010,16(18):2283-2290. ( 1) 1)
|
| [17] | SCHIERACK P,NORDHOFF M,POLLMANN M,et al.Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochemistry and Cell Biology,2006,125(3):293-305. ( 1) 1)
|
| [18] | 孙建芝,贾继辉,曲伟,等.多种乳酸杆菌黏附活性的研究[J]. 医学检验与临床,2006,17(5):38-41. ( 2) 2)
|
| [19] | 邢咏梅,贾继辉,王红艳,等.两种生物状态肠道益生菌的黏附和黏附拮抗效应的对比研究[J]. 中国微生态学杂志,2004,16(2):69-72. ( 1) 1)
|
| [20] | PARSOT C,SANSONETTI P.Invasion and the pathogenesis of Shigella infections[J]. Current Topics in Microbiology and Immunology,1996,209:25-42. ( 1) 1)
|
| [21] | KALISCHUK L D,INGLIS G D,BURET A G.Strain-dependent induction of epithelial cell oncosis by Campylobacter jejuni is correlated with invasion ability and is independent of cytolethal distending toxin[J]. Microbiology,2007,153(9):2952-2963. ( 1) 1)
|
| [22] | WINE E,GAREAU M G,JOHNSON-HENRY K,et al.Strain-specific probiotic (Lactobacillus helveticus) inhibition of Campylobacter jejuni invasion of human intestinal epithelial cells[J]. FEMS Microbiology Letters,2009,300(1):146-152. ( 1) 1)
|
| [23] | SEARLE L E J,BEST A,NUNEZ A,et al.A mixture containing galactooligosaccharide, produced by the enzymic activity of Bifidobacterium bifidum,reduces Salmonella enterica serovar Typhimurium infection in mice[J]. Journal of Medical Microbiology,2009,58(1):37-48. ( 1) 1)
|
| [24] | AGUILAR C,VANEGAS C,KLOTZ B.Antagonistic effect of Lactobacillus strains against Escherichia coli and Listeria monocytogenes in milk[J]. The Journal of Dairy Rrsearch,2010,78(2):136-143. ( 1) 1)
|




