2. 华中农业大学动物医学院, 武汉 430070;
3. 武汉轻工大学, 武汉 430070
2. College of Veterinary Medicine, Huazhong Agricultural University, Wuhan 430070, China;
3. Wuhan University of Light Industry, Wuhan 430070, China
哺乳动物的肝脏在解剖结构上和肠道一样同处于优先利用摄入营养物质的位置,在新陈代谢中起着至关重要的作用。汪江松等[ 1 ]研究认为,50%~70%消化道内的氨基酸进入门静脉循环,大多数氨基酸脱去氨基的主要方式是转氨基和脱氨基作用,进而形成尿素或合成蛋白质,其余部分则由肝静脉进入血液循环。而肝脏合成的蛋白质可能是肌肉和肠道氨基酸的重要来源[ 2 ]。Lapierre等[ 3 ]研究表明,牛门静脉释放的总氨基酸有34%左右在肝脏代谢,组氨酸、蛋氨酸、苯丙氨酸等必需氨基酸主要在肝脏内分解,赖氨酸、苏氨酸和支链氨基酸主要在肝外组织分解。另外,肠上皮细胞和肠道微生物分解氨基酸产生的氨既可以在肝脏合成尿素经肾脏排泄,也可以合成谷氨酰胺供外周组织利用。因此,肝脏是氨基酸等营养物质代谢最旺盛的器官,一直以来肝脏代谢异常的并发症脂肪肝和肝脏解毒等医学方面的研究[ 4,5 ]较多,而对于其营养物质代谢的研究却很少见报道。
肝脏不仅在生物合成、代谢和解毒方面有重要作用,而且,肝脏还是体内重要的血液存储器。研究表明,虽然肝脏只有机体体重的2.5%,但是它却存储着心脏输出血量的25%[ 6 ]。因此血液是肝脏代谢的基础通道,根据结构上的特征,肝脏是所有实质性器官中唯一一个由静脉和动脉双重供血的器官:流入肝脏的血液1/4来自肝动脉,它主要供给肝脏所需的氧气,是肝脏的营养血管;另外3/4来自门静脉(由胃、肠、脾、胰等脏器静脉汇集而成),它把来自消化道的各种营养物质和有害物质输入肝脏,经肝脏加工处理后,通过肝静脉到下腔静脉,从而进入全身循环,是肝脏的功能血管[ 7,8 ]。Huntington等[ 9 ]和赵胜军等[ 10 ]分别在牛和羊上对肝静脉血管插管技术进行了探索,且取得成功。但是与牛和羊相比,可能是由于仔猪抗应激能力较差,术后恢复能力较弱,血管较细,且动物的体内结构不同,肝静脉比较深,血管不易找到等等原因,使得对于仔猪肝静脉血管插管的安装至今很少见到报道。
另外,血插管技术使用的导管多数是聚氯乙烯材质,经过自己加工改装组成合适的插管,这种导管一方面比较柔软不易安装,另一方面组装接头部位易脱落,从而使得安装的导管可利用时间较短。本试验采用的是聚氨酯材质的成品导管包,它具有特质导管材料,穿入血管后导管变软,减少血管内膜损伤等特点,另外,因采用专业连接技术使其具有防脱落、防渗透及防感染的优点。本试验旨在仔猪上建立肝静脉-门静脉-肠系膜静脉-颈动脉血管插管系统,及检测新型导管包能否保持血管良好的疏通性,为仔猪肝脏营养物质的代谢研究提供技术支持。
1 材料与方法 1.1 试验动物选择健康、体重(20.0±1.1) kg的杜×长×大三元杂交去势公仔猪18头,在环境温度为21~25 ℃的代谢室内采用代谢笼(1.50 m×0.75 m×0.68 m)单栏饲养,栏内有独立的饮水器和给料器。每天08:00、16:00、24:00按时饲喂,待试猪适应5 d后进行手术,以减小手术过程中的应激。
1.2 肝静脉-门静脉-肠系膜静脉-颈动脉插管系统的安装 1.2.1 试验材料药品及耗材:主要有肥皂、络合碘、75%酒精棉、0.1%新洁尔灭溶液(苯扎溴铵溶液)、肝素-生理盐水溶液(200和100 IU/mL)、镇定剂(硫酸阿托品)、止血敏(酚磺乙胺)、5和10 mL注射器、抗生素、生理盐水、链霉素、异氟烷、戊巴比妥钠、消炎粉(灭菌结晶磺胺)、芦荟手套、破伤风抗霉素、无损伤缝合线(4-0,蓝黑色)、无损伤缝合线(6-0,蓝黑色)、油性记号笔、肝素帽、4号线、7号线、10号线、一次性口罩、头皮针等。
手术器械包:纱布、创布、刀片(圆头,24号)、巾钳(6把)、刀柄(4号,1把)、止血钳(8把)、平剪(1把)、线剪(1把)、毛箭(1把)、眼科剪(2把)、长镊子(1把)、平口镊子(2把)、小镊子(2把)、小剪刀(2把)、有齿镊(1把)、长持针器(2把)、短持针器(2把)、圆弯针(3个)、三棱针(3个)和拉钩(4把)、托盘、脸盆、水桶、绳子及麻绳、手术衣帽等。手术衣帽和整个手术间在手术前1 h用紫外线照射消毒。所有手术器械在术前采用120~125 ℃的高压蒸汽灭菌30 min,然后在烘箱中烘干备用。
插管的规格与预处理:肠系膜静脉、门静脉和肝静脉用内外径分别为1.67和2.41 mm的中央静脉导管,长度约为30 cm。颈动脉导管直径与门-肝静脉的一样,长度约为45 cm(MMCVCB,1-14-30,北京天地和协科技有限公司),使用前插管内注满肝素-生理盐水溶液(200 IU/mL)。
1.2.2 动-静脉插管的安装(图1)动物术前的处理:试猪手术前8 h注射抗生素(每只每次1 600 000 U青霉素+1 000 000 U链霉素),试猪手术前20 min按约0.4 mL/kg BW注射镇定剂8 mL,5 min后以0.1 mL/kg注射止血敏2 mL。
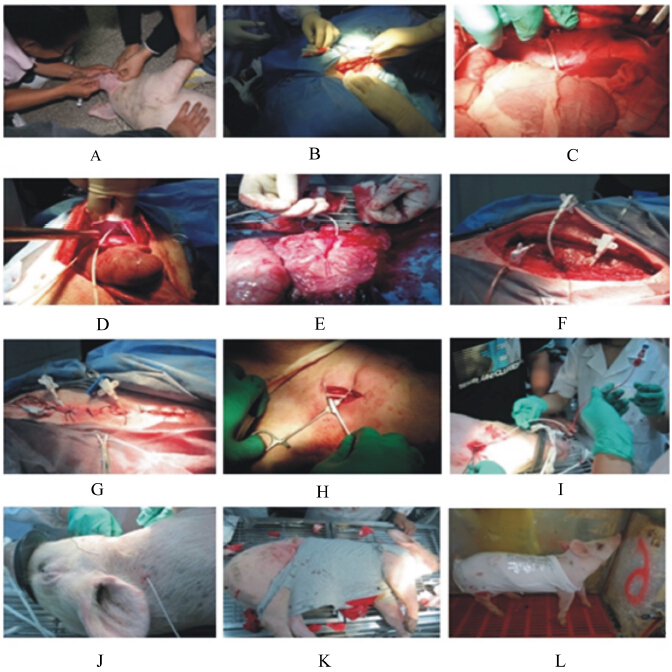 | 图1 动-静脉插管的安装 Fig.1 Installation of arterial-venous catheters A:诱导麻醉 induced anesthesia,B:开创 incision,C:门静脉插管安装 installation of portal venous catheter,D:肝静脉插管安装 installation of hepatic venous catheter,E:肠系膜静脉插管安装 installation of mesentery venous catheter,F:腹膜缝合 saturation of peritoneum,G:肌肉皮肤缝合 saturation of muscle and skin,H:颈动脉插管安装 installation of jugular arterial catheter,I:颈动脉插管安装 installation of jugular arterial catheter,J:颈动脉插管固定 fixation of jugular arterial catheter,K:穿衣固定 dressing fixation clothes,L:术后恢复 postoperative recovery。 |
诱导麻醉动物:通过耳静脉按2.5~3.5 mL/kg BW注射含戊巴比妥钠2%的生理盐水,以诱导仔猪麻醉。
保定动物:试猪左侧位卧于可调手术台,并将其调整至腹部稍向上倾,用麻绳保定四肢。
备皮:肥皂水润洗手术部位,刮毛,待毛刮净后用清水清洗术部,络合碘消毒,75%酒精脱碘,盖好创布。
呼吸麻醉动物:麻醉诱导成功后给仔猪安装上呼吸面罩,进一步采用异氟烷气体呼吸麻醉,在开始5~10 min内将麻醉剂控制阀的旋钮调至最大刻度5处,然后将旋钮置于3或2刻度处,以维持麻醉。过程中根据试猪的瞳孔扩张程度和呼吸深度来调节旋钮。
开创:手术切口位于左侧最后肋骨2 cm处,与肋骨平行切开,距腰椎横突2 cm。切开皮肤约15 cm,按肌纤维走向钝性剥离腹外斜肌、腹内斜肌、腹直肌,分离肌肉、腹膜。用肝脏拉钩提拉腹壁,增大手术空间,暴露术部。
安装插管:按照黄瑞林等[ 11 ]的方法分别在肠系膜静脉、肝静脉、门静脉和颈动脉安装插管。肝静脉插管的安装操作,用纱布和拉钩提起上腹壁,将肝脏往下压,充分暴露肝的膈面。在肝与膈肌结合顶端有一悬韧带,其下为肝静脉窦,是几个较大肝静脉在后腔静脉的出口处。剪断悬韧带,用医用6-0无损伤缝合线预做一荷包缝合。将导管逆肝静脉血流方向插入,然后把插管缝合在膈肌上。导管在整个手术过程中要尽量使其充满200 IU/mL的肝素-生理盐水溶液,末端安上肝素帽。
固定插管:尽量在保证血插管顺畅的前提下,将其固定在尽可能高的背部,严禁180°弯曲血管。每2根插管间距1 cm左右,注意给插管做标记,以方便分辨。在导管引出体表后,依次连续缝合关闭腹膜、结节缝合各层肌肉、外翻结节缝合皮肤。创口处涂抹消炎粉以防感染。
1.3 对氨基马尿酸(pAH)灌注及采样方法
1.3.1 pAH灌注方法
pAH灌注按照方正峰等[ 12 ]的方法进行。
1% pAH溶液的配制:称取5.00 g pAH,用生理盐水溶于500 mL容量瓶中,超声波溶解,定容至500 mL。然后调节pH为7.45,再通过0.45 μm滤膜过滤。现配现用。
pAH的灌注:正常采食第7天07:00开始灌注,灌注前禁食16 h,通过肠系膜静脉连续9 h灌注1% pAH溶液。
灌注方法如下:首先将注满1% pAH溶液的50 mL注射器安装在注射泵上,注射器针头连接约2 m长的硅胶管(内外径为0.6 mm×1.2 mm ),再将硅胶管通过注射头与回肠肠系膜插管针头连接。灌注开始5 min内,以3.820 mL/min的速度进行注射,然后则以0.788 mL/min的速度连续注射9 h。
1.3.2 采样方法待动物恢复正常采食后第5天开始采样。具体操作如下:
试猪在采样前1天晚上停喂饲料,采集采食前0.5 h和采食后0.5、1.5、3.0、5.0、7.5 h门静脉、肝静脉及颈动脉血液。每次采集用10 mL注射器缓慢均匀地从颈动脉、门静脉、肝静脉插管抽取血液,前2 mL丢弃,然后换新的注射器抽取10 mL,装入预先加了数滴肝素-生理盐水溶液(200 IU/mL)的离心管中,再将离心管置于冰瓶中,送实验室离心。血液于3 500×g低温(4 ℃)冷冻离心15 min,分别移取动静脉血液上清液分装在1.5 mL离心管中,-80 ℃冰箱保存,直到检测。
1.4 pAH浓度的测定按照李铁军等[ 13 ]的方法测定。简要操作如下:分别移取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1.0 mL pAH标准液,按顺序分别加入2 mL的亚硝酸钠(NaNO2)溶液、氨基磺酸铵溶液和N-1萘乙二胺盐酸盐溶液,用双蒸水定容至50 mL,其pAH浓度则分别为0、0.2、0.4、0.6、0.8、1.0、1.2、 1.4、1.6、1.8 和2.0 mg/L,然后用722E型分光光度计于波长550 nm处测吸光度,得出标准浓度方程。
分别取动、静脉血浆样品0.1 mL,置于5 mL容量瓶中,按顺序依次加入0.2 mL的NaNO2 溶液、氨基磺酸铵溶液和N-1萘乙二胺盐酸盐溶液,用双蒸水定容至5 mL,摇匀后室温下静置30 min,然后用722E型分光光度计于波长550 nm处测定吸光度,根据标准浓度方程,计算样品的pAH浓度。
1.5 门静脉和肝静脉血流速度的测定门静脉和肝静脉血流速度的测定参照Huntington等[ 9 ]的方法。公式如下:
PVPF=Ci×IR/[(pAHpv-pAHa)·BW];
HVPF=Ci×IR/[(pAHhv-pAHa)·BW]。
式中:PVPF为门静脉血液流速[L/(kg·h)];Ci为pAH灌注液浓度(g/L);IR为pAH灌注流速(L/h);pAHpv为门静脉血液中pAH浓度(g/L);pAHa为颈动脉血液中pAH浓度(g/L);BW为灌注时试猪的体重(kg);HVPF为肝静脉血液流速[L/(kg·h)];pAHhv为门静脉血液中pAH浓度(g/L)。
1.6 数据分析用Excel 2007对pAH的吸光度与浓度的数据进行线性回归分析,检验回归方程统计的显著性,并根据R2值判断标准曲线的拟合程度;用SAS 6.12软件单因素方差分析不同时间点血流速度变化。
2 结 果 2.1 手术结果整个试验18头安装血管导管的仔猪,有12头可成功应用于营养物质代谢的研究,且安装在仔猪身上的导管疏通性良好的时间平均为16 d,最长可达20 d。
2.2 血流速度的测定结果 2.2.1 pAH测定的标准曲线根据吸光度的测定结果,以pAH的浓度(mg/L)为纵坐标,吸光度(OD550 nm)为横坐标,绘制标准曲线(图2),每个浓度测2次D值,取其平均值绘制曲线。根据每个待测样品的值和标准曲线方程C=3.493 922D-2.082 96(R2=0.999 897,P<0.001),计算待测样品pAH的浓度。
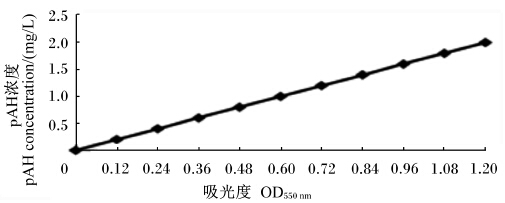 | 图2 pAH浓度与吸光度的回归曲线
Fig.2 The regression curve of pAH concentration and absorbance |
2.2.2 门静脉和肝静脉血流速度的变化
由图3和图4所示,肝静脉和门静脉流速在食后都开始上升,且食后3.0 h血流速度达到最高,门静脉流速最高为2.80 L/(kg·h)和981.40 mL/min,比采食前高了53.01%;肝静脉流速达到4.04 L/(kg·h)和1 414.65 mL/min,比采食前提高了44.29%。且肝静脉和门静脉血流速度的变化趋势几乎一致,肝静脉的血流速度明显高于门静脉。
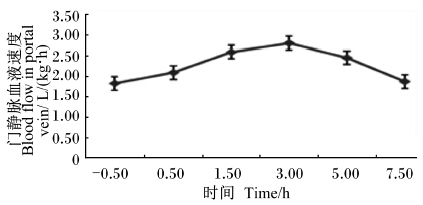 | 图3 采食前后门静脉的血流速度变化 Fig.3 The variation of blood flow in portal vein before and after feeding |
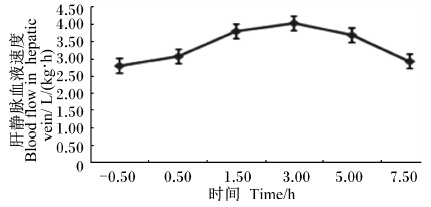 | 图4 采食前后肝静脉的血流速度变化 Fig.4 The variation of blood flow in hepatic vein before and after feeding |
血流量是定量营养物质吸收测定的关键因素,对于肝脏内血流速度的研究很早就有报道,Katz等[ 14 ]提出用燃料稀释剂技术通过体内插管测定肝脏的血流速度,Wanninger等[ 15 ]对检测肝脏血流速度的各种方法进行了评估,同时认可了此方法的可行性。近年来大量学者通过在动物体安装肠系膜静脉-门静脉-颈动脉血管导管系统,研究了营养物质在肠道内的代谢规律[ 16,17 ]。为了研究仔猪在采食饲粮后门静脉和肝静脉血流速度变化规律,我们选择在采食前0.5 h和采食后0.5、1.5、3.0、5.0、7.5 h采集血样,从而测定此时的血流速度。Anderson[ 18 ]提出用pAH染料稀释剂的方法检测猪门静脉的血流速度,Yen等[ 19 ]证实了选取不为动物所吸收的pAH作为指示剂检测血流速度的可靠性,至今应用较广。本试验参照文献[ 11, 12, 13 ]提供的研究方法进行,结果得出,门静脉和肝静脉的血流速度都在采食后开始上升,上升趋势与Reverter等[ 20 ]结果相一致。从单个时间点的门静脉血流速度值来看,当表示为L/(kg·h)时与方正峰等[ 12 ]的研究接近;当表示为mL/min时,门静脉的血流速度最高达981.40 mL/min,约是Yen等[ 19 ]研究体重54 kg试猪的1/2,方正峰等[ 12 ]研究体重9.71 kg试猪的2倍,推测此原因可能是由于试猪体重不同所致。从采食后3.0 h平均值来看,与Hooda等[ 21 ]和Yen等[ 19 ]研究相一致,门静脉血流速度为41.60 mL/(kg·min)和873.54 mL/min,虽然与Anderson[ 18 ]报道的体重27 kg试猪门静脉血流速度为40~60 mL/(kg·min)相比稍偏低,但是差异不显著。
由于肝脏对氧气供应不足和消耗过量极敏感,大量学者研究了二异丙酚对肝脏血流速度和肝脏氧气平衡的影响[ 22,23 ],结果都说明肝脏内的血流速度约等于门静脉加肝动脉血流之和,而作为血液流出肝脏的唯一血管-肝静脉,其流出量与肝脏内血流速度应大约相等,即肝静脉流出肝脏的血流速度等于肝动脉与门静脉血流速度之和,本试验结果与此相一致。本试验结果显示:肝静脉的血流速度与门静脉血流速度之比约为1.0 ∶ 0.7,验证了经门静脉流入肝脏的血流量占肝脏总血流量3/4的试验结果,也与Huntington等[ 9 ]研究的牛肝静脉-门静脉血流速度之比和Meierhenrich等[ 23 ]研究的人肝脏-门静脉血流速度大致相同。有研究表明肝脏内血流速度受血压、姿势改变、二氧化碳水平等的影响[ 24,25 ],而Fang等[ 16 ]和Reverter等[ 20 ]研究表明,饲粮对试猪门静脉的血流速度差异不显著。
Rerat等[ 26 ]提出门静脉和颈动脉血管插管技术及血流探针的同时安置是研究营养物质动态吸收的一个极好的模型,这个模型的成功应用必须要有复杂的外科手术、术后精心的护理、血管插管的维持及准确的血流量的测定。为了调整手术的性能、材料的可利用性及模型的应用,各个试验也对手术过程进行了改进[ 27,28,29 ]。本试验在手术过程中同样进行了改进:1)导管材料上由之前的聚氯乙烯改为聚氨酯,聚氯乙烯硬度大对血管内膜损伤较严重,感染血管组织,导致血管脱落机率高,可利用时间短。聚氨酯质轻、耐磨损不滑、柔软度好、抗拉强度大、对动物刺激小,可利用时间长。同时将需要组装的导管改为成品导管包,防止组装的导管不牢固对术后导管流通性产生影响,但是费用昂贵。2)其次将导管由单口改为多口,即在单腔口相距1~2 cm处,左右相对剪开2个小孔,防止导管与血管腔错位后,血管不流通。3)在导管外易弯曲的地方加3~5 cm的聚丙烯管固定,从而增强血管流通的可能性。4)为了提高手术成功率,本试验对血管安装过程中将导管逆肝静脉血流方向插入,然后把插管缝合在膈肌上,以固定导管。且在手术完成的缝合时,对腹膜进行了单独缝合。
影响手术成功的因素,顺利安装是很重要,同样术后护理也同样重要。同所有学者进行外科手术一样,本试验在术后护理的过程中同样对温度和术后试猪体质较差等问题进行了关注,比如术后连续注射抗生素(每只每次1 600 000 U青霉素+1 000 000 U链霉素)3 d,每天注射2次,以防试猪感染;术后即刻通过门静脉血插管注射5%葡萄糖给试猪供给营养,如果猪状态不是太好,连续输液2天;术后使用保温灯和空调将温度保持在30 ℃;尽可能饲喂些适口性好、营养价值高的食物,保证饮水充足;每天给试猪测量体温,体温是影响试猪采食的一个重要的因素。及时清理食槽,防止猪吃到霉变的饲料;对手术间进行灭蚊蝇,及时倒垃圾。另外,为了避免试猪因伤口瘙痒磨蹭血管导管,时刻注意伤口的愈合情况,发现红肿和试猪磨蹭现象往伤口上洒消炎粉。
整个试验使用了18头猪,其中2头试猪术后导管脱落,1头是衣服宽松被试猪蹭掉,门静脉、肝静脉和肠系膜静脉处的导管卡在了代谢笼地板上,1头由于颈动脉固定不稳被仔猪咬掉而脱落;手术过程中1头由于在安装肝静脉导管时重复次数多,消耗时间过长,大量失血而死亡;肝静脉和颈动脉血管导管不流通,注射约5 mL肝素-生理盐水溶液后再次流通的试猪有3头,说明管内是血块,可以正常利用;血管导管时而堵塞,采血时由于血管堵塞采不出血的试猪有2头,堵塞原因是1头门静脉导管在皮肤伤口处打折,1头颈动脉在腹腔内弯曲;1头试猪术后出现全身痉挛,侧身转圈,不能直立,也不能正常采食,人工强饲后未得到改善,原因是颈动脉安装过程可能碰撞了颈部的迷走神经,交感神经功能亢进,从而影响了仔猪正常活动。
综合以上问题我们建议:术后给试猪穿好衣服,且一定要宽松适当,以防被试猪蹭掉;为了保证导管的疏通性,保证每天冲洗血插管2次(肝素-生理盐水溶液100 IU/mL),对于个别容易堵塞的血管导管可选择冲洗3次,肝素帽2~4 d更换一次;尽量选择地板缝隙较小的代谢笼,避免导管卡在缝隙的可能性;手术导管安装过程中及安装完成时一定要细心,对每一步都要做到尽可能保证良好;另外,手术后保证每天测量仔猪体温,发现异常及时治疗。最后,18头猪试猪可成功用于肝脏代谢研究的有12头,其中仔猪血管导管的疏通性一般。
4 结 论① 本试验安装的导管系统保证血管疏通性良好的平均时间为16 d。
② 采食后门静脉和肝静脉的血流速度上升,门静脉流速最高为2.80 L/(kg·h)和981.40 mL/min;肝静脉流速达到4.04 L/(kg·h)和1 414.65 mL/min。
③ 18头试猪中的12头可成功用于肝脏营养物质代谢研究,肝静脉和门静脉的血流变化趋势相似。
| [1] | 汪江松,邹思湘,张玉静.现在动物生物化学[M]. 3版.北京:中国农业科技出版社,1999:411-434. ( 1) 1)
|
| [2] | ELWYN D H.The role of the liver in regulation amino acid and protein metabolism[M]//MUNRO H N.Mammalian protein metabolism.New York:Academic Press,1970:523-557. ( 1) 1)
|
| [3] | LAPIERRE H,BERNIER J F,DUBREUIL P,et al.The effect of feed intake level on splanchnic metabolism in growing beef steers[J]. The Journal of Animal Science,2000,78(4):1084-1099. ( 1) 1)
|
| [4] | SCHAFFLER A,SCHÖLMERICH J,BÜCHLER C.Mechanisms of disease:adipocytokines and visceral adipose tissue-emerging role in nonalcoholic fatty liver disease[J]. Nature Clinical Practice Gastroenterology and Hepatology,2005,2(6):273-280 ( 1) 1)
|
| [5] | DROBNÁ Z,WALTON F S,PAUL D S,et al.Metabolism of arsenic in human liver:the role of membrane transporters[J]. Archives of Toxicology,2010,84(1):3-16. ( 1) 1)
|
| [6] | LAUTT W W,GREENWAY C V.Conceptual review of the hepatic vascular bed[J]. Hepatology,1987,7(5):952-963. ( 1) 1)
|
| [7] | RAPPAPORT A M.Hepatic blood flow:morphologic aspects and physiologic regulation[J]. International Review of Physiology,1980,21:1-63. ( 1) 1)
|
| [8] | VOLLMAR B,MENGER M D.The hepatic microcirculation:mechanistic contributions and therapeutic targets in liver injury and repair[J]. Physiological Reviews,2009,89(4):1269-1339. ( 1) 1)
|
| [9] | HUNTINGTON G B,REYNOLDS C K,STROUD B H.Techniques for measuring blood flow in splanchnic tissues of cattle[J]. Journal of Dairy Science,1989,72(6):1583-1595. ( 3) 3)
|
| [10] | 赵胜军,王林枫,王玲,等.羊肝、门、肠系膜静脉和颈动脉血管瘘管手术安装及体会[J]. 饲料工业,2010(增刊2):106-108. ( 1) 1)
|
| [11] | 黄瑞林,印遇龙,李铁军,等.用于营养物质代谢的动静脉插管技术Ⅰ.插管及血流量计安装手术[J]. 中国兽医杂志,2003,39(6):19-20. ( 2) 2)
|
| [12] | 方正峰,彭健,黄飞若,等.肠道营养物质代谢的仔猪动-静脉插管技术的建立[J]. 中国兽医学报,2010,30(8):88-92. ( 4) 4)
|
| [13] | 李铁军,印遇龙,黄瑞林,等.用于营养物质代谢的猪动静脉插管技术的研究.Ⅱ.门静脉营养物质净流量测定方法[J]. 中国畜牧杂志,2003,39(2):28-29. ( 2) 2)
|
| [14] | KATZ M L,BERGMANN E N.Simultaneous measurements of hepatic and portal venous blood flow in the sheep and dog[J]. American Journal of Physiology:Heart and Circulatory Physiology,1969,216(4):946-952. ( 1) 1)
|
| [15] | WANNINGER J,LIEBISCH G,SCHMITZ G,et al.Lipidomic analysis of the liver identifies changes of major and minor lipid species in adiponectin deficient mice[J]. Experimental and Molecular Pathology,2013,94(2):412-417. ( 1) 1)
|
| [16] | FANG Z F,LUO J,QI Z L,et al.Effects of 2-hydroxy-4-methylthiobutyrate on portal plasma flow and net portal appearance of amino acids in piglets[J]. Amino Acids,2009,36(3):501-509. ( 2) 2)
|
| [17] | YEN J T,VAREL V H,NEIENABER J A.Metabolic and microbial responses in western crossbred and in Meishan growing pigs fed a high-fiber diet[J]. The Journal of Animal Science,2004,82(6):1740-1755. ( 1) 1)
|
| [18] | ANDERSON D M.The measurement of portal and hepatic blood flow in pigs[J]. The Proceeding of Nutrition Society, 1974,33:30A. ( 2) 2)
|
| [19] | YEN J T,KILLEFER J.A method for chronically quantifying net absorption of nutrients and gut metabolites into hepatic portal vein in conscious swine[J]. The Journal of Animal Science,1987,64(3):923-934. ( 3) 3)
|
| [20] | REVERTER M,LUNDH T,GONDA H L,et al.Portal net appearance of amino acids in growing pigs fed a barley-based diet with inclusion of three different forage meals[J]. British Journal of Nutrition,2000,84(4):483-494. ( 2) 2)
|
| [21] | HOODA S,MATTE J J,WILKINSON C W,et al.Technical note:an improved surgical model for the long-term studies of kinetics and quantification of nutrient absorption in swine [J]. The Journal of Animal Science,2009,87(6):2013-2019. ( 1) 1)
|
| [22] | DOURSOUT M F,JOSEPH P M,LIANG Y Y,et al.Role of propofol and its solvent,intralipid,in nitric oxide-induced peripheral vasodilatation in dogs[J]. British Journal of Anaesthesia,2002,89(3):492-498. ( 1) 1)
|
| [23] | MEIERHENRICH R,GAUSS A,MVHLING B,et al.The effect of propofol and desflurane anaesthesia on human hepatic blood flow:a pilot study[J]. Anaesthesia,2010,65(11):1085-1093. ( 2) 2)
|
| [24] | EIPEL C,ABSHAGEN K,VOLLMAR B.Regulation of hepatic blood flow:the hepatic arterial buffer response revisited[J]. World Journal of Gastroenterol,2010,16(48):6046-6057. ( 1) 1)
|
| [25] | GELMAN S.General anesthesia and hepatic circulation[J]. Canadian Journal of Physiology and Pharmacology,1987,65(8):1762-1779. ( 1) 1)
|
| [26] | RERAT A,VAUGELADE P,VILLIERS P.A new method for measuring the absorption of nutrients in the pig:critical examination[M]//Current concepts of digestion and absorption in pigs.Scotland: Reading,England,and Hannah Research Institute,2000:177-216. ( 1) 1)
|
| [27] | BAJJALIEH N L,JENSEN A H,FRANK G R,et al.A technique for monitoring nutrient absorption in the conscious unrestrained pig[J]. Journal of Animal Science,1981,52(1):101-107 ( 1) 1)
|
| [28] | ZHU T,PANG Q Y,MCCLUSKEY S A,et al.Effect of propofol on hepatic blood flow and oxygen balance in rabbits[J]. Canadian Journal of Anesthesia,2008,55(6):364-370. ( 1) 1)
|
| [29] | TEN HAVE G A,BOST M C,SUYK-WIERTS J C,et al.Simultaneous measurement of metabolic flux in portally-drained viscera,liver,spleen,kidney and hindquarter in the conscious pig[J]. Laboratory Animals,1996,30(4):347-358. ( 1) 1)
|




