2. 宁波大学海洋学院, 鱼类营养研究室, 宁波 315211
2. Laboratory of Fish Nutrition, School of Marine Sciences, Ningbo University, Ningbo 315211, China
黄颡鱼(Pelteoobagrus fulvidraco)俗称嘎牙子、黄姑、黄腊丁、黄鳍鱼等,属鲶形目(Siluriformes) 科(Bagridae)黄颡鱼属(Pelteobagrus),是广泛分布于长江、黄河、珠江等流域的小型杂食性经济淡水鱼类。该鱼肉质细嫩、少细刺、味道鲜美、无鳞片,且营养丰富,药用价值高,因而成为备受人们喜爱的优质食用鱼[1]。随着淡水渔业的不断发展以及黄颡鱼市场需求量的日益增加,有关提高黄颡鱼整体养殖质量的方法成为研究的热点。消化酶主要是由消化腺和消化系统分泌的反映鱼类消化生理机能的重要酶类,大致可分蛋白酶类、淀粉酶类及脂肪酶类等,消化酶活性的高低决定着鱼类对营养物质的消化能力。研究特殊功能饲料添加剂对黄颡鱼消化酶活性的影响,对研究鱼类配合饲料及提高鱼类品质具有重要的指导意义。
褐藻糖胶(fucoidan)又名褐藻多糖硫酸酯、岩藻聚糖、岩藻聚糖硫酸酯等,它是以小滴状存在于褐藻类海藻细胞间组织中或黏液基质中,并能从叶片表面分泌出来的一种水溶性杂多糖,主要成分是L-岩藻糖-4-硫酸酯,由于其分子链末端存在天然硫酸基,使得褐藻糖胶表现出广泛而特殊的生理活性[2]。研究表明,褐藻糖胶具有广泛的生物活性,如抗肿瘤、抗凝血、抗病毒、降血脂、调节免疫系统、抗氧化等[3,4]。褐藻糖胶还可促进肠胃蠕动,降低甘油三酯、胆固醇含量,加速肠道内多余胆固醇及有害物质尤其是重金属的排出,且对肝脏无毒害作用[5,6]。关于褐藻糖胶对鱼类生长性能和消化酶活性的影响尚未见报道,本试验拟研究褐藻糖胶对黄颡鱼幼鱼生长性能和消化酶活性的影响,以期完善和丰富黄颡鱼养殖的营养学资料,为配制优质的人工配合饲料提供理论依据。
1 材料与方法 1.1 试验材料分别采用商品褐藻糖胶和自提褐藻糖胶进行试验。商品褐藻糖胶由市场上购得,为陕西慈緣生物技术有限公司产品,自提褐藻糖胶为本实验室自提。
自提褐藻糖胶的提取步骤:铜藻样品于2012年11月采集于浙江南麂岛海域。新鲜藻体采集冲洗晾干后于-20 ℃冻存。提取前取出,解冻并用摇摆式小型粉碎机粉碎。主要采用水提法提取褐藻糖胶,并用乙醇重沉淀法进行初步纯化,具体操作步骤见图1。提取物中含有其他蛋白质、矿物质及少量色素等杂质,这些物质对鱼体不产生影响,因此以提取物中总糖含量作为褐藻糖胶的有效浓度。采用苯酚-硫酸法[7]检测初步纯化的褐藻糖胶总糖含量,采用浊度法[8]测定硫酸根含量。褐藻糖胶样品中水分及粗灰分含量的测定方法参照AOAC(1995)[9]的方法,即水分含量采用105 ℃常压干燥法测定,粗灰分含量采用550 ℃高温炉灼烧法测定。样品中粗蛋白质含量测定采用考马斯亮蓝比色法[10],葡萄糖醛酸含量测定采用硫酸-咔唑法[11]。
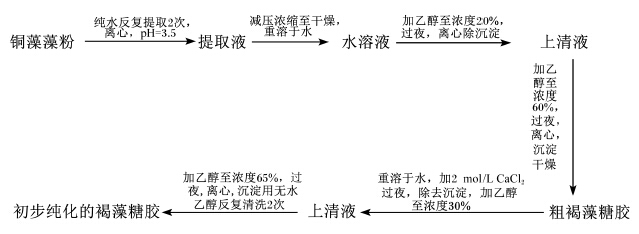 | 图1 褐藻糖胶的提取、分离和初步纯化示意图
Fig.1 The diagrammatic sketch of fucoidan’s extraction, separation and purification |
1.2 试验饲料
设定饲料中褐藻糖胶的有效浓度分别为0.05%、0.10%、0.20%,以纤维素作为填充剂,添加自提褐藻糖胶的3个组分别命名为X1、X2、X3组,添加商品褐藻糖胶的3个组分别命名为Y1、Y2、Y3组,并设不添加褐藻糖胶的对照组。试验饲料组成及营养水平见表1。饲料原料粉碎后过60目筛,按照配方要求准确称量,混匀。微量成分采取逐级扩大法预混合,再与大宗原料混合均匀,液体原料加入后过60目筛,使其混合均匀。混均后,加入28%~30%的水,再次混匀后用双螺杆制粒机挤压成粒径分别为3和4 mm的2种颗粒饲料,制粒后于90 ℃烘箱中熟化0.5 h,干燥后于-20 ℃保存备用。饲料成分分析参照AOAC(1995)[9]的方法,即水分含量采用105 ℃常压干燥法测定,粗蛋白质含量采用凯氏定氮法测定,粗灰分含量采用550 ℃高温灼烧法测定,粗脂肪含量采用索氏抽提法测定。
| 表1 商品褐藻糖胶及自提褐藻糖胶的基本组成 Table 1 Basal composition of commercial fucoidan and extractive fucoidan % |
| 表2 试验饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of experimental diets (air-dry basis) % |
试验用黄颡鱼幼鱼购自浙江嘉兴一星公司养殖基地,在试验条件下饲养2周后开始试验。试验前,禁食24 h后取健康、体重相近的黄颡鱼幼鱼进行分组。将420尾平均体重为(40.8±0.60) g的黄颡鱼幼鱼随机分为7组,每组3个重复,每个重复20尾,以重复为单位饲养于500 L圆柱形蓝色塑料桶中。试验期为12周。试验用水为经过曝气处理的自来水,整个养殖过程中连续充气(1 L/min),溶氧浓度保持或接近饱和。每2周测量1次体重,每天投喂2次,日投喂量为其体重的6%~8%,投喂时间为07:00、17:00,投喂后1 h观察其摄食情况,根据鱼的进食情况调整投喂量。每天除污1次,前2周隔天换水1次,之后视水质情况每天换水40%~60%。试验期间,水温为26~31 ℃,pH 7.5~7.8,氨氮浓度不高于0.05 mg/L,溶氧浓度不低于6 mg/L。
1.4 样品采集与指标测定 1.4.1 生长性能指标试验结束后,禁食12 h,测量并记录每桶试验鱼的数量和总重,按下列公式计算生长性能指标:
增重率(weight gain rate,WGR,%)=100×(终末体重-初始体重)/初始体重; 特定生长率(specific growth rate,SGR,%/d)=100×(ln终末体重-ln初始体重)/饲养天数; 饲料系数(feed conversion ratio,FCR)=摄食量/(终末体重-初始体重); 蛋白质效率(protein efficiency rate,PER,%)=100×(终末体重-初始体重)/(摄食量×饲料蛋白质含量)。 1.4.2 消化酶活性试验结束后次日08:00进行取样。每桶随机取3尾鱼,在冰上解剖,取其胃和肠道并剔除脂肪,用预冷的蒸馏水冲洗,滤纸吸干后称重。以重量(g) : 体积(mL)=1 : 9的比例加入预冷的生理盐水,冰浴条件下玻璃匀浆器机械匀浆,2 500 r/min离心10 min,吸取上清液于-20 ℃冻存,使用前于4 ℃解冻。胃中淀粉酶、脂肪酶、胃蛋白酶及肠道中淀粉酶、脂肪酶活性的测定采用南京建成生物工程研究所生产的试剂盒进行测定。淀粉酶活性单位定义:每毫克组织蛋白质在37 ℃条件下与底物作用30 min,水解10 mg淀粉为1个酶活性单位;脂肪酶活性单位定义:在37 ℃条件下,每毫克组织蛋白质在反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位;胃蛋白酶活性单位定义:每毫克组织蛋白质37 ℃条件下每分钟分解蛋白质生成1 μg氨基酸为1个酶活性单位。
1.5 数据处理与分析试验数据用平均值±标准误(mean±SE)表示,采用SPSS 16.0统计软件中的ANOVA过程进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较,P<0.05为差异显著。
2 结果与分析 2.1 褐藻糖胶对黄颡鱼幼鱼生长性能的影响由表3可知,黄颡鱼幼鱼的终末体重、WGR、SGR均以X2组为最高,显著高于对照组(P<0.05),X1、X3、Y1、Y2、Y3组黄颡鱼幼鱼的终末体重、WGR、SGR与对照组相比差异不显著(P>0.05)。各组黄颡鱼幼鱼的FCR和PER均没有显著差异(P>0.05)。
| 表3 褐藻糖胶对黄颡鱼幼鱼生长性能的影响 Table 3 Effects of fucoidan on growth performance of juvenile yellow catfish (n=3) |
由表4可知,无论是添加商品褐藻糖胶还是自提褐藻糖胶,亦或是改变其有效浓度,对黄颡鱼幼鱼胃中淀粉酶和胃蛋白酶以及肠道中淀粉酶活性的影响均不显著(P>0.05)。添加2种褐藻糖胶后黄颡鱼幼鱼胃和肠道中脂肪酶活性均有不同程度的升高,其中X2、Y1、Y2、Y3组胃中及X1、X2、X3、Y1组肠道中脂肪酶活性较对照组显著升高(P<0.05),但同一种褐藻糖胶的不同有效浓度对胃和肠道中脂肪酶活性的影响不显著(P>0.05)。添加自提褐藻糖胶时,有效浓度为0.10%时胃中脂肪酶活性最高,有效浓度为0.20%时肠道中脂 肪酶活性最高。添加商品褐藻糖胶时,胃中脂肪 酶活性随有效浓度的增加而有所降低,肠道中脂肪酶活性则随有效浓度的增加而有所升高。
| 表4 褐藻糖胶对黄颡鱼幼鱼消化酶活性的影响 Table 4 Effects of fucoidan on digestive enzyme activities of juvenile yellow catfish (n=3) U/mg prot |
本试验结果发现,褐藻糖胶对黄颡鱼幼鱼胃和肠道中脂肪酶活性具有提高作用。脂蛋白脂酶(lipoprteinlipase,LPL)是一种分解甘油三酯和磷脂的脂肪酶,激素敏感性脂肪酶(hormone-sensitive triglayceride lipase,HSL)是一种能水解甘油三酯、甘油二酯、甘油一酯和胆甾烯基酯的中性脂肪酶。Park等[12]和Yokota等[13]的研究均发现褐藻糖胶可通过提高LPL和HSL的基因表达来增加LPL和HSL的合成,从而提高LPL和HSL的活性。邢燕红[14]研究发现褐藻糖胶可显著提高脂血症大鼠血清和肝脏中LPL的活性。吴清和等[15]研究发现褐藻糖胶可能通过增强LPL的活性来降低血清甘油三酯的含量。同时,作为功能性多糖,褐藻糖胶是一种天然的双歧因子,对人体和动物消化道菌群结构有一定的影响[16],能通过促进双歧杆菌的增殖来维持肠道菌群的平衡[17]。研究发现,摄食褐藻糖胶后猪肠道菌群结构得到改善,乳酸杆菌数量有所增加[18]。强俊等[19]就低聚木糖对奥尼罗非鱼(Oreochromis niloticus×O. aureus)和王艳[20]就果寡糖对银鲫(Carassius auratus)消化酶活性的影响所进行的研究结果表明功能性多糖对鱼体消化酶活性的影响具有相似的规律。因此,褐藻糖胶可能主要通过以下2种途径来影响黄颡鱼幼鱼的脂肪酶活性:1)通过增加LPL、HSL等脂肪酶的基因表达来提高其活性。2)通过调整消化道内菌群结构和数量来影响脂肪酶活性。
脂肪是鱼类最佳的能量来源,用于鱼体增重和分解供能的脂肪总利用率达90%以上[21]。消化酶活性大小可以反映机体的基本消化生理特征,提高鱼体的消化酶活性可促进机体对营养物质的吸收利用率,在一定程度上可促进鱼体的生长。褐藻糖胶具有降血脂、降胆固醇等生物活性[22,23,24],它主要是通过抑制外源性脂质吸收、促进内源性脂质代谢(激活脂代谢酶、促进低密度脂蛋白受体mRNA表达等)和增加胆汁酸排泄这3个方面来调节脂质代谢(降低甘油三酯、总胆固醇、低密度脂蛋白胆固醇含量并升高高密度脂蛋白胆固醇含量等)[14]。本试验发现,添加有效浓度为0.10%的自提褐藻糖胶可显著促进黄颡鱼幼鱼的生长,其他有效浓度的自提褐藻糖胶并没有对黄颡鱼幼鱼的生长产生显著影响。此外,添加有效浓度为0.05%~0.20%的商品褐藻糖胶均没有对黄颡鱼幼鱼的生长产生显著影响。这可能是由于褐藻糖胶的添加可通过提高脂肪酶活性来提高鱼体对脂肪的吸收利用率,促进机体的生长,但褐藻糖胶对脂肪的消化、吸收与利用主要有上述3种方式,在促进吸收利用的同时也加速了脂肪的代谢,这3种作用的强弱可能与有效浓度有关。有关其详细作用机制有待进一步研究。
褐藻糖胶并非单一结构的化合物,而是具有不同化学组分的一族化合物,其还含有少量半乳糖、木糖、阿拉伯糖、葡萄糖、糖醛酸等糖类,同时还含有蛋白质及钠、钾、钙等金属离子[25,26]。褐藻糖胶独特的生物活性主要是由于组成成分高度的硫酸酯化,此外,褐藻糖胶的多糖结构、相对分子质量、多糖外的其他成分组成对其生物活性也有一定的影响[27,28,29]。本研究发现,自提褐藻糖胶在一定有效浓度(0.10%)下可显著促进黄颡鱼幼鱼的生长,而商品褐藻糖胶在各有效浓度(0.05%、0.10%、0.20%)下对黄颡鱼幼鱼的生长均不存在显著影响;自提褐藻糖胶和商品褐藻糖胶的添加均提高了黄颡鱼幼鱼肠道中脂肪酶的活性,但二者对肠道中脂肪酶活性的影响程度不同,自提褐藻糖胶在0.05%~0.20%有效浓度内均可显著提高黄颡鱼幼鱼肠道中脂肪酶活性,而商品褐藻糖胶尽管在0.05%和0.10%有效浓度时肠道脂肪酶活性有所提高,但与对照组相比差异不显著。同时,二者对黄颡鱼胃中脂肪酶活性的影响程度也存在差异。对比2种褐藻糖胶可知,自提褐藻糖胶对肠道中脂肪酶活性的提高作用优于商品褐藻糖胶,而商品褐藻糖胶对胃中脂肪酶活性的提高作用优于自提褐藻糖胶。对2种褐藻糖胶中粗蛋白质、葡萄糖醛酸及硫酸根含量的测定发现,自提褐藻糖胶与商品褐藻糖胶在组成上存在差异,因此二者对黄颡鱼幼鱼生长性能和脂肪酶活性影响存在差异的原因可能是由于自提褐藻糖胶与商品褐藻糖胶在分子大小、结构及组成之间存在差异。有关褐藻糖胶对鱼类生长性能和消化酶活性影响的具体作用机制有待深入研究。
4 结 论① 饲料中添加有效浓度为0.10%的自提褐藻糖胶可显著促进黄颡鱼幼鱼的生长,而添加有效浓度为0.05%~0.20%的商品褐藻糖胶对黄颡鱼幼鱼的生长无显著影响。
② 添加2种褐藻糖胶后黄颡鱼幼鱼胃和肠道中脂肪酶活性均有不同程度的升高,自提褐藻糖胶对肠道中脂肪酶活性的提高作用优于商品褐藻糖胶,而商品褐藻糖胶对胃中脂肪酶活性的提高作用优于自提褐藻糖胶。
| [1] | 李明峰.黄颡鱼生物学研究进展[J]. 现代渔业信息,2010,25(9):16-22. ( 1) 1)
|
| [2] | 纪明候.海藻化学[M]. 北京:科学出版社,2004:318-327. ( 1) 1)
|
| [3] | WIJESEKARA I,PANGESTUTI R,KIM S K.Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J]. Carbohydrate Polymers,2011,84(1):14-21. ( 1) 1)
|
| [4] | 詹林盛,张新生,吴晓红,等.海带多糖的免疫调节作用[J]. 中国生化药物杂志,2001,22(3):116-118. ( 1) 1)
|
| [5] | 范晓,郑乃余,张燕霞.海带中褐藻酸盐组成的研究[J]. 海洋与湖沼,1988,19(1):64-70. ( 1) 1)
|
| [6] | PASKINS-HURBUR A J,SKORYNA S C,TANAKA Y,et al.Fucoidan:its binding of lead and other metals[J]. Botanica Marina,1978,21(1):13-22. ( 1) 1)
|
| [7] | 张惟杰.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1999:11-12. ( 1) 1)
|
| [8] | DODGSON K S,PRICE R G.A note on the determination of the ester sulphate content of sulphated polysaccharides[J].Biochemical Journal,1962,84(1):106-110. ( 1) 1)
|
| [9] | AOAC.Official methods of analysis of official analytical chemists international[S]. 16th ed.Arlington,VA:Association of Official Analytical Chemists,1995. ( 2) 2)
|
| [10] | 鲁子贤.蛋白质和酶学研究方法[M].北京:科学出版社,1989:37-39. ( 1) 1)
|
| [11] | BITTER T,MUIR H M.A modified uronic acid carbazole reaction[J]. Analytical Biochemistry,1962,4(4):330-334. ( 1) 1)
|
| [12] | PARK M K,JUNG U,ROH C.Fucoidan from marine brown algae inhibits lipid accumulation[J]. Marine Drugs,2011,9(8):1359-1367. ( 1) 1)
|
| [13] | YOKOTA T,NAGASHIMA M,GHAZIZADEH M,et al.Increased effect of fucoidan on lipoprotein lipase secretion in adipocytes[J]. Life Sciences,2009,84(15/16):523-529. ( 1) 1)
|
| [14] | 邢燕红.褐藻糖胶(FPS)的调脂机制探讨 .硕士学文论文.广州:广州中医药大学,2005:1-43.( 2) 2)
|
| [15] | 吴清和,荣向路,邢燕红,等.褐藻糖胶调节大鼠脂质代谢紊乱的作用[J]. 中药新药与临床药理,2007,18(6):434-437. ( 1) 1)
|
| [16] | 张桂兰,程薇莉,毕洪玲,等.褐藻硫酸多糖对老年人肠道双歧杆菌促增殖作用的研究[J]. 中国微生态学杂志,2001,13(2):85-86. ( 1) 1)
|
| [17] | LYNCH M B,SWEENEY T,CALLAN J J,et al.The effect of dietary Laminaria-derived laminarin and fucoidan on nutrient digestibility,nitrogen utilisation,intestinal microflora and volatile fatty acid concentration in pigs[J]. Journal of the Science of Food and Agriculture,2010,90(3):430-437. ( 1) 1)
|
| [18] | O'SULLIVAN L,MURPHY B,MCLOUGHLIN P,et al.Prebiotics from marine macroalgae for human and animal health applications[J]. Marine Drugs,2010,8(7):2038-2064. ( 1) 1)
|
| [19] | 强俊,王辉,李瑞伟,等.低聚木糖对奥尼罗非鱼幼鱼生长、体成分和消化酶活力的影响[J]. 淡水渔业,2009,39(6):63-68. ( 1) 1)
|
| [20] | 王艳.果寡糖对银鲫非特异性免疫功能及消化酶活性的影响 .硕士学位论文.广州:华中农业大学,2008:1-55.( 1) 1)
|
| [21] | BORLONGAN I G,BENITEZ L V.Lipid and fatty acid composition of milkfish ( Chanos chanos forsskal) grown in freshwater and seawater[J].Aquaculture,1992,140(1/2):79-89. ( 1) 1)
|
| [22] | 李兆杰,薛长湖,林洪,等.岩藻聚糖硫酸酯降血脂及抗氧化作用的研究[J]. 营养学报,1999,21(3):280-283. ( 1) 1)
|
| [23] | HUANG L,WEN K,GAO X,et al.Hypolipidemic effect of fucoidan from Laminaria japonica in hyperlipidemic rats[J]. Pharmaceutical Biology,2010,48(4):422-426. ( 1) 1)
|
| [24] | 张秀坤.羊栖菜岩藻聚糖硫酸酯的制备与降血脂活性研究 .硕士学位论文.青岛:中国海洋大学,2009:1-79. ( 1) 1)
|
| [25] | BILAN M I,GRACHEV A A,USTUZHANINA N E,et al.Structure of a fucoidan from the brown seaweed Fucus evanescens C.Ag.[J]. Carbohydrate Research,2002,337(8):719-730. ( 1) 1)
|
| [26] | ANASTYUK S D,SHEVCHENKO N M,NAZARENKO E L,et al.Structural analysis of a fucoidan from the brown alga Fucus evanescens by MALDI-TOF and tandem ESI mass spectrometry[J]. Carbohydrate Research,2009,344(6):779-787. ( 1) 1)
|
| [27] | 李波,魏新军,赵良,等.褐藻糖胶的结构及构效关系研究[J]. 天然产物研究与开发,2006,18(6):1052-1056. ( 1) 1)
|
| [28] | 刘书琦,张文清,沈方红.褐藻糖胶的化学组成及生物活性的研究[J]. 生物技术通报,2008(增刊):34-37. ( 1) 1)
|
| [29] | 付志飞,管华诗,刘红兵.褐藻糖胶的抗肿瘤作用及构效关系研究进展[J]. 中国海洋药物,2013,32(4):76-82. ( 1) 1)
|




