铜是赖氨酰氧化酶(lysyl oxidase,LOX)、细胞色素C氧化酶(cytochrome C oxidase,COX)、铁氧化酶(ferroxidase)、酪氨酸酶(tyrosinase,TYR)以及铜锌超氧化物歧化酶(copper-zinc superoxide dismutase,Cu-ZnSOD)等的重要组成成分,在甲壳动物中,酚氧化酶(phenoloxidase,PO)和铜蓝蛋白(ceruloplasmin,CP,又称铜氧化酶)是非常重要的铜蛋白[1],是甲壳类动物维持正常生理功能和生长发育所必需的[2]。正常海水中的铜不能满足对虾的生理需求,因此需要在饲料中添加铜,以满足对虾生长和代谢对铜的需求[3,4,5]。有关凡纳滨对虾(Litopenaeus vannamei)对饲料中铜需求量的研究主要集中在以硫酸铜(SC)为铜源上。Davis等[4]报道,以硫酸铜为铜源时,凡纳滨对虾对饲料中铜的需求量为32 mg/kg。硫酸铜存在易吸潮结块、不便加工贮存、易破坏维生素、吸收率低、排出体外污染环境等缺点,因此,近年研究人员开始了其他铜源如微量元素氨基酸螯合铜、碱式氯化铜(TBCC)等的研究。由于微量元素氨基酸螯合盐存在成本高、产品质量参差不齐、效果不稳定等问题,有关凡纳滨对虾饲料中添加微量元素氨基酸螯合铜的研究并不多见,已有研究[2,6,7,8]结果也不一致。碱式氯化铜具有含铜量高、不易吸潮结块、易于混匀、对饲料原料及某些维生素的破坏性弱[9]等特点,是近年来新开发的一种高效安全的铜源,在畜禽的研究中,碱式氯化铜能提高仔猪[10]、肉鸡的生产性能,降低养殖成本[11]。目前,关于碱式氯化铜在水产动物上应用的研究[12,13]比较少,在对虾中更是未见报道。因此,本试验拟研究饲料中硫酸铜、羟基蛋氨酸铜(HMC)、碱式氯化铜3种铜源及其不同添加水平对凡纳滨对虾幼虾生长性能、血清生化指标、非特异性免疫酶活性及肌肉氨基酸含量的影响,旨在比较不同铜源及铜添加水平对虾类的营养和免疫效果,为不同铜源在凡纳滨对虾饲料中的应用提供理论依据和参考。
1 材料与方法 1.1 试验饲料以酪蛋白、鱼粉为蛋白质源,以鱼油、豆油为脂肪源,配制基础饲料(表1)。在基础饲料的基础上,采用双因素试验设计,以羟基蛋氨酸铜(购自长沙兴嘉生物工程股份有限公司,饲料级,铜含量≥12%)、碱式氯化铜(购自长沙兴嘉生物工程股份有限公司,饲料级,铜含量≥58%)、硫酸铜[具体物质为五水硫酸铜(CuSO4·5H2O),购自广州光华科技股份有限公司,分析纯,铜含量≥25%)]为铜源,并设铜添加水平分别为0、8、16、32、64 mg/kg,配制13种等氮等能饲料,即未添加铜的基础饲料,分别以羟基蛋氨酸铜、碱式氯化铜、硫酸铜为铜源并分别添加8、16、32、64 mg/kg铜的试验饲料,上述饲料中铜含量分别为2.44、7.10、17.15、31.80、56.20、7.63、17.86、34.15、62.66、8.66、18.13、34.74、63.26 mg/kg。各种原料粉碎过80目筛,按表1的配方准确称量各种饲料原料,微量添加成分采取逐级扩大法混合均匀,再添加30%左右的水再次混匀,经60 ℃熟化30 min后,压制成粒径为1.0和1.5 mm的颗粒饲料,风干后用封口袋密封,放于-20 ℃冰箱中保存备用。
| 表1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) % |
试验虾购自湛江中联养殖有限公司。选择初始体重为(0.330±0.001) g的健康凡纳滨对虾幼虾1 560尾,随机分为13组,每组3个重复,每个重复40尾,以重复为单位饲养于容积为0.38 m3的玻璃纤维钢桶中。试验1~4周每2天换水1次,5~8周每天换水1次,换水量为总水量的30%~50%。试验在广东海洋大学东海岛海洋生物研究基地室内养殖系统内进行。养殖过程参照杨奇慧等[14]的方法进行。试验期间水温28~31 ℃,盐度28‰~32‰,pH 8.0~8.2, 氨氮浓度<0.03 mg/L,溶氧浓度≥5.0 mg/L。试验期为8周。
1.3 样品采集样品采集参照杨奇慧等[14]的方法进行。每桶随机取10尾虾,用1 mL无菌注射器于第5步足基部血窦取血,将血液置于1.5 mL离心管中,4 ℃冰箱中静置过夜后,在4 ℃、8 000 r/min下离心10 min,取上清液于-80 ℃保存备用;每桶另随机取10尾虾,称重后于冰浴中剥离肝胰腺,再取前段肌肉,将肝胰腺、肌肉置于2 mL离心管中-80 ℃保存备用。
1.4 指标测定 1.4.1 血清生化指标的测定采用日立7070型生化分析仪进行血清总蛋白、葡萄糖和甘油三酯含量的测定,测定所用试剂盒均购自威特曼生物科技有限公司。
1.4.2 非特异性免疫酶活性的测定肝胰腺总超氧化物歧化酶(T-SOD)和铜锌超氧化物歧化酶活性、血清铜蓝蛋白活性均采用南京建成生物工程研究所生产的试剂盒测定,血清酚氧化酶活性参照Huang等[15]的方法测定。
1.4.3 肌肉氨基酸含量的测定参照GB/T 18246—2000中的水解法测定肌肉氨基酸含量。
1.5 生长性能指标计算公式成活率(SR,%)=100×终末虾尾数/初始虾尾数;
增重率(WGR,%)=100×(终末均重-
初始均重)/初始均重;
特定生长率(SGR,%/d)=100×[ln终末均重-
ln初始均重]/饲养天数。
1.6 数据处理与分析结果用平均值±标准差表示。采用SPSS 17.0统计软件对数据进行双因素方差分析,若存在显著性差异,再采用Duncan氏法进行多重比较,检验组间的差异显著性,P<0.05表示差异显著。饲料中铜的最适含量通过折线模型进行回归分析,用拐点以下的直线斜率比值比较凡纳滨对虾对羟基蛋氨酸铜、碱式氯化铜、硫酸铜的相对生物利用率。
2 结 果 2.1 饲料中铜源及铜添加水平对凡纳滨对虾幼虾生长性能的影响由表2可知,饲料中铜添加水平对凡纳滨对虾幼虾的终末体重、增重率和特定生长率有显著影响(P<0.05),对成活率无显著影响(P>0.05)。添加8~64 mg/kg铜的组对虾的终末体重、增重率、特定生长率均显著高于未添加铜的组(P<0.05)。铜源对凡纳滨对虾幼虾的终末体重、增重率、特定生长率和成活率无显著影响(P>0.05),且铜源和铜添加水平的交互作用对上述指标亦无显著影响(P>0.05)。
| 表2 饲料中铜源及铜添加水平对凡纳滨对虾幼虾生长性能的影响 Table 2 Effects of dietary copper source and supplemental level on growth performance of juvenile Litopenaeus vannamei (n=3) |
由表3可知,饲料中铜源对凡纳滨对虾幼虾血清总蛋白、甘油三酯含量有显著影响(P<0.05),对血清葡萄糖含量无显著影响(P>0.05)。饲料中铜添加水平对凡纳滨对虾幼虾血清总蛋白、葡萄糖、甘油三酯含量有显著影响(P<0.05)。饲料中铜源与铜添加水平的交互作用对凡纳滨对虾幼虾血清总蛋白含量有显著影响(P<0.05),对血清葡萄糖、甘油三酯含量无显著影响(P>0.05)。
| 表3 饲料中铜源及铜添加水平对凡纳滨对虾幼虾血清生化指标的影响
Table 3 Effects of dietary copper source and supplemental level on serum biochemical indices of juvenile Litopenaeus vannamei (n=3)
|
总蛋白含量:以羟基蛋氨酸铜和硫酸铜为铜源时,均以添加32 mg/kg铜的组最高,显著高于添加0、8、16 mg/kg铜的组(P<0.05);以碱式氯化铜为铜源时,以添加64 mg/kg铜的组最高,显著高于其他组(P<0.05)。添加32 mg/kg铜时,羟基蛋氨酸铜组显著高于硫酸铜组(P<0.05),硫酸铜组显著高于碱式氯化铜组(P<0.05)。
葡萄糖含量:添加32、64 mg/kg铜的组显著低于添加0、8和16 mg/kg铜的组(P<0.05)。
甘油三酯含量:以未添加铜的组最高,显著高于添加8、32和64 mg/kg铜的组(P<0.05);羟基蛋氨酸铜组显著高于碱式氯化铜组(P<0.05),与硫酸铜组差异不显著(P>0.05)。 2.3 饲料中铜源及铜添加水平对凡纳滨对虾幼虾非特异性免疫酶活性的影响
由表4可知,饲料中铜源、铜添加水平及二者的交互作用对凡纳滨对虾幼虾血清铜蓝蛋白、酚氧化物酶活性及肝胰腺总超氧化物歧化酶和铜锌超氧化物歧化酶活性有显著影响(P<0.05)。
| 表4 饲料中铜源及铜添加水平对凡纳滨对虾幼虾非特异性免疫酶活性的影响
Table 4 Effects of dietary copper source and supplemental level on non-specific immune enzyme activities of juvenile Litopenaeus vannamei(n=3)
|
血清铜蓝蛋白活性:以羟基蛋氨酸铜、碱式氯化铜和硫酸铜为铜源时,均以添加32 mg/kg铜的组最高,显著高于添加0、8、16 mg/kg的组(P<0.05)。当添加8、32、64 mg/kg铜时,均以硫酸铜组最高,且硫酸铜组显著高于碱式氯化铜组(P<0.05),但与羟基蛋氨酸铜组差异不显著(P>0.05)。
血清酚氧化物酶活性:以羟基蛋氨酸铜为铜源时,以添加16 mg/kg铜的组最高,显著高于添加0、8、64 mg/kg铜的组(P<0.05);以碱式氯化铜为铜源时,以添加32 mg/kg铜的组最高,显著高于添加0、8、16 mg/kg铜的组(P<0.05);以硫酸铜为铜源时,以添加32 mg/kg铜的组最高,显著高于添加0、64 mg/kg铜的组(P<0.05)。当添加8 mg/kg铜时,以硫酸铜组最高,显著高于碱式氯化铜组(P<0.05);当添加16 mg/kg铜时,以羟基蛋氨酸铜组最高,显著高于硫酸铜和碱式氯化铜组(P<0.05);当添加32、64 mg/kg铜时,均以碱式氯化铜组最高,显著高于羟基蛋氨酸铜和硫酸铜组(P<0.05)。
肝胰腺总超氧化物歧化酶活性:以羟基蛋氨酸铜为铜源时,以添加32 mg/kg铜的组最高,显著高于添加0、16 mg/kg铜的组(P<0.05);以碱式氯化铜为铜源时,以添加16 mg/kg铜的组最高,显著高于添加0、32 mg/kg铜的组(P<0.05);以硫酸铜为铜源时,以添加64 mg/kg铜的组最高,显著高于添加0、16 mg/kg铜的组(P<0.05)。当添加32 mg/kg铜时,以羟基蛋氨酸铜组最高,显著高于碱式氯化铜组(P<0.05);当添加64 mg/kg铜时,以硫酸铜组最高,显著高于羟基蛋氨酸铜和碱式氯化铜组(P<0.05)。
肝胰腺铜锌超氧化物歧化酶活性:以羟基蛋氨酸铜和硫酸铜为铜源时,均以添加32 mg/kg铜的组最高,显著高于其他组(P<0.05);以碱式氯化铜为铜源时,以添加8 mg/kg铜的组最高,显著高于其他组(P<0.05)。当添加8 mg/kg铜时,以碱式氯化铜组最高,显著高于羟基蛋氨酸铜和硫酸铜组(P<0.05);当添加16 mg/kg铜时,以硫酸铜组最高,显著高于羟基蛋氨酸铜组(P<0.05);当添加32 mg/kg铜时,以硫酸铜组最高,显著高于碱式氯化铜组(P<0.05);当添加64 mg/kg铜时,以硫酸铜组最高,显著高于羟基蛋氨酸铜和碱式氯化铜组(P<0.05)。 2.4 凡纳滨对虾幼虾饲料中3种铜源相对生物利用率比较
由表5和图1可知,以血清铜蓝蛋白活性为评价指标,以羟基蛋氨酸铜、碱式氯化铜、硫酸铜为铜源时,经折线模型得出饲料中铜的最适含量分别为17.52、20.32、20.29 mg/kg。以硫酸铜为标准物时,羟基蛋氨酸铜和碱式氯化铜的相对生物利用率分别为115.15%、71.88%。
| 表5 以血清铜蓝蛋白活性为评价指标时羟基蛋氨酸铜和碱式氯化铜的相对生物利用率 Table 5 Relative bioavailability of HMC and TBCC for serum CP activity as an evaluation index |
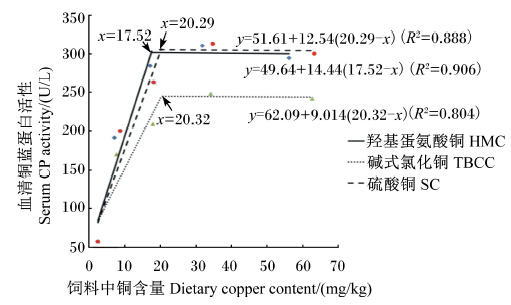 | 图1 饲料中铜含量与凡纳滨对虾幼虾血清中铜蓝蛋白活性的关系
Fig.1 Relationship of dietary copper content and serum CP activity of juvenile Litopenaeus vannamei |
2.5 饲料中铜源及铜添加水平对凡纳滨对虾幼虾肌肉氨基酸含量的影响
由表6可知,饲料中铜源及铜添加水平对凡纳滨对虾幼虾肌肉中丙氨酸(Ala)、精氨酸(Arg)、天冬氨酸(Asp)、甘氨酸(Gly)和谷氨酸(Glu)含量均有显著影响(P<0.05),且铜源及铜添加水平的交互作用对Ala、Asp、Gly、Glu含量均有显著的影响(P<0.05)。
| 表6 饲料中铜源及铜添加水平对凡纳滨对虾幼虾肌肉中氨基酸含量的影响 Table 6 Effects of dietary copper source and supplemental level on amino acid contents in muscle of juvenile Litopenaeus vannamei (n=3) % |
Ala含量:以羟基蛋氨酸铜为铜源时,以添加16 mg/kg铜的组最高,显著高于添加64 mg/kg铜的组(P<0.05);以碱式氯化铜为铜源时,各组间差异不显著(P>0.05);以硫酸铜为铜源时,以添加32 mg/kg铜的组最高,显著高于其他组(P<0.05)。当添加16、32、64 mg/kg铜时,均以硫酸铜组最高,显著高于羟基蛋氨酸铜和碱式氯化铜组(P<0.05)。
Arg含量:在铜源方面,表现为硫酸铜组显著高于碱式氯化铜组(P<0.05);在铜添加水平方面,表现为未添加铜的组显著高于各添加铜的组(P<0.05)。
Asp含量:以羟基蛋氨酸铜为铜源时,以未添加铜的组最高,显著高于各添加铜的组(P<0.05);以碱式氯化铜为铜源时,以未添加铜的组最高,显著高于添加16、32、64 mg/kg铜的组(P<0.05);以硫酸铜为铜源时,以添加32 mg/kg铜的组最高,显著高于添加8、16 mg/kg铜的组(P<0.05)。当添加32、64 mg/kg铜时,均以硫酸铜组最高,显著高于羟基蛋氨酸铜和碱式氯化铜组(P<0.05)。
Gly含量:以羟基蛋氨酸铜和碱式氯化铜为铜源时,以未添加铜的组最高,显著高于其他组(P<0.05),以硫酸铜为铜源时,以添加16 mg/kg铜的组最低,显著低于添加0、32、64 mg/kg铜的组(P<0.05)。当添加32、64 mg/kg铜时,以硫酸铜组最高,显著高于碱式氯化铜组(P<0.05)。
Glu含量:以羟基蛋氨酸铜和碱式氯化铜为铜源时,以未添加铜的组最高,显著高于其他组(P<0.05),以硫酸铜为铜源时,以添加32 mg/kg铜的组最高,显著高于添加8、16 mg/kg铜的组(P<0.05)。当添加32、64 mg/kg铜时,以硫酸铜组最 高,显著高于羟基蛋氨酸铜和碱式氯化铜组(P<0.05)。
3 讨 论
3.1 饲料中铜源及铜添加水平对凡纳滨对虾幼虾生长性能的影响
铜是鱼、虾等水产动物生长所必需的微量元素之一,是甲壳类动物血液中铜蓝蛋白(运输氧的载体)的中心原子[16]。目前,关于铜源及铜添加水平对凡纳滨对虾生长的影响已有一些报道。Bhardwaj等[2]研究指出,羟基蛋氨酸铜对凡纳滨对虾的促生长效果较硫酸铜好。董晓慧等[6]研究表明,饲料中添加10、30、50 mg/kg的硫酸铜和蛋氨酸铜均能提高凡纳滨对虾的增重率,且蛋氨酸铜的促生长作用较硫酸铜好,饲料中添加10 mg/kg的蛋氨酸铜即可满足对虾生长的需要。周萌等[7]报道,饲料中添加硫酸铜、蛋氨酸铜和富马酸铜均能不同程度提高凡纳滨对虾的生长,以蛋氨酸铜为铜源时效果最好,而以硫酸铜为铜源时效果最差。但郭志勋等[8]的研究则表明,当添加30 mg/kg铜时,硫酸铜的促生长效果优于蛋氨酸铜。在本试验条件下,比较不同铜添加水平的影响时发现,分别以硫酸铜、羟基蛋氨酸铜和碱式氯化铜为铜源时,各添加铜的组幼虾终末体重、增重率和特定生长率均显著高于未添加铜的组,说明饲料中添加上述3种铜源均能提高凡纳滨对虾幼虾的生长性能,这与董晓慧等[6]和周萌等[7]的研究结果一致。由表2的结果可知,3种铜源对凡纳滨对虾幼虾各生长性能指标的影响不显著,从数值上看,增重率和特定生长率均以硫酸铜组最高,这与郭志勋等[8]的研究结果一致。这可能与不同试验所用蛋氨酸铜的种类不同有关,也有可能与动物生长的环境不同有关,具体的原因需要进一步深入研究。
3.2 饲料中铜源及铜添加水平对凡纳滨对虾幼虾血清生化指标的影响血清总蛋白含量一定程度上反映了饲料中蛋白质的营养水平和动物对蛋白质的消化吸收程度,体内蛋白质合成作用和氮沉积增强,则血清总蛋白含量增加[17]。邢芳芳等[18]报道,蛋氨酸铜和甘氨酸铜能增加蛋白质的吸收和利用。本研究发现,血清总蛋白含量随饲料中铜添加水平的增加而增加,以添加32 mg/kg羟基蛋氨酸铜的组对虾的血清总蛋白含量最高,说明饲料中添加32 mg/kg羟基蛋氨酸铜能够增加蛋白质的吸收和利用。这可能与氨基酸螯合物的添加增加了饲料中必需氨基酸的量或者是优化了必需氨基酸的比例有关。
3.3 饲料中铜源及铜添加水平对凡纳滨对虾幼虾非特异性免疫酶活性的影响铜是赖氨酰氧化酶、细胞色素C氧化酶、酪氨酸酶、铜蓝蛋白、酚氧化物酶及铜锌超氧化物歧化酶等多种酶的重要组成成分[1],广泛参与机体的新陈代谢。其中,铜蓝蛋白是甲壳类动物运输氧的载体[5],对甲壳类动物非常重要。酚氧化物酶是重要的防御酶,在血淋巴中以无活性的酚氧化物酶原的形式存在,在微生物多糖、环境因子和金属离子的作用下转变成有活性的酚氧化物酶[19],其可比较敏感的反映机体的免疫状态[20]。超氧化物歧化酶(superoxide dismutase,SOD)具有清除自由基以及催化过氧化物自由基歧化为过氧化物和氧气的功能[21]。当 超氧化物歧化酶活性降低时,生物体内就会积累过多的自由基,导致代谢紊乱,正常生理功能失调,免疫和防御水平下降,从而容易引起疾病的发生[22]。该酶包含铜锌超氧化物歧化酶和锰超氧化物歧化酶(Mn-SOD)2种形式[23],铜锌超氧化物歧化酶含有铜和锌2种金属元素,其中锌原子与酶分子结构稳定性有关,铜原子参与酶活性中心的组成,直接与酶的活性有关[6]。
由表4结果可知,饲料中添加适量的铜能够提高血清铜蓝蛋白、酚氧化酶和肝胰腺总超氧化物歧化酶、铜锌超氧化物歧化酶活性。以羟基蛋氨酸铜和硫酸铜为铜源时,血清铜蓝蛋白、酚氧化酶和肝胰腺总超氧化物歧化酶、铜锌超氧化物歧化酶均在添加32 mg/kg铜时表现出最高的活性。以碱式氯化铜为铜源时,血清铜蓝蛋白、酚氧化酶均在添加32 mg/kg铜时表现出最高的活性,而肝胰腺总超氧化物歧化酶则在添加16 mg/kg铜时表现出最高的活性。目前,关于铜对凡纳滨对虾幼虾非特异免疫酶活性影响的报道较少。郭志勋等[22]研究发现,饲料中添加硫酸铜能够提高凡纳滨对虾的血清酚氧化物酶和超氧化物歧化酶活性,当添加30 mg/kg铜时,2种酶的活性均最高。陈娟等[23]研究发现,饲料中添加30和45 mg/kg铜时,凡纳滨对虾血清中酚氧化物酶和超氧化物歧化酶活性较高。生物学利用率能够体现营养物质的吸收和利用程度,Shao等[13]对异育银鲫(Carassius auratus gibelio)的研究结果表明,以血浆铜蓝蛋白活性为评价指标时,异育银鲫对碱式氯化铜的相对生物利用率最高,氨基酸螯合铜次之,硫酸铜最低。在本试验中,以血清铜蓝蛋白活性为评价指标时,凡纳滨对虾幼虾对蛋氨酸铜的相对生物利用率最高,硫酸铜次之,碱式氯化铜最低,说明有机态铜的生物利用率要高于无机态铜,这与乔永刚等[24]的研究结果相一致。本试验结果得出的碱式氯化铜的相对生物利用率较硫酸铜低,与Shao等[13]的结果不同,可能与养殖对象不同有关,具体原因还有待进一步的研究。
3.4 饲料中铜源及铜添加水平对凡纳滨对虾幼虾肌肉氨基酸含量的影响铜不仅在维持鱼体的生理功能中起特殊作用,而且还是鱼类呈鲜味不可缺少的因子[25]。动物肌肉中的氨基酸,特别是鲜味氨基酸Ala、Arg、Asp、Gly、Glu,与肌肉风味密切相关[26]。然而,铜对动物肌肉中氨基酸含量的影响报道较少,特别是铜对凡纳滨对虾幼虾肌肉中氨基酸含量的影响尚未见报道。林汝榕等[27]在研究铜、镉对中华哲水蚤(Calanus sinicus)的影响时发现,在铜、镉浓度较低时,中华哲水蚤的总氨基酸含量明显提高,铜、镉浓度提高时,总氨基酸含量则呈现下降的趋势。王安利等[28]研究发现,二价铜离子(Cu2+)能使中国明对虾(Penaeus chinensis)肌肉中必需氨基酸、非必需氨基酸、鲜味氨基酸及总氨基酸含量升高。本研究发现,铜源对凡纳滨对虾幼虾肌肉中Ala、Arg、Asp、Gly和Glu含量有显著影响,上述氨基酸的总含量以硫酸铜组最高,其原因可能是由不同的铜源提供的阴离子不同而引起的,但具体作用机制有待进一步研究。
4 结 论以血清铜蓝蛋白活性为评价指标,以羟基蛋氨酸铜、碱式氯化铜和硫酸铜为铜源时,经折线模型得出饲料中铜的最适含量分别为17.52、20.32、20.29 mg/kg。通过比较可知,羟基蛋氨酸铜的相对生物利用率最高,硫酸铜次之,碱式氯化铜最低。
| [1] | O'Dell B L.Biochemistry of copper[J]. Medical Clinicals of North America,1976,60(4):697-703. ( 2) 2)
|
| [2] | BHARDWAJ A S,PATNAIK S,BROWDY C L,et al.Comparative evaluation of an inorganic and a commercial chelated copper source in Pacific white shrimp Litopenaeus vannamei (Boone) fed diets containing phytic acid[J].Aquaculture,2014,422:63-68. ( 3) 3)
|
| [3] | DAVIS D A,GATLIN Ⅲ D M.Dietary mineral requirements of fish and marine crustaceans[J]. Reviews in Fisheries Science,1996,4(1):75-99. ( 1) 1)
|
| [4] | DAVIS D A, LAWRENCE A L, GATLIN Ⅲ D M.Dietary copper requirement of Penaeus vannamei[J]. Nippon Suisan Gakkaishi,1993,59(1):117-122. ( 2) 2)
|
| [5] | LEE M H,SHIAU S Y.Dietary copper requirement of juvenile grass shrimp,Penaeus monodon,and effects on non-specific immune responses[J]. Fish & Shell Fish Immunology,2002,13(4):259-270. ( 2) 2)
|
| [6] | 董晓慧,杨原志,郑石轩,等.饲料中不同铜源和水平对凡纳滨对虾生长、免疫和组织铜含量的影响[J]. 大连水产学院学报,2007,22(5):377-383. ( 4) 4)
|
| [7] | 周萌,王安利,曹俊明.饲料中不同形式的铜及添加量对凡纳滨对虾(Paneaus vannamei)生长性能、血清铜蓝蛋白和生长激素水平的影响[J]. 海洋与湖沼,2010,41(4):577-582. ( 3) 3)
|
| [8] | 郭志勋,陈毕生,徐力文,等.蛋氨酸铜和硫酸铜在凡纳对虾饲料中的应用效果比较[J]. 南方水产,2005,1(2):56-60. ( 3) 3)
|
| [9] | 李红雪,计成,马秋刚,等.碱式氯化铜的分子结构、产品稳定性及理化特性研究[J]. 中国饲料,2004(6):28-29. ( 1) 1)
|
| [10] | 吕林,罗绪刚,萧作平,等.碱式氯化铜对断奶仔猪的促生长效应研究[J]. 中国饲料,2007(2):30-31. ( 1) 1)
|
| [11] | 张政军,吕林,罗绪刚,等.碱式氯化铜对平养肉鸡生长性能、饲粮中维生素E和植酸酶稳定性的影响[J]. 营养学报,2008,30(5):470-474. ( 1) 1)
|
| [12] | SHAO X P,LIU W B,LU K L,et al.Effects of tribasic copper chloride on growth,copper status,antioxidant activities,immune responses and intestinal microflora of blunt snout bream (Megalobrama amblycephala) fed practical diets[J].Aquaculture,2012,338:154-159. ( 1) 1)
|
| [13] | SHAO X P,LIU W B,XU W N,et al.Effects of dietary copper sources and levels on performance,copper status,plasma antioxidant activities and relative copper bioavailability in Carassius auratus gibelio[J]. Aquaculture,2010,308(1):60-65. ( 3) 3)
|
| [14] | 杨奇慧,谭北平,董晓慧,等.铬对凡纳滨对虾生长性能、血清生化指标及非特异性免疫酶活性的影响[J]. 动物营养学报,2013,25(4):2-10. ( 2) 2)
|
| [15] | HUANG J,YANG Y,WANG A.Reconsideration of phenoloxidase activity determination in white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2010,28(1):240-244. ( 1) 1)
|
| [16] | OWEN C A.Biochemical aspects of copper:copper proteins,ceruloplamin,and copper protein binding[M]. Saddle River,NJ:Noyes Publications,1982:41-44. ( 1) 1)
|
| [17] | LUO X G,DOVE C G.Effect of dietary copper and fat on nutrient utilization,digestive enzyme activities,and tissue mineral levels in weanling pigs[J]. Journal of Animal Science,1996,74(8):1888-1896. ( 1) 1)
|
| [18] | 邢芳芳,燕富永,孔祥峰,等.甘氨酸铜、蛋氨酸铜替代硫酸铜对仔猪血清生化指标的影响[J]. 江苏农业学报,2008,24(3):378-380. ( 1) 1)
|
| [19] | CARDENAS W,DANKERT J R.Phenoloxidase specific activity in the red swamp crayfish,Procambarus clarkia[J]. Fish & Shellfish Immunology,1997,7(5):283-295. ( 1) 1)
|
| [20] | CHENG W,JUANG F M,CHEN J C.The immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus at different salinity levels[J]. Fish & Shell fish Immunology,2004,16(3):295-306. ( 1) 1)
|
| [21] | FATTMAN C L,SCHAEFER L M,OURY T D.Extracellular superoxide dismutase in biology and medicine[J]. Free Radical Biology & Medicine,2003,35(3):236-256. ( 1) 1)
|
| [22] | 郭志勋,陈毕生,徐力文,等.饲料铜的添加量对南美白对虾生长、血液免疫因子及组织铜的影响[J]. 中国水产科学,2003,10(6):526-528. ( 2) 2)
|
| [23] | LIN Y H,SHIE Y Y,SHIAU S Y.Dietary copper requirements of juvenile grouper,Epinephelus malabaricus[J]. Aquaculture,2008,274(1):161-165. ( 2) 2)
|
| [23] | LIN Y H,SHIE Y Y,SHIAU S Y.Dietary copper requirements of juvenile grouper,Epinephelus malabaricus[J].Aquaculture,2008,274(1):161-165.( 2) 2)
|
| [24] | 乔永刚,谭北平,麦康森,等.军曹鱼对随饲料中铜需要量的研究[J]. 中国海洋大学学报,2013,43(4):34-41. ( 1) 1)
|
| [25] | 姜琳琳,苏捷.鱼肉风味品质的研究进展[J]. 水利渔业,2008,28(4):19-20. ( 1) 1)
|
| [26] | 唐利华,方热军,周汝顺,等.不同铬源对肉鸡肌肉品质及氨基酸含量的影响[J]. 浙江大学学报:农业与生命科学版,2013,39(1):111-118. ( 1) 1)
|
| [27] | 林汝榕,李少菁.铜、镉对中华哲水蚤氨基酸含量影响的实验研究[J]. 海洋与湖沼,1991,22(3):242-248. ( 1) 1)
|
| [28] | 王安利,王维娜,王建平,等.海水中的铜对中国对虾体内氨基酸含量及代谢的影响[J]. 中山大学学报:自然科学版,2000,39(增刊):127-131. ( 1) 1)
|




