2. 河南科技大学动物科技学院, 洛阳 471003
2. College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China
随着转基因技术在育种领域的高速发展,转基因的动物、植物、微生物也慢慢地走进人们的生活。由于转基因作物具有抗病性、抗虫性、抗逆性等特点,为农业商业全球化做出了贡献,但其饲用安全性也成为人们日益关注的焦点。水稻作为全球主要的粮食来源之一,面临的主要问题就是病虫害,由于长期大量地使用化工农药,一方面增加了粮食的生产成本;另一方面由于农药的残留引发了生态系统的紊乱[1]。于是具有抗虫特性的转Bt(Bacillus thuringiensis,Bt)基因水稻便应运而生,它是利用苏云金芽孢杆菌中的内毒素蛋白Cry1Ac/Cry1Ab基因导入到水稻的基因组中获得的,具有抗鳞翅目昆虫特性[2]。转Bt基因水稻在增产增收方面确实发挥了很大的作用,同时人们对关于食品转基因化的安全性问题提出了质疑和担忧。人们关心的重点一方面是转入水稻的外源基因表达的蛋白质是否会通过食物链最终进入人体,并在人体内沉积,对人体造成潜在的危害;另一方面是担心转入基因表达的外源蛋白质在动物体消化后是否会在其排泄物中残留,通过排泄物进入生态系统对环境造成危害。目前关于转Bt基因糙米表达的杀虫蛋白质和基因在动物体中的残留报道结果不一[3,4,5,6,7,8,9,10]。大多数研究表明,转Bt基因糙米中的外源基因和外源蛋白质不会在动物体内残留[11,12];也有研究表明,在用转Bt基因糙米饲养的动物体内或排泄物中发现了外源蛋白质和基因的残留[3,4,5]。本试验以生长猪为研究对象,以70%转Bt基因糙米添加到饲粮,通过聚合酶链式反应(PCR)和酶联免疫吸附试验(ELISA)等方法检测猪体、体液及其排泄物中外源基因和蛋白质的残留,并对生长猪内脏器官组织切片进行分析对比,从而全面地评价转Bt基因水稻对动物体和环境的影响,进而为指导转基因水稻在食品生产上的应用提供可靠依据,对完善转Bt基因水稻的安全评价具有重要意义。
1 材料与方法 1.1 试验材料水稻:试验用转Bt基因水稻(浙优5号)是由浙大208S×非转基因ZR9两系杂交所得的抗虫新品种;对照品种是扬两优6号,为浙优5号的亲本非转基因品种。2个品种均由华中农业大学提供。
豆粕和豆油:由黑龙江九三粮油工业集团有限公司提供的“九三牌”非转基因豆粕和豆油。
1.2 试验动物及饲养管理试验采用30头体重为(35.76±2.52) kg的生长猪,利用生长性能测定站饲喂,试验组(test group,TG)饲粮含有70%转Bt糙米;对照组(control group,CG)饲粮使用等量的亲本非转基因糙米,饲粮中的其他原料均为非转基因。试验期90 d,根据生长猪不同时期的营养需求分为前期(第1~45天)和后期(第46~90天)2个阶段分别配制饲粮,试验期间猪只自由采食和饮水。试验所用生长猪由中国农业科学院北京畜牧兽医研究所昌平试验猪场提供。
1.3 试验饲粮试验饲粮配制参照中华人民共和国农业行业标准《猪饲养标准》(NY/T 65—2004)[6]中国肉脂型生长猪饲养标准,分阶段配制糙米-豆粕型粉料饲粮。各阶段试验饲粮组成及营养水平见表1。
| 表1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) % |
试验期的第45和90天的09:00—10:00和15:00—16:00每天2次,采用无抓捕应激方式分别收集猪只的唾液、尿液和粪便。将试验期第45和90天采集的唾液、尿液及粪便样品分别进行充分混匀,-20 ℃保存备用。试验结束后每组随机选取6头(3公3母)猪只进行屠宰。屠宰前12 h停料,电击晕后吊挂放血屠宰。取心脏、肝脏、脾脏、肺脏、肾脏、胃、胰脏、十二指肠、空肠、回肠、背最长肌等组织器官和空肠食糜等,置入液氮中速冻后转入-80 ℃保存。同时取心脏、肝脏、脾脏、肺脏、肾脏、十二指肠、空肠、回肠等组织器官,用无菌生理盐水冲洗干净,放入10%的甲醛溶液中固定,用于制作组织切片。
1.5 组织切片的制作和观察取出适量的保存在甲醛中的组织样品,通过梯度酒精脱水、二甲苯透明、石蜡包埋、切成6 μm的切片,通过苏木精-伊红(HE)染色后将制作好的组织切片置于显微镜下,十二指肠、空肠和回肠组织切片在40倍下观察拍照,心脏、肝脏、脾脏、肺脏和肾脏组织切片在100倍下观察拍照,并对观察结果进行分析。
1.6 外源蛋白质的残留检测将生长猪各组织器官及各组粪样、尿液样、血清样、唾液样、食糜样等取出后转入真空冷冻干燥仪冻干,然后将冻干样品磨碎过筛后,于-20 ℃保存备用。称取已处理好的组织样品粉末按照试剂盒(QualiPlateTM Kit for Cry1Ab/Cry1Ac)测定步骤方法进行。
1.7 外源基因的残留检测首先是DNA提取,为了避免在PCR检测过程中出现假阴性的现象,采用转Bt基因糙米为饲粮原料的饲料样品中的Cry1Ac/Cry1Ab基因片段作为扩增条件的阳性对照,Cry1Ac/Cry1A基因片段扩增引物序列如表2所示。其次是DNA扩增,按照表3反应体系进行PCR扩增。混合之后置于PCR仪中按以下程序反应:94 ℃预变性3 min;94 ℃变性30 s; Cry1Ac/Cry1A基因55 ℃退火30 s;72 ℃延伸30 s,循环35次;72 ℃延伸10 min。由北京信诺金达科技公司进行测定。所有组织、血液、尿液、唾液、粪样、饲料样中的DNA均是通过上述条件扩增,扩增产物在1%琼脂糖凝胶上电泳,溴化乙锭进行染色并在紫外光下观察结果。
| 表2 Cry1Ac/Cry1Ab基因引物序列 Table 2 Primer sequences of Cry1Ac/Cry1A genes |
| 表3 PCR反应体系
Table 3 PCR reaction system
|
试验数据采用SAS 9.2统计软件进行处理,采用ANOVA程序对数据进行t检验分析。以P<0.05作为差异显著性判断标准。
2 结果与分析 2.1 饲用转Bt基因糙米对生长猪组织器官形态结构的影响如图1所示,观察结果显示心脏肌纤维横纹清楚,无变性、坏死等改变,血管处无充血、出血情况出现,间质内未见水肿等;肝脏以中央静脉为中心的肝索向四周放射状的排列,且肝小叶清晰可见,细胞核位于细胞中央,在汇管区未见有纤维状组织增生出现;肺脏清晰可见疏松的肺泡,未见病变区;肾脏中肾小管和肾小球的结构清晰,轮廓明显,肾脏结构正常,肾小球的囊腔中也没有渗出液,也无增生变化;脾脏表面的被膜完整未见增厚且结构正常,淋巴小结数目和大小都正常,且分化的淋巴细胞良好;各段小肠的组织切片显示也是发育正常,且肠道绒毛和隐窝深度也没有异常的情况。未见组织器官的显微结构出现明显的病理变化,表明转Bt基因糙米用作生长猪饲粮原料,对生长猪内脏器官组织的亚显微结构未产生不良的影响。
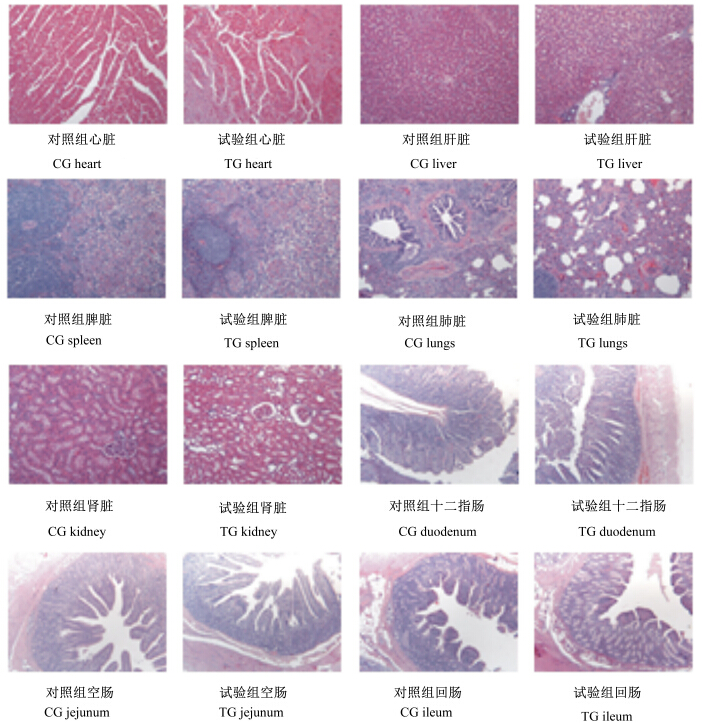 | 图1 饲喂不同饲粮的生长猪的组织切片
Fig.1 Histopathological picture of growing pigs fed different diets |
2.2 转Bt基因糙米表达的外源蛋白质在生长猪组织器官、体液及排泄物中的残留
转基因糙米经检测含有Cry1Ac/Cry1Ab蛋白质2.25 μg/g。转基因组饲粮中,前期饲粮中含有外源Cry1Ac/Cry1Ab蛋白质1.52 μg/μL,后期饲粮中外源含有外源Cry1Ac/Cry1Ab蛋白质1.93 μg/μL。其余亲本的非转基因饲粮和糙米中均未检测出外源的Cry1Ac/Cry1Ab蛋白质。饲喂转Bt基因糙米饲粮、非转基因糙米饲粮的生长猪的心脏、肝脏、脾脏、肺脏、肾脏、胃、胰脏、十二指肠、空肠、回肠、背最长肌等组织器官中均未检测到Cry1Ac/Cry1Ab蛋白质的残留。在血清、尿液及排泄物中也未检测出有残留。但在转基因饲粮组的生长猪的唾液中检测到了Cry1Ac/Cry1Ab蛋白质含量为0.26 μg/μL,亲本非转基因组生长猪的唾液中没有检测到Cry1Ac/Cry1Ab蛋白质的残留。
2.3 转入糙米中的Cry1Ac/Cry1Ab基因在生长猪组织器官、体液及排泄物中的残留如图2、图3所示,在饲喂转Bt基因糙米饲粮的生长猪的心脏、肝脏、脾脏、肺脏、肾脏、胃、胰脏、十二指肠、空肠、回肠、背最长肌等组织器官及体液(血清、尿液、唾液)和排泄物中未检测出转入基因的片段。结果表明转基因糙米中的外源基因未通过食物向生长猪的组织器官和体液中转移和累积,也未对生态环境造成危害。
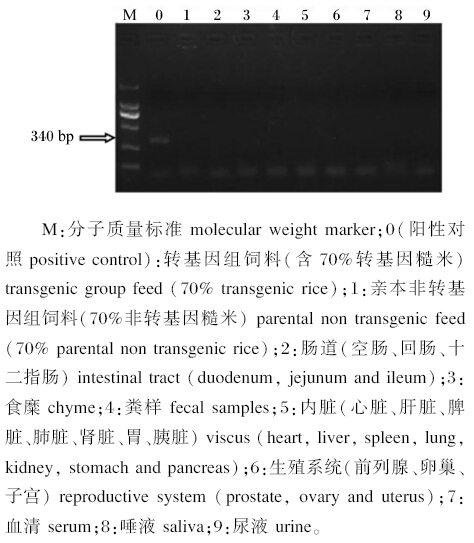 | 图2 对照组生长猪各组织中外源基因(Cry1Ac/Cry1Ab)检测 Fig.2 The detection of exogenous gene (Cry1Ac/Cry1Ab) in organization of growing pigs in control group |
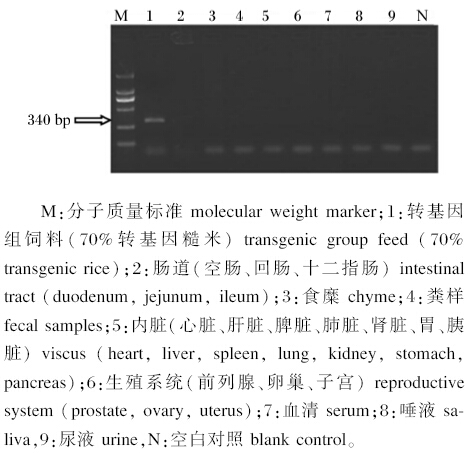 | 图3 试验组生长猪各组织中外源基因(Cry1Ac/Cry1Ab)检测 Fig.3 The detection of exogenous gene (Cry1Ac/Cry1Ab) in organization of growing pigsin test group |
以转基因的作物作为动物的饲料原料,其转入的基因片段或是该基因表达的外源蛋白质是否会像作物自身原有的DNA表达的蛋白质一样在动物的消化道内被降解,是否会在动物体内发生转移并在体内积累,是目前人们极为关注的问题。
转基因作物作为动物饲粮,动物机体的组织器官的组织结构是否因为转基因食物的原因发生了变化,可以直接或间接地反映动物机体的组织和器官是否发生损伤及损伤的程度,同时也能够反映组织器官的功能性变化。本试验结果显示,未见生长猪体组织及内脏器官的显微结构发生明显的变化,与之前的大多数研究结果一致[7]。Yonemochi等[8]研究表明,饲喂转基因玉米Cry9c后,生长猪的组织器官(心脏、肝脏、脾脏、肾脏、十二指肠、空肠、回肠等)未发生明显的组织学变化。杨月欣等[9]研究了转SCK基因大米对生长猪生长状况的影响,对内脏器官进行了组织学观察未见异常。Hammond等[10,11]和Cao等[12]利用转基因玉米的饲喂试验也得到相同的结果。本试验表明,转基因糙米作为动物饲粮饲喂,不会对动物体的组织结构产生不良的影响。
3.2 转Bt基因糙米中的Cry1Ac/Cry1Ab基因在生长猪组织器官及排泄物中的残留目前检测转基因作物中的外源DNA在动物体内残留最常用的方法就是PCR方法,通过PCR方法检测转基因作物中的外源的DNA残留,可以检测转基因作物中的多种转入的基因片段。本试验也同样采用了PCR方法,根据转Bt基因糙米中的Cry1Ac/Cry1Ab基因序列合成用于检测的引物进行PCR扩增,琼脂糖凝胶电泳显示条带(340 bp)从而证实了以该水稻为原料的生长猪饲粮中含有转基因成分。在生长猪的组织器官、体液、排泄物中均未检测出Cry1Ac/Cry1Ab基因片段。这也与之前的研究结果一致[13,14]。Tony等[15]研究了转Bt176基因的玉米在肉鸡上的安全评价,结果显示在肉鸡所有组织和器官中均没有检测到转入的Bt基因的片段残留。同样的还有Einspanie等[16,17]和Rossi等[18]以肉鸡和生长猪作为试验对象,也未在试验动物的机体中检测到外源基因的残留。Ash等[19]也以抗草甘膦的豆粕饲喂蛋鸡,结果显示在蛋鸡的内脏器官及鸡蛋中均未发现转入的抗草甘膦基因片段。以上研究结果均与本试验结果一致,表明转Bt基因糙米中的外源基因未在生长猪的内脏器官、体液中残留,也未通过排泄物对生态系统造成危害。
3.3 转Bt基因糙米表达的外源蛋白质在生长猪组织器官及排泄物中的残留在转基因作物中外源基因表达的外源蛋白质是否能在动物体内发生残留,通常采用的方法是ELISA。大多研究表明了转基因作物中外源基因表达的外源蛋白质会通过动物的消化道进行消化分解[20,21,22,23]。Jennings等[16,17]通过转基因的抗虫玉米对肉仔鸡和生长猪的同时饲用,结果显示在其肌肉、器官组织中均未检测到外源基因及其表达蛋白质的残留。随后王长康等[24]、朱元招等[25]利用抗草甘膦的转基因豆粕对蛋鸡、番鸭及生长猪上进行了试验也得出了相似的结果,显示在试验动物的心脏、肝脏、肠道、胰腺、食道、肌肉、蛋品、肌肉及排泄物中均未发现有转基因成分的残留。Chowdhury等[26]同样利用了转基因的玉米对生长猪进行了试验,表明了转基因的外源蛋白质没有在生长猪的血液中沉积和残留。本试验结果显示,在2组生长猪的组织器官、血液、尿液、食糜、粪便中均未发现残留的外源Cry1Ac/Cry1Ab蛋白质,但在试验组猪只的唾液中检测到了有0.26 μg/μL外源Cry1Ac/Cry1Ab蛋白质,由于在同组猪只的尿液和血液中并没有检测到外源Cry1Ac/Cry1Ab蛋白质的残留,故其原因可能是口腔中还未消化完全的转Bt基因饲粮导致的。结果表明,转基因糙米作为动物饲粮饲用,糙米中的外源基因及其表达蛋白质会同糙米本身原有的自身蛋白质一样通过动物的消化道进行消化分解,未在动物机体中残留,也没有通过动物的排泄物进入生态环境对生态环境造成危机。
4 结 论转Bt基因糙米未对生长猪的组织器官造成生理结构的损伤,同时未在生长猪的组织器官、血液、尿液、食糜、粪便中检测到转Bt基因糙米中的外源蛋白质和外源基因。可以认为转Bt基因糙米中的外源蛋白质和外源基因与水稻中的常规蛋白质和基因一样在生长猪体内被消化代谢完全,不会在动物体内残留,也不会通过排泄物造成生态污染。
| [1] | 曹正辉,王占彬,顾宪红.转基因水稻饲用安全性评价的研究进展[J]. 中国畜牧兽医,2013,40(11):88-92. ( 1) 1)
|
| [2] | FANG H,DONG B,YAN H,et al.Effect of vegetation of transgenic Bt rice lines and their straw amendment on soil enzymes, respiration, functional diversity and community structure of soil microorganisms under field conditions[J]. Journal of Environmental Sciences,2012,24(7):1259-1270. ( 1) 1)
|
| [3] | PHIPPS R H,DEAVILLE E R,MADDISON B C.Detection of transgenic and endogenous plant DNA in rumen fluid, duodenal digesta,milk,blood,and feces of lactating dairy cows[J]. Journal of Dairy Science,2003,86(12):4070-4078. ( 2) 2)
|
| [4] | CHOWDHURY E H,SHIMADA N,MURATA H,et al.Detection of Cry1Ab protein in gastrointestinal contents but not visceral organs of genetically modified Bt11-fed calves[J]. Veterinary and Human Toxicology,2003,45(2):72-75. ( 2) 2)
|
| [5] | CHOWDHURY E H,KURIBARA H,HINO A,et al.Detection of corn intrinsic and recombinant DNA fragments and Cry1Ab protein in the gastrointestinal contents of pigs fed genetically modified corn Bt11[J]. Journal of Animal Science,2003,81(10):2546-2551. ( 2) 2)
|
| [6] | 中华人民共和国农业部.NY/T65-2004猪饲养标准[S]. 北京:中国标准出版社,2004. ( 2) 2)
|
| [7] | 谭建庄,刘莎莎,孙哲,等.抗草甘膦转基因豆粕对肉仔鸡肠黏膜免疫的影响[J]. 动物营养学报,2011,23(5):836-841. ( 2) 2)
|
| [8] | YONEMOCHI C,SUGA K,HARADA C,et al.Tevaluation of transgenic event CBH 351 (StarLink) corn in pig[J]. Animal Science Journal,2010,81(1):94-101. ( 2) 2)
|
| [9] | 杨月欣,陈淑蓉,韩军花,等.转SCK基因大米的营养学评价--小型猪比较喂养研究[J]. 营养学报,2005,27(1):38-41,45. ( 2) 2)
|
| [10] | HAMMOND B,DUDEK R,LEMEN J,et al.Results of a 13 week safety assurance study with rats fed grain from glyphosate tolerant corn[J]. Food and Chemical Toxicology,2004,42(6):1003-1014. ( 2) 2)
|
| [11] | HAMMOND B,LEMEN J,DUDEK R,et al.Results of a 90-day safety assurance study with rats fed grain from corn rootworm-protected corn[J]. Food and Chemical Toxicology,2006,44(2):147-160. ( 2) 2)
|
| [12] | CAO S,HE X,XU W,et al.Safety assessment of Cry1C protein from genetically modified rice according to the national standards of PR China for a new food resource[J]. Regulatory Toxicology and Pharmacology,2010,58(3):474-481. ( 2) 2)
|
| [13] | WALSH M C,BUZOIANU S G,REA M C,et al.Effects of feeding Bt MON810 maize to pigs for 110 days on peripheral immune response and digestive fate of the cry1Ab gene and truncated Bt toxin[J]. PloS One,2012,7(5):e36141. ( 1) 1)
|
| [14] | BUZOIANU S.Fate of transgenic DNA and protein in pigs fed genetically modified Bt maize and effects on growth and health .Ph.D.Theses. Waterford:Waterford Institute of Technology,2011. ( 1) 1)
|
| [15] | TONY M A,BUTSCHKE A,BROLL H,et al.Safety assessment of Bt176 maize in broiler nutrition:degradation of maize-DNA and its metabolic fate[J]. Archives of Animal Nutrition,2003,57(4):235-252. ( 1) 1)
|
| [16] | JENNINGS J C,ALBEE L D,KOLWYCK D C,et al.Attempts to detect transgenic and endogenous plant DNA and transgenic protein in muscle from broilers fed yield gard corn borer corn[J]. Poultry Science,2003,82(3):371-380. ( 2) 2)
|
| [17] | JENNINGS J C,KOLWYCK D C,KAYS S B,et al.Determining whether transgenic and endogenous plant DNA and transgenic protein are detectable in muscle from swine fed Roundup Ready soybean meal[J]. Journal of Animal Science,2003,81(6):1447-1455. ( 2) 2)
|
| [18] | ROSSI F,MORLACCHINI M,FUSCONI G,et al.Effect of Bt corn on broiler growth performance and fate of feed-derived DNA in the digestive tract[J]. Poultry Science,2005,84(7):1022-1030. ( 1) 1)
|
| [19] | ASH J,NOVAK C,SCHEIDELER S E.The fate of genetically modified protein from Roundup Ready soybeans in laying hens1[J]. The Journal of Applied Poultry Research,2003,12(2):242-245. ( 1) 1)
|
| [20] | CHEN M,YE G Y,LIU Z C,et al.Analysis of Cry1Ab toxin bioaccumulation in a food chain of Bt rice, an herbivore and a predator[J]. Ecotoxicology,2009,18(2):230-238. ( 1) 1)
|
| [21] | 刘莎莎.转基因豆粕对肉仔鸡饲用安全性的研究 .硕士学位论文.长春:吉林大学,2011. ( 1) 1)
|
| [22] | 杜红方.转基因水稻作为肉仔鸡日粮原料的安全性评价 .博士学位论文.北京:中国农业科学院,2006. ( 1) 1)
|
| [23] | 周联高.高赖氨酸转基因稻谷对肉仔鸡饲用安全性的研究 .硕士学位论文.江苏:扬州大学,2009. ( 1) 1)
|
| [24] | 王长康,陈文炳,邵碧英,等.饲料中的转基因成分在家禽体内代谢残留的研究[J]. 食品科学,2007,28(8):428-432. ( 1) 1)
|
| [25] | 朱元招,尹靖东,李德发,等.生长猪对转基因豆粕外源DNA的代谢研究[J]. 畜牧兽医学报,2005,36(10):1083-1086. ( 1) 1)
|
| [26] | CHOWDHURY E H,KURIBARA H,HINO A,et al.Detection of corn intrinsic and recombinant DNA fragments and CrylAb protein in gastrointestinal of pig fed genetically modified corn Bt11[J]. Journal of Animal Science,2003,81(10):2546-2551. ( 1) 1)
|




