黄曲霉毒素(aflatoxin,AF)是黄曲霉和寄生曲霉的次级代谢物,世界粮农组织对食用作物的污染情况进行了估计,发现在约25%受真菌毒素污染的作物中,AF污染最为严重[1]。美国农业经济学家统计,AF污染的饲料每年至少要使美国畜牧业遭受10%的经济损失[2]。目前,已发现的AF约20种,其中黄曲霉毒素B1(AFB1)因毒性最强、分布最广、危害最大而被列入一级致癌物[3]。同时,AFB1也是最有潜力的细胞毒性物质,它进入机体产生活性氧簇(ROS)从而引起氧化应激反应[4,5],造成慢性或急性中毒,最终导致畸形、突变和癌症的发生[6,7,8]。
在机体抗氧化应激过程中,核转录因子E2相关因子2(Nrf2)是重要的调节因子,正常情况下,Nrf2和细胞骨架相关蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)以二聚体的形式存在于细胞质中,维持细胞的酶类和抗氧化物处于基础表达水平,使细胞处于稳定状态[9,10]。氧化应激源作用下,Nrf2与Keap1解偶连后转移入核,与抗氧化反应元件(antioxidant response element,ARE)上位点结合,启动ARE调控的Ⅱ相解毒酶及抗氧化酶基因表达,增加细胞对氧化应激的抗性[11]。
硒(Se)是机体必需的微量元素,也是一种有效的抗氧化剂,它能够清除体内代谢产生的氧自由基离子等,保护细胞膜及细胞器膜免受氧自由基的干扰和损害[12]。关于Se用于AF毒性缓解的报道[13,14]已有很多,但其作用机制鲜有研究。为此,本试验以爱拔益加(AA)肉鸡为试验对象,旨在研究Se对AFB1引起肉鸡肝脏毒性损伤的保护及其可能作用机制,为Se更有效的利用提供科学依据。
1 材料与方法 1.1 试验设计选用1日龄AA肉鸡90羽,随机分为3组,每组3个重复,每个重复10只,公母各占1/2,初始体重差异不显著(P>0.05)。对照组饲喂基础饲粮 (AFB1含量小于国家饲料卫生标准GB 13078—2001规定,Se含量为0.1 mg/kg),其为参照NRC(1994)营养需要配制的粉状配合饲料,基础饲粮组成及营养水平见表1。AFB1组饲喂在基础饲粮中添加100 μg/kg AFB1的试验饲粮(AFB1添加量参考文献[15]),Se组饲喂在AFB1组饲粮中添加0.3 mg/kg Se的试验饲粮(Se添加量参考文献[13, 16]),Se以亚硒酸钠(Na2SeO3)的形式添加。试验期为42 d,其中,1~21日龄饲喂前期料,22~42日龄饲喂后期料。肉仔鸡自由采食,充足饮水,常规免疫。
| 表1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验所需材料分别为:AFB1(Sigma公司)、Na2SeO3(陕西石油化工研究设计院)、多聚甲醛(上海凌峰化学试剂有限公司)、动物切片石蜡(熔点60~62 ℃,上海国药集团化学试剂有限公司)、抗氧化和肝功能测试盒、苏木精-伊红(HE)染液(南京建成生物工程研究所)、Nrf2抗体(美国Santa Cruz Biotechnology公司)、含半胱氨酸的天冬氨酸蛋白水解酶-3(caspase-3)抗体(美国Cell Signaling Technology公司)、胞质胞核蛋白提取试剂盒和BCA蛋白质测定试剂盒(碧云天)。试验中所使用到的仪器设备有:石蜡切片机Leica RM-2235和烘片机Leica HI-1220(上海徕卡仪器有限公司)、光学显微镜Nikon YS-100(日本Nikon株式会社)、酶标仪(美国Thermo公司)、5417-R型台式冷冻高速离心机(德国Eppendorf公司)、低温冷冻离心机J2-MI型(德国Beckman公司)和虚拟显微镜(日本Olympus公司)。
1.3 样品采集试验第42天,每组随机抽取6只采样,采样前禁食24 h,自由饮水。静脉采血,3 500 r/min离心15 min,取上清,置于-20 ℃冰箱保存。采血后屠宰,采集肝脏组织,部分放入4%多聚甲醛溶液固定,用于制作肝脏病理切片;部分-20 ℃冷冻保存,用于肝脏氧化应激反应指标的测定和免疫组织化学、蛋白质印迹分析。
1.4 检测指标及方法 1.4.1 生产性能指标根据饲养试验,统计体重、采食量、死亡情况和肝脏重,计算平均日采食量(ADFI)、平均日增重(ADG)、料重比(F/G)和死淘率。肝脏重统计数n=6,其他生产性能指标统计数n=30。
1.4.2 肝脏组织病理切片将经4%多聚甲醛固定24 h的肝脏样本经透明、透蜡、包埋等处理后,制成5 μm的切片,苏木精 — 伊红(HE)染色,镜检观察并拍照。
1.4.3 血清生化(肝功能)指标静脉采血后,3 500 r/min离心15 min,吸取上清液,采用试剂盒测定谷丙转氨酶(GPT)和谷草转氨酶(GOT)的活性。统计数n=6。
1.4.4 肝脏氧化指标称取肝脏组织0.10~0.15 g,按重量体积比加入9倍体积的冰冷生理盐水,用组织匀浆机10 000~15 000 r/min充分研磨,然后3 800 r/min离心15 min,吸取上清液备用。统计数n=6。采用试剂盒测定肝的总蛋白(TP)、过氧化氢(H2O2)、丙二醛(MDA)、谷胱甘肽(GSH)的含量和总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性。
1.4.5 免疫组织化学法将固定好的肝脏样本经透明、透蜡、包埋等处理后,于3-氨基丙基三乙氧基硅烷(3-aminopropyl-triethoxysilane,APES)预处理的载玻片上制成5 μm的切片。切片经二甲苯和酒精逐步处理后,置于0.01 mol/L的柠檬酸钠溶液,高温加热15 min,再在含3%过氧化氢(H2O2)的甲醇中放置30 min。使用羊血清封闭1 h后,加入Nrf2抗体(0.01 mol/L磷酸缓冲液稀释200倍),4 ℃孵育过夜。经二抗孵育和二氨基联苯胺(DAB)显色等过程后,镜检拍照。
1.4.6 蛋白质印迹法取60 mg肝脏组织进行匀浆,3 500 r/min离心10 min,使用胞质胞核提取试剂盒将质核分离,BCA试剂盒测其蛋白质浓度,根据上样量计算样品与蛋白质变性剂添加量。蛋白变性之后,以组蛋白(H-3)为内参,经上样、跑胶、转膜、封闭、一抗和二抗孵育等步骤,最后加发光液显影并拍照。统计数n=3。
1.5 数据统计分析试验数据使用Excel 2007进行初步处理后,采用Graphpad Prism 5.0软件进行统计,用one-way ANOVA和Turkey氏多重比较法进行分析,结果以平均值±标准误(mean±SEM)或者平均值表示,P<0.05为差异显著。
2 结果与分析 2.1 Se对AFB1暴露肉鸡生产性能的影响由表2可知,1~21日龄时,Se和AFB1对ADFI、ADG、F/G及肝脏重无显著影响(P>0.05);从饲喂的全期(1~42日龄)看,与对照组相比,AFB1组肉鸡肝脏重显著降低(P<0.05),ADFI和F/G有所升高(P>0.05),ADG略有降低(P>0.05);与AFB1组相比,Se组肉鸡ADFI和F/G有所降低(P>0.05),肝脏重则显著增加(P<0.05),3组的死淘率差异不显著(P>0.05)。
| 表2 饲粮添加Se对AFB1暴露肉鸡生产性能的影响 Table 2 Effects of Se on performance of AFB1 exposed broilers |
由表3可知,与对照组相比,饲粮添加AFB1会导致肉鸡血清GOT(P>0.05)和GPT(P<0.05)活性升高,肝TP含量有所降低,但差异不显著(P>0.05);Se组GOT和GPT活性与AFB1组比有所降低,但差异不显著(P>0.05)。
| 表3 添加Se对AFB1暴露肉鸡肝功能指标的影响 Table 3 Effects of Se on liver function of AFB1 exposed broilers |
由表4可知,饲粮添加AFB1会降低肝脏GSH含量、GSH-Px和T-SOD活性(P<0.05),同时,增加了H2O2(P>0.05)和MDA(P<0.05)含量。与AFB1组相比,Se组GSH-Px和T-SOD活性恢复到正常水平且2组间差异显著(P<0.05),H2O2和MDA含量有一定程度的改善(P>0.05)。
| 表4 添加Se对AFB1暴露肉鸡肝脏氧化和抗氧化指标的影响 Table 4 Effects of Se on liver oxidant and antioxidant action of AFB1 exposed broilers |
由组织形态学图片(图1)可以看出,添加AFB1的肝脏组织中出现大量的出血位点,细胞之间间隙变大,细胞排列不紧凑,肝脏实质胰腺泡排列紊乱、卵圆形细胞增生和坏死(图1-B)。而对照组(图1-A)和Se组(图1-C)肝组织结构和细胞形态基本正常。
 | 图1 Se对AFB1暴露肉鸡肝脏组织学的影响 Fig.1 Effects of Se on histomorphology of AFB1 exposed broilers |
由图2可以看出,饲粮添加AFB1会使肝细胞Nrf2入核表达增加,呈现阳性表达(图2-B);而加Se后,Nrf2阳性表达降低,表明了Nrf2在核内的表达减少(图2-C)。
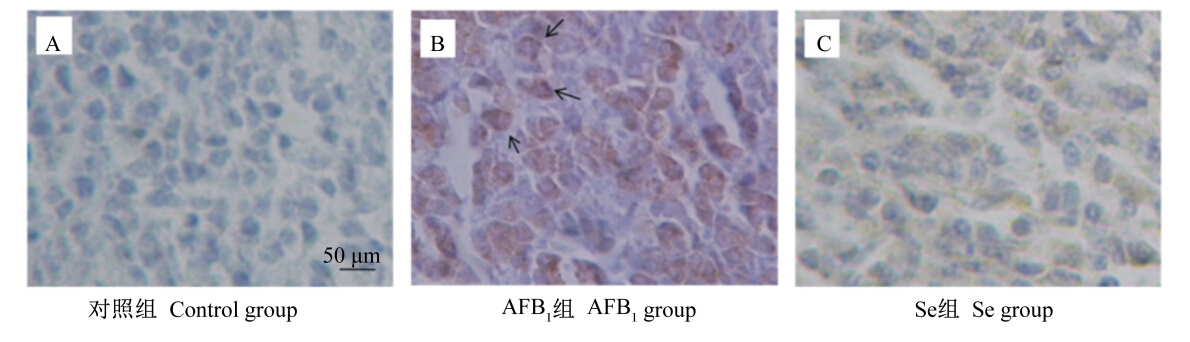 | 图2 Se对AFB1暴露肉鸡肝细胞胞核Nrf2表达的影响(免疫组织化学法) Fig.2 Effects of Se on Nrf2 expression in hepatocytes nucleus of AFB1 exposed broilers (immunohistochemisty assay) |
由图3可知,饲粮加入AFB1后,胞核内Nrf2的表达量显著高于对照组和加Se组(P<0.05),Se组和对照组胞核内Nrf2的表达量无显著差异(P>0.05);同时,AFB1组发现caspase-3的入核表达,但对照组和Se组没有出现(图3-A)。图3-A经灰度分析软件检测后得到目的蛋白和内参蛋白的比值(图3-B)。
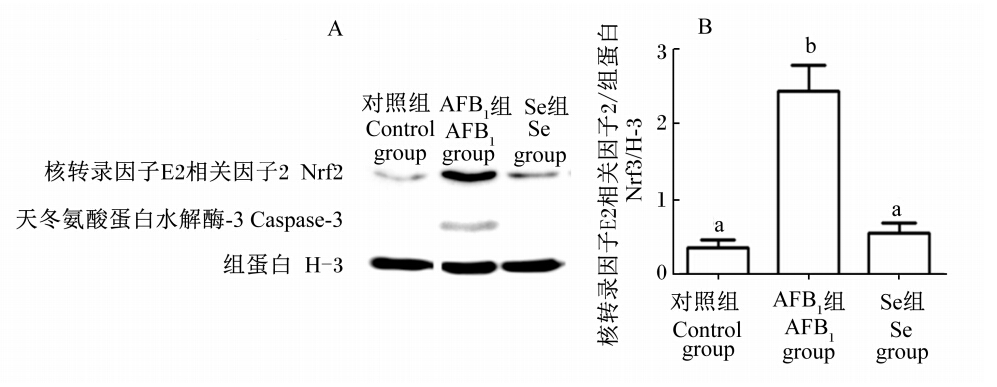 | 图3 Se对AFB1暴露肉鸡肝细胞胞核Nrf2和caspase-3表达的影响(蛋白质印迹法)
Fig.3 Effects of Se on Nrf2 and caspase-3 expression in hepatocytes nucleus of AFB1 exposed broilers (western blotting)数据柱标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Date column with the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). |
家禽是对AFB1最为敏感动物之一,AFB1可导致ADG和ADFI降低,其影响程度与家禽品种、日龄等因素有关[17],而对于动物AFB1中毒并无特效药物治疗。石达友等[18]研究发现,每天给雏鸭灌胃1 mg/kg的Na2SeO3能显著缓解AFB1所致雏鸭生长性能下降的影响,显著降低F/G和死亡率。本试验发现,AFB1组肉鸡精神沉郁且粪便偏绿,但死淘率并未显著增加。与对照组相比,AFB1组F/G升高了12.50%,肝脏重降低了28.20%,且并无明显肿大,李亚琳[19]使用甲醛对小鼠攻毒时也发现攻毒组小鼠肝脏的脏器系数降低,因此我们推测本试验采用的100 μg/kg AFB1可能增加了肉鸡肝脏代谢负荷,抑制了肝脏的正常生长发育,从而导致AFB1组肉鸡肝脏重显著低于对照组和Se组。加Se后,肝脏重与对照组相比差异不显著,与AFB1组相比差异显著。王钟翊等[20]使用含霉变玉米的饲粮饲喂麻鸭,发现与对照组相比,AFB1组ADG降低了18.32%,F/G提高了7.61%。在AFB1污染饲粮中添加纳米Se,ADG、F/G与对照组相比差异均不显著,与AFB1组相比差异均显著。本试验中,1~42日龄,AFB1组的ADFI比对照组升高5.55%,ADG降低2.86%,Se组ADFI和F/G得到一定的改善,但其效果并不明显。 3.2 Se对AFB1暴露肉鸡肝功能指标的影响
肝脏是机体物质代谢的活动中心,肝脏酶GOT、GPT是代谢过程中必不可少的催化剂[21],同时也是反映肝实质损害的指标,当肝细胞受损时,它们会被释放入血液。曹红等[22]给肉仔鸡饲喂含相同水平的AFB1饲粮后,发现血清GOT、GPT活性显著升高。本试验中,饲粮添加AFB1后,GPT活性显著升高,GOT活性则有升高趋势,说明饲喂AFB1污染饲粮能够诱导肉仔鸡AF中毒症的发生,扰乱肝脏正常功能,这一结果与Stanley[23]在肉仔鸡上的试验结果类似;添加Se后,这些指标趋于正常,这与Se的免疫功能保护作用相关,也表明Se能缓解AFB1对肝功能的损伤。
3.3 Se对AFB1暴露肉鸡氧化和抗氧化指标的影响氧化和抗氧化指标的变化是机体是否受到氧化应激反应的直观表现[24,25]。Wang等[26]研究发现,AFB1在显著降低其暴露肉鸡脾脏内GSH-Px、T-SOD活性和GSH含量的同时,使MDA含量升高。本试验中,AFB1组肉鸡肝脏T-SOD、GSH-Px活性及GSH含量显著降低,表明AFB1暴露消耗了肝脏内大量抗氧化酶及非酶物质;H2O2是ROS的一种,MDA是细胞膜脂质过氧化的产物,因而随着这些物质含量的降低,H2O2和MDA含量显著升高。Se是一些抗氧化酶的必需组成[27],也是动物机体非酶促抗氧化系统的组成部分[28],因而,当在含AFB1的饲粮中添加Se后,机体抗氧化酶的表达增多,抗氧化能力也随之增强。
3.4 Se对AFB1暴露肉鸡肝脏组织学的影响Kumar等[29]报道饲喂AF的肉鸡肝脏出现肿大和苍白,本试验中,组织病理学切片观察发现添加AFB1会使肝脏组织出现大量的出血位点,细胞间隙增大,细胞排列不紧凑。肝脏实质胰腺泡排列紊乱、卵圆形细胞增生和坏死,这说明肝脏作为AFB1作用的靶器官受到损伤作用。Se组肉鸡肝脏组织结构和细胞形态基本恢复,这是由于Se降低AFB1引起的肝脏氧化损伤作用,从而使肝脏恢复正常状态。
3.5 Se对AFB1暴露肉鸡肝细胞胞核Nrf2和caspase-3表达的影响本试验Western blotting分析发现,AFB1组caspase-3入核表达增加,这说明AFB1诱导了肝细胞的凋亡,这一结果与Brahmi等[30]研究结果类似。对照组和Se组肝细胞核中没有发现caspase-3,表明Se对AFB1引起的细胞凋亡起到了缓解作用。
免疫组织化学和Western blotting分析皆发现,AFB1组中,肝细胞核中Nrf2表达量显著高于对照组,这可能是由于AFB1引起机体损伤的重要原因之一是在体内产生ROS[31],当ROS浓度超过细胞所能承受的抗氧化能力时,细胞和组织中便会出现氧化应激[32],ROS激活Nrf2抗氧化通路[33],促使胞质Nrf2解离进入胞核。进入细胞核的Nrf2与抗氧化反应元件ARE作用,调控ARE依赖的第II相解毒酶和抗氧化酶基因的转录,这些酶包括谷胱甘肽S转移酶(GSTs)和超氧化物歧化酶(SOD)等[9],足够的抗氧化酶水平能够降低ROS的形成,并保护机体抵抗凋亡损伤[23]。
试验也发现,当在AFB1污染饲粮中添加Se后,胞核Nrf2含量维持在对照组水平,我们推测出现这一结果原因可能有以下2点:1)Se属于非酶系抗氧化物,本身具有抵抗自由基的作用,从而减少作用于细胞质Nrf2抗氧化通路的ROS,使Nrf2入核表达减少;2)Se是一些ARE下游调控的抗氧化酶(如GSH-Px)的重要组成,它能够参与这些酶的合成,使抗氧化酶产量增加,而增加的酶负反馈调节胞质中Nrf2的解离,从而使加Se组Nrf2入核减少。
4 结 论① 饲粮添加100 μg/kg AFB1会使42日龄肉鸡的ADFI和F/G升高,ADG和肝脏重降低,血清GOT、GPT活性升高,同时,会使肝脏产生氧化应激反应,损伤肝细胞,引起细胞凋亡,激活Nrf2抗氧化通路。
② 在AFB1污染饲粮中添加0.3 mg/kg Se能在一定程度上缓解AFB1引起的肉鸡肝脏氧化应激损伤,原因可能是Se本身具有的抗氧化作用以及它能够参与Nrf2抗氧化通路下游抗氧化酶的合成,从而降低ROS水平,减少其对Nrf2入核表达的刺激作用。关于这一结果的具体作用机理还需进一步研究。
| [1] | Council for Agricultural Science and Technology (CAST) of USA.Mycotoxins:economic and health risks[M]. Ames, Iowa.Council for Agricultural Science and Technology, 1989, 116:91-91. ( 1) 1)
|
| [2] | SMILEY R D, DRAUGHON F A.Preliminary evidence that degradation of aflatoxin B1 by Flavobacterium aurantiacum is enzymatic[J]. Journal of Food Protection, 2000, 63(3):415-418. ( 1) 1)
|
| [3] | LEESON S, DIAZ G, SUMMERS J D.Poultry metabolic disorders and mycotoxins[M]. Britain:Nottingham University Press, 1995. ( 1) 1)
|
| [4] | TOWNER R A, QIAN S T, KADⅡSKA M B, et al.In vivo identification of afiatoxin-induced free radicals in rat bile[J]. Free Radical Biology and Medicine, 2003, 35(10):1330-1340. ( 1) 1)
|
| [5] | TOWNER R A, MASON R P, REINKE L A.In vivo detection of afiatoxin-induced lipid free radicals in rat bile[J]. Biochimica et Biophysica Acta(BBA):General Subjects, 2002, 1573(1):55-62. ( 1) 1)
|
| [6] | EATON D L, GROOPMAN J D.The toxicology of afiatoxins:human health, veterinary, and agricultural significance[M]. London:Academic Press, 1994:544. ( 1) 1)
|
| [7] | ABDEL-WAHHAB M A, OMARA E A, ABDEL-GALIL M M, et al.Zizyphus spina-christi extract protects against afiatoxin B1-initiated hepatic carcinogenicity[J]. African Journal of Traditional Complementary and Alternative Medicines, 2007, 4(3):248-256. ( 1) 1)
|
| [8] | ABDEL-WAHHAB M A, HASSAN N S, EI-KADY A A, et al.Red ginseng extract protects against afiatoxin B1 and fumonisins-induced hepatic pre-cancerous lesions in rats[J]. Food and Chemical Toxicology, 2010, 48(2):733-742. ( 1) 1)
|
| [9] | KWAK M K, WAKABAYASHI N, KENSLER T W.Chemoprevention through the Keap1-Nrf2 signaling pathway by phase 2 enzyme inducers[J]. Mutation Research, 2004, 555(1):133-148. ( 2) 2)
|
| [10] | MIN K J, KIM J H, JOU L, et al.Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2[J]. Glia, 2008, 56(9):1028-1037. ( 1) 1)
|
| [11] | 钟敏.Nrf2-Keap1抗氧化系统研究进展[J]. 中国公共卫生, 2006, 22(3):360-362. ( 1) 1)
|
| [12] | 刘永旺, 刘海舰, 王宝琴, 等.富硒麦芽对链尿佐菌素诱发糖尿病大鼠糖脂代谢的影响[J]. 南京农业大学学报, 2004, 27(3):81-84. ( 1) 1)
|
| [13] | GREGORY Ⅲ J F.Effect of dietary selenium on the metabolism of aflatoxin B1 in turkeys[J]. Food and Chemical Toxicology, 1984, 22(8):637-642. ( 2) 2)
|
| [14] | GRIFFIN A C.Role of selenium in the chemoprevention of cancer[J]. Advances in Cancer Research, 1979(29):419-442. ( 1) 1)
|
| [15] | 李红梅, 张勇.钠基膨润土和黄曲霉毒素吸附剂对肉鸡生长性能屠体性能及免疫性能的影响[J]. 当代畜牧, 2009(7):20-22. ( 1) 1)
|
| [16] | SHLIG A A.Effect of vitamin E and selenium supplement in reducing aflatoxicosis on performance and blood parameters in broiler chicks[J]. Iraqi Journal of Veterinary Sciences, 2009, 23:97-103. ( 1) 1)
|
| [17] | 卿中全, 于炎湖.黄曲霉毒素对家禽生产性能和健康的影响[J]. 中国饲料, 2000(3):35-36. ( 1) 1)
|
| [18] | 石达友, 廖申权, 刘念, 等.硒对黄曲霉毒素B1中毒雏鸭肾组织抗氧化功能的影响[J]. 中国兽医杂志, 2011, 47(12):19-21. ( 1) 1)
|
| [19] | 李亚琳.甲醛对小鼠肝脏毒性作用的研究[J]. 动物医学进展, 2013, 34(4):125-129. ( 1) 1)
|
| [20] | 王钟翊, 李前勇, 张德志.纳米硒对肉鸭日粮中黄曲霉毒素B1拮抗作用的研究[J]. 粮食与饲料工业, 2009(9):38-41. ( 1) 1)
|
| [21] | MOHIUDDIN S M.Effects of aflatoxin on immune response in viral diseases[J]. Poultry Adviser, 1992(20/21/23/24):50-5363. ( 1) 1)
|
| [22] | 曹红, 尹逊慧, 陈善林, 等.黄曲霉毒素解毒酶对岭南黄肉仔鸡日粮中黄曲霉毒素B1解毒效果的研究[J]. 动物营养学报, 2010, 22(2):424-430. ( 1) 1)
|
| [23] | STANLEY V G, OJO R, WOLDESENBET S, et al.The use of Saccharomyces cerevisiae to suppress the effects of aflatoxcosis in broiler chicks[J]. Poultry Science, 1993, 72(10):1867-1872. ( 2) 2)
|
| [24] | ALPSOY L, YILDIRIM A, AGAR G.The antioxidant effects of vitamin A, C and E on aflatoxin B1-induced oxidative stress in human lymphocytes[J]. Toxicology and Industrial Health, 2009, 25(2):121-127. ( 1) 1)
|
| [25] | KOTAN E, ALPSOY L, ANAR M, et al.Protective role of methanol extract of Cetraria islandica (L.) against oxidative stress and genotoxic effects of AFB1 in human lymphocytes in vitro[J]. Toxicology and Industrial Health, 2011, 27(7):599-605. ( 1) 1)
|
| [26] | WANG F Y, SHU G, PENG X, et al.Protective effects of sodium selenite against aflatoxin B1-induced oxidative stress and apoptosis in broiler spleen[J]. Environmental Research and Public Health, 2013, 10(7):2834-2844. ( 1) 1)
|
| [27] | FORCEVILLE X.Effects of high doses of selenium, as sodium selenite, in septic shock patients a placebo-controlled, randomized, double-blind, multi-center phase Ⅱ study-selenium and sepsis[J]. Journal of Trace Elements in Medicine and Biology, 2007, 21(Suppl.1):62-65. ( 1) 1)
|
| [28] | 曾昭惠, 张宗玉.自由基对线粒体DNA的氧化损伤与衰老[J]. 生物化学与生物物理进展, 1995, 22(5):429-432. ( 1) 1)
|
| [29] | KUMAR R, BALACHANDRAN C.Histopathological changes in broiler chickens fed aflatoxin and cyclopiazonic acid[J]. Veterinarski Arhiv, 2009, 79(1):31-40. ( 1) 1)
|
| [30] | BRAHMI D, BOUAZIZ C, AYED Y, et al.Chemopreventive effect of cactus Opuntia ficus indica on oxidative stress and genotoxicity of aflatoxin B1[J]. Nutrition and Metabolism, 2011, 8:73. ( 1) 1)
|
| [31] | CHAN H T, CHAN C, HO J W.Inhibition of glycyrrhizic acid on aflatoxin B1-induced cytotoxicity in hepatoma cells[J]. Toxicology, 2003, 188(2/3):211-217. ( 1) 1)
|
| [32] | SIES H.Oxidative stress:oxidants and antioxidants[J]. Experimental Physiology, 1997, 82(2):291-295. ( 1) 1)
|
| [33] | KOBAYASHI M, YAMAMOTO M.Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J]. Advances in Enzyme Regulation, 2006, 46(1):113-140. ( 1) 1)
|




