姜黄素(curcumin)是从姜科姜黄属植物姜黄(Curcumin longa)中提取的一种天然酚类色素,具有无毒无害的特点。自从1815年首次发现以来,姜黄素这种酚类色素已成为世界各国广泛使用的7个天然色素品种之一,是联合国粮农组织(FAO)专家委员会和世界卫生组织(WHO)批准的一种食品添加剂,广泛应用于食品加工领域。研究发现,姜黄素除了具有优良的着色性,还具有多种营养活性和药理学功能,包括抗氧化、降血脂和免疫增强等作用。近年来,随着人们对抗生素副作用认识的增强和对畜产品安全要求的提高,天然植物提取物作为抗生素替代品应用于动物生产已经成为研究热点。天然来源的姜黄素作为一种新型的绿色无公害饲料添加剂,开始在动物生产领域崭露头角。
1 姜黄素的理化性质姜黄素是一种植物源性的双阿魏酰甲烷化合物,也是草本植物姜黄的主要活性成分之一。姜黄素的熔点为183 ℃,呈结晶状,分子式为C21H20O6,分子量为368.37 g/mol[1]。从外观上看,姜黄素是一种鲜亮的橙黄色粉末物质,双羰基是它的显色基团。从化学结构上看(图1),姜黄素有一个α,β-不饱和-β-二酮基,且在2个苯环上分别有酚羟基和甲氧基[2]。
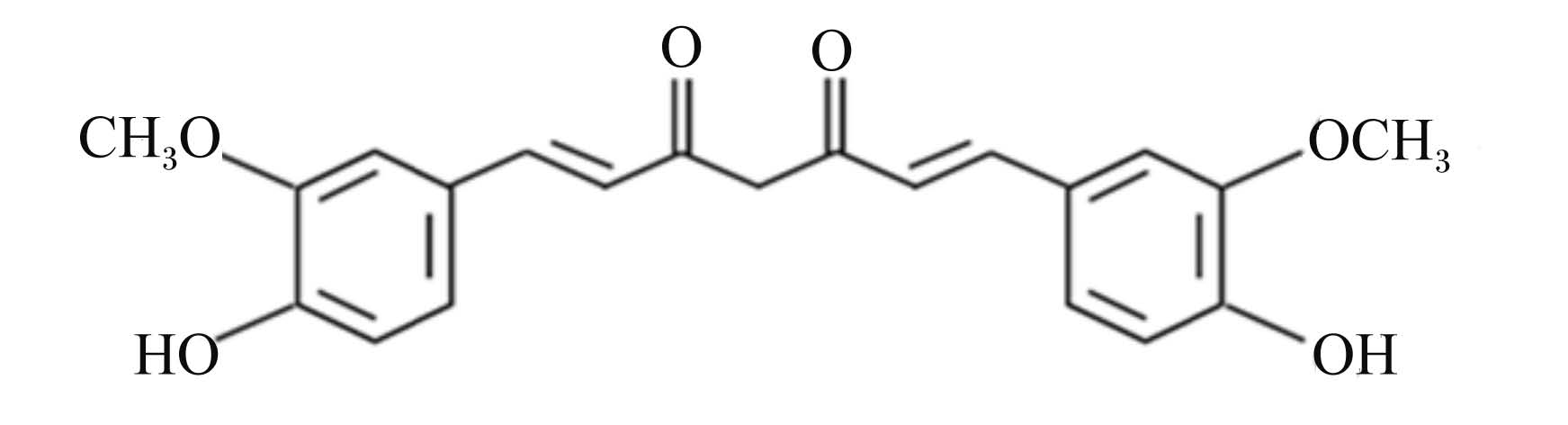 | 图1 姜黄素的结构式 Fig. 1 Structural formula of curcumin[2] |
姜黄素的溶解性和稳定性与溶剂的种类和pH相关。作为脂溶性的多酚类物质,姜黄素极不溶于水,但易溶于有机溶剂,如二甲基亚砜、丙酮和乙醇等。在酸性和中性条件下,姜黄素可以稳定保存。在碱性条件下,姜黄素非常不稳定,分解反应的产物主要为阿魏酸、阿魏酰甲烷和香草醛,其中的阿魏酰甲烷部分会迅速形成缩合产物,呈现黄色或棕褐色。目前生产上应用的姜黄素产品是由姜黄素、去甲姜黄素、双去甲姜黄素和环丙烷姜黄素等组成的混合物[3, 4]。体外抗氧化试验结果发现,姜黄素的抗氧化活性大于去甲姜黄素和双去甲姜黄素[5]。
2 姜黄素的生物学利用率和主要应用形式各种动物模型和人类临床试验表明,高剂量口服姜黄素不会对机体产生毒副作用。姜黄素的最高耐受剂量可达每人每天口服12 g[6, 7]。虽然许多研究证实了姜黄素的药理学安全性和治疗效果,但它在机体中血药浓度低,生物利用率不高,组织分布局限,转化速度快且代谢周期短。上述因素严重制约了姜黄素在动物生产和人类生活中的广泛应用[8]。临床研究显示,志愿者口服3 600 mg剂量的姜黄素后,血浆中的姜黄素水平因低于检测下限而无法测定,这一结果与前人的报道[9, 10]一致。利用同位素标记法,研究姜黄素在大鼠体内的代谢途径。结果显示,无论是口服还是腹腔注射,24 h内绝大部分的姜黄素都被排泄出机体,其中主要存在于粪便中,但在尿液中也检测到了少量姜黄素[11]。这提示,姜黄素在水溶液中的低溶解度和不稳定性与其在机体内的低生物学利用率关系密切。
通过阻断姜黄素的代谢途径或与姜黄素形成复合物,可以显著提高姜黄素在机体内的生物学利用率[8]。目前常见的提高姜黄素生物学利用率的途径有以下几种:1)固相分散型姜黄素。韩刚等[12]采用固相分散技术,显著提高了姜黄素在机体内的溶解度和生物学利用率。动物试验结果显示,与同等剂量的姜黄素相比,固相分散型姜黄素可显著提高肉鸡血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)的活性,显著降低血清中丙二醛(MDA)的含量。同时,固相分散型姜黄素对肉鸡血脂代谢也有显著的改善作用,与姜黄素原型相比,饲粮中添加固相分散型姜黄素可显著提高肉鸡的抗氧化能力和降低血脂水平[12]。2)姜黄素-磷脂复合物。研究表明,磷脂可提高某些天然药物在机体内的吸收效率,增强其治疗效果。在姜黄素-磷脂复合物中,姜黄素的实际含量约为32.04%,但与姜黄素原型或磷脂原型相比,该复合物在水溶液中具有更强的溶解性。大鼠攻毒试验表明,姜黄素-磷脂复合物通过提高谷胱甘肽(GSH)相关代谢酶活性,保护肝脏免受四氯化碳诱导的氧化损伤。在相同的添加剂量下,姜黄素-磷脂复合物可显著提高血清中游离的姜黄素水平,且该姜黄素具有更长的代谢周期,与姜黄素原型相比,姜黄素-磷脂复合物具有更好的吸收率和生物利用率[13]。3)姜黄素与胡椒碱结合使用。胡椒碱是从红胡椒中提取出来的一种多酚物质,其本身具有抗炎症、抗癌和抗氧化等多种生物学功能。药物动力学研究发现,胡椒碱对肝脏和肠道内的β-葡萄苷酸酶具有显著的抑制作用。当姜黄素与胡椒碱结合使用时,胡椒碱通过抑制葡萄苷酸化反应,减缓机体对姜黄素的首过代谢和降解作用,从而提高其生物学利用率和吸收率[14, 15]。4)纳米包被技术。纳米包被技术因包被物质的溶解性不同而选取不同的方法。由于姜黄素是一种脂溶性的多酚类物质,所以试验采用乳糜分散蒸发法对姜黄素进行包被处理。给小鼠口服纳米包被的姜黄素,结果发现,与普通姜黄素相比,纳米包被姜黄素显著提高了姜黄素在小鼠体内的生物学利用率[16, 17]。
3 姜黄素的抗氧化作用姜黄素是一种天然的链断式抗氧化剂,具有多种生物学功能,包括抗炎症、抗癌症和降血脂等[18]。研究认为,姜黄素的多种药理学活性与其优良的抗氧化性质密切相关。姜黄素的抗氧化活性主要来自2个方面:一是姜黄素作为自由基清除剂,直接中和环境中多余的自由基;二是姜黄素作为细胞内抗氧化信号通路的诱导剂,通过增强抗氧化酶活和二项代谢酶的活性,提高细胞的抗氧化防御能力。
3.1 体外抗氧化活性本实验室研究结果显示,作为一种脂溶性的抗氧化剂,姜黄素具有极强的自由基清除活性。与β-胡萝卜素、花青素等7种天然提取物相比,姜黄素具有最强的1,1-二苯基苦基苯肼自由基(DPPH·)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(ABTS·+)清除率。在10 μg/mL浓度时,姜黄素可及时清除超氧阴离子(O-2·)、过氧化氢(H2O2)自由基,且表现出优良的高铁氧化还原力[19]。Ak等[20]、Poorichaya等[21]通过体外试验也得到了类似的结果。
细胞模型较简单的化学反应体系更能反映出机体的复杂性,其试验结果也更具代表性。因此,为了进一步研究姜黄素的体外抗氧化活性,研究者选取鸡红细胞为试验对象,通过水溶性自由基2,2-偶氮二(2-脒基丙烷)盐酸盐(AAPH)诱导红细胞建立氧化应激模型,结果显示,姜黄素可缓解AAPH诱导的红细胞溶解和细胞凋亡,显著提高红细胞SOD活性和降低MDA含量[19]。Deng等[22]以人红细胞为试验材料,以维生素C为阳性对照,发现姜黄素可显著抑制AAPH介导的溶血反应,且作用效果优于维生素C。这提示,姜黄素作为一种脂溶性的抗氧化剂,可能利用自身的亲脂性整合进入红细胞膜磷脂区域,直接发挥中和自由基和抗氧化的作用[19]。
3.2 体内抗氧化功能近几年研究发现,姜黄素是核因子E2相关因子2(Nrf2)抗氧化信号通路的一个重要诱导剂。Nrf2是细胞氧化应激反应中的关键因子。在正常条件下,Nrf2与其阻抑蛋白Kelch样环氧氯丙烷相关蛋白-1(Keap1)结合,停留在细胞质,通过泛素化作用最终被降解。但在氧化应激条件下,级联放大的信号通过氧化修饰改变了Nrf2的构象,使其从Keap1上分离下来,进入细胞核,与抗氧化反应元件(ARE)结合,启动二项解毒酶和抗氧化酶等基因的表达。Gao等[23]的试验结果显示,姜黄素通过激活Nrf2的转录,保护肝脏免受砷诱导的氧化损伤。Sahin等[24]以鹌鹑为试验动物,研究姜黄素和热应激对肝脏功能的影响,结果显示,饲粮添加姜黄素可显著抑制热应激诱导的肝脏抗氧化酶失活;同时,姜黄素可上调Nrf2的蛋白质表达水平,提示姜黄素的抗氧化活性与激活Nrf2通路存在联系。
除了维持机体的氧化还原平衡,最新研究还发现,姜黄素可以通过线粒体-亚细胞定位,显著缓解应激源导致的氧化损伤。Waseem等[25]报道,姜黄素通过线粒体途径,显著缓解了重金属顺铂诱导的肝脏和脑组织氧化损伤。线粒体是细胞内活性氧(ROS)生成的主要场所。当发生氧化应激时,线粒体成为首当其冲的受损靶器官,尤其是线粒体中裸露的DNA和膜不饱和脂肪酸[26, 27]。本实验室团队研究发现,在热应激模型中,姜黄素通过提高线粒体抗氧化酶活和增强线粒体的生发作用,显著降低了肉鸡骨骼肌中的脂质过氧化反应和DNA的氧化损伤,这一结果与Vazeille等[28]的结果相似。线粒体功能紊乱是机体发生氧化损伤的重要机制之一,主要表现为氧化磷酸化能量转换功能速率降低,线粒体跨膜电位和ATP合成能力下降,线粒体DNA氧化损伤增加,线粒体膜的脂质过氧化反应及转录效率降低,线粒体生成的ROS增加等[26, 29]。本实验室之前的研究结果显示,在D-氨基半乳糖/脂多糖(D-GalN/LPS)诱导的肝脏急性损伤模型中,姜黄素显著降低了线粒体ROS的水平,抑制了线粒体膜电位的降低。肝脏病理学切片和透射电镜的结果也证实了姜黄素对线粒体的保护作用。Molina-Jijón等[30]报道姜黄素通过线粒体途径,显著缓解了重金属铬诱导的肾脏氧化损伤。有研究指出,天然的黄酮类物质可特异性的富集于线粒体中,发挥保护机体的作用[31]。姜黄素作为一植物源性的多酚物质,可能通过亚细胞定位发挥抗氧化活性,但其具体的作用机理尚需进一步研究。
4 姜黄素在肉鸡生产中应用目前关于姜黄素在动物生产中应用研究还处于起步阶段,且主要侧重于对家禽的报道。饲粮中添加不同水平的姜黄素可改善肉鸡的生产性能,提高肌肉品质,增强机体的免疫功能和抗氧化力。
4.1 提高生产性能胡忠泽等[32]用250 mg/kg姜黄素饲喂爱拔益加(AA)肉鸡,同时设对照组和抗生素负对照组,试验结果发现,与对照组相比,添加250 mg/kg姜黄素可显著提高21、42日龄肉鸡的体重、日增重和42日龄肉鸡的采食量,显著降低21日龄肉鸡的料重比;与抗生素负对照组相比,姜黄素可显著提高21日龄肉鸡的体重和日增重,但姜黄素对肉鸡的成活率没有显著影响。祝国强等[33]以肉鸡为动物模型,在肉鸡饲粮中分别添加150、200、250 mg/kg的姜黄素,结果显示,7周龄时,与对照组相比,200、250 mg/kg姜黄素分别使肉鸡体重显著提高了4.48%、1.59%,料重比显著降低了7.39%、6.40%;不同水平姜黄素有升高肉鸡全期体增重、降低料重比的趋势,但差异不显著。姜黄素对肉鸡生产性能的改善作用,不仅表现为提高体增重和降低料重比,研究发现姜黄素还可以显著提高肉鸡的屠宰性能,提高胴体产出率。祝国强等[34]试验发现,与对照组相比,200、250 mg/kg姜黄素均显著提高了42日龄肉鸡的全净膛重、屠宰率、胸肌重和腿肌重;100 mg/kg姜黄素有提高屠宰性能的趋势,但差异不显著。Durrani等[35]试验发现,饲粮添加0.5%的姜黄素可显著提高胸肌重和腿肌重,心脏和肌胃重量有升高的趋势,但与对照组差异不显著。
在应激条件下,肉鸡的发育受到抑制,生长性能降低,而饲粮添加姜黄素可缓解应激对肉鸡生长产生的负面影响。Gowda等[36]研究发现,饲粮添加不同水平姜黄素类物质可显著缓解黄曲霉毒素诱导的肉鸡生产性能的降低,与黄曲霉毒素添加组相比,饲喂222、444 mg/kg姜黄素类物质可显著提高肉鸡的体增重,显著降低料重比。这与Nader等[37]报道的结果基本一致。
4.2 改善肌肉品质姜黄素作为一种天然脂溶性黄色色素,一方面可以通过直接的沉积作用改善肉色;另一方面还可以通过调节肌肉中的脂肪含量和营养成分分布,提高肌肉的品质。祝国强等[33, 34]通过比色法和光密度法,检测姜黄素对肉鸡宰后肌肉肉色的影响,结果显示,宰杀后45 min,与对照组相比,姜黄素组的肉色差异不显著;但在4 ℃条件下保存24 h后,姜黄素组的肉色显著优于对照组,且这种肉色改善作用具有剂量依赖性。这提示,姜黄素可通过改善贮藏肌肉的色泽,提高肌肉品质。祝国强等[33]研究发现,添加150、200、250 mg/kg姜黄素有改善肌肉品质的作用,200、250 mg/kg姜黄素可显著降低胸肌和腿肌中总胆固醇和甘油三酯的水平;姜黄素有升高胸肌粗蛋白质含量的趋势,但差异不显著;200、250 mg/kg姜黄素分别显著提高了腿肌中粗蛋白质的含量16.83%和12.13%;3个水平的姜黄素均可显著降低腿肌中粗脂肪的含量,显著提高胸肌和腿肌中水分的含量;姜黄素对肌肉品质的改善作用,腿肌优于胸肌,且200 mg/kg的效果最佳。
4.3 增强免疫功能胡忠泽等[32]的试验结果显示,250 mg/kg姜黄素可显著提高肉鸡的胸腺指数和新城疫抗体效价40.00%和36.97%。但对法氏囊指数没有显著影响。然而,Nouzarian等[38]发现不同水平姜黄素类物质对肉鸡新城疫和流感病毒的抗体效价没有显著影响。胡忠泽等[32]进一步试验发现,姜黄素可显著促进肉鸡胸腺的生长发育,提高T淋巴细胞数和淋巴细胞的转化率,增强白细胞的吞噬功能。陈征义等[39]研究了姜黄素提取物对肉仔鸡免疫器官发育的影响,结果提示,姜黄素可改善肉鸡胸腺、法氏囊和脾脏等免疫器官的组织学形态。姜黄素不仅可以促进机体免疫器官的发育,而且还可以通过提高血清中的免疫球蛋白水平等多方面来增强机体抵御应激缓解的能力。250、500 mg/kg姜黄素可显著增加肉鸡血清中免疫球蛋白G(IgG)水平,而免疫球蛋白A(IgA)和免疫球蛋白M(IgM)水平有升高趋势,但差异不显著[32]。Emadi等[40]研究发现,饲粮添加0.25%、0.50%和0.75%的姜黄素类物质,可显著提高血清中乳酸脱氢酶和谷草转氨酶的活性,显著降低谷丙转氨酶和碱性磷酸酶的活性。这与Kumari等[41]的结果一致。Emadi等[42]和Arshami等[43]的试验结果均显示,饲粮添加姜黄素可显著降低血清白蛋白水平,但对红细胞总数和红细胞比容没有显著影响。
4.4 提高抗氧化能力姜黄素是一种脂溶性的天然抗氧化剂。体外研究显示,姜黄素可有效清除超氧阴离子、过氧化氢等活性氧自由基。体内试验表明,姜黄素除了可直接中和自由基外,还可以通过提高机体的抗氧化酶活性、诱导抗氧化基因的表达,来间接发挥抗氧化活性。Zhang等[19]在体外以鸡红细胞为模型,通过AAPH诱导氧化应激。试验结果显示,姜黄素可显著缓解AAPH介导的红细胞溶血作用,降低红细胞内脂质过氧化水平,提高SOD活性,最终抑制红细胞的凋亡。动物试验表明姜黄素具有降低血清、组织内脂质过氧化物,提高总抗氧化能力,增强SOD、GPx等活性的功能。胡忠泽等[32]通过给AA肉鸡饲喂250、500 mg/kg姜黄素发现,姜黄素可显著提高肉仔鸡血清中SOD、GPx和过氧化氢酶(CAT)活性,降低血清中MDA含量。韩刚等[44]通过肉鸡试验也得到了类似的结果。研究显示,姜黄素具有优良的抗氧化功能,并可以通过激活Nrf2抗氧化信号通路增强机体的抗氧化防御系统,但目前关于姜黄素对肉鸡抗氧化功能影响的机制研究有待进一步展开。
5 小 结大量的国内外研究结果表明,姜黄素具有良好的抗氧化作用,饲喂姜黄素可有效改善畜禽机体的健康状态,提高组织抵御氧化应激的能力。但是,目前对于姜黄素在畜禽饲粮中的适宜添加比例和具体的抗氧化作用机制仍不十分明确,尚需进行深入研究,以期为姜黄素作为一种绿色、新型饲料添加剂更有效地应用于畜禽生产提供更多理论依据。
| [1] | GOEL A,KUNNUMAKKARA A B,AGGARWAL B B.Curcumin as "curecumin":from kitchen to clinic[J]. Biochemical Pharmacology,2008,75(4):787-809. ( 1) 1)
|
| [2] | PRIYADARSINI K I,MAITY D K,NAIK C H,et al.Role of phenolic O-H and methylene hydrogen on the free radical reactions and antioxidant activity of curcumin[J]. Free Radical Biology & Medicine,2003,35(5):475-484. ( 1) 1)
|
| [3] | ANAND P,THOMAS S G,KUNNUMAKKARA A B,et al.Biological activities of curcumin and its analogues (Congeners) made by man and mother nature[J]. Biochemical Pharmacology,2008,76(11):1590-1611. ( 1) 1)
|
| [4] | PRIYADARSINI K I.Photophysics,photochemistry and photobiology of curcumin:studies from organic solutions,bio-mimetics and living cells[J]. Journal of Photochemistry and Photobiology C:Photochemistry Reviews,2009,10(2):81-95. ( 1) 1)
|
| [5] | JAYAPRAKASHA G K,JAGANMOHAN RAO L,SAKARIAH K K.Antioxidant activities of curcumin,demethoxycurcumin and bisdemethoxycurcumin[J]. Food Chemistry,2006,98(4):720-724. ( 1) 1)
|
| [6] | CHENG A L,HSU C H,LIN J K,et al.Phase I clinical trial of curcumin,a chemopreventive agent,in patients with high-risk or pre-malignant lesions[J]. Anticancer Research,2001,21(4B):2895-2900. ( 1) 1)
|
| [7] | LAO C D,RUFFIN M T Ⅵ,NORMOLLE D,et al.Dose escalation of a curcuminoid formulation[J]. BMC Complementary and Alternative Medicine,2006,6:10. ( 1) 1)
|
| [8] | ANAND P,KUNNUMAKKARA A B,NEWMAN R A,et al.Bioavailability of curcumin:problems and promises[J]. Molecular Pharmacology,2007,4(6):807-818. ( 2) 2)
|
| [9] | GARCEA G,JONES D J,SINGH R,et al.Detection of curcumin and its metabolites in hepatic tissue and portal blood of patients following oral administration[J]. British Journal of Cancer,2004,90(5):1011-1015. ( 1) 1)
|
| [10] | TAMVAKOPOULOS C,DIMAS K,SOFIANOS Z D,et al.Metabolism and anticancer activity of the curcumin analogue,dimethoxycurcumin[J]. Clinical Cancer Research,2007,13(4):1269-1277. ( 1) 1)
|
| [11] | HOLDER G M,PLUMMER J L,RYAN A J.The metabolism and excretion of curcumin (1,7-bis-(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione) in the rat[J]. Xenobiotica,1978,8(12):761-768. ( 1) 1)
|
| [12] | 韩刚,肖倩,刘莉,等.姜黄素固体分散体对肉鸡脂肪代谢的影响[J]. 黑龙江畜牧兽医,2012(1):55-57. ( 2) 2)
|
| [13] | MAITI K,MUKHERJE K,GANTAIT A,et al.Curcumin-phospholipid complex:preparation,therapeutic evaluation and pharmacokinetic study in rats[J]. International Journal of Pharmaceutics,2007,330(1/2):155-163. ( 1) 1)
|
| [14] | SHOBA G,JOY D,JOSEPH T,et al.Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers[J]. Planta Medica,1998,64(4):353-356. ( 1) 1)
|
| [15] | SURESH D,SRINIVASAN K.Studies on the in vitro absorption of spice principles-curcumin,capsaicin and piperine in rat intestines[J]. Food and Chemical Toxicology,2007,45(8):1437-1442. ( 1) 1)
|
| [16] | SHAIKH J,ANKOLA D D,BENIWAL V,et al.Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer[J]. European Journal of Pharmaceutical Sciences,2009,37(3/4):223-230. ( 1) 1)
|
| [17] | BHAWANA,BASNIWAL R K,BUTTAR H S,et al.Curcumin nanoparticles:preparation,characterization,and antimicrobial study[J]. Journal of Agricultural and Food Chemistry,2011,59(5):2056-2061. ( 1) 1)
|
| [18] | KHOPDE M S,PRIYADARSINI K I,VENKATESAN P,et al.Free radical scavenging ability and antioxidant efficiency of curcumin and its substituted analogue[J]. Biophysical Chemistry,1999,80(2):85-91. ( 1) 1)
|
| [19] | ZHANG J F,HOX X,AHMAD H,et al.Assessment of free radicals scavenging activity of seven natural pigments and protective effects in AAPH-challenged chicken erythrocytes[J]. Food Chemistry,2014,145:57-65. ( 4) 4)
|
| [20] | AK T,GULCIN I.Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions,2008,174(1):27-37. ( 1) 1)
|
| [21] | POORICHAYA S,PHISALAPHONG C,NAKORNCHAI S,et al.Comparative antioxidant activities of curcumin and its demethoxy and hydrogenated derivatves[J]. Biological & Pharmaceutical Bulletin,2007,30(1):74-78. ( 1) 1)
|
| [22] | DENG S L,CHEN F W,ZHOU B,et al.Protective effects of curcumin and its analogues against free radical-induced oxidative haemolysis of human red blood cells[J]. Food Chemistry,2006,98(1):112-119. ( 1) 1)
|
| [23] | GAO S,DUAN X X,WANG X,et al.Curcumin attenuates arsenic-induced hepatic injuries and oxidative stress in experimental mice through activation of Nrf2 pathway,promotion of arsenic methylation and urinary excretion[J]. Food and Chemical Toxicology,2013,59:739-747. ( 1) 1)
|
| [24] | SAHIN K,ORHAN C,TUZCU M,et al.Curcumin ameloriates heat stress via inhibition of oxidative stress and modulation of Nrf2/HO-1 pathway in quail[J]. Food and Chemical Toxicology,2012,50(11):4035-4041. ( 1) 1)
|
| [25] | WASEEM M,PARVEZ S.Mitochondrial dysfunction mediated cisplatin induced toxicity:modulatory role of curcumin[J]. Food and Chemical Toxicology,2013,53:334-342. ( 1) 1)
|
| [26] | ANDREYEV A Y,KUSHNAREVA Y E,STARKOV A A.Mitochondrial metabolism of reactive oxygen species[J]. Biochemistry,2005,70(2):200-214. ( 2) 2)
|
| [27] | BRAND M D,AFFOURTIT C,ESTEVES T C,et al.Mitochondrial superoxide:production,biological effects,and activation of uncoupling proteins[J]. Free Radical Biology & Medicine,2004,37(6):755-767. ( 1) 1)
|
| [28] | VAZEILLE E,SLIMANI L,CLAUSTRE A,et al.Curcumin treatment prevents increased proteasome and apoptosome activities in rat skeletal muscle during reloading and improves subsequent recovery[J]. The Journal of Nutritional Biochemistry,2012,23(3):245-251. ( 1) 1)
|
| [29] | CORREA F,BUELNA-CHONTAL M,HERNÁNDEZ-RESÉNDIZ S,et al.Curcumin maintains cardiac and mitochondrial function in chronic kidney disease[J]. Free Radical Biology & Medicine,2013,61:119-129. ( 1) 1)
|
| [30] | MOLINA-JIJÉN E,TAPIA E,ZAZUETA C,et al.Curcumin prevents Cr(VI)-induced renal oxidant damage by a mitochondrial pathway[J]. Free Radical Biology & Medicine,2011,51(8):1543-1557. ( 1) 1)
|
| [31] | DORTA D J,PIGOSO A A,MINGATTO F E,et al.The interaction of flavonoids with mitochondria:effects on energetic processes[J]. Chemico-Biological Interactions,2005,152(2/3):67-78. ( 1) 1)
|
| [32] | 胡忠泽,金光明,王立克,等.姜黄素对肉鸡生产性能和免疫机能的影响[J]. 粮食与饲料工业,2004(10):44-45. ( 5) 5)
|
| [33] | 祝国强,侯风琴.姜黄素对肉仔鸡日增重、脂质代谢、肉品质的影响[J]. 饲料博览,2007(3):49-51. ( 3) 3)
|
| [34] | 祝国强,王斌,侯风琴,等.姜黄素对肉鸡生产性能及肉品质的影响[J]. 饲料工业,2009,30(13):8-10. ( 2) 2)
|
| [35] | DURRANI F R,ISMAIL M,SULIAN A,et al.Effect of different levels of feed added turmeric (Curcuma longa) on the performance of broiler chicks[J]. Journal of Agricultural and Biological Science,2006,1(2):9-11. ( 1) 1)
|
| [36] | GOWDA N K,LDOUX D R,ROTTINGHAUSET G E,et al.Antioxidant efficacy of curcuminoids from turmeric (Curcuma longa L.) powder in broiler chickens fed diets containing aflatoxin B1[J]. The British Journal of Nutrition,2009,102(11):1629-1634. ( 1) 1)
|
| [37] | NADER R,MAJID GHOLAMI A.Evaluation of turmeric extract on performance indices impressed by induced aflatoxicosis in broiler chickens[J]. Toxicology & Industrial Health,2011,27(10):956-960. ( 1) 1)
|
| [38] | NOUZARIAN R,TABEIDIAN S A,TOGHYANI M,et al.Effect of turmeric powder on performance,carcass traits,humoral immune responses,and serum metabolites in broiler chickens[J]. Journal of Animal and Feed Sciences,2011,20:389-400. ( 1) 1)
|
| [39] | 陈征义,吴迪.姜黄素和饲用抗生素对肉鸡生产性能和免疫机能的影响[J]. 广东饲料,2010,19(6):24-26. ( 1) 1)
|
| [40] | EMADI M,KERMANSHAHI H.Effect of turmeric rhizome powder on performance and carcass characteristics of broiler chickens[J]. International Journal of Poultry Science,2006,5(11):1069-1072. ( 1) 1)
|
| [41] | KUMARI P,CUPTA M K,RANJAN R,et al.Curcuma longa as feed additive in broiler birds and its patho-physiological effects[J]. Indian Journal of Experimental Biology,2007,45(3):272-277. ( 1) 1)
|
| [42] | EMADI M,KERMANSHAHI H.Effect of turmeric rhizome powder on immunity responses of broiler chickens[J]. Journal of Animal and Veterinary Advances,2007,6(7):833-836. ( 1) 1)
|
| [43] | ARSHAMI J,PILEVAR M,AAMI AZGHAD M,et al.Hypolipidemic and antioxidative effects of Curcumin on blood parameters,humoral immunity,and jejunum histology in Hy-line hens[J]. Avicenna Journal of Phytomedicine,2013,3(2):178-185. ( 1) 1)
|
| [44] | 韩刚,郭肖菲,肖倩,等.姜黄素固体分散体对肉鸡血脂和抗氧化能力的影响[J]. 饲料工业,2011(11):30-31. ( 1) 1)
|



