禽类蛋壳基质蛋白质含量为0.89%~1.18%,蛋壳含有2%的有机质,其中70%是蛋白质,11%是多糖[1],100 g蛋壳粉平均含有28.8~54.4 mg的酸溶蛋白质[2]。在蛋壳形成的钙化阶段,子宫液中检测到一系列分子质量14~180 ku的特异性蛋白质,可分为ovocleidins和ovocalyxins两大类,前者主要有ovocleidin-17(OC-17)、ovocleidin-116(OC-116),后者主要有ovocalyxin-21(OCX-21)、ovocalyxin-25(OCX-25)、ovocalyxin-32(OCX-32)和ovocalyxin-36(OCX-36)。OCX-36在蛋壳、壳膜中含量丰富,具有抑菌等生物活性。通过免疫荧光技术检测,表征其生物学功能可以评估禽蛋的自然防御能力,从而降低消费者摄入鸡蛋导致的食源性疾病的风险。本文就OCX-36在禽蛋中的分布、基因结构以及生物活性等研究做简要综述,旨在为研究该蛋白质提供参考。
1 OCX-36在蛋壳中分布及来源2007年法国国家农业科学研究所的Jol Gautron和其团队首先命名了ovocalyxin-36[3](ovum,拉丁语,卵的意思;calyx,拉丁语,壳的意思[4]。此词可翻译为卵壳素-36),OCX-36是一种在蛋壳高效钙化时表达的蛋白质,主要位于蛋壳内层和壳膜,由453个氨基酸组成,分子质量36 ku,已知其cDNA序列全长1 995 bp[3]。肉仔鸡OCX-36基因序列和斑马雀(56%)同源性较接近。同OC-17、OC-116和OCX-32基因相比,OCX-36基因在物种间高度保守。
光学显微镜和电子显微镜胶体金免疫标记定位研究证实,整个蛋壳中的OCX-36在与膜相邻的壳的内侧区域(乳头锥体层)具有最强的免疫染色,是蛋壳、蛋壳膜中丰度最高的蛋白质[3]。利用RT-PCR技术对OCX-36起源的研究表明,OCX-36 mRNA的表达发生在蛋壳形成(峡部和子宫)以及消化道的输卵管区域等钙化发生组织[5, 6]。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,蛋壳在形成过程中,蛋白质混合物组分,包括以水溶性前体存在的蛋壳基质成分,在钙化过程不同阶段的变化相当大,特别是32~36 ku蛋白质在生长活跃阶段尤为明显[3]。
在蛋壳形成的钙化阶段,子宫液中的OCX-36含量较高,它只在子宫中表达。进入子宫后,表达受到增量调控,因此,这种蛋白质可能是控制蛋壳形成的重要因素。排卵后的18 h在白峡、红峡以及子宫中均能检测出,只有宫旁组织在排卵3 h之后才能检测到[3]。OCX-36蛋白质在输卵管的管腔内的传输路径为从红峡和子宫向白峡迁移,这可以解释其与壳膜形成的关联。1.5 h内通过白峡,沉积为高度交联的胞外纤维网状结构的蛋壳膜形成了最内层的壳膜。这些纤维作为用于酶和蛋白质的结构支撑,可以防止微生物的入侵[7, 8, 9, 10, 11]。在孵化(鸡胚尿囊膜分泌响应酸)之前,乳头层钙储备体溶解,这个过程会溶解OCX-36,蛋壳变得越来越薄[12]。
Mann[10]在卵黄膜中也检测出了OCX-36,同时也对火鸡的蛋壳蛋白质的基因组序列进行分析,结果表明OC-116和OCX-36占已鉴定蛋白质的37%,未检出鸡蛋壳中其他的特异蛋白质[11]。
2 OCX-36的基因结构禽蛋特异性蛋白质的演变与脊椎动物繁衍的进化是相关的。OCX-36是鸟类高度特异性的基因,出现在鸟类和哺乳动物分化之后,源于原始杀菌通透性增加蛋白质/脂多糖结合蛋白质/腭肺鼻上皮癌关联蛋白质(BPI/LBP/PLUNC)基因簇的顺接重复[12, 13]。从系谱树鉴定出原鸡属OCX-36基因和其他哺乳类原鸡属普通BPI/LBP/PLUNC基因的直系同源关系。搜索鸡的基因库进行核苷酸序列比对,OCX-36基因嵌套在BPI/LBP/PLUNC基因簇的20号染色体上,靠近BPI L3,LPLUNC 3,4,在核苷酸9834141和9842177之间,基因组序列长8 037 bp,由15个大小在43(外显子12)~477 bp(外显子15)不等的外显子与14个尺寸范围从80(内含子10)~1 185 bp(内含子11)的内含子组成。OCX-36基因的外显子/内含子构成与LBP和BPI的基因是非常相似、高度保守的,与相应的外显子具有相同的尺寸[3, 14]。
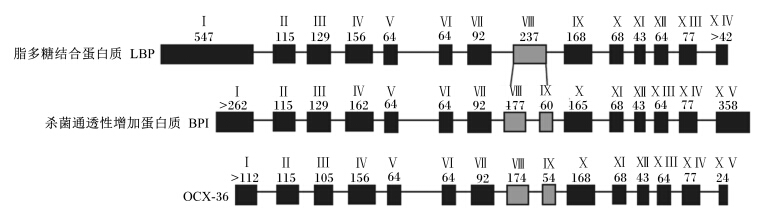 | 图1 OCX-36蛋白质与人脂多糖结合蛋白质、人杀菌通透性增加蛋白质基因结构的对比
Fig. 1 Comparison of the genomic structure of human LBP,human BPI and OCX-36 proteins[3] |
同线分析结果表明,在脊椎动物原始基因中至少有1个PLUNC基因,此外,BPI/LBP/PLUNC基因簇在脊椎动物中是保守的[13]。OCX-36出现在鸡形目基因组而不在哺乳类基因组。tBlastn数据搜索,在哺乳类和硬骨鱼均未发现OCX-36的匹配,表明OCX-36是原鸡属特有的。在EMBL数据库中进行核苷酸序列比对搜索,也没有检测到任何其他序列显著的同源性。与此相反,氨基酸序列比对搜索结果显示与哺乳动物LBP、BPI和胆固醇酯转运蛋白以及PLUNC家族蛋白质有20%~25%同源。
OCX-36条带N-末端氨基酸测序,得到的序列为VLSGLSCAISPRAMQQV,OCX-36的氨基酸序列残基33-244和273-439分别对应于LBP/BPI蛋白质家族结构域的N-末端和C-末端。真核生物线性序检测到在位置23~26有1个可能的糖胺聚糖附着功能性位点,但是直接测序法并不能检测到这种转译后修饰作用。预测的蛋白激酶C催化的磷酸化位点丝氨酸-31、丝氨酸-63和丝氨酸-323,或酪蛋白激酶2催化的磷酸化位点苏氨酸-135、苏氨酸-145和丝氨酸-304,通过肽测序法均未检测到[3]。
3 OCX-36的作用与机制 3.1 影响蛋壳的形成与品质壳基质蛋白质对蛋壳的形成有调控作用。试验表明刚收集的新鲜子宫液会发生CaCO3的自动聚沉,沉淀的颗粒包裹着特定的子宫液蛋白质,并且子宫液能改变CaCO3体外条件下的沉淀动力学特性。Gautron等[14]通过试验证明蛋鸡输卵管液里有壳基质蛋白质的前体,证实了壳基质蛋白质参与蛋壳矿化过程,而OCX-36在蛋壳钙化过程中起着正调节的作用[3],这符合其在蛋壳形成阶段表达上调这一现象。
基质蛋白质同时在生物矿化过程和决定机械性能的方面发挥了重要作用。蛋壳钙化过程中,方解石晶体的生长竞争与基质蛋白质相互作用,形成高度复杂有序的生物矿化结构。
Falini等[15]指出,壳层中的可溶性蛋白质决定了CaCO3的晶型,同时CaCO3晶体的形貌还与基质蛋白质的浓度有关。晶体的形貌是由各个方向上晶体的相对生长速率决定的。可溶性蛋白质选择性地吸附在生长晶体的特定晶面上,改变了不同晶面的相对生长速率,从而导致晶体改变,影响晶体的形貌。Rodriguez-Navarro等[16]发现蛋壳的晶体结构和蛋壳强度之间有显著的相关性。随着蛋鸡年龄变大,蛋壳有机基质发生变化。结构分析显示,老龄蛋鸡的蛋壳中有2个优先的晶体取向,而育成鸡的蛋壳中只有1个。老龄蛋鸡的蛋壳断裂强度是育成鸡的1/2,并且在结构性能如厚度、颗粒形态和晶体结构方面表现出较大变异性。据此可以推测作为壳基质蛋白质中丰度较大的蛋白质,OCX-36对蛋壳的品质有一定的影响。
3.2 抑菌活性与机制禽蛋组分对病原体的天然抗病性决定于蛋壳的物理屏障和化学防御,因为抑菌蛋白质和肽是由输卵管的管腔细胞分泌并成为蛋清、蛋壳膜和蛋壳的成分。禽类OCX-36是BPI/LBP/PLUNC基因位点的成员,其蛋白质序列与哺乳动物BPI/LBP的相似,在基因结构上,LBP、BPI和OCX-36有很高的保守性,显示出在进化过程中的关联性[17]。据此假设OCX-36具有抑菌活性[3, 4]。
3.2.1 抑菌活性Wellman-Labadie等[18]研究了哑天鹅(Cygnus olor)、棕胁秋沙鸭(Lophodytes cucullatus)、林鸳鸯(Aix sponsa)、加拿大黑雁(Branta canadensis)4种雁形目蛋壳蛋白质提取物的抑菌活性。壳基质蛋白质提取物能够抑制金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)D31、绿脓杆菌(Pseudomonas aureginosa)和枯草芽孢杆菌(Bacillus cereus),其中从棕胁秋沙鸭蛋壳中提取的蛋白质尤为有效。
Mine等[2]从蛋壳中提取出含有OCX-36的蛋壳基质蛋白质混合物。将此混合物按100 μg/mL的浓度与微生物一起孵育,发现该蛋白质混合物可以有效抑制枯草芽孢杆菌、金黄色葡萄球菌和绿脓杆菌的活性,在孵育早期(孵育4 h前)对大肠杆菌和肠炎沙门氏菌也有一定的抑制作用。
3.2.2 与脂磷壁酸/脂多糖(LTA/LPS)的结合活力纯化的OCX-36的抗菌活性及其结合LTA和LPS的能力评估试验表明,OCX-36蛋白质能够显著抑制金黄色葡萄球菌ATCC6538的细胞活力,抑菌效果呈剂量和时间依赖性,且不同浓度的抑制效果不一样;源于母鸡基因分型的脯氨酸-71(Pro-71)和丝氨酸-71(Ser-71)这2个类型的OCX-36的抑菌活性亦很显著[19]。
LBP和BPI是PLUNC蛋白质家族的成员。这2种蛋白质成员结合LPS,并在LPS介导的细胞信号转导中发挥拮抗作用。人LBP增强了LPS诱导的炎症反应,而BPI表现出抗菌和消炎作用[20, 21]。人PLUNCs分为短PLUNCs(SPLUNCs 1、2和3)和长PLUNCs(LPLUNCs 1、2、3、4和6)蛋白质。SPLUNCs和LPS具有同源性,结合BPI的N-末端结构域,而LPLUNCs和BPI的2个N-末端和C-末端具有整体同源性。BPI的N-端结构域负责其中和细胞内毒素和抗菌活性,调理活性与它的C-末端结构域相关[22]。OCX-36蛋白质是BPIFB蛋白家族中的新成员,SPLUNC根被BPIFA取代,LPLUNC根被BPIFB替换[23]。SPLUNC 1能够抑制绿脓杆菌生长和结合LPS[24]。SPLUNC 1对铜绿假单胞菌的体外抗菌作用是SPLUNC 1蛋白质增加细菌细胞的通透性,在感染部位具有趋化巨噬细胞和嗜中性粒细胞的作用[25]。SPLUNC 1显示了显著的抗支原体肺炎活性,轻微抑制大肠杆菌的生长[26]。PLUNC蛋白质结合LPS,具有抑菌活性,诱导细菌凝集,并参与细胞因子的产生[27]。基于OCX-36与BPI/LBP/PLUNC蛋白质具有共同的结构特征,推测OCX-36也参与了对病原体的先天性免疫反应[4]。
分别采用革兰氏阴性菌和革兰氏阳性菌的细胞壁成分,即病原体相关的分子模式(PAMP),研究OCX-36是否结合LPS和LTA。PAMP的一些实例包括LTA、LPS和脂阿拉伯甘露聚糖(LAM)。OCX-36表现出显著的结合大肠杆菌O111 ∶ B4脂蛋白能力,表明其与BPI和LBP相似,参与宿主防御抵御细菌。OCX-36也从金黄色葡萄球菌ATCC 6538上结合LTA,这说明其抑制金黄色葡萄球菌的生长很可能依赖于它与细菌细胞壁LTA的相互作用。在与金黄色葡萄球菌LTA结合时,Pro-71形式的OCX-36的LTA结合活性比两者混合以及Ser-71形式的OCX-36蛋白质要显著[19]。扫描电镜观察发现OCX-36蛋白质可能是以通过破坏细菌细胞膜的完整性的方式达到抑菌作用。
4 小 结目前,国内外对该蛋白质的相关性研究尚处于起步阶段,OCX-36的抑菌活性已经得到了充分的证明,然而抑菌机理还没有进行深入的研究。蛋白质的抗菌性能与蛋壳相关联,改变蛋壳的性质直接关系到增加蛋的污染风险和消费者食源性疾病的暴发,研究环境和饲料的因素影响该蛋白质的活动或者含量,选择增加该蛋白质的含量,优化禽蛋的自然防御系统;将OCX-36用作生物标记分子物,观察其在胚胎发育过程的防御作用,以及如何保护未受精的卵子抵御致病菌的侵染,这些研究将有助于减少禽蛋食源性疾病的发生。此外,蛋壳基质成分在调控蛋壳形成和蛋壳机械性能方面起积极作用,OCX-36在蛋壳钙化过程中和方解石晶体的相互作用机制还有待进一步研究。最后,研究OCX-36的结构可以更好的发现及解释其生物活性。
| [1] | SUGINO H,NITODA T,JUNEJA L R.General chemical composition of hen eggs[C]//YAMAMOTO T,JUNEJA L R,HATTA H,et al.Hen eggs:their basic and applied science.Boca Raton,FL:CRC Press,1997:13-24.( 1) 1)
|
| [2] | MINE Y,OBERLE C,KASSAIFY Z.Eggshell matrix proteins as defense mechanism of avian eggs[J]. Journal of Agricultural and Food Chemistry,2003,51(1):249-253. ( 2) 2)
|
| [3] | GAUTRON J,MURAYAMA E,VIGNAL A,et al.Cloning of ovocalyxin-36,a novel chicken eggshell protein related to lipopolysaccharide-binding proteins,bactericidal permeability-increasing proteins,and PLUNC family proteins[J]. The Journal of Biological Chemistry,2007,282(8):5273-5286. ( 9) 9)
|
| [4] | GAUTRON J,RÉHAULT-GODBERT S,PASCAL G,et al.Ovocalyxin-36 and other LBP/BPI/PLUNC-like proteins as molecular actors of the mechanisms of the avian egg natural defences[J]. Biochemical Society Transactions,2011,39(4):971-976. ( 3) 3)
|
| [5] | MANN K,GAUTRON J,NYS Y,et al.Disulfide-linked heterodimeric clusterin is a component of the chicken eggshell matrix and egg white[J]. Matrix Biology,2003,22(5):397-407. ( 1) 1)
|
| [6] | HINCKE M T,TSANG C P,COURTNEY M,et al.Purification and immunochemistry of a soluble matrix protein of the chicken eggshell (ovocleidin 17)[J]. Calcified Tissue International,1995,56(6):578-583. ( 1) 1)
|
| [7] | HINCKE M T,NYS Y,GAUTRON J,et al.The eggshell:structure,composition and mineralization[J]. Frontiers in Bioscience,2012,17(1):1266-1280. ( 1) 1)
|
| [8] | NYS Y,GAUTRON J,GARCIA-RUIZ J M,et al.Avian eggshell mineralization:biochemical and functional characterization of matrix proteins[J]. Comptes Rendus Palevol,2004,3(6/7):549-562. ( 1) 1)
|
| [9] | FERNANDEZ M S,ARAYA M,ARIAS J L.Eggshells are shaped by a precise spatio-temporal arrangement of sequentially deposited macromolecules[J]. Matrix Biology,1997,16(1):13-20. ( 1) 1)
|
| [10] | MANN K.Proteomic analysis of the chicken egg vitelline membrane[J]. Proteomics,2008,8(11):2322-2332. ( 2) 2)
|
| [11] | MANN K,MANN M.The proteome of the calcified layer organic matrix of turkey (Meleagris gallopavo) eggshell[J]. Proteome Science,2013,11(1):40. ( 2) 2)
|
| [12] | CHIANG S C,VELDHUIZEN E J A,BARNES F A,et al.Identification and characterisation of the BPI/LBP/PLUNC-like gene repertoire in chickens reveals the absence of a LBP gene[J]. Developmental and Comparative Immunology,2011,35(3):285-295. ( 2) 2)
|
| [13] | TIAN X,GAURTON J,MONGET P,et al.What makes an egg unique? Clues from evolutionary scenarios of egg-specific genes[J]. Biology of Reproduction,2010,83(6):893-900. ( 2) 2)
|
| [14] | GAURTON J,HINCKE M T,NYS Y.Precursor matrix proteins in the uterine fluid change with stages of eggshell formation in hens[J]. Connective Tissue Research,1997,36(3):195-210. ( 2) 2)
|
| [15] | FALINI G,ALBECK S,WEINER S,et al.Control of aragonite or calcite polymorphism by mollusk shell macromolecules[J]. Science,1996,271(5245):67-69. ( 1) 1)
|
| [16] | RODRIGUEZ-NAVARRO A,KALIN O,NYS Y,et al.Influence of the microstructure on the shell strength of eggs laid by hens of different ages[J]. British Poultry Science,2002,43(3):395-403. ( 1) 1)
|
| [17] | SHAI Y.Mechanism of the binding,insertion and destabilization of phospholipid bilayer membranes by α-helical antimicrobial and cell nonselective membrane-lytic peptides[J]. Biochimica et Biophysica Acta (BBA):Biomembranes,1999,1462(1/2):55-70. ( 1) 1)
|
| [18] | WELLMAN-LABADIE O,PICMAN J,HINCKE M T.Antimicrobial activity of the Anseriform outer eggshell and cuticle[J]. Comparative Biochemistry and Physiology,2008,149(4):640-649. ( 1) 1)
|
| [19] | CORDEIRO C M M,ESMAILI H,ANSAH G,et al.Ovocalyxin-36 is a pattern recognition protein in chicken eggshell membranes[J]. PLoS One,2013,8(12):e84112. ( 2) 2)
|
| [20] | KRASITY B C,TROLL J V,WEISS J P,et al.LBP/BPI proteins and their relatives:conservation over evolution and roles in mutualism[J]. Biochemical Society Transactions,2011,39(4):1039-1044. ( 1) 1)
|
| [21] | TOBIAS P S,MATHISON J C,ULEVITCH R J.A family of lipopolysaccharide binding proteins involved in responses to gram-negative sepsis[J]. The Journal of Biological Chemistry,1988,263(27):13479-13481. ( 1) 1)
|
| [22] | SCHULTZ H,WEISS J P.The bactericidal/permeability-increasing protein (BPI) in infection and inflammatory disease[J]. Clinica Chimica Acta,2007,384(1/2):12-23. ( 1) 1)
|
| [23] | BINGLE C D,SEAL R L,CRAVEN C J.Systematic nomenclature for the PLUNC/PSP/BSP30/SMGB proteins as a subfamily of the BPI fold-containing superfamily[J]. Biochemical Society Transactions,2011,39(4):977-983. ( 1) 1)
|
| [24] | BARTLETT J A,GAKHAR L,PENTERMAN J,et al.PLUNC:a multifunctional surfactant of the airways[J]. Biochemical Society Transactions,2011,39(4):1012-1016. ( 1) 1)
|
| [25] | ZHOU H D,LI X L,LI G Y,et al.Effect of SPLUNC1 protein on the Pseudomonas aeruginosa and Epstein-Barr virus[J]. Molecular and Cellular Biochemistry,2008,309(1/2):191-197. ( 1) 1)
|
| [26] | SAYEED S,NISTICO L,CROIX C,et al.Multifunctional role of human SPLUNC1 in Pseudomonas aeruginosa infection[J]. Infection and Immunity,2013,81(1):285-291. ( 1) 1)
|
| [27] | CHU H W,THAIKOOTTATHIL J,RINO J G,et al.Function and regulation of SPLUNC1 protein in Mycoplasma infection and allergic inflammation[J]. The Journal of Immunology,2007,179(6):3995-4002. ( 1) 1)
|




