雌马酚(equol,Eq)最早是1932年Martian在怀孕的马(equine)尿液中分离得来,它属于有雌激素作用的二元酚(diphenol),因此Eq被命名equol。随后发现牛、鸡、猴、黑猩猩、犬、大鼠、小鼠、猪和人的尿液或血浆中也有Eq。Eq是大豆异黄酮在肠道微生物菌群作用下的代谢产物,生物活性广泛,具有激素样作用、抗氧化作用、免疫调控功能和保健功能。研究发现Eq的生物活性比大豆异黄酮更高[1, 2],大豆异黄酮的生物学作用可能归因于Eq。近年来Eq在动物体内的产生和代谢及生物学功能已经成为研究热点。
1 Eq的理化性质Eq分子式为C15H14O3,相对分子质量为242.27,化学名称为7-羟基-3-(4-羟苯基)-苯并二氢吡喃,属于非甾体类雌激素。Eq无极性,难溶于水,在酸中不稳定易被破坏。由于C-3具有手性,Eq有2种对映体,即R型-Eq[R-(+)-equol]和S型-Eq[S-(-)-equol],其中机体内大豆黄素(daidzein,Dai)代谢产生的Eq为S型-Eq,而人工合成的Eq则是R型-Eq和S型-Eq的混合物即外消旋Eq[(±)-Eq]。S型-Eq和R型-Eq性质有所差别,对雌激素受体(ER)-α、ER-β亲和性不一样。S型-Eq与ER-β亲和力较强,R型-Eq与ER-α亲和力较弱,与ER-β的亲和力更弱,2种异构体与ER的亲和力均高于其前体物Dai[1]。
2 Eq的生成及代谢Eq的生成途径见图1。Eq来自于大豆异黄酮的代谢,大豆异黄酮在大豆中主要以非活性的大豆苷形式存在,约占97%~98%,被动物摄入后在空肠中β-葡萄糖苷酶作用下,生成有活性游离型的Dai,也称大豆苷元。少量Dai被肠上皮细胞直接吸收,大量的Dai通过肠肝循环到达结肠被微生物菌群代谢。在结肠,Dai可在细菌酶的作用下代谢,参与的主要细菌有芽孢菌属、梭菌属、乳酸杆菌属等[3],具体过程为:Dai先加氢形成二氢大豆苷元,也称双氢大豆素(dihydrodaidzein,DHD),DHD既可通过C-环开环形成O-脱甲基安哥拉紫檀素(O-desmethylangolensin,O-DMA),也可去酮形成Eq[4]。Shimada等[5]研究发现乳酸球菌20-92可通过大豆苷元还原酶(daidzein reductase)催化Dai还原为DHD,通过二氢大豆苷元-Eq还原酶催化DHD还原为Eq。大豆苷元还原酶和二氢大豆苷元-Eq还原酶都属于还原型辅酶Ⅱ[NADP(H)]依赖性酶[6]。韩伟[7]从健康成人肠道中获得的产Eq肠道菌Slackia属菌株HY-2,发现该菌株也可产生大豆苷元还原酶和二氢大豆苷元-Eq还原酶,而且都需要Dai的诱导。
目前关于Eq代谢的研究很少。最早人们以为Eq性质比较稳定,没有进一步的生物转化。Rüfer等[8]研究多氯联苯处理的雄性Wister大鼠肝脏微粒体代谢Eq时,发现Eq可被转化为6种代谢产物,主要是3-羟基-Eq(3-OH-Eq)和6-羟基-Eq(6-OH-Eq),其次是8-羟基-Eq(8-OH-Eq)和非对映异构体4-羟基-Eq(4-OH-Eq),而且Eq是通过大豆异黄酮羟化或者P450酶催化羟化。Setchell等[9]研究报道,成年人一次性口服25 mg Eq后,在4~6 h时血浆Eq浓度最高,半衰期是8.8 h,药代动力学和其他大豆异黄酮类似,但是Eq的血浆清除速率比大豆异黄酮慢很多。Walsh等[10]用人结肠癌(Caco-2)细胞模拟肠道细胞试验时,结果发现只有游离Eq才能进入Caco-2细胞,而且这些游离Eq大部分可被转化成葡萄糖苷配基和硫酸配基形式,然后溢出细胞发挥生物活性。
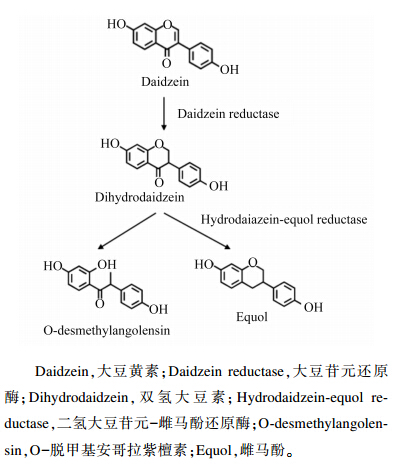 | 图1 推测的Dai转化为Eq的代谢途径 Fig. 1 Proposed metabolic pathway from Dai to Eq[11] |
除了马、人尿液以外,在绵羊血浆、大鼠、小鼠、猴等动物尿液中也发现含有Eq,但并不是所有的动物都能利用Dai代谢生成Eq。通过摄入大豆蛋白,Eq未能在汉普夏-杜洛克杂交猪血清和妇女血浆中检测出,鼠和猴血清中Eq占大豆异黄酮总量的71%~90%[12],这可能与动物肠道内富含生成Eq细菌有关。而人群中能够代谢Dai为Eq的比率是35%,黄种人比率高于白种人和黑种人,这可能与机体的生理功能、遗传背景和膳食结构有关系[13, 14]。Védrine等[15]研究发现,人连续1个月食用富含大豆异黄酮食物后,Eq生成者血浆中Eq浓度显著高于第1天,但是非Eq生成者体内依然不能生成Eq。
3.2 肠道微生物菌群结构Eq的生成必须有肠道内微生物菌群的参与,无菌动物不能产生Eq。人肠道菌群的数量级是1014,由于分离细菌的条件不一致,分离肠道产Eq菌比较复杂,已经发现分离的产Eq菌有乳酸球菌、乳酸杆菌、梭菌、真杆菌等。简而言之,有些菌可分阶段(大豆苷→Dai→DHD→Eq)将Dai最终分解为Eq,也有菌可直接将Dai分解为Eq[16]。研究发现人粪便中梭状芽孢杆菌HGH6、黏液真杆菌Julong 732、乳酸杆菌sp. Niu-O16等可将Dai或DHD代谢产生Eq[17]。产Eq菌可以是单独1种细菌还可以是多种细菌共同作用,而且有些细菌可抑制Eq生成[3]。人体中S型-Eq可能是多种细菌产生的,Decroos等[18]研究发现在人粪便中共同产Eq菌有肠球菌EPI1、乳酸菌EPI2、大芬戈尔德菌EPI3、韦永氏球菌。Tamura等[19]给成年小鼠饲喂大豆异黄酮饲粮4周后,体外培养粪便微生物,结果表明,与饲喂酪蛋白-异黄酮饲粮组小鼠相比,大豆异黄酮组小鼠粪便中梭型菌数显著降低,乳酸菌数显著升高。Yu等[20]分离鉴定了猪粪中产Eq菌,鉴定出1种真细菌。猪体内生成Eq的能力和人类类似,于卓腾等[21]通过体外培养二花脸猪的粪样微生物,结果发现部分二花脸猪粪样菌群具有降解大豆异黄酮产生Eq的能力。在此基础上,郑卫江等[22]又检测了梅山猪和大白母猪的尿液和粪便,发现长期饲喂玉米-豆粕饲粮均可产生Eq,但是Dai代谢为Eq的能力在猪品种间存在差异。肠道中的乳糖酶活性也可影响Eq的生成,当机体的乳糖酶活性较低时,可分解少量的大豆异黄酮,大量的大豆异黄酮进入到结肠代谢为Eq,同时,低乳糖酶活性会影响其他营养物质到达结肠的时间,进一步影响肠道微生物菌群[23]。
3.3 饲粮组成研究发现,Eq的产量与机体摄入的饲粮组成也有一定关系[24],如脂肪、碳水化合物、纤维素、果糖、维生素。饲粮中必须含有大豆异黄酮底物大豆(或母绵羊摄入含芒柄花黄素的红三叶草)[25],动物血浆或尿液中才可能检测到Eq。氢气可作为转化过程的电子供体促进Eq的生成。Rowland等[26]研究发现摄入脂肪量与尿液中Eq的量呈显著负相关关系,推测可能是脂肪的摄入降低了肠道微生物合成Eq的能力。Miyanaga等[27]研究发现产Eq者(血清中Eq浓度≥0.5 ng/mL)摄入的大豆和绿茶要显著多于非产Eq者,而且产Eq者消耗的硒和粗纤维更低。Hedlund等[28]研究表明,白种人产Eq能力受长期摄入的大量大豆及肉食影响。Lampe等[29]也发现,妇女产Eq者摄入碳水化合物占总能量比例要显著高于非产Eq者,而且消耗更多植物蛋白质和食物纤维。Zheng等[30]研究发现体外培养大白妊娠母猪粪便微生物,在200 mmol/L大豆苷元中添加10 g/L乳果糖可显著提高Eq的生成量。
3.4 抗生素摄入抗生素会改变Eq的产量,抗生素能破坏肠道微生物菌群平衡,从而影响大豆异黄酮肠道微生物正常生长与转化。Blair等[31]研究发现在猕猴体内,卡那霉素、脱氧土霉素、万古霉素、甲硝哒唑可显著降低血浆中Eq浓度,其中卡那霉素在降低血浆Eq浓度同时显著提高血浆中Dai、DHD和黄豆黄素浓度;而多西环素对血浆Eq浓度无影响,但可显著提高血浆中Dai、染料木黄酮(genistein,Gen)、二氢染料木素和黄豆黄素浓度,可能是因为有些抗生素对肠道微生物代谢大豆异黄酮有直接作用,另外一些抗生素则改变肠壁吸收状况。Atkinson等[32]也发现一些抗生素可改变Eq产量,但是对DHD产量及Dai转为DHD的转化率无影响,也说明肠道细菌的复杂性。倪鑫等[33]把ICR小鼠粪样加入大豆苷元和抗生素进行培养,结果发现使用正常成人剂量抗生素(阿莫西林、氧氟沙星、诺氟沙星、多西环素、利君沙、头孢拉定、阿奇霉素、吉他霉素、土霉素、利福平、甲硝唑),均能完全抑制ICR小鼠肠道微生物菌群体外转化大豆苷元为Eq能力;当加入成人剂量1/32时,阿莫西林、氧氟沙星、诺氟沙星、多西环素、利君沙、头孢拉定可显著降低培养基中Eq浓度,其他5种抗生素则完全抑制大豆苷元向Eq的转化。
4 Eq的生物学功能 4.1 激素样作用Eq作为大豆异黄酮的代谢产物,最早被人们关注的是其雌激素样作用。当体内雌激素缺乏时,其可成为雌激素促效剂;而当体内雌激素过多时,与ER竞争性结合,减少雌激素与ER结合的机会,从而减轻雌激素的促细胞增殖作用,降低与雌激素有关的疾病危险。王建等[34]研究表明在体外培养的大鼠成骨细胞中添加Eq,可促进成骨细胞增殖及前成骨细胞向成骨细胞的转化,Eq的促进作用可能是通过ER所介导。Legette等[35]也发现在去卵巢大鼠饲粮中添加200 mg/kg外消旋Eq可促进其骨骼发育,显著增加子宫上皮细胞的增殖指数。据Shutt等[36]报道Eq对小鼠子宫增重的效果相当于Gen。Nishide等[37]研究发现S型-Eq可通过与ER结合,减少炎症细胞因子,降低去卵巢小鼠的骨骼损失。女性雌激素失衡可导致很多疾病,如乳腺癌、动脉粥样硬化、骨质疏松,而Eq可与ER受体结合,发挥雌激素功效,从而抑制雌激素失衡导致的相关疾病。Ishiwata等[38]研究表明,服用S型-Eq可显著改善日本非产Eq妇女在围绝经期或绝经后期的情绪症状。
Eq在雄性动物体内表现为抗雄激素作用。Eq与5α-二氢睾酮(5α-dihydrotestosterone,5α-DHT)有高亲和力,可与其结合使其隔离,不能与5α-DHT受体结合[39]。雄激素可促进前列腺癌细胞的生长,Lund等[39]研究发现,用人前列腺癌(LNCap)细胞做体外试验时,5α-DHT可显著增加LNCap细胞的雄激素刺激生物标记物即前列腺特异性抗原(prostate specific antigen,PSA)水平,而5α-DHT+Eq有抑制PSA水平增加的趋势;同时在动物试验中,Eq处理显著降低了大鼠的前列腺重和血浆5α-DHT水平。Loutchanwoot等[40]研究也发现,高剂量Eq(250 mg/kg BW)可显著降低大鼠精囊的绝对重量和相对重量。
4.2 抗氧化Eq属于多酚类物质,可作为氢/电子受体,清除自由基。Rimbach等[41]研究发现Eq在清除巨噬细胞产生的一氧化氮(NO)能力上和Dai类似,仅次于Gen,Rüfer等[8]也有类似结果。Choi等[42]比较了大豆异黄酮代谢产物对人HepG2细胞抗氧化活性的影响,结果表明O-DMA、Eq、Dai和大豆苷元都可显著提高过氧化氢酶(CAT)和总超氧化物歧化酶(T-SOD)活性,其中O-DMA和Eq抗氧化能力高于Dai。Hwang等[43]报道,Eq处理细胞可抑制可J774细胞产生的超氧根离子(O2-·),是通过失活还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶复合物,同时降低细胞产生的O2-·,导致NO水平提高。Jackman等[44]发现,Eq在高血压小鼠动脉中具有弱的抗氧化性。Sierens等[45]发现Eq可以保护因氧化应激造成的DNA损伤。Cheng等[46]报道,Eq通过降低内皮一氧化氮合酶(NOS)表达,显著抑制由利托那韦诱导的猪肺动脉和人肺动脉上皮细胞氧化损伤。Rowlands等[47]发现,Eq通过调节线粒体活性氧产生激活内皮细胞NOS活性和氧化还原通路。Choi等[48]发现,短期摄入Eq能显著提高CAT和超氧化物歧化酶(SOD)活性,抵抗小鼠氧化应激。
4.3 免疫调控Gen和Dai对机体有免疫调控功能[49, 50]。研究发现,Gen可抑制体内抗原特异性免疫反应和体外淋巴细胞分化,可促进自然杀伤细胞和细胞毒素T细胞的细胞毒性反应和细胞因子数量[51]。Dai可显著降低由脂多糖(LPS)诱导的树突状细胞的细胞表面标记物分化抗原簇(CD)40、CD80的含量,显著降低促炎症因子如白细胞介素(IL)-6和肿瘤坏死因子-α(TNF-α)的含量[52]。但是Eq作为大豆异黄酮的代谢产物,研究较少。Eq的免疫保护作用可能是有其抗氧化作用所介导的,Widyarini等[53]研究小鼠皮肤受到长波紫外线(320~400 nm)损伤时,涂抹Eq对皮肤有免疫保护作用,不仅在于可激活皮肤的雌激素受体信号通路,还可诱导内源皮肤抗氧化酶-血红素加氧酶(hemeoxygenase,HO)起保护作用。Selvaraj等[54]研究发现,通过饲粮或皮下注射Eq对30日龄去卵巢小鼠阴道上皮厚度有剂量增加效应,而对胸腺或脂肪组织均无影响。Kang等[55]研究发现LPS处理小鼠时,注射Eq可通过下调巨噬细胞的蛋白激酶B(Akt)激活来抑制NO产量和可诱导NOS基因表达。Sakai等[56]研究免疫卵清蛋白的BALB/c小鼠体内,Eq可促进特定抗体IgE的产生。
4.4 保健功能大量人医方面的研究表明,Eq对肿瘤、心血管疾病的防治有一定作用。Magee等[57]研究发现,R型-Eq和S型-Eq可通过下调基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)的表达来抑制人乳腺癌MDA-MB-231细胞的增殖。Eq对紫外线或者7,12-二甲苯蒽(DMBA)诱发的皮肤癌有抑制作用,Widyarini等[58]研究发现,皮肤涂抹Eq对患皮肤癌的无毛小鼠有保护作用,短期研究表明Eq可通过抑制肿瘤引发的生物标志物鸟氨酸脱羧酶的诱导来发挥作用,而且有剂量依赖性。Eq对牛的主动脉内皮细胞有保护作用,Eq可抑制过氧化氢(H2O2)引起的牛主动脉内皮细胞死亡,显著增加其磷酸化p38丝裂原激活的蛋白激酶(p38-MAPK)和B细胞淋巴瘤2(Bcl-2)的表达量[59]。
5 Eq在畜禽生产中的应用及存在问题目前,大豆异黄酮在猪、鸡、鸭上有一定应用。Eq作为大豆异黄酮代谢产物,在畜禽上的研究及应用非常有限。对鸡而言,研究集中于早期蛋内注射Eq影响肉鸡性腺发育与肉质性状,但是具体机理尚待研究。如吴晶等[60]报道,鸡蛋胚早期发育过程中注射20 μg Eq可显著提高49日龄雌性鸡的卵巢重。Wei等[61]报道,给7日龄鸡蛋胚分别注射低剂量(10 μg)和高剂量(100 μg)Eq,49日龄屠宰肉鸡,结果表明:Eq对肉鸡生长性能无显著影响;雌性鸡肉质受Eq影响更大,低剂量和高剂量组的肉色红度(a*值)与对照组相比,分别降低了24.10%和21.50%,2组蒸煮损失分别降低了12.11%和16.82%,高剂量组24和48 h滴水损失分别降低了60.27%和45.72%,而雄性肉鸡仅高剂量组显著降低蒸煮损失;同时,Eq可改善肉鸡抗氧化性能,低剂量组可显著提高肉鸡血浆谷胱甘肽过氧化物酶(GSH-Px)活性,低剂量组和高剂量组都可提高胸肌中T-SOD活性。对于猪而言,主要是南京农业大学朱伟云课题组自2008年开始研究不同品种猪产Eq规律,而且已经鉴定出部分细菌[20, 21, 22],并对肠道微生物进行营养调控,如添加乳果糖增强其产Eq的能力[30]。
本实验室开展了Eq对氧化处理鸡体外培养细胞的影响研究,结果表明添加20 μmol Eq显著降低了LPS刺激巨噬细胞中丙二醛(MDA)的含量,随着Eq的水平提高,细胞中谷胱甘肽(GSH)含量呈上升趋势。添加40、160 μmol的Eq可调控Toll样受体4(TLR4)、核转录因子NF-E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、IL-1β、TNF-α、IL-2和IL-6基因的表达,结果提示Eq能增强细胞对病原分子的应答反应,有利于细胞免疫功能、抗氧化功能的发挥[62]。另外,本实验室也研究了Eq对鸡小肠上皮细胞(intestinal epithelial cell,IEC)氧化应激的影响发现,Eq可以抑制H2O2引起的细胞MDA含量升高,并能够显著提高细胞SOD的活性;添加100 nmol Eq显著提高了Nrf2、肠黏膜紧密连接蛋白(claudin)和SOD-1基因的表达量,综上推测Eq有缓解鸡IEC氧化应激的作用[63]。
自然状态下不是所有动物肠道都可代谢产生Eq,即使是同一品种不同个体之间Eq的产生也可能存在差别。肠道产Eq菌比较复杂,目前尚未研究清楚,食用大豆异黄酮能使产Eq者血浆中Eq浓度显著提高,非产Eq者依然不能产生Eq[15],说明肠道产Eq菌对Eq的生成起着关键作用。目前已有研究利用化学方法来合成Eq,Muthyala等[1]研究提出以Dai或芒柄花黄素为底物,甲酸铵作为供氢体,20%氢氧化钯炭[Pd(OH)2/C]作为催化剂,醋酸作反应溶剂,反应产物为外消旋Eq,但其步骤繁琐、成本高。Heemstra等[64]以2-溴-4甲氧基苯甲醇、溴化钠为原料,经过多步化学反应,氢化铝锂(LiAlH4)作为手性助剂,得到S型-Eq,反应中使用了昂贵试剂及催化剂。史成阳[65]通过以间苯二酚和对羟基苯乙酸为原料,经过傅克酰基化、环合、羟基保护、催化加氢、脱水和手性催化还原,对反应条件进行优化,得到S型-Eq、R型-Eq和消旋体Eq,这种方法使用原料廉价,而且避免了高污染高危险性试剂,但仍需中试放大及工业化放大进行验证。目前看来,通过合成得到的Eq大多产量低而且价格昂贵,应用于科学研究,作为商品生产的条件还不成熟。因此亟待加强对肠道产Eq菌的分离鉴定、Eq产量的调控技术和化学合成技术及其抗氧化功能和免疫功能的机理进行深入研究。
6 小 结Eq具有激素样、抗氧化、免疫调控及保健等生物学作用,畜禽最常见的饲粮类型就是玉米-豆粕型,如果能提高畜禽肠道大豆异黄酮代谢为Eq的产量,不仅对畜禽本身有益,还可降低成本。在此过程中,肠道微生物菌群发挥了很重要的作用,那么为了提高其代谢效率,鉴定、分离并应用于非产Eq者体内就显得尤为重要。焦磷酸测序技术能够帮助发现肠道内不能被培养的产Eq菌。利用微生物学法和化学合成法,借鉴目前在人医上新的技术和思路,将有助于Eq在畜禽上的安全高效应用。
| [1] | MUTHYALA R S,JU Y H,SHENG S B,et al.Equol,a natural estrogenic metabolite from soy isoflavones:convenient preparation and resolution of R-and S-equols and their differing binding and biological activity through estrogen receptors alpha and beta[J]. Bioorganic & Medicinal Chemistry,2004,12(6):1559-1567. ( 3) 3)
|
| [2] | MUÑOZ Y,GARRIDO A,VALLADARES L.Equol is more active than soy isoflavone itself to compete for binding to thromboxane A2 receptor in human platelets[J]. Thrombosis Research,2009,123(5):740-744. ( 1) 1)
|
| [3] | SÁNCHEZ-CALVO J M,RODRÍGUEZ-IGLESIAS M A,MOLINILLO J M,et al.Soy isoflavones and their relationship with microflora:beneficial effects on human health in equol producers[J]. Phytochemistry Reviews,2013,12(4):979-1000. ( 2) 2)
|
| [4] | SETCHELL K D R,CLERICI C.Equol:history,chemistry,and formation[J]. The Journal of Nutrition,2010,140:1355S-1362S. ( 1) 1)
|
| [5] | SHIMADA Y,YASUDA S,TAKAHASHI M,et a1.Cloning and expression of a novel NADP(H)-dependent daidzein reductase,an enzyme involved in the metabolism of daidzein,from equol-producing Lactococcus strain 20-92[J]. Applied and Environmental Microbiology,2010,76(17):5892-5901. ( 1) 1)
|
| [6] | SHIMADA Y,TAKAHASHI M,MIYAZAWA N,et al.Identification of two novel reductases involved in equol biosynthesis in Lactococcus strain 20-92[J]. Journal of Molecular Microbiology and Biotechnology,201l,2l(3/4):160-172. ( 1) 1)
|
| [7] | 韩伟.黄豆苷元代谢相关酶的分离提取及其酶学性质研究[D]. 硕士学位论文.哈尔滨:东北农业大学,2013. ( 1) 1)
|
| [8] | RÜFER C E,KULLING S E.Antioxidant activity of isoflavones and their major metabolites using different in vitro assays[J]. Journal of Agricultural and Food Chemistry,2006,54(8):2926-2931. ( 2) 2)
|
| [9] | SETCHELL K D,BROWN N M,LYDEKING-OLSEN E.The clinical importance of the metabolite equol- a clue to the effectiveness of soy and its isoflavones[J]. The Journal of Nutrition,2003,132(12):3577-3584. ( 1) 1)
|
| [10] | WALSH K R,FAILLA M L.Transport and metabolism of equol by Caco-2 human intestinal cells[J]. Journal of Agricultural and Food Chemistry,2009,57(18):8297-8303. ( 1) 1)
|
| [11] | HEINONEN S,WÄHÄLÄ K,ADLERCREUTZ H.Identification of isoflavone metabolites dihydrodaidzein,dihydrogenistein,6'-OH-O-dma,and cis-4-OH-equol in human urine by gas chromatography-mass spectroscopy using authentic reference compounds[J]. Analytical Biochemistry,1999,274(2):211-219. ( 1) 1)
|
| [12] | GU L W,HOUSE S E,PRIOR R L,et al.Metabolic phenotype of isoflavones differ among female rats,pigs,monkeys,and women[J]. The Journal of Nutrition,2006,136(5):1215-1221. ( 1) 1)
|
| [13] | ATKINSON C,NEWTON K M,BOWLES E J,et al.Demographic,anthropometric,and lifestyle factors and dietary intakes in relation to daidzein-metabolizing phenotypes among premenopausal women in the United States[J]. American Journal of Clinical Nutrition,2008,87(3):679-687. ( 1) 1)
|
| [14] | LAMPE J W.Is equol the key to the efficacy of soy foods?[J]. American Journal of Clinical Nutrition,2009,89(5):1664S-1667S. ( 1) 1)
|
| [15] | VÉDRINE N,MATHEY J,MORAND C,et al.One-month exposure to soy isoflavones did not induce the ability to produce equol in postmenopausal women[J]. European Journal of Clinical Nutrition,2006,60(9):1039-1045. ( 2) 2)
|
| [16] | 蔡莉,王培玉,张玉梅.雌马酚产出相关细菌研究进展[J]. 世界华人消化杂志,2010,18(13):1360-1365. ( 1) 1)
|
| [17] | ELGHALI S,MUSTAFA S,AMID M,et al.Bioconversion of daidzein to equol by Bifidobacterium breve 15700 and Bifidobacterium longum BB536[J]. Journal of Functional Foods,2012,4(4):736-745. ( 1) 1)
|
| [18] | DECROOS K,VANHEMMENS S,CATTOIR S,et al.Isolation and characterisation of an equol-producing mixed microbial culture from a human faecal sample and its activity under gastrointestinal conditions[J]. Archives of Microbiology,2005,183(1):45-55. ( 1) 1)
|
| [19] | TAMURA M,HIRAYAMAB K,ITOHB K,et al.Effects of soy protein-isoflavone diet on plasma isoflavone and intestinal microflora in adult mice[J]. Nutrition Research,2002,22(6):705-713. ( 1) 1)
|
| [20] | YU Z T,YAO W,ZHU W Y.Isolation and identification of equol-producing bacterial strains from cultures of pig faeces[J]. FEMS Microbiology Letters,2008,282(1):73-80. ( 2) 2)
|
| [21] | 于卓腾,姚文,朱伟云.体外培养发现二花脸猪粪样菌群具有降解大豆黄酮产生雌马酚的能力[J]. 南京农业大学学报,2009,32(1):164-167. ( 2) 2)
|
| [22] | 郑卫江,侯艳君,姚文,等.肠道微生物代谢产物雌马酚的生成及其主要影响因素[J]. 微生物学报,2013,53(12):1251-1257. ( 2) 2)
|
| [23] | TAMURA A,SHIOMI T,HACHIYA S,et al.Low activities of intestinal lactase suppress the early phase absorption of soy isoflavones in Japanese adults[J]. Clinical Nutrition,2008,27(2):248-253. ( 1) 1)
|
| [24] | SETCHELL K D R,BROWN N M,SUMMER S,et al.Dietary factors influence production of the soy isoflavone metabolite S-(-)equol in healthy adults[J]. The Journal of Nutrition,2013,143(12):1950-1958. ( 1) 1)
|
| [25] | SHUTT D A,BRADEN A W H.The significance of equol in relation to the oestrogenic responses in sheep ingesting clover with a high formononetin content[J]. Australian Journal of Agricultural Research,1968,19(4):545-553. ( 1) 1)
|
| [26] | ROWLAND I R,WISEMEN H,SANDERS T A B,et al.Interindividual variation in metabolism of soy isoflavones and lignans:influence of habitual diet on equol production by the gut microflora[J]. Nutrition and Cancer,2000,36(1):27-32. ( 1) 1)
|
| [27] | MIYANAGA N,AKAZA H,TAKASHIMA N,et al.Higher consumption of green tea may enhance equol production[J]. Asian Pacific Journal of Cancer Prevention,2003,4(4):297-301. ( 1) 1)
|
| [28] | HEDLUND T E,MARONI P D,FERUCCI P G,et al.Long-term dietary habits affect soy isoflavone metabolism and accumulation in prostatic fluid in caucasian men[J]. The Journal of Nutrition,2005,135(6):1400-1406. ( 1) 1)
|
| [29] | LAMPE J W,KARR S C,HUTCHINS A M,et al.Urinary equol excretion with a soy challenge:influence of habitual diet[J]. Experimental Biology Medicine,1998,217(3):335-339. ( 1) 1)
|
| [30] | ZHENG W J,HOU Y J,SU Y,et al.Lactulose promotes equol production and changes the microbial community during in vitro fermentation of daidzein by fecal inocula of sows[J]. Anaerobe,2014,25:47-52. ( 2) 2)
|
| [31] | BLAIR R M,APPT S E, FRANKE A A.Treatment with antibiotics reduces plasma equol concentration in cynomolgus monkeys (Macaca fascicularis)[J]. The Journal of Nutrition,2003,133(7):2262-2267. ( 1) 1)
|
| [32] | ATKINSON C,FRANKENFELD C L,LAMPE J W.Gut bacterial metabolism of the soy isoflavone daidzein:exploring the relevance to human health[J]. Experimental Biology and Medicine,2005,230:155-170. ( 1) 1)
|
| [33] | 倪鑫,郝庆红,成志远,等.不同抗生素对ICR小鼠肠道微生物体外转化黄豆苷原的影响[J]. 世界华人消化杂志,2010,18(7):716-721. ( 1) 1)
|
| [34] | 王建,王斌,糜漫天,等.雌马酚对大鼠成骨细胞增殖和分化的影响[J]. 武警医学院学报,2009,18(12):1050-1053. ( 1) 1)
|
| [35] | LEGETTE L L,MARTIN B R,SHAHNAZARI M,et al.Supplemental dietary racemic equol has modest benefits to bone but has mild uterotropic activity in ovariectomized rats[J]. The Journal of Nutrition,2009,139(10):1908-1913. ( 1) 1)
|
| [36] | SHUTT D A,COX R I.Steroid and phyto-oestrogen binding to sheep uterine receptors in vitro[J]. Journal of Endocrinology,1972,52(2):299-310. ( 1) 1)
|
| [37] | NISHIDE Y,TADAISHI M,KOBORI M.Possible role of S-equol on bone loss via amelioration of inflammatory indices in ovariectomized mice[J]. Journal of Clinical Biochemistry and Nutrition,2013,53(1):41-48. ( 1) 1)
|
| [38] | ISHIWATA N,MELBY M K,MIZUNO S,et al.New equol supplement for relieving menopausal symptoms:randomized,placebo-controlled trial of Japanese women[J]. Menopause,2009,16(1):141-148. ( 1) 1)
|
| [39] | LUND T D,MUNSON D J,HALDY M E,et al.Equol is a novel anti-androgen that inhibits prostate growth and hormone feedback[J]. Biology of Reproduction,2004,70(4):1188-1195. ( 2) 2)
|
| [40] | LOUTCHANWOOT P,SRIVILAI P,JARRY H.Effects of the natural endocrine disruptor equol on the pituitary function in adult male rats[J]. Toxicology,2013,304:69-75. ( 1) 1)
|
| [41] | RIMBACH G,DE PASCUAL-TERESA S,EWINS B A,et al.Antioxidant and free radical scavenging activity of isoflavone metabolites[J]. Xenobiotica:The Fate of Foreign Compounds in Biological Systems,2003,33(9):913-925. ( 1) 1)
|
| [42] | CHOI E J,KIM G H.The antioxidant activity of daidzein metabolites,O-desmethylangolensin and equol,in HepG2 cells[J]. Molecular Medicine Reports,2013,9(1):328-332. ( 1) 1)
|
| [43] | HWANG J,WANG J,MORAZZONI P,et al.The phytoestrogen equol increases nitric oxide availability by inhibiting superoxide production:an antioxidant mechanism for cell-mediated LDL modification[J]. Free Radical Biology & Medicine,2003,34(10):1271-1282. ( 1) 1)
|
| [44] | JACKMAN K A,WOODMAN O L,CHRISSOBOLIS S,et al.Vasorelaxant and antioxidant activity of the isoflavone metabolite equol in carotid and cerebral arteries[J]. Brain Research,2007,1141:99-107. ( 1) 1)
|
| [45] | SIERENS J,HARTLEY J A,CAMPBELL M J,et al.Effect of phytoestrogen and antioxidant supplementation on oxidative DNA damage assessed using the comet assay[J]. Mutation Research,2001,485(2):169-176. ( 1) 1)
|
| [46] | CHENG C,WANG X W,WEAKLEY S M,et al.The soybean isoflavonoid equol blocks ritonavir-induced endothelial dysfunction in porcine pulmonary arteries and human pulmonary artery endothelial cells[J]. The Journal of Nutrition,2009,140(1):12-17. ( 1) 1)
|
| [47] | ROWLANDS D J,CHAPPLE S,RCM S,et al.Equol-stimulated mitochondrial reactive oxygen species activate endothelial nitric oxide synthase and redox signaling in endothelial cells roles for F-Actin and GPR30[J]. Hypertension,2011,57(4):833-840. ( 1) 1)
|
| [48] | CHOI E J.Evaluation of equol function on anti- or prooxidant status in vivo[J]. Journal of Food Science,2009,74(2):65-71. ( 1) 1)
|
| [49] | HÄMÄLÄINEN M,NIEMINEN R,VUORELA P,et al.Anti-inflammatory effects of flavonoids:genistein,kaempferol,quercetin,and daidzein inhibit STAT-1 and NF-κB activation along with their inhibitory effect on iNOS expression and NO production in activated macrophages[J]. Mediators of Inflammation,2007,2007:45673. ( 1) 1)
|
| [50] | SAKAI T,KOGISO M.Soy isoflavones and immunity[J]. The Journal of Medical Investigation.2008,55(3/4):167-173. ( 1) 1)
|
| [51] | COOKE P S,SELVARAJ V,YELLAYI S,et al.Genistein,estrogen receptors,and the acquired immune response[J]. Journal of Nutrition,2006,136(3):704-708. ( 1) 1)
|
| [52] | YUM M K,JUNG M Y,CHO D,et al.Suppression of dendritic cells'maturation and functions by daidzein,a phytoestrogen[J]. Toxicology and Applied Pharmacology,2011,257(2):174-181. ( 1) 1)
|
| [53] | WIDYARINI S,DOMANSKI D,PAINTER N,et al.Photoimmune protective effect of the phytoestrogenic isoflavonoid equol is partially due to its antioxidant activities[J]. Photochemical & Photobiological Sciences,2012,11(7):1186-1192. ( 1) 1)
|
| [54] | SELVARAJ V,ZAKROCZYMSKI M A,NAAZ A,et al.Estrogenicity of the isoflavone metabolite equol on reproductive and non-reproductive organs in mice[J]. Biology of Reproduction,2004,71(3):966-972. ( 1) 1)
|
| [55] | KANG J S,YOON Y D,HAN M H,et al.Equol inhibits nitric oxide production and inducible nitric oxide synthase gene expression through down-regulating the activation of Akt[J]. International Immunopharmacology,2007,7(4):491-499. ( 1) 1)
|
| [56] | SAKAI T,FUROKU S,NAKAMOTO M,et al.The soy isoflavone equol enhances antigen-specific IgE production in ovalbumin-immunized BALB/c mice[J]. Journal of Nutritional Science and Vitaminology,2010,56(1):72-76. ( 1) 1)
|
| [57] | MAGEE P J,ALLSOPP P,SAMALETDIN A,et al.Daidzein,R-(+)equol and S-(-)equol inhibit the invasion of MDA-MB-231 breast cancer cells potentially via the down-regulation of matrix metalloproteinase-2[J]. European Journal of Nutrition,2014,53(1):345-350. ( 1) 1)
|
| [58] | WIDYARINI S,HUSBAND A J,REEVE V E.Protective effect of the isoflavonoid equol against hairless mouse skin carcinogenesis induced by UV radiation alone or with a chemical cocarcinogen[J]. Photochemistry and Photobiology,2007,81(1):32-37. ( 1) 1)
|
| [59] | CHUNG J E,KIM S Y,JO H H,et al.Antioxidant effects of equol on bovine aortic endothelial cells[J]. Biochemical and Biophysical Research Communications,2008,375(3):420-424. ( 1) 1)
|
| [60] | 吴晶,魏晓静,管少华,等.蛋内注射雌马酚对肉鸡性腺发育的影响[J]. 畜牧与兽医,2010,42(11):72-74. ( 1) 1)
|
| [61] | WEI X J,NI Y D,LU L Z,et al.The effect of equol injection in ovo on posthatch growth,meat quality and antioxidation in broilers[J]. Animal,2011,5(2):320-327. ( 1) 1)
|
| [62] | 苟钟勇,蒋守群,郑春田,等.雌马酚对鸡巨噬细胞抗氧化保护和免疫调控作用的研究[C]//动物生理生化学分会第七届全国代表大会暨第十三次学术交流会.沈阳:中国畜牧兽医学会动物生理生化学分会,2014.( 1) 1)
|
| [63] | 林厦菁,蒋守群.雌马酚对鸡小肠上皮细胞氧化应激模型的影响[C]//动物生理生化学分会第七届全国代表大会暨第十三次学术交流会.沈阳:中国畜牧兽医学会动物生理生化学分会,2014.( 1) 1)
|
| [64] | HEEMSTRA J M,KERRIGAN S A,DOERGE D R,et al.Total synthesis of (S)-equol[J]. Organic Letters,2006,8(24):5441-5443. ( 1) 1)
|
| [65] | 史成阳.(S)-雌马酚的全合成[D]. 硕士学位论文.哈尔滨:黑龙江大学,2012:57. ( 1) 1)
|




